Fe2+/H2O2体系O2生成路径
2016-07-07赵海谦高杏存王忠华高继慧东北石油大学土木建筑工程学院黑龙江大庆6338哈尔滨工业大学能源科学与工程学院黑龙江哈尔滨5000
赵海谦,高杏存,王忠华,高继慧(东北石油大学土木建筑工程学院,黑龙江 大庆 6338;哈尔滨工业大学能源科学与工程学院,黑龙江 哈尔滨5000)
Fe2+/H2O2体系O2生成路径
赵海谦1,高杏存1,王忠华1,高继慧2
(1东北石油大学土木建筑工程学院,黑龙江 大庆 163318;2哈尔滨工业大学能源科学与工程学院,黑龙江 哈尔滨150001)
摘要:掌握Fe2+/H2O2体系O2的生成路径,可为避免H2O2无效分解,开发经济高效的Fe2+/H2O2体系利用技术指明方向。采用添加自由基捕获剂的方法,探究Fe2+/H2O2体系内各种自由基对O2生成速率的影响,进而确定O2的生成路径。结果表明:Fe2+/H2O2体系内不会产生大量g不是生成O2的主要反应物质;gOH被全部捕获后,体系中仍产生大量HO2g,但此时无O2生成,证明生成O2的反应由gOH和HO2g两种自由基直接参与。分析认为反应体系内O2生成的主要路径。控制Fe2+/H2O2体系定向生成gOH,抑制HO2g的产生,是提高Fe2+/H2O2体系中H2O2利用率的有效手段。
关键词:Fe2+/H2O2体系;无效分解;O2;自由基
2015-12-02收到初稿,2016-01-06收到修改稿。
联系人:王忠华。第一作者:赵海谦(1981—),男,博士,副教授。
Received date: 2015-12-02.
Foundation item: supported by the Heilongjiang Province Department of Education Funds (12541093).
引 言
Fe2+/H2O2体系在废水净化,尤其在废水中有机物降解方面,具有一般化学氧化法无法比拟的优势,至今已成功应用于多种工业废水的处理[1-6]。H2O2利用率低而导致的经济性差是Fe2+/H2O2技术应用的主要瓶颈[7]。造成H2O2利用率低的主要原因是其在降解污染物过程中的无效分解。H2O2发生无效分解的典型产物是O2,分析O2生成路径可为揭示Fe2+/H2O2体系内H2O2无效分解机制及减少H2O2无效消耗提供理论基础,进而为开发经济高效的Fe2+/H2O2利用技术指明方向。
目前,尚无针对Fe2+/H2O2体系O2生成路径的专门研究。但很多Fe2+/H2O2反应及H2O2分解机理的研究中均提及生成O2的反应步骤。Walling[8-9]对Fenton反应机理进行了深入研究,其提出的Fenton反应及Fenton降解有机物的反应机理被多次引用。在其有关反应机理的描述中,O2由HO2g与Fe3+之间的反应生成,而HO2g来自H2O2与Fe3+及H2O2与gOH之间的反应

Perez-Benito[10]在研究Fe3+催化H2O2分解动力学时,推测了Fe3+、Fe2+、H2O2共存体系的反应机理,机理中认为O2来源于与Fe3+的反应以及HO2g自身歧化反应
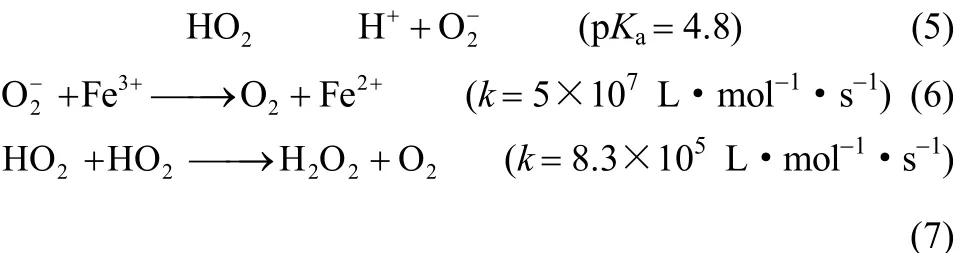
De Laat等[11]推测了Fe3+、Fe2+、H2O2共存体系的反应机理,将体系内可能发生的化学反应进行了汇总,O2可能经如下反应生成,但其中后两者不是生成O2的主要反应。

可见,有关Fe2+/H2O2体系中O2生成路径的认识尚未完全统一。但现有反应机理普遍认为HO2g及O−2g是体系生成O2的主要反应物质,且认为O−2g主要由HO2g产生[反应(5)]。只要体系内存在HO2g就会通过反应(7)或反应(5)+反应(6)而生成O2。生成O2的主要反应没有gOH的直接参与。
gOH与HO2g之间的反应是大气化学领域的研究热点,该反应具有极大的反应速率常数[12-13]。根据Fe2+/H2O2反应机理,Fe2+/H2O2体系反应过程中同时存在gOH、HO2g两种自由基[8],推测两种自由基间的快速反应(8)是该体系生成O2的主要反应路径。为验证该推测,对Fe2+/H2O2体系内O2生成路径进行了实验研究。采用向Fe2+/H2O2体系中添加自由基捕获剂的方法,确定各种自由基对O2生成速率的影响,进而确定O2的生成路径。本研究对深入认识H2O2无效分解途径,提高H2O2利用效率具有重要意义。
1 实验部分
1.1试剂
双氧水(H2O2,质量分数30%)、七水硫酸亚铁(FeSO4g 7H2O)、二甲基亚砜(DMSO)、草酸钛钾、盐酸羟胺(NH2OHg HCl)均为国产分析纯。茜素紫3B、氯化硝基四氮唑蓝(NBT)由Sigma-Aldrich公司生产。
1.2分析仪器
紫外可见分光光度计,T6型,北京普析通用;增强型气体分析仪,VARIO PLUS型,德国MRU;滴定仪,ZDJ-5型,上海雷磁;纯水机,Master-s型,上海和泰。
1.3实验方法
1.3.2O2生成速率测试Fe2+/H2O2体系O2生成速率测试在H2O2分解实验系统中进行,如图1所示。配制一定浓度H2O2溶液980 ml倒入鼓泡反应器内,称取1.39 g的FeSO4g 7H2O溶解于20 ml去离子水中充分搅拌后待用。采用高纯N2吹扫系统管路及反应器以排除空气,末端通过MRU气体分析仪检测O2浓度,当O2浓度降低至0并保持不变时证明系统内残留空气已全部排空。用注射器将配制好的FeSO4溶液注入反应器内,构成Fe2+/H2O2反应体系,FeSO4初始浓度为5 mmol·L−1,H2O2溶液初始浓度为30~500 mmol·L−1。N2携带反应生成的O2进入MRU烟气分析仪进行监测。实验中N2气量维持2 L·min−1不变,实验时间为10 min,通过恒温水浴维持反应体系温度恒定。通过O2浓度监测结果,即可计算得到O2的生成速率及10 min内O2生成量。反应前后分别采用钛盐光度法对H2O2浓度进行检测。

图1 O2生成速率测试系统Fig.1 Schematic diagram of O2generation rate test system1—N2cylinder; 2—gas valves; 3—bubble column reactor; 4—MRU gas analyzer; 5—thermometer; 6—thermostatic water bath
1.3.3H2O2浓度检测H2O2浓度检测采用钛盐光度法进行。取1 ml待测溶液稀释至一定倍数,向其中加入适量草酸钛钾,暗处反应10 min后,用分光光度计检测380 nm位置的吸光度[16]。
1.3.4HO2g检测取1.7 g的H2O2(30%)溶液于50ml容量瓶中,加去离子水稀释至刻度,配制成300 mmol·L−1的H2O2溶液。将溶液移入100 ml烧杯内,通过加热磁力搅拌器控制溶液温度30℃,搅拌速度200 r·min−1。准确称取0.0216 g茜素紫3B加入H2O2溶液,取1 ml溶液并添加3 ml去离子水稀释后,用分光光度计检测茜素紫3B的初始吸光度值(569 nm)[17]。向含有茜素紫3B的H2O2溶液中添加4.68 g DMSO,充分搅拌后再加入0.0695 g FeSO4g 7H2O,构成Fe2+/H2O2/DMSO体系。反应10 min后,对茜素紫3B浓度进行取样测试。通过茜素紫3B浓度变化情况即可判断Fe2+/H2O2体系中gOH被捕获后是否存在大量HO2g。
2 结果与讨论
2.1O2生成规律
掌握Fe2+/H2O2体系内O2生成规律是探究O2生成路径的前提,本实验确定了10 min反应时间内Fe2+/H2O2体系O2生成速率的变化趋势(图2)及O2生成量与H2O2消耗量的关系(图3)。

图2 Fe2+/H2O2体系O2生成速率Fig.2 O2generation rate in Fe2+/H2O2system[H2O2]0= 30—500 mmol·L−1, [Fe2+]0= 5 mmol·L−1, 60℃

图3 O2生成量与H2O2消耗量的关系Fig.3 Relationship between amount of O2production and H2O2consumptionA—[H2O2]0: 30 mmol·L−1; B—[H2O2]0: 100 mmol·L−1; C—[H2O2]0: 300 mmol·L−1; D—[H2O2]0: 500 mmol·L−1; [Fe2+]0= 5 mmol·L−1, 60℃
从图2可以看出,Fe2+/H2O2体系反应过程中伴有明显O2生成,H2O2初始浓度越高,O2的生成速率越快。无论H2O2初始浓度高低,O2生成速率均呈先快速增加后缓慢减小的趋势,60 s左右出现O2生成速率的极值。在相同Fe2+初始浓度及温度条件下,O2生成速率的极值近似正比于H2O2初始浓度值。可见,随着H2O2初始浓度增加,H2O2分解速率加快,体系内自由基的生成速率也加快。生成O2的反应一定有某些自由基的参与,自由基生成速率加快必然导致O2生成速率加快,10 min反应时间内H2O2消耗量及O2生成量增多。从图3可知,O2生成量与H2O2消耗量存在一定比例关系,O2生成量约为H2O2消耗量的1/2。
2.2Fe2+/H2O2体系内g检测
根据Fe2+/H2O2反应机理,Fe2+/H2O2体系内同时产生大量gOH和HO2g。有文献记载,酸性条件下HO2gH++O−2g反应速率很慢[18-19],由于Fe2+/H2O2体系呈酸性,可推断体系中g生成速率亦很慢。为证明此推断,对Fe2+/H2O2体系反应10 min过程中的O−2g累计浓度进行了分光光度检测。结果如图4所示。

图4 甲臜浓度测试结果Fig.4 Detection of formazan[H2O2]0= 30 mmol·L−1, [Fe2+]0= 5 mmol·L−1, [NBT]0:[H2O2]0= 1:1, 40℃
从图4可知,无论稀释倍数高低,Fe2+/H2O2体系反应10 min后并没有明显甲臜吸收峰,同时试管内未发现明显蓝色沉淀物,表明Fe2+/H2O2体系分解过程中O−2g的生成速率极慢。从图3可见,H2O2初始浓度为30 mmol·L−1时,10 min过程中Fe2+/H2O2体系的O2生成量为9.8 mmol,如果反应(6)与反应(9)是生成O2的主要路径,则反应10 min过程中,体系将生成9.8 mmolO−2g,生成的O−2会迅速和NBT反应生成甲臜。然而,体系内并未检测到甲臜吸收峰,由此可知O−2不是Fe2+/H2O2体系生成O2的主要反应物质。
2.3gOH在O2生成过程中的作用
为考察gOH在Fe2+/H2O2体系O2生成过程中的作用,向Fe2+/H2O2体系添加gOH捕获剂DMSO[20-21],对比添加DMSO前后O2生成速率的变化反映gOH 对O2生成的影响(表1)。添加DMSO前后Fe2+/H2O2体系分解过程中O2生成速率如图5所示。

表1 DMSO对O2生成量及H2O2消耗量的影响Table 1 Effect of DMSO on O2generation and H2O2consumption
Note: [H2O2]0= 300 mmol·L−1, [Fe2+]0= 5 mmol·L−1, [DMSO]0: [H2O2]0= 4:1, 60℃.

图5 gOH对O2生成速率的影响Fig.5 Effect of gOH on O2generation rate[H2O2]0= 300 mmol·L−1, [Fe2+]0= 5 mmol·L−1, [DMSO]0:[H2O2]0= 4:1, 60℃
未添加DMSO时,Fe2+/H2O2体系分解时产生大量O2,10 min内O2生成量为96.6 mmol,H2O2消耗量为196.5 mmol。当添加DMSO后,H2O2分解速率加快,10 min时H2O2已全部分解,但整个分解过程没有O2生成。可见,当gOH全部被捕获后,体系无O2生成,gOH在Fe2+/H2O2体系内O2的生成过程中起重要作用。导致这一现象的发生有两种可能:①gOH直接参与O2的生成反应,添加DMSO后使体系缺乏生成O2的反应物gOH;②gOH不直接参与O2生成反应,但gOH的捕获影响了HO2g的生成,进而影响O2的产生。因此,尚不能判断gOH是否直接参与到产生O2的反应中。
2.4gOH是否直接参与O2生成反应
为了确定gOH是否直接参与生成O2的反应,需要确定gOH被捕获后,体系内是否存在大量HO2g。如果gOH被捕获后,体系仍可生成大量HO2g,但无O2生成,则表明产生O2的反应不可能是HO2g的歧化反应(7)以及HO2g与Fe3+的反应(4),gOH一定直接参与到产生O2的反应中。
含有醌和半醌结构的物质可与Fenton体系产生的HO2g发生快速反应。


茜素紫3B(AV)分子结构(图6)中含有醌类结构,其与HO2g同样具有很快的反应速率[17]。

图6 茜素紫3B分子式Fig.6 Molecular formula of Alizarin Violet 3B
茜素紫3B的水溶液呈紫色,通过褪色来研究其与Fenton内HO2g的反应问题已有报道。本次研究向Fe2+/H2O2/DMSO体系添加一定浓度茜素紫3B,通过体系在569 nm处吸光度的变化来确定体系内是否存在HO2g。从图7可知,反应前体系中可以检测到明显的茜素紫3B吸收峰(稀释4倍),反应10 min后,茜素紫3B吸收峰几乎消失。可见,Fe2+/H2O2体系添加DMSO将gOH全部捕获后,体系中仍可生成大量HO2g。

图7 茜素紫3B浓度检测结果Fig.7 Test results of Alizarin Violet 3B concentration[H2O2]0= 300 mmol·L−1, [Fe2+]0= 5 mmol·L−1, [DMSO]0:[H2O2]0= 4:1, [AV]0= 1 mmol·L−1, 30℃
gOH被捕获后,Fe2+/H2O2体系内仍可产生大量HO2g,但此时并无O2生成。可以断定,并不是因为gOH被捕获后影响HO2g的生成而抑制了O2的产生,gOH一定直接参与生成O2的反应,反应(4)和反应(7)并不是Fe2+/H2O2体系O2的生成路径。
2.5HO2g在O2生成过程中的作用
为验证HO2g在O2生成过程中的作用,采用向Fe2+/H2O2体系内添加盐酸羟胺NH2OHg HCl的方法,将体系内Fe3+迅速还原为Fe2+,抑制HO2g的生成[7]。添加NH2OHg HCl后,Fe2+/H2O2体系O2生成速率如图8所示。可见,添加与H2O2等物质的量的NH2OHg HCl后,Fe2+/H2O2体系分解过程中O2的生成速率与生成量大大降低,仅在反应初期有少量O2生成。原因是,添加NH2OHg HCl后,体系Fe3+大大降低,严重制约了HO2g的生成,导致O2生成速率大幅度下降。由此可以确定,HO2g直接参与生成O2的反应中。
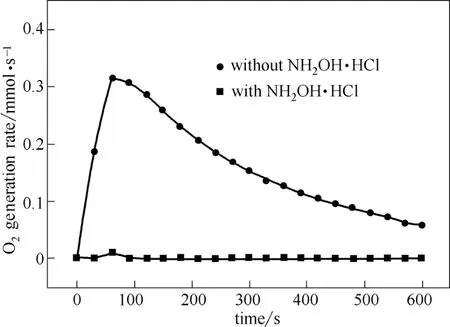
图8 HO2g对O2生成速率的影响Fig.8 Effect of HO2g on O2generation rate[H2O2]0= 300 mmol·L−1, [Fe2+]0= 5 mmol·L−1, [NH2OHg HCl]0: [H2O2]0= 1:1, 60℃
综合以上分析,gOH与HO2g均直接参与到生成O2的反应中,反应是 Fe2+/H2O2体系O2生成的主要路径。由于Fe3+的累计,Fe2+/H2O2体系分解过程中同时产生大量gOH与HO2g,这两种自由基会以极快的速率反应生成O2,大大降低自由基利用率,导致H2O2无效分解。降低Fe3+浓度,可以大大降低反应(2)的速率,减少体系内HO2g的浓度。Fe2+/H2O2体系内H2O2主要通过反应(1)消耗,即定向生成gOH。这样可以大幅度降低反应的速率,避免氧化性自由基快速消耗。因此,控制Fe2+/H2O2体系内H2O2定向生成gOH对提高体系内H2O2利用率具有重要意义。
3 结 论
采用实验方法,确定了Fe2+/H2O2体系中O2的生成路径。得到如下结论:O−2g不是Fe2+/H2O2体系生成O2的主要反应物质;gOH与HO2g均直接参与生成O2的反应,是Fe2+/H2O2体系O2生成的主要路径;降低Fe3+浓度,抑制HO2g的生成,使Fe2+/H2O2体系定向生成gOH,是提高H2O2利用率的关键。
References
[1]FENTON H J H. Oxidation of tartaric acid in presence of iron [J]. Journal of the Chemical Society, Transactions, 1894, 65: 899-910.
[2]蒋胜韬, 祝建中, 管玉江, 等. 非均相类Fenton法降解硝基苯化工废水的效能及其机制 [J]. 化工学报, 2014, 65 (4): 1488-1494. DOI: 10.3969/j.issn.0438-1157.2014.04.045. JIANG S T, ZHU J Z, GUAN Y J, et al. Performance of heterogeneous Fenton-like system for degradation of nitrobenzenecontaining wastewater [J]. CIESC Journal, 2014, 65 (4): 1488-1494. DOI: 10.3969/j.issn.0438-1157.2014.04.045.
[3]WANG Y, LIU Y, LIU T, et al. Dimethyl phthalate degradation at novel and efficient electro-Fenton cathode [J]. Applied Catalysis B: Environmental, 2014, 156: 1-7.
[4]PANIZZA M, CERISOLA G. Electro-Fenton degradation of synthetic dyes [J]. Water Research, 2009, 43 (2): 339-344.
[5]KAVITHA V, PALANIVELU K. Degradation of nitrophenols by Fenton and photo-Fenton processes [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2005, 170 (1): 83-95.
[6]SU C C, PAGALING E D, PERALTA G L, et al. Comparison of aniline degradation by Fenton and electro-Fenton reactors using plate and rod electrodes [J]. Environmental Progress & Sustainable Energy, 2013, 32 (4): 1111-1117.
[7]CHEN L W, MA J, LI X C, et al. Strong enhancement on Fenton oxidation by addition of hydroxylamine to accelerate the ferric and ferrous iron cycles [J]. Environmental Science & Technology, 2011, 45 (9): 3925-3930.
[8]WALLING C. Fenton's reagent revisited [J]. Accounts of Chemical Research, 1975, 8 (4): 125-131.
[9]WALLING C. Intermediates in the reactions of Fenton type reagents [J]. Accounts of Chemical Research, 1998, 31 (4): 155-157.
[10]PEREZ-BENITO J F. Iron (Ⅲ)-hydrogen peroxide reaction: kinetic evidence of a hydroxyl-mediated chain mechanism [J]. The Journal of Physical Chemistry A, 2004, 108 (22): 4853-4858.
[11]DE LAAT J, GALLARD H É. Catalytic decomposition of hydrogen peroxide by Fe(Ⅲ) in homogeneous aqueous solution: mechanism and kinetic modeling [J]. Environmental Science & Technology, 1999, 33 (16): 2726-2732.
[12]THRUSH B A, WILKINSON J P T. The rate of reaction of HO2radicals with HO and with NO [J]. Chemical Physics Letters, 1981, 81 (1): 1-3.
[13]HONG Z, LAM K Y, SUR R, et al. On the rate constants of OH+HO2and HO2+HO2: a comprehensive study of H2O2thermal decomposition using multi-species laser absorption [J]. Proceedings of the Combustion Institute, 2013, 34 (1): 565-571.
[14]刘瑞恒, 付时雨, 詹怀宇. 氯化硝基四氮唑蓝显色检测超氧阴离子自由基的研究 [J]. 分析测试学报, 2008, 27 (4): 355-359. DOI: 10.3969/j.issn.1004-4957.2008.04.004. LIU R H, FU S Y, ZHAN H Y. Spectrophotometric determination of superoxide anion radical with nitroblue tetrazolium [J]. Journal of Instrumental Analysis, 2008, 27 (4): 355-359. DOI: 10.3969/j.issn.1004-4957.2008.04.004.
[15]MERCHANT M, HARDY R, WILLIAMS S. Quantitative detection of superoxide ions in whole blood of the American alligator (alligator mississippiensis) [J]. Spectroscopy Letters, 2008, 41 (5): 199-203.
[16]姜成春, 庞素艳, 马军, 等. 钛盐光度法测定Fenton氧化中的过氧化氢 [J]. 中国给水排水, 2006, 22 (4): 88-91. DOI: 10.3321/ j.issn:1000-4602.2006.04.025. JIANG C C, PANG S Y, MA J, et al. Spectrophotometric determination of hydrogen peroxide in Fenton reaction with titanium oxalate [J]. China Water & Waste Water, 2006, 22 (4): 88-91. DOI: 10.3321/j.issn:1000-4602.2006.04.025.
[17]MA J H, SONG W J, CHEN C C, et al. Fenton degradation of organic compounds promoted by dyes under visible irradiation [J]. Environmental Science & Technology, 2005, 39 (15): 5810-5815.
[18]BIELSKI B H, CABELLI D E, ARUDI R L, et al. Reactivity ofradicals in aqueous solution [J]. Journal of Physical and Chemical Reference Data, 1985, 14 (4): 1041-1100.
[19]NIE Z, TIAN Q, LIU Y P, et al. Superoxide anion radical generation in the NaOH/H2O2/Fe(III) system: a spin trapping ESR study [J]. Magnetic Resonance in Chemistry, 2006, 44 (1): 38-44.
[20]BABBS C F, GRIFFIN D W. Scatchard analysis of methane sulfinic acid production from dimethyl sulfoxide: a method to quantify hydroxyl radical formation in physiologic systems [J]. Free Radical Biology and Medicine, 1989, 6 (5): 493-503.
[21]王洪良, 钟宇博, 石磊, 等. UV/H2O2作用下冰中苯酚的光转化及其与羟基自由基的关系 [J]. 吉林大学学报(理学版), 2014, 52 (1): 144-150. WANG H L, ZHONG Y B, SHI L, et al. Phenol photolysis in ice and the relationship between the photolysis and hydroxyl radicals under UV/H2O2system [J]. Journal of Jilin University (Science Edition), 2014, 52 (1): 144-150.
O2generation path in Fe2+/H2O2system
ZHAO Haiqian1, GAO Xingcun1, WANG Zhonghua1, GAO Jihui2
(1Institute of Civil Engineering & Architecture, Northeast Petroleum University, Daqing 163318, Heilongjiang, China;2College of Energy Science and Engineering, Harbin Institute of Technology, Harbin 150001, Heilongjiang, China)
Abstract:It is important to understand the O2generation path in Fe2+/H2O2system to avoid invalid decomposition of H2O2and to reduce the cost of pollutants degradation technology using Fe2+/H2O2system. In this paper, radical scavengers were adopted to investigate the roles of different radicals on the generation of O2in Fe2+/H2O2system. The results showed that there were fewg in Fe2+/H2O2system, andwas not the main reagent to generate O2. After gOH was captured, the generation rate of HO2g was still high, however, there was no O2generation. This indicated that gOH and HO2g took part in the reaction to generate O2directly.is the main reaction path to generate O2. Controling H2O2decomposition path towards gOH and restraining the production of HO2g were the effective ways to increase the utilization rate of H2O2.
Key words:Fe(Ⅱ)/H2O2system; invalid decomposition; O2; radical
中图分类号:O 643
文献标志码:A
文章编号:0438—1157(2016)06—2625—06
DOI:10.11949/j.issn.0438-1157.20151820
基金项目:黑龙江省教育厅项目(12541093)。
Corresponding author:WANG Zhonghua, wangzhonghua0725@163.com
