MDEA与MEA脱碳反应动力学
2016-07-07唐建峰张国君史泽林黄彬王曰赵铭钰中国石油大学华东储运与建筑工程学院山东青岛66580中交煤气热力研究设计院有限公司辽宁沈阳0000
唐建峰,张国君,史泽林,黄彬,王曰,赵铭钰(中国石油大学(华东)储运与建筑工程学院,山东 青岛 66580;中交煤气热力研究设计院有限公司,辽宁 沈阳 0000)
MDEA与MEA脱碳反应动力学
唐建峰1,张国君1,史泽林1,黄彬1,王曰2,赵铭钰1
(1中国石油大学(华东)储运与建筑工程学院,山东 青岛 266580;2中交煤气热力研究设计院有限公司,辽宁 沈阳 110000)
摘要:通过双模理论及反应釜吸收实验的方法,建立了胺液脱碳拟一级传质反应模型,并对其进行了实验验证。通过模型中的增强因子、二级反应速率常数及传质速率分析了伯胺MEA(乙醇胺)及叔胺MDEA(甲基二乙醇胺)的动力学特性,以此为基础进一步分析了MDEA+MEA混合胺液的交互作用、动力学特性,并得到了较优的胺液配比。研究结果表明:伯胺MEA的增强因子及传质速率数值大于叔胺MDEA,随着气液传质过程进行,传质速率逐渐减小;对于混合胺液,表观反应速率常数以及增强因子随着MEA浓度的增加以及温度的升高而逐渐增大;当总胺浓度为3mol·L-1时,MDEA+MEA(2 mol·L−1+1 mol·L−1)的混合胺液增强因子数值为0.5,传质速率较大,为最优混合胺液配比。
关键词:天然气;脱碳;MDEA;MEA;动力学;传质
2015-09-21收到初稿,2016-03-25收到修改稿。
联系人及第一作者:唐建峰(1973—),男,教授。
Received date: 2015-09-21.
Foundation item: supported by the Development of Large Tower for Natural Gas Pretreatment ([2014]495) and the Fundamental Research Funds for the Central Universities Fund (14CX05033A).
引 言
天然气脱碳是天然气预处理工艺的关键环节,天然气脱碳工艺方法种类繁多,如化学吸收法、物理吸收法、膜分离法等[1-3]。目前醇胺法由于其吸收容量大、传质速率快、脱除率高等优点仍然是脱碳工艺中应用最为广泛的方法[4-6]。天然气脱碳用胺液种类较多,常用的有伯胺、仲胺、叔胺、烯胺等,国内外学者在研究各种胺液气液传质动力学时采用的理论主要有双膜理论、渗透理论、表面更新理论[7-11]。
本文以双膜理论为基础,结合胺液与CO2反应机理,建立MDEA、MEA单一胺液及两者混合溶液的化学反应动力学模型,并计算各胺液的基本动力学参数、增强因子、传质速率,旨在为天然气工业脱碳工艺提供理论指导。
1 气液反应理论与模型建立
1.1MDEA+MEA混合胺液气液反应理论
MDEA+MEA混合胺液中与CO2反应的粒子有水分子、MDEA分子、MEA分子、OH−。各种粒子与CO2的反应具体过程如下。
(1)CO2的水解反应[12-15]在二氧化碳的水解反应环节,主要分析CO2气体分子与水分子和OH−的反应。
(2)CO2与MDEA的反应虽然CO2的水解反应可以发生,但是MDEA分子可以加速这一反应过程,这可以用Donaldson等[16]提出的碱催化水合机理来解释。该理论认为:MDEA与CO2首先反应生成两性离子化合物,然后两性离子化合物快速水解反应。
(3)CO2与MEA的反应MEA的反应机理比较成熟,普遍认为的是两性离子机理[17-18],理论核心是MEA与CO2首先生成氨基甲酸盐类物质,然后进行该物质的水解反应。
1.2MDEA+MEA混合胺液交互作用理论
由1.1节反应理论可以得出混合胺液的反应速率,但是该部分并不能详细阐述MEA分子和MDEA分子共同存在时,粒子之间相互影响而使反应速率增加的原因。所以在1.2节主要介绍MDEA+MEA混合胺液的交互作用。混合胺液的交互作用可以用质子反应来表示。该反应主要发生在胺液和CO2反应所生成的两性离子RNH2+COO−,存在交互作用时,反应方程式修正为[19-20]

其中,β定义为化学反应交互作用系数,其值为0~1,当β=0时,则表示两种胺液不存在化学反应交互作用。交互作用系数可以通过增强因子进行计算
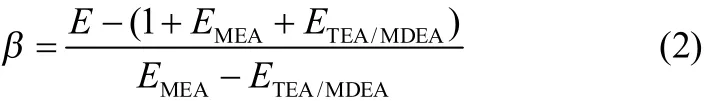
1.3动力学模型的建立
Lewis等[21]提出双膜理论计算传质速率的公式为

式中,k0L表示无化学反应时的传质系数,本文采用Danckwerts等[18]测定液相总传质系数,即通过测定蒸馏水吸收纯CO2的瞬时速率与时间的对应关系,结果显示,在本次研究采用的反应釜中测得结果为1×10−4~6×10−4m·s−1;CAi表示气液界面处气体的浓度,计算时采用亨利定律进行计算;CA0表示液相内部所含气体浓度,由于液相内部气体浓度很低,可忽略不计,即CA0=0。要想求解方程式(3),仍需要确定增强因子E,其确定过程如下。
假设不同种类胺液吸收CO2时,CO2用A来表示,4种不同种类的胺液用B来表示,B的化学计量数为α,垂直于界面的方向为Z方向,在液膜内部取一微元段,长度为dz,在该微元段内建立扩散-反应方程得
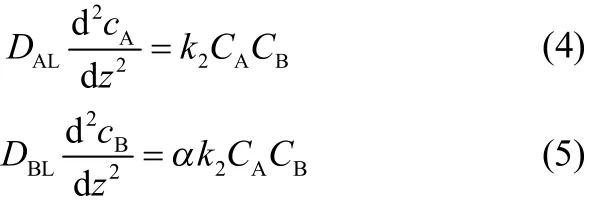
边界条件设定为

可得增强因子的表达式为
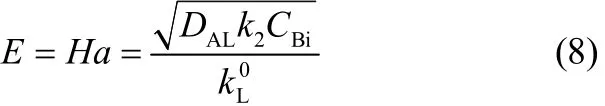
综合上述分析可得传质速率的表达式为

公式中的二级反应速率常数、扩散系数、胺液浓度和亨利系数都能够通过计算拟合出来,通过公式可以计算出各种胺液及实验条件下的理论传质速率。
2 实验部分
本文是采用文献[22]中所使用的实验装置,如图1所示。其实验内所产生的系统误差主要来自于温度传感器及压力变送器。反应釜内温度采用Pt100温度传感器进行测量,准确度为±0.2%;而釜内的压力采用Rosemount 3051型差压式压力变送器进行测量,精度0.075%,在实验研究误差允许范围内。在实验过程中,气液两相传质过程是在反应釜内进行的。本文采用的实验是:在反应开始时向反应釜充入一定压力气体,随着传质过程的进行气体的压力会逐渐降低,通过反应釜的感应器可以得到每一时刻的压力变化值,根据压力变化和气体状态方程计算得到每一时刻的传质通量,通过实验计算得到的传质通量的表达式为

式中,S为胺液吸收面积,即反应釜截面积与搅拌轴截面积之差;Δn为反应过程中消耗的CO2的物质的量,可通过气体状态方程计算得到。

图1 吸收实验装置Fig. 1 Absorption experimental flow chart1—pure CO2gas;2—pressure reducing valve;3,4,5,6—needle valve;7—pressure sensor;8—constant temperature water bath; 9—vacuum pump;10—reaction kettle;11—magnetic stirring;12—gas phase temperature sensor;13—liquid temperature sensor;14—data acquisition system
3 结果与讨论
3.1单一胺液化学反应动力学研究
3.1.1模型验证动力学模型验证实验过程中,胺液的总浓度为3 mol·L−1。CO2气体的压力为0.21 MPa。根据实验数据和动力学模型分别计算不同吸收温度下传质速率的实验值与理论值,并进行对比,结果如图2所示。
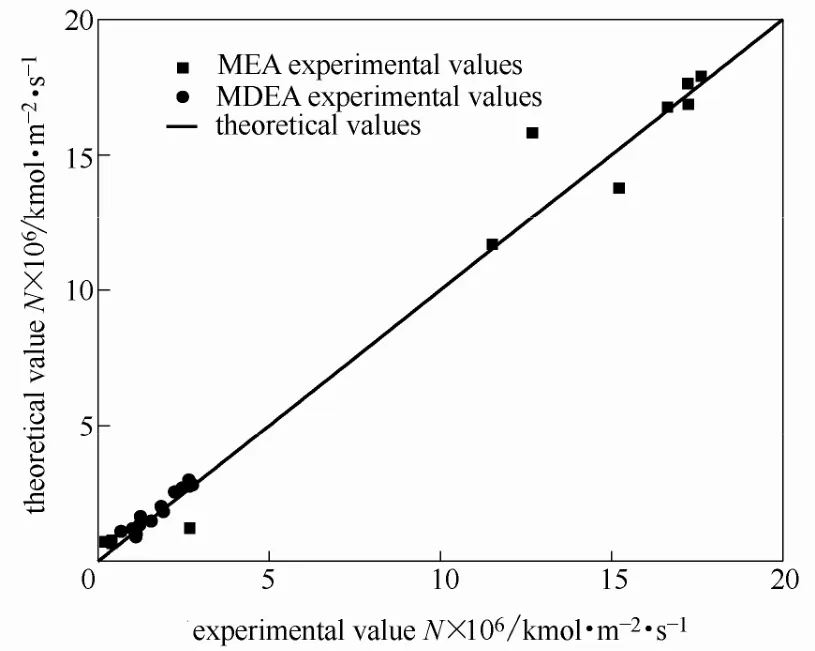
图2 单一胺液传质速率理论值与实验值的对比Fig. 2 Comparison of single amine mass transfer rates of theoretical value with experimental value
由于MEA传质速率较快,因此,反应时间较短,实验数据点较少。从图2中利用两种胺液动力学模型计算的传质速率理论值与实验值的对比可以看出,MEA、MDEA动力学模型计算值与实验值均吻合较好,模型可以较好地对MEA的理论值进行预测。相比较而言,该模型对MDEA的预测结果比对MEA的预测结果要精准。由于MDEA为叔胺,传质速率较慢,因此,其图像数据点多集中在左下角。MEA传质速率较快,其图像上点多集中在右上方。
3.1.2动力学参数的求解在该部分主要计算胺液和二氧化碳进行气液传质反应过程中的二级反应速率常数k2和化学反应级数。假设胺液的反应级数为m,CO2的反应级数为n,并由于反应过程中胺液过量,将浓度假设为初始浓度,对传质速率微分方程进行简化并取对数,可得线性方程

通过图3中可以看出,不同种类单一胺液的二级反应速率常数数量级相差很大,MEA超过10000 m3·(kmol·s)−1。MDEA为叔胺,二级反应速率常数远远小于伯胺。通过数字可以明显看出,MEA的传质速率优于MDEA。并且随着温度的升高二级反应速率常数变大。
反应级数n计算结果相差不大,以胺液吸收温度50℃,二氧化碳的压力为0.21 MPa为例,计算结果如表1所示。
通过结果可以看出,不同种类单一胺液与CO2的反应基本接近拟一级反应。在两种胺液中,伯胺的反应速率常数较大,反应速度较快的优势比较明显。

图3 胺液二级反应速率随温度的变化Fig. 3 Second-order reaction rates of amines changing with temperature

表1 50℃时胺液吸收CO2的反应级数Table 1 Reaction order of CO2absorption by amines under 50℃
3.1.3增强因子与传质速率本节对MEA、MDEA单一胺液共进行了40、45、50、55、60℃ 5个吸收温度下的增强因子计算,以吸收温度60℃为例,两种不同胺液增强因子随时间的变化如图4所示,增强因子E随温度的变化如图5所示。

图4 60℃时不同种类胺液增强因子随反应时间的变化Fig. 4 Chemical enhancement factors of different amines changing with time under 60℃

图5 胺液增强因子随温度的变化Fig. 5 Chemical enhancement factors of different amines changing with temperature
通过两种不同种类单一胺液在吸收温度60℃下的增强因子对比可以看出,两种不同种类的胺液在反应过程中,化学增强因子接近于直线,但反应结束时,略有下降的趋势,这是由于反应过程中胺液相对于CO2为过量,胺液的浓度几乎不变,化学增强作用保持一致,但实际过程中,在反应结束时,胺液浓度略有下降,因此,导致曲线稍有下降。此外,不同种类胺液曲线有长短之分,曲线越短代表在反应釜CO2含量相同的情况下,吸收时间越短,传质速率越快。从图中可知,MEA的反应速率要远远高于MDEA。通过增强因子随温度的变化曲线可知,随着温度的升高化学反应增强因子逐渐增大,同样,这也是由于二级反应速率常数k2的增加引起的。
根据建立的动力学模型,计算了不同种类单一胺液在60℃不同吸收温度下的传质速率随时间的变化情况,如图6所示。

图6 60℃下不同种类胺液传质速率的对比Fig. 6 Comparison of mass transfer rates of amines under 60℃
通过图6可以看出,在相同的吸收温度下,MEA、MDEA两种单一胺液传质速率均随着时间的增长而逐渐降低,最终趋于0。其中,MEA由于与CO2均属于液膜内可以完成的快速反应,因此,传质速率变化规律较为一致,反应时间较短,大多数时间内,均能保持较高的传质速率,但在接近吸收结束阶段时,传质速率突然下降,分析原因认为是由于吸收实验的初期,CO2分布比较均匀,其扩散作用对吸收的影响较为一致,随着反应的进行,气液界面CO2浓度迅速降低,CO2扩散作用成为反应的控制因素,因此造成传质速率下降趋势加快,出现陡降;MDEA为叔胺,由于其分子中均不含氢质子,不能与CO2直接反应,因此,传质速率随时间变化较为缓慢,反应时间较长。上述两种单一胺液传质速率的变化规律与实验结果一致。
3.2混合胺液化学反应动力学研究
3.2.1模型验证本次模型验证所用的混合胺液配比如表2所示,采用的气体为CO2纯酸气,气体压力为0.21 MPa,气液传质的吸收温度控制在50℃,气液传质反应釜的搅拌速率为220 r·min−1。3种不同配比胺液的动力学模型验证结果如图7所示。

表2 MDEA+MEA混合胺液配比组分Table 2 Component ratios of MDEA+MEA mixed amines

图7 MDEA+MEA混合胺液传质速率理论值与实验值的对比Fig. 7 Comparison of MDEA+MEA mixed amine mass transfer rates of theoretical value with experimental value
通过图7可以看出,本文建立的MDEA+MEA混合胺液的动力学模型准确性较好,但在反应即将终止阶段,传质速率实验值较小,此时,3种不同配比下传质速率的实验值和理论值偏差略大,且随着MEA添加量的增加,这种误差逐渐增大。MEA、MDEA单一胺液的传质反应符合拟一级反应,但是当MDEA+MEA混合胺液进行脱碳反应时,由于胺液之间的交互作用使得其反应速率大于相同浓度单一胺液的反应速度。并且随着MEA浓度的增大,混合胺液的交互作用也随之增大,使得混合胺液反应速度更快。因此MEA浓度较高混合胺液的反应速度略大于拟一级反应模型计算出的反应速度,导致模型存在偏差。但这不影响总体模型的准确性以及后续进一步的分析。
3.2.2动力学参数的求解根据2.3节建立的混合胺液的动力学模型,计算混合总胺浓度为3 mol·L−1,不同吸收温度(40、50和60℃),不同配比条件下的表观反应速率,如图8所示。

图8 不同温度条件下不同配比混合胺液表观反应速率常数曲线Fig. 8 Apparent reaction rate of different component ratio mixed amines under different temperatures
通过图8的结果对比可以看出,3种吸收温度下,随着MEA添加量的增多,两种混合胺液的表观反应速率常数均逐渐增大,且在吸收温度较低时,表观反应速率常数随着MEA添加量的增加呈现线性增长,随吸收温度升高,逐渐偏离线性关系。这说明采用拟一级反应来描述MDEA和MEA与CO2的反应在吸收温度较高时存在一定的偏差,吸收温度较低时,准确度较高。此外,可以看出,MEA即使少量的添加也能增大反应速率,说明MEA可以大大提高叔胺的吸收性能。
3.2.3增强因子与传质速率基于建立的动力学模型,分析了不同配比下混合胺液气液传质过程的增强因子与传质速率,本次计算采用的二氧化碳气体为0.21 MPa,吸收温度为50℃,计算的结果如图9~图11所示。
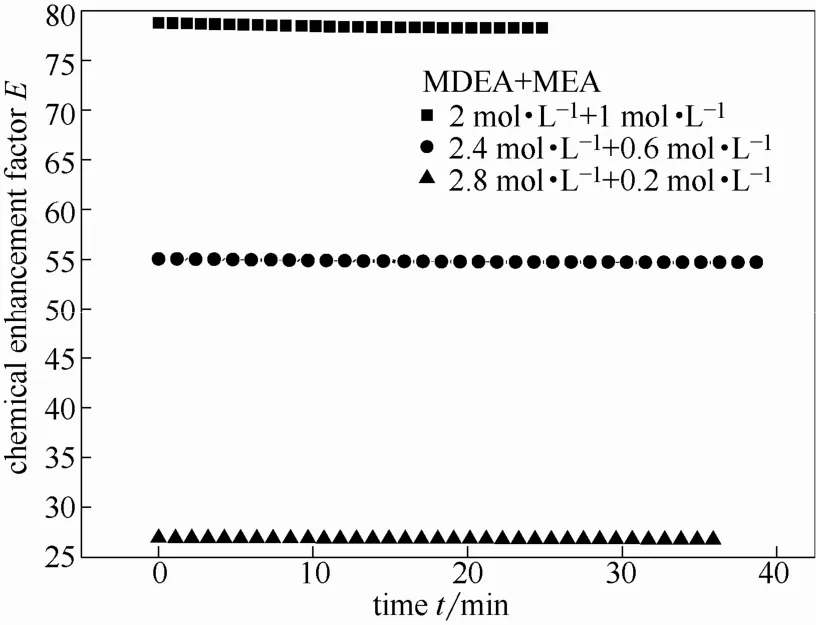
图9 不同配比混合胺液增强因子随反应过程的变化Fig. 9 Chemical enhancement factors of different component ratio mixed amines changing with time
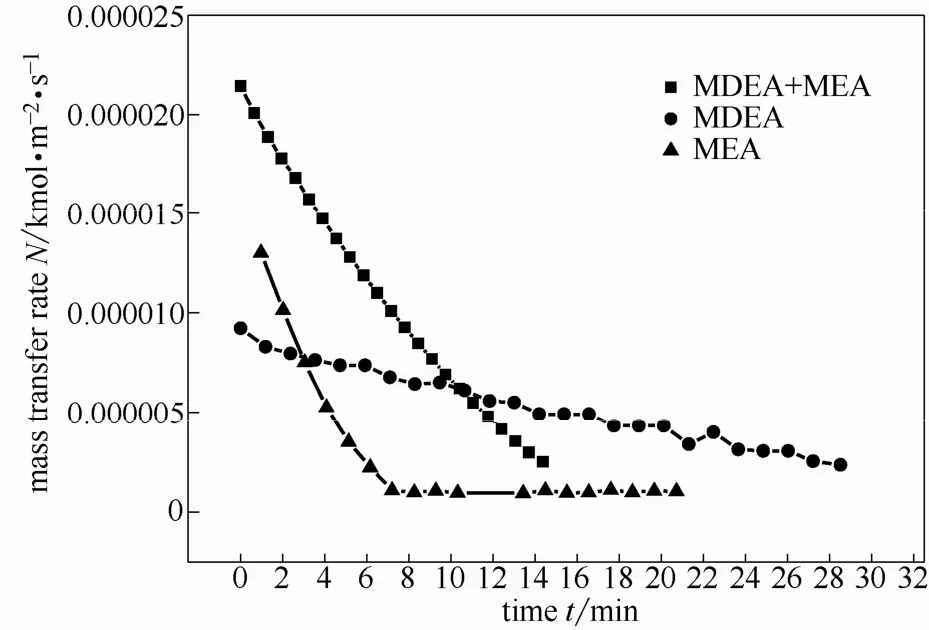
图10 2 mol·L−1MDEA+1 mol·L−1MEA的传质速率随时间的变化Fig. 10 Mass transfer rate of 2 mol·L−1MDEA+1 mol·L−1MEA changing with time
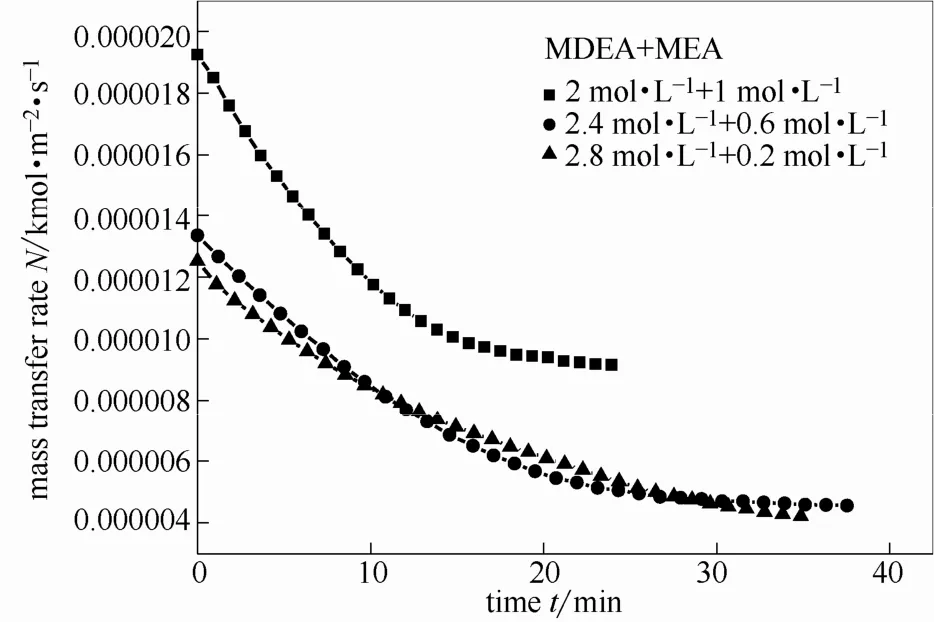
图11 不同配比混合胺液传质速率随时间的变化Fig. 11 Mass transfer rates of different component ratio mixedamines changing with time
通过图9可以得到:当配比选用2 mol·L−1MDEA +1 mol·L−1MEA时,混合胺液的增强因子最大。随着反应时间的推移,增强因子略微减小。这是因为随着反应的进行MEA的浓度减少速率大于MDEA的减少速率,增强因子会产生下降。由于胺液的量远远大于气体的量,所以增强因子下降不明显。
通过图10可以看出,随着反应的进行,MEA含量降低,MDEA+MEA传质速率开始明显下降。此外,由图可以看出,混合胺液的传质速率并不是单纯的相同浓度的两个单一组分传质速率的叠加,由图2 mol·L−1MDEA与1 mol·L−1MEA混合后,与2 mol·L−1MDEA和1 mol·L−1MEA传质速率的叠加之和相比还要高,特别是反应刚开始阶段。这是由于反应开始阶段,反应主要以MEA为主,随着反应的进行,MEA逐渐被消耗完全,吸收过程转而以MDEA为主。
上述现象存在的原因是存在交互作用,导致混合胺液的传质速率较单一胺液会大大增加。通过图11可以看出,添加MEA之后,对两种混合胺液来说,其传质速率都有提升。MEA含量越高,传质速率越大。这充分说明混合胺液之间存在交互作用,不同配比胺液交互作用的大小不同。当MEA含量为33.3%时,交互作用明显,传质速率明显提升。3.2.4交互作用通过对两种混合胺液在3种不同MEA添加比例条件下的实验,计算得出交互作用系数随着MEA配比以及液相负荷的变化结果,如图12所示。

图12 不同MEA添加比例的交互作用系数Fig.12 Interaction coefficient of different MEA proportions
通过图12可以看出两种混合胺液表现出了明显的化学反应交互作用,随着MEA添加比例的增加,交互作用系数快速增长。在MDEA+MEA混合胺液中,当MEA添加比例为33.3%时,交互作用系数达到0.5左右。
通过图13可以看出,随着混合胺液吸收的进行,两种胺液的交互作用逐渐减弱。吸收开始阶段,交互作用系数较高,此时,吸收主要以MEA为主。随着反应的进行,液相负荷逐渐增大,MEA逐渐被消耗,溶液中碱性变弱,此时,叔胺由于浓度较高,碱性比MEA高,逐渐成为吸收的主体胺液,此时,混合胺液的增强因子主要由叔胺提供。因此,可以看出,交互作用的大小与液相吸收负荷以及溶液中MEA的浓度均有直接的关系。
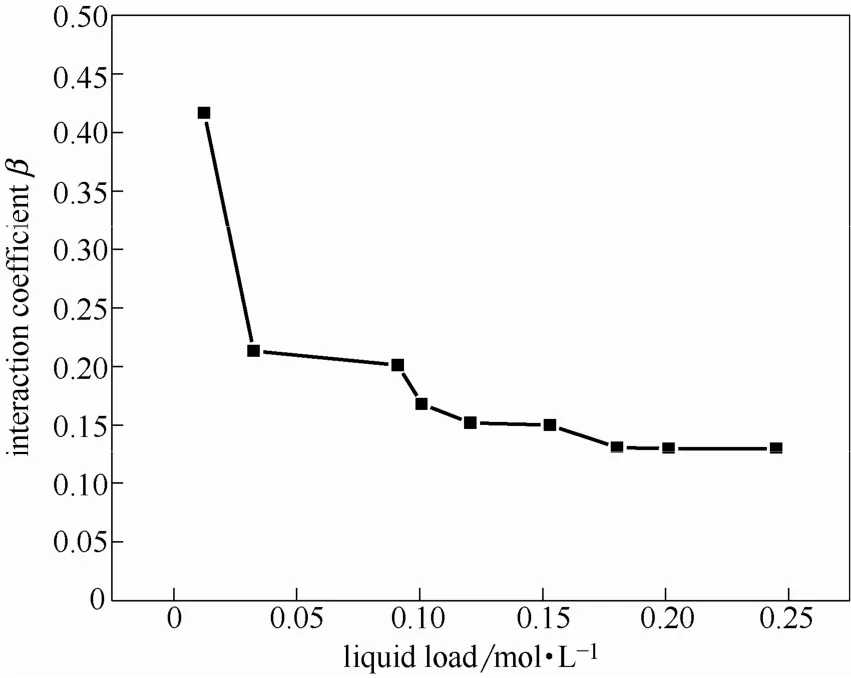
图13 2 mol·L−1MDEA+1 mol·L−1MEA交互作用系数随液相负荷的变化Fig. 13 Interaction coefficient of 2 mol·L−1MDEA+1 mol·L−1MEA changing with liquid load
4 结 论
(1)采用拟一级反应建立的单一胺液化学反应动力学模型可以很好地预测伯胺以及叔胺的气液传质性能。MDEA+MEA混合胺液动力学模型与实验值吻合较好,但随着MEA浓度的增加,模型的准确度有所降低。
(2)对于单一胺液,从动力学参数分析来看,MEA的二级反应速率常数k2较大,MDEA二级反应速率常数远远小于MEA。随着温度的升高,二级反应速率常数增大。从增强因子与传质速率分析来看,MEA单一胺液的增强因子E要远远大于MDEA。随着气液传质过程进行增强因子逐渐减小,当温度升高时,增强因子变大。从传质速率分析来看,MEA传质速率远远大于MDEA,随着气液传质过程进行,传质速率逐渐减小。
(3)对于混合胺液,表观反应速率常数Kapp以及增强因子E随着MEA浓度的增加以及温度的升高而逐渐增大。MDEA+MEA混合胺液的增强因子大于各单一组分胺液增强因子的和。MDEA+MEA混合胺液交互作用系数随着MEA浓度的增加而增大。但是随着反应的进行,MEA浓度逐渐减小,交互作用系数逐渐下降。当总胺浓度为3 mol·L−1时(2 mol·L−1MDEA +1 mol·L−1MEA),传质速率较大,吸收效果较好,为最优配比。
符号说明
CA——气相浓度,kmol·m−3
CAL——气体在液相中的浓度,kmol·m−3
CAi——气液界面处气体的浓度,kmol·m−3
CA0——液相内部所含气体浓度,kmol·m−3
CB——液体浓度,kmol·m−3
CBi——每一时刻胺液在液相中的浓度,kmol·m−3
CBL——胺液在液相中的浓度,kmol·m−3
cCO2——CO2浓度,kmol·m−3
DAL——气体在液相中的扩散系数,m2·s−1
DBL——胺液在液相中的扩散系数,m2·s−1
dz——z方向上的液膜厚度,m
E——增强因子
HA——亨利系数,kmol·(m3·MPa)−1
Ha——八田准数
k2——二级反应速率常数,m3·(kmol·s)−1
k0L——无化学反应时的传质系数,m·s−1
kov——总包反应速率常数,s−1
k′——常数
N——传质速率,kmol·(m2·s)−1
NCO2——传质通量,kmol·(m2·s)−1
n——反应级数
Δn——反应过程中消耗的CO2的物质的量,kmol
Pg——气相分压,MPa
S——胺液吸收面积,m2
τ——时间,s
α——反应级数
β——化学反应交互作用系数
下角标
A——气体
B——胺液
L——液相
i——任一时刻
References
[1]冯叔初, 郭揆常, 等. 油气集输与矿场加工[M]. 东营: 中国石油大学出版社, 2006: 367-399. FENG S C, GUO K C, et al. Oil and Gas Gathering and Refinery Processing[M]. Dongying: China University of Petroleum Press, 2006: 367-399.
[2]苏欣, 古小平, 范小霞. 天然气净化技术研究进展 [J]. 宁夏石油化工, 2005, (2): 1-5. SU X, GU X P, FAN X X. Review of natural gas purification process [J].Ningxia Petroleum and Chemical Industry, 2005, (2): 1-5.
[3]王兰芝, 李桂明, 杨红健, 等. 天然气净化技术研究进展 [J]. 河南化工, 2006, (23): 11-13. WANG L Z, LI G M, YANG H J, et al. Research progress of natural gas purifying processes [J]. Henan Chemical Industry, 2006, (23): 11-13.
[4]HANNA K P, ANDRZEJ C. Kinetics of CO2desorption from aqueous N-methyldiethanolamine solutions [J]. Chemical Engineering Journal, 2011, 168(1): 367-375.
[5]姜宁, 李春福, 王远江, 郭庆生. 天然气脱二氧化碳工艺方法综述[J]. 化学工程与装备, 2011, (7): 147-150. JIANG N, LI C F, WANG Y J, GUO Q S. Review of removal processes for carbon dioxide from natural gas [J]. Chemical Engineering & Equipment, 2011, (7): 147-150.
[6]HUGHE T P S P W, 徐正斌, YAN Y X. 二氧化碳脱除工艺优选[J]. 国外油田工程, 2003, 19(1): 32-34. HUGHE T P S P W, XU Z B, YAN Y X. Optimization of carbon dioxide removal process [J]. Foreign Oilfield Engineering , 2003, 19(1): 32-34.
[7]LEWIS W K, WHITMAN W G. Principles of gas absorption [J]. Ind. Eng. Chem., 1924, (16):12-15.
[8]WHITMAN W G. The two-film theory of gas absorption [J]. Chem. Met. Engineering, 1923, 29(4):146-148.
[9]HIGBIE R. The rate of absorption of pure gas into a still liquid during short period of exposure [J]. Trans. AIChE J., 1935, 31: 365-388.
[10]DANCKWERTS P V. Significance of liquid-film coefficients in gas absorption [J]. Ind. Eng. Chem., 1951, 43: 1460-1467.
[11]余国琮, 袁希钢. 化工计算传质学导论[M]. 天津: 天津大学出版社, 2011: 213-214. YU G Z, YUAN X G. Chemical Computational Mass-transfer [M]. Tianjin: Tianjin University Press, 2011: 213-214.
[12]连之伟, 孙德兴. 热质交换原理与设备[M]. 北京: 中国建筑工业出版社, 2011: 60-61. LIAN Z W, SUN D X. Calorific Value Exchange Principle and Equipment [M]. Beijing: China Architecture & Building Press, 2011: 60-61.
[13]仲伟龙. CO2化学吸收技术研究[D]. 杭州: 浙江大学, 2008. ZHONG W L. Study on CO2chemical absorption technology [D]. Hangzhou: Zhejiang University, 2008.
[14]宿辉, 崔琳. 二氧化碳的吸收方法及机理研究 [J]. 环境科学与管理, 2006, 31(8) : 79-80. SU H, CUI L. Research on absorption method and mechanism of carbon dioxide [J]. Environmental Science and Management, 2006, 31(8): 79-80.
[15]王挹薇, 张成芳, 钦淑均. MDEA溶液吸收CO2动力学研究 [J].化工学报, 1991, (4): 466-474. WANG Y W, ZHANG C F, QIN S J. Dynamics research of mdea solution absorb CO2[J]. Journal of Chemical Industry and Engineering(China), 1991, (4): 466-474.
[16]Donaldson T L, Nguyen Y N. Carbon dioxide reaction kinetics and transport in aqueous amine membranes [J]. Ind. Eng. Chem. Fundam., 1980, 19(3): 260-266.
[17]程振民, 朱开宏, 袁渭康. 高等反应工程教程[M]. 上海: 华东理工大学出版社, 2010: 195-202. CHENG Z M, ZHU K H, YUAN W K. A Senior Course of Chemical Reaction Engineering on the Graduate Level[M]. Shanghai: East China University of Science and Technology, 2010: 195-202.
[18]DANCKWERTS P V, MCNEIL K M. The absorption of carbon dioxide into aqueous amine solutions and the effects of catalysis [J]. Trans. Inst. Chem. Eng., 1967, 45: T32-T49.
[19]刘应书, 魏广飞, 张辉. 填料吸收塔内乙醇胺溶液吸收CO2增强因子 [J]. 化工学报, 2014, 65(8): 3054-3061. LIU Y S, WEI G F, ZHANG H. Enhancement factor of CO2absorption by ethanolamine aqueous solution in packed tower [J]. CIESC Journal, 2014, 65(8): 3054-3061.
[20]CAPLOW M. Kinetics of carbamate formation and breakdown [J]. Journal of the American Chemical Society, 1968, 90(24): 6795-6803.
[21]LEWIS W K, WHITMAN W G. Principles of gas absorption [J]. Ind. Eng. Chem., 1924, (16):12-15.
[22]付浩. 天然气脱酸胺液的筛选及配比优化研究[D]. 青岛: 中国石油大学(华东), 2014. FU H. Studies on screening formula of amine solution basing on MDEA for decarburizing of natural gas and optimizing the ratio [D]. Qingdao: China University of Petroleum, 2014.
Decarbonization reaction kinetics of MDEA and MEA
TANG Jianfeng1, ZHANG Guojun1, SHI Zelin1, HUANG Bin1, WANG Yue2, ZHAO Mingyu1
(1College of Pipeline and Civil Engineering, China University of Petroleum, Qingdao 266580, Shandong, China;2CCCC Gas & Heat Research and Design Institute Co., Ltd., Shenyang 110000, Liaoning, China)
Abstract:Based on the small reaction kettle experiment device, the data approximation could be adopt to establish the kinetics model by two-film theory. Then the reaction kinetics of amine solutions of MEA (monoethanolamine), MDEA (methyldiethanolamine) and both mixtures were analyzed by the model. The reaction kinetics models of MEA and MDEA, which was established by pseudo-first-order reaction, could forecast gas-liquid mass transfer performance of them well after experimental verification. The result showed that the interaction coefficient and mass transfer rate of MEA was higher than that of MDEA. The mass transfer rates decreased with the process of reaction. In addition, the apparent propagation rate constant and enhancement factor of mixed amine increased with the increasing temperature and the ratio of MEA. At last, it forecasted that the mixed amine of MDEA+MEA (2 mol·L−1+1 mol·L−1) had the better decarbonization performance, which had higher mass transfer rate with its enhancement factor of 0.5.
Key words:natural gas; decarbonization; MDEA; MEA; reaction kinetic; mass transfer
中图分类号:TE 644
文献标志码:A
文章编号:0438—1157(2016)06—2355—08
DOI:10.11949/j.issn.0438-1157.20151480
项目基金:天然气预处理用大型塔器研制(工信部联装 [2014]495 号);中央高校基本科研业务费专项资金项目(14CX05033A)。
Corresponding author:Prof. TANG Jianfeng, tangpaper@126.com
