黄芩苷对代谢性炎症及肠道菌群的调节作用探讨
2016-07-07刘思颖邝枣园张韧谢伟群陈健
刘思颖,邝枣园,张韧,谢伟群,陈健
(1.广州中医药大学基础医学院研究生部,广东广州 510006;2.广州中医药大学基础医学院,广东广州 510006)
黄芩苷对代谢性炎症及肠道菌群的调节作用探讨
刘思颖1,邝枣园2,张韧2,谢伟群1,陈健1
(1.广州中医药大学基础医学院研究生部,广东广州510006;2.广州中医药大学基础医学院,广东广州510006)
摘要:【目的】探讨黄芩苷对高脂血症模型代谢性炎症及肠道菌群的调节作用。【方法】选取32只C57BL/6J雄性小鼠随机平均分为正常组、模型组、黄芩苷高剂量组(剂量为50 mg·kg-1·d-1)、黄芩苷低剂量组(剂量为25 mg·kg-1·d-1)。高脂饲料喂养3周后,2个黄芩苷用药组分别给予不同浓度黄芩苷灌胃5周。采用酶联免疫吸附法检测各组小鼠血清血脂水平以及肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)及内毒素水平,采用Miseq平台对小鼠肠道粪便微生物进行基因测序。【结果】与正常组比较,模型组总胆固醇及低密度脂蛋白水平显著升高(P<0.01),高密度脂蛋白水平显著降低(P<0.01),血清TNF-α、IL-6和内毒素水平显著升高(P<0.01);黄芩苷高剂量组的TNF-α、IL-6、内毒素水平均较模型组显著降低(P<0.05或P<0.01),黄芩苷低剂量组内毒素水平亦较模型组显著降低(P<0.01)。测序生物信息学分析发现,在门的水平,模型组脱铁杆菌门和变形杆菌门数目较正常组显著增多,疣微菌门数目较正常组显著减少。在属的水平,模型组Christensenella、uncultured_ Peptococcaceae、脱硫弧菌属数目较正常组显著增多,而粪球菌属、Akkermansia及uncultured_Lachnospiraceae数目较正常组显著减少;黄芩苷高、低剂量组脱硫弧菌属丰度均较模型组降低。各组革兰氏阴性菌与革兰氏阳性菌数目之比,模型组较正常组显著升高(P<0.05),黄芩苷低剂量组较模型组显著降低(P<0.05)。【结论】黄芩苷能治疗高脂饮食引起的代谢性炎症,这可能与黄芩苷能调节肠道菌群的结构有关。
关键词:黄芩苷;代谢性炎症;肠道菌群;革兰氏阴性菌
目前,高脂饮食以及缺乏锻炼的不良生活方式逐渐影响着人类的健康。研究表明:长期高脂饮食、体内营养过剩容易引起高脂血症,患者长期处于炎症的状态,则肠道菌群的结构也会发生改变,这些异常与许多疾病的发生密切相关[1-4]。中药黄芩提取出的单体黄芩苷具有一定的抗炎功效[5-6]。因此,本研究观察了黄芩苷对高脂饮食引起的小鼠高脂血症模型代谢性炎症及肠道菌群结构紊乱的作用,初步探讨黄芩苷抗代谢性炎症的机制,现报道如下。
1 材料与方法
1.1动物与饲料C57BL/6J小鼠,SPF级,雄性,体质量17~20 g,合格证号:SCXK(粤)2013-0002,由广东省医学实验动物中心提供。喂养于广州中医药大学实验动物中心SPF级实验室,实验许可证号:SYXK(粤)2013-0085。小鼠高脂饲料由广东省医学实验动物中心配制,配方质量分数分别是:常规饲料83%、猪油10%、蛋黄粉5%、胆固醇1.5%;胆盐0.5%。
1.2药物、试剂及仪器黄芩苷(中国食品药品检定研究院,批号:110715-201318);总胆固醇(TC)测试盒(批号:20150929)、高密度脂蛋白(HDL)测试盒(批号:20150930)、低密度脂蛋白(LDL)测试盒(批号:20150919)均购自南京建成生物工程研究所;肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)及内毒素酶联免疫吸附检测试剂盒均购自北京诚林生物科技有限公司;粪便DNA提取试剂盒(德国Qiagen公司,批号:151024773)。多通道移液器(德国Eppendorf公司,型号:30-300uL);分析天平(德国Sartorius公司,型号:BS124S);高速冷冻离心机(湖南赫西仪器装备有限公司,型号:3H24RI);多标记微孔板检测仪(美国PerkinElmer公司,型号:Enspire)。
1.3动物分组、造模与给药取C57BL/6J雄性小鼠32只适应性喂养1周后,按体质量随机分为4组,分别为正常组、模型组、黄芩苷高剂量组和黄芩苷低剂量组,每组8只,遂开始实验。除正常组小鼠日常喂以常规饲料外,其他组小鼠均日常给予高脂饲料喂养以造高脂血症模型。当实验进行到第4周时开始每日定时1次灌胃干预,正常组与模型组均灌胃0.5 mL/d/只无菌生理盐水;黄芩苷高剂量组灌胃黄芩苷50 mg·kg-1·d-1(临床等效量的10倍);黄芩苷低剂量组灌胃黄芩苷25 mg·kg-1·d-1(临床等效量的5倍);黄芩苷均用无菌生理盐水稀释。连续灌胃5周后,将小鼠麻醉摘眼球取血后处死,并无菌操作取其盲肠部粪便。
1.4血脂及IL-6、TNF-α、内毒素指标检测用无菌、无热源的EP管取得血液,室温静置1 h后,于4℃、3 000 r/min离心20 min,吸取上层血清,分装保存于-80℃,分别按试剂盒操作说明测定TC、HDL与LDL水平。采用酶联免疫吸附试验严格按照试剂盒说明书测定血清中IL-6、TNF-α、内毒素的浓度,内毒素检测时运用的各种实验耗材均为无热源产品。
1.5粪便菌群的基因组DNA提取与PCR扩增将各组小鼠肠道新鲜粪便放入无菌冻存管-80℃冻存,依照试剂盒说明书步骤提取小鼠粪便菌群的基因组DNA。利用Qubit2.0 DNA检测试剂盒对基因组DNA精确定量后,采用引物341F 5’-CCTACGGGNGGCWGCAG-3’,785R 5’-GACTACHV GGGTATCTAATCC-3’,扩增细菌16S rDNA的V3-V4区。PCR反应体系为:5×FastPfu缓冲液4 μL、2.5 mmol/L脱氧核糖核苷三磷酸(dNTP)2 μL、5 μmol/L的正向引物0.8 μL、5 μmol/L的反向引物0.8 μL、FastPfu多聚酶0.4 μL、DNA 10 ng,加ddH2O至总体积20 μL。PCR反应条件为:1×(3 min、95°C);32×(30 s、95℃;30 s、55℃;45 s、72℃);10 min,72℃、10℃保存。PCR产物上样3 μL用20 g/L琼脂糖凝胶80 V恒压,40 min电泳以鉴定结果。对DNA进行回收,回收产物用Qubit 2.0定量,根据测得的DNA浓度,将所有样品按照1∶1的比例进行混合;混合后充分震荡均匀。该混合样品接下来用于后续的样品建库(加测序标签)与Miseq高通量测序平台进行高通量测序。
将引物序列、短片段、低复杂度及低质量序列、非靶区域序列、嵌合体去除后,将高质量序列的生物信息学从以下方面分析:(1)操作分类单元(OTU)分类。将多条序列按其序列间的距离对相似性在97%以上的序列进行聚类归并,生成接近于属的分类操作单元OTU。(2)采用软件RDP classifier进行物种分类。采用Nave Bayesian assignment算法对每条序列在genus水平上计算其分配到此rank中的概率值,分类阈值为0.8。(3)alpha多样性分析,采用Coverage、richness、ACE、Chao1、Shannon评估指数分别对样本进行多样性分析。(4)Beta多样性分析,用来比较多组样本之间的差别度量。(5)比较样本或组间丰度差异,找出样本或组间丰度存在显著差异的菌群。
2 结果
2.1各组小鼠血脂水平比较表1结果显示:模型组小鼠出现了脂代谢紊乱,与正常组比较,模型组总胆固醇及低密度脂蛋白水平显著升高(P<0.01),而高密度脂蛋白水平显著降低(P<0.01),表明造模成功;黄芩苷高、低剂量组与模型组各项血脂水平比较差异均无统计学意义(P>0.05)。
表1 各组小鼠血脂水平比较Table 1 Comparison of mouse blood fat levels in various groups (±s)
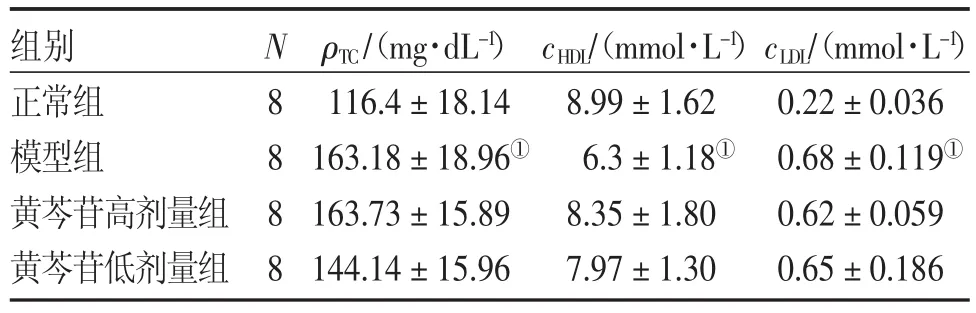
表1 各组小鼠血脂水平比较Table 1 Comparison of mouse blood fat levels in various groups (±s)
①P<0.01,与正常组比较
组别正常组模型组黄芩苷高剂量组黄芩苷低剂量组N8888 ρTC/(mg·dL-1)116.4±18.14 163.18±18.96①163.73±15.89 144.14±15.96 cHDL/(mmol·L-1)8.99±1.62 6.3±1.18①8.35±1.80 7.97±1.30 cLDL/(mmol·L-1)0.22±0.036 0.68±0.119①0.62±0.059 0.65±0.186
2.2各组血清IL-6、TNF-α、内毒素水平比较表2结果显示:模型组血清IL-6、TNF-α、内毒素水平较正常组均显著升高(P<0.01);与模型组比较,黄芩苷高剂量组血清IL-6、TNF-α、内毒素水平显著降低(P<0.05或P<0.01),黄芩苷低剂量组内毒素水平显著降低(P<0.01)。
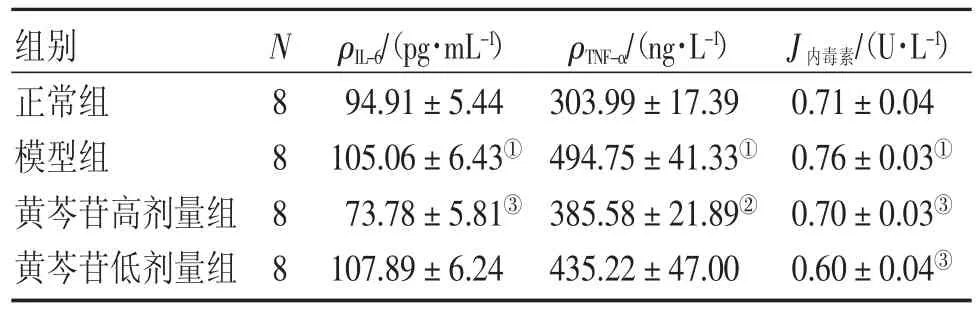
表2 各组小鼠血清IL-6、TNF-α、内毒素水平比较Table 2 Effect of baicalin on serum IL-6,TNF-α and endotoxin in various groups
2.3测序结果
2.3.1菌群多样性分析表3结果显示:OTUs数目的变化中,模型组较正常组显著升高,黄芩苷高剂量组较模型组显著降低(均P<0.05)。Shannon指数主要衡量群落的多样性,模型组群落多样性较正常组显著降低,黄芩苷低剂量组较模型组显著升高(均P<0.05)。ACE与Chao1指数是对菌群物种的总数评估,数据表明模型组较正常组的菌群物种总数大,2个用药组与模型组无明显差异。Coverage指数指各样品文库的覆盖率,正常组、模型组、黄芩苷高剂量组数值均在0.9以上,黄芩苷低剂量组数值稍低,说明样本序列中未被测出的概率较低。β分析得到UniFrac距离如图1,样本间相距越远则菌群差异越大。可以看出,正常组与模型组菌群组内差异均较小,2组的组间差异在4组中最大;黄芩苷高剂量组与黄芩苷低剂量组菌群组内差异均较大,与其余2组组间比较的差异没有一定的规律性。

表3 各组小鼠肠道菌群多样性指数Table 3 The mouse intestinal flora diversity indexes in various groups
2.3.2物种丰度差异门水平的丰度比较见图2,模型组脱铁杆菌门(Deferribacteres)和变形杆菌门(Proteobacteria)数目较正常组增多,疣微菌门(Verrucomicrobia)数目较正常组减少。属水平的丰度比较见图3,模型组Christensenella、uncultured_ Peptococcaceae、脱硫弧菌属(Desulfovibrio)数目明显较正常组升高,而粪球菌属(Coprococcus)、Akkermansia及uncultured_Lachnospiraceae较正常组减少;黄芩苷高剂量组及黄芩苷低剂量组脱硫弧菌属(Desulfovibrio)丰度均较模型组降低。统计丰度最大的前50个菌属(丰度排在50后的菌所占数目比例很小,暂忽略不计),各组的革兰氏阴性菌与革兰氏阳性菌之比(p)均数见图4,结果显示:模型组阴性菌/阳性菌显著高于正常组(P<0.05),黄芩苷低剂量组阴性菌/阳性菌显著低于模型组(P<0.05)。

图1 各样品UniFrac距离Figure 1 Weighted UniFrac distance of various samples

图2 各组小鼠肠道菌群门水平丰度比较Figure 2 Comparison of abundance of mice intestinal flora at phylum level in various groups
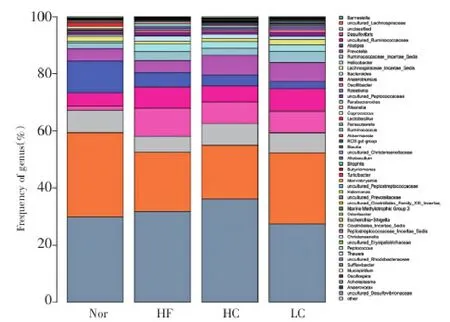
图3 各组小鼠肠道菌群属水平丰度比较Figure 3 Comparison of abundance of mouse intestinal flora at genus level in various groups
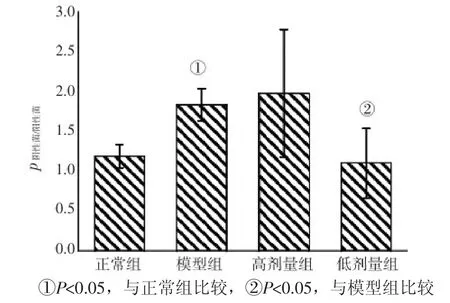
图4 各组小鼠肠道菌群中革兰氏阴性菌与阳性菌的比例Figure 4 The ratio of gram-negative bacteria to grampositive bacteria of mouse intestinal flora in various groups
3 讨论
众多研究已证实,高脂血症患者长期体内存在代谢性炎症,这是由摄入营养物和代谢过剩触发的一种低程度、慢性的系统性炎症。长期的高脂饮食会导致肠道上皮细胞损伤、渗透性增加,肠道微生物的结构改变,细菌和(或)细菌内毒素大量进入循环系统,炎症因子IL-6、TNF-α分泌增加,最终导致代谢性炎症的发生[1-4]。黄芩苷抗炎效果显著,王敏等[7]曾发现黄芩苷能降低ApoE基因敲除小鼠血清中TNF-α水平。在本研究中,高脂饮食后的小鼠血清IL-6、TNF-α及内毒素水平显著升高,经黄芩苷干预后,高剂量组此3项指标显著降低,低剂量组内毒素水平显著降低,表明黄芩苷针对C57BL/6J小鼠单纯高脂饮食导致的炎症反应有明显改善作用。
有研究[8]发现,硫酸盐还原菌的代谢产物会破坏肠屏障,诱导炎症的发生。本研究对各组小鼠肠道微生物基因测序发现,与正常组比较,高脂模型小鼠肠道中属于硫酸盐还原菌类的uncultured_ Peptococcaceae及脱硫弧菌属(Desulfovibrio)增多;同时抗炎细菌[9]Akkermansia减少;而Christensenella、粪球菌属(Coprococcus)及uncultured_Lachnospiraceae在高脂诱导下的变化尚未见其它文献报道,具体原因有待进一步研究。此外,本研究发现黄芩苷对高脂饮食后的菌群结构能起到一定调节作用。2种剂量黄芩苷均能降低脱硫弧菌属(Desulfovibrio)的数目,并且低剂量黄芩苷能降低革兰氏阴性菌的比例。Cani等[10]提出高脂饮食引起的内毒素升高,可能与肠道内革兰阴性菌的增加有关。因此,本课题组推测,黄芩苷能通过调节肠道菌群结构,降低肠道革兰氏阴性菌与阳性菌之比,减少内毒素入血以及炎性因子的分泌,从而减轻代谢性炎症。又因为代谢性炎症的水平受到肠道免疫系统、肠通透性、肠道菌群等多方面因素的影响[1-4]。因此,相对于模型组,低剂量黄芩苷能降低革兰氏阴性菌与阳性菌的比例,但对于IL-6、TNF-α无明显调节作用,高剂量黄芩苷不能降低革兰氏阴性菌比例,而降低了内毒素水平,这些情况可能是由于其他因素的干预所致,具体原因还有待进一步研究。
参考文献:
[1]Ji Y,Sakata Y,Tso P.Nutrient-induced inflammation in the intestine[J].Curr Opin Clin Nutr Metab Care,2011,14(4):315.
[2]Ding S,Lund P K.Role of intestinal inflammation as an early event in obesity and insulin resistance[J].Curr Opin Clin Nutr Metab Care,2011,14(4):328.
[3]任婷婷,卢放根,张尤历,等.高脂饮食对SD大鼠肠道菌群的影响[J].世界华人消化杂志,2010,18(25):2694.
[4]Hu L,Fang X,Liu H,et al.Protective effects of 18βglycyrrhetinic acid on LPS-induced injury in intestinal epithelial cells[J].Chin J Nat Med Jan,2013,11(1):24.
[5]Lin L,Wu X D,Davey A K,et al.The anti-inflammatory effect of baicalin on hypoxia/reoxygenation and TNF -alpha induced injury in cultural rat cardiomyocytes[J].Phytother Res,2010,24(3):429.
[6]Zhu J,Wang J,Sheng Y,et al.Baicalin improves survival in a murine model of polymicrobial sepsis via suppressing inflammatory response and lymphocyte apoptosis[J].PLoS One,2012,7(5):e35523.
[7]王敏,刘向群,陈焕琴,等.黄芩苷对ApoE基因敲除小鼠高敏C反应蛋白、肿瘤坏死因子-α及脂联素的影响[J].中国老年学杂志,2013,33(1):101.
[8]Bisson-Boutelliez C,Massin F,Dumas D,et al.Desulfovibrio spp.survive within KBcells andmodulate inflammatory responses[J].Mol Oral Microbiol,2010,25(3):226.
[9]Festi D,Schiumerini R,Eusebi L H,et al.Gut microbiota and metabolic syndrome[J].World J Gastroenterol,2014,20(43):16079.
[10]Cani P D,Amar J,Iglesias M A,et al.Metabolic endotoxemia initiates obesity and insulin resistance[J].Diabetes,2007,56:1767.
【责任编辑:黄玲】
·中药质量与控制·
Regulatory Effect of Baicalin on Metaflammation and Intestinal Flora
LIU Siying1,KUANG Zaoyuan2,ZHANG Ren2,XIE Weiqun1,CHEN Jian1
(1.Dept.of Postgraduate Affairs,Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China;2.College of Fundamental Medical Science,Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China)
Abstract:Objective To observe the regulatory effect of baicalin on metaflammation and intestinal flora of hyperlipidemic mouse model.Methods Thirty-two male C57BL/6J mice were randomly divided into 4 groups,namely normal group,model group,low- and high-dose baicalin groups(25,50 mg·kg-1·d-1).Mice of normal group were fed with ordinary forage and mice of model group were fed with high-fat forage for 8 weeks.Mice of low- and high-dose group were given gastric gavage of different concentrations of baicalin for 5 weeks after fed with high-fat forage for 3 weeks.Blood lipid,tumor necrosis factor(TNF-α),interleukin 6(IL-6)and endotoxin levels in the serum were determined by enzyme-linked immunosorbent assay(ELISA).Gene sequencing of enteric microorganism was conducted by Miseq system.Results The total cholesterol and low-density lipoprotein of model group were significantly higher(P<0.01),high-density lipoprotein was lower(P<0.01),and TNF-α,IL-6 and endotoxin were notably higher(P<0.01)than those of the normal group.Compared with the model group,TNF-α,IL-6 and endotoxin of high -dose baicalin group were decreased(P<0.05 or P<0.01),and endotoxin level of low -dose baicalin group was also decreased(P<0.01).Bioinformatics analysis results indicated that the abundance of Deferribacteres and Proteobacteria of model group was significantly higher at phylum level,while the abundance of Verrucomicrobia was significantly lower than that of the normal group.At Genus level,the abundance of Christensenella,uncultured_Peptococcaceae and Desulfovibrio of the model group was significantly higher,while the abundance of Coprococcus,Akkermansia and uncultured_Lachnospiraceae was significantly lower than that of the normal group.The abundance of Desulfovibrio of both low- and high-dose baicalin groups was lower than that of the model group.The ratio of gram-negative bacterium to gram-positive bacterium of the model group was increased as compared with the normal group(P<0.05),while that of low-dose baicalin group was decreased significantly compared with the model group(P<0.05).Conclusion Baicalin has therapeutic effect on metaflammation caused by high fat diet,and its mechanism is probably related with the regulatory effect of intestinal flora.
Key words:baicalin;metaflammation;intestinal flora;gram-negative bacterium
中图分类号:R285.5
文献标志码:A
文章编号:1007-3213(2016)03 - 0372 - 05
DOI:10.13359/j.cnki.gzxbtcm.2016.03.021
收稿日期:2016-01-30
作者简介:刘思颖(1990-),女,硕士研究生;E-mail:xiaoying106@foxmail.com
通讯作者:邝枣园,女,教授;E-mail:zyhuang@gzucm.edu.cn
基金项目:广州中医药大学中医基础理论重点学科资助项目
