拟南芥CWINV1启动子GUS表达载体构建及转基因植株的鉴定
2016-07-07任春梅湖南农业大学生物科学技术学院长沙40282作物基因工程湖南省重点实验室长沙4028
程 姣,黄 弈,任春梅,2*(湖南农业大学生物科学技术学院,长沙4028;2作物基因工程湖南省重点实验室,长沙4028)
拟南芥CWINV1启动子GUS表达载体构建及转基因植株的鉴定
程 姣1,黄 弈1,任春梅1,2*
(1湖南农业大学生物科学技术学院,长沙410128;2作物基因工程湖南省重点实验室,长沙410128)
摘 要:CWINV是编码细胞壁蔗糖转化酶的基因。为深入探讨CWINV基因的表达调控机理,构建了拟南芥CWINV1基因启动子的GUS融合表达载体并转入拟南芥,获得了转基因植株。GUS染色的结果进一步验证了重组表达载体的正确性和实用性。
关键词:拟南芥;CWINV1;载体构建;GUS染色
蔗糖转化酶是一种最常见的酶,存在于酵母、细菌和植物中,在植物中能够不可逆地催化蔗糖的水解反应,生成葡萄糖和果糖,因此,蔗糖转化酶在高等植物蔗糖代谢中起着关键的作用。转化酶参与了植物的生长、器官建成、糖分运输、韧皮部卸载及调节库组织糖分构成及水平[1]。根据其最适pH、亚细胞定位和溶解度等方面的不同,蔗糖转化酶可进一步细分为细胞壁蔗糖转化酶、液泡蔗糖转化酶和细胞质蔗糖转化酶[2]。细胞壁蔗糖转化酶基因最先从胡萝卜中分离得到[3],随后在马铃薯、拟南芥、番茄和葡萄等植物中也分离到编码该酶的全长或部分的cDNA序列。细胞壁蔗糖转化酶基因在质外体中表达最活跃,并通过增加蔗糖的浓度梯度加快蔗糖卸载[4]。
目前,在拟南芥中分离出了4个编码细胞壁蔗糖转化酶的相关基因,其中CWINV1基因的表达水平最高[5],但其确切的生理生化功能和作用机制尚不清楚。本研究通过构建CWINV1基因启动子的GUS融合表达载体,转入拟南芥Col - 0野生型中,并通过抗性筛选和GUS染色鉴定,以获得稳定遗传的转基因植株,为深入研究CWINV1基因的表达特征提供基础材料。
1 材料与方法
1.1实验材料
拟南芥(Arabidopsis thaliana)野生型Col -0,大肠杆菌(Escherichia coli)DH5α,根癌农杆菌(Agro bacterium tumefactions)GV3101,载体pCAMBIA1301,由作物基因工程湖南省重点实验室植物信号传导课题组保存。
1.2植物培养条件
将拟南芥种子用消毒液浸泡10 min后,无菌水清洗3次,播种于含1%蔗糖的MS固体培养基上,避光4℃春化3 d后,转入光照培养室生长,培养温度(22±2)℃;光周期为16 h光照/8 h黑暗。待其生长7 d后,移栽到盛有浸透营养液的人工土壤(东北黑土与蛭石的体积比为1∶1)中,移栽后盖透明塑料薄膜1~2 d,生长条件同上。
1.3pCWINV1::GUS表达载体的构建
1.3.1引物设计及CWINV1启动子片段的克隆
根据TAIR网站上公布的拟南芥CWINV1基因上游启动子区域序列,采用Primer Premier 5.0引物设计软件设计1对扩增引物PCWIN - F/ PCWIN -R,并在上下游引物的5′端分别加上PstⅠ和NcoⅠ酶切位点,PCR扩增预期目的片段大小约为1800 bp。克隆引物序列为:
PCWIN - F,5′- AACTGCAGACTTTGATGCCCT G -3′(下划线标记为PstⅠ酶切位点);
PCWIN - R,5′- CATGCCATGGCTTTGTGGCTT -3′(下划线标记为NcoⅠ酶切位点)。
根据合成引物的预测退火温度,确定引物PCWIN - F/ PCWIN - R的最适退火温度为58℃。用SDS法[6]提取拟南芥叶片总DNA,以此为模板,用引物PCWIN - F/ PCWIN - R进行PCR扩增,琼脂糖凝胶电泳后回收目的片段并纯化。
1.3.2载体连接及农杆菌的转化
用PstⅠ和NcoⅠ限制性内切酶对目的片段和pCAMBIA1301载体进行双酶切,回收目的片段和目的载体。用T4连接酶将CWINV1基因启动子连接至pCAMBIA1301载体的相应位点。通过热激法将重组载体转化至大肠杆菌DH5α,取阳性克隆送上海铂尚公司测序。提取测序验证正确的重组质粒通过电击法转化到根癌农杆菌GV3101中,进行菌落PCR鉴定和质粒PCR验证。
1.4拟南芥的转化与GUS染色
挑选经验证已转入重组载体的农杆菌阳性菌落置于含有卡那霉素(50 mg/ L)、庆大霉素(100 mg/ L)、利福平(50 mg/ L)的YEB液体培养基中活化扩大。采用浸花法[7]转化拟南芥Col - 0野生型。收获T0代种子播种于含有潮霉素(25 mg/ L)的MS固体培养基上,长日照培养2周后将抗性植株移栽至含有营养液的人工土壤中正常生长。为了检测目的片段是否已经整合到转化子的基因组上,设计1对载体检测引物pC1301 - F/ pC1301 - R,预期片段大小约为2000 bp。检测引物序列为:
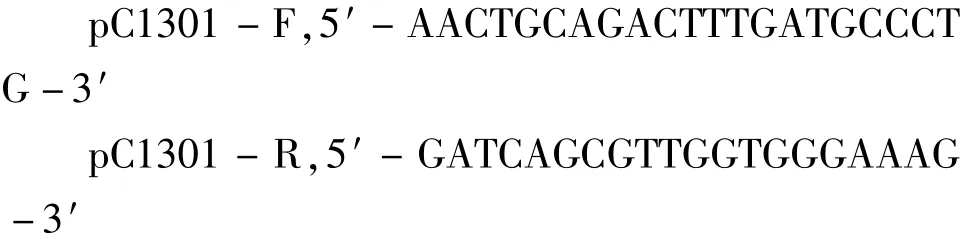
用SDS[6]法提取抗性植株叶片的总DNA,以此为模板,用检测引物pC1301 - F/ pC1301 - R进行PCR检测,同时取拟南芥Col - 0野生型做对照,鉴定转化子。
选取抗性植株的幼苗进一步进行GUS组织化学染色鉴定,同时取相同生长状况的转入pCAMBIA1301质粒的拟南芥幼苗以及Col - 0野生型做对照。取新鲜组织,置于GUS染液中完全浸泡,37℃染色过夜,染色后去除GUS染液,用卡诺固定液脱色5~10 h后75%无水乙醇洗涤1~2次,用显微镜观察染色结果并拍照。
2 结果与分析
2.1CWINV1启动子的GUS表达载体构建
利用PlantCARE对CWINV1基因上游启动子序列进行分析,其包含了大量核心启动子元件TATA - box以及在启动子和增强区域常见的顺式作用元件CAAT - box。此外,该启动子还包含了与光响应有关的元件Box 4、G - Box、I - Box等以及一些热诱导和调控植物激素的元件。这表明CWINV1基因启动子在调控植物生长发育的过程中有着重要的作用。为了进一步确定拟南芥CWINV1基因启动子的时空表达模式,利用PCR克隆了CWINV1基因上游启动子区域序列,约有1800 bp,用限制性内切酶PstⅠ和NcoⅠ双酶切CWINV1基因启动子片段和pCAMBIA1301载体,用T4连接酶将目的片段连接到带有报告基因GUS的pCAMBIA1301载体上,构建成了pCWINV1::GUS融合表达载体(图1)。为了验证载体的正确性,对pCWINV1::GUS进行PstⅠ和NcoⅠ双酶切(图2)。结果显示:目的片段与预期结果相符,表明pCWINV1::GUS表达载体构建成功。

图1 pCWINV1::GUS表达载体示意图Fig.1 Schematic diagram of pCWINV1::GUS vector

图2 pAtCWINV1::GUS表达载体双酶切检测结果Fig.2 Identification of pAtCWINV1::GUS vector by restriction enzyme digestion
2.2拟南芥转化及转化子的鉴定
将构建好的pCWINV1::GUS表达载体通过电击法转入根癌农杆菌GV3101,并利用农杆菌介导的浸花法转入拟南芥Col -0野生型中,获得4株带有潮霉素抗性的植株,移至人工土壤正常生长,提取叶片总DNA,用检测引物pC1301 - F/ pC1301 - R对转基因植株进行PCR检测。PCR产物的电泳结果(图3)显示,Col - 0野生型没有出现条带(1号泳道),而4株抗性植株(2~5号泳道)的PCR产物条带大小与质粒阳性对照(6号泳道)一致。这表明,转基因植株基因组序列中导入了目的片段。
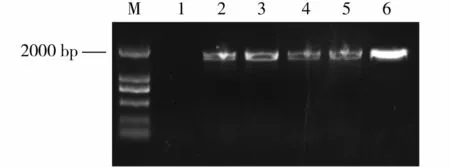
图3 GUS转化子PCR检测结果Fig.3 PCR identification of GUS transformed Arabidopsis
2.3转基因拟南芥的GUS染色检测
为了进一步验证重组载体的正确性和实用性,将转基因拟南芥继代培养并通过PCR检测后的T2代播种于含潮霉素(25 mg/ L)的MS固体培养基上,置于光照培养室生长7 d后对幼苗进行GUS组织化学染色检测,通过光学显微镜观察染色结果。结果显示:GUS基因在未转入重组载体的拟南芥Col -0野生型阴性对照幼苗中没有表达(图4A),而在转入重组载体的Col -0野生型幼苗(图4B)以及转入pCAMBIA1301质粒的阳性对照(图4C)中,GUS基因在幼苗中都有明显表达,进一步证明了CWINV1基因成功启动了GUS基因的表达,故pCWINV1::GUS重组载体成功转入了拟南芥植株。
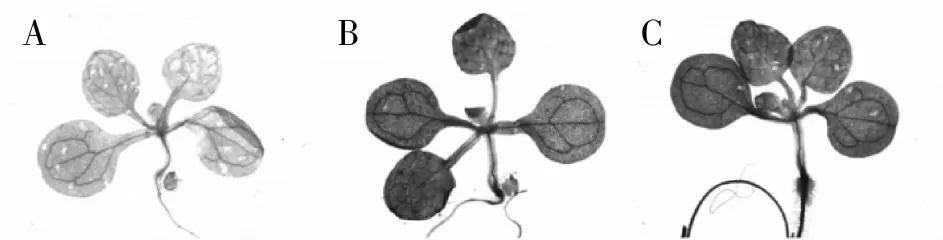
图4 GUS转化子染色检测结果Fig.4 Stain identification of GUS transformants
3 结论与讨论
本研究成功构建了拟南芥细胞壁蔗糖转化酶基因CWINV1启动子的GUS融合表达载体,并通过转化Col -0野生型的方式获得了稳定遗传的转基因植株,为进一步研究CWINV1基因的表达特征提供了可靠的遗传材料。
本研究中构建的载体,目的是使CWINV1启动子启动GUS基因的表达,GUS染色的结果证明了CWINV1基因启动子已转入拟南芥中,而其表达调控机理有待于进一步的分析。高等植物细胞壁上的转化酶是β-呋喃果糖苷酶类的一种,这种细胞壁转化酶可以与单糖转运蛋白协同调控细胞的分裂和生长[8]。现有的研究表明,拟南芥细胞壁转化酶至少由4个基因编码,分别是CWINV1、CWINV2、CWINV4、CWINV5,其中CWINV1基因被普遍认为是蔗糖在韧皮部卸载的一个主效基因[9]。由于植株的生长发育全过程都受控于基因表达,本研究中重组表达载体的成功构建为研究CWINV1基因的表达提供了重要材料,也为深入研究植物细胞壁蔗糖转化酶的分子机制奠定了研究基础。
参考文献:
[1] 刘慧英,朱祝军.转化酶在高等植物蔗糖代谢中的作用研究进展[J].植物学通报,2002,19(6):666 -674.
[2] Hayes MA,Davies C,Dry IB.Isolation,functional characterization,and expression analysis of grapevine hexose transporters:differential roles in sick and source tissues [J].J Exp Bot,2007,58(8):1985 -1997.
[3] Sturm A,Chrispeels MJ.cDNA cloning of carrot extracellular[beta]- fructosidase and its expression in response to wounding and bacterial infection[J].Plant Biologists,1990,2:1107 -1119.
[4] Fromm J,Eschrich N.Correlation of ionic movements with phloem unloading and loading in barley leaves[J].Plant Physiology and Biochemistry,1989,27:577 -585.
[5] Lammens W,Le RK,Van LA,et al.Crystal structures of Arabidopsis thaliana cell - wall invertase mutants in complex with sucrose[J].Molecular Biology,2008,377:378 -385.
[6] Dellaporta SL,Wood J,Hicks JB.A plant DNA mini preparation:VersionⅡ[J].Plant Molecular Biology Reporter,1983,1(4):19 -21.
[7] Clough SJ,Bent AF.Floral dip:a simplified method for〛Agrobacterium - mediated transformation of Arabidopsis thaliana[J].Plant J,1998,16(6):735 -743.
[8] Weschke W,Panitz R,Gubatz S,et al.The role of invertases and hexose transporters in controlling sugar ratios in maternal and filial tissues of barley caryopses during early development[J].Plant,2003,33(2):395 -411.
[9] 阮燕晔,张 莹,王 波.拟南芥atCWINV1基因T -DNA插入纯合突变体PCR鉴定及表型观察[J].河南农业科学,2011,40(5):62 -66.
The GUS Expression Vector Construction of Arabidopsis CWINV1 Promoter and Identification of Transgenic Plants
CHENG Jiao1,HUANG Yi1,REN Chunmei1,2*
(1 College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha,Hunan 410128,China;2 Crop Gene Engineering Key Laboratory of Hunan Province,Changsha,Hunan 410128,China)
Abstract:CWINV gene encoding the cell wall invertase.CWINV play an important role in plant growth and development,especially blooming,fruit setting,seed formation and other reproductive development period.But its function has not been elucidated in detail.In order to further exploring the mechanism of CWINV gene expression and regulation,the plant expression vectors of CWINV1 gene promoter was constructed with GUS fused report genes,and then transformed into Arabidopsis,transgenic plants were obtained.GUS staining results further verifies the correctness and practicability of the recombinant expression vector.
Keywords:Arabidopsis;CWINV1;vector construction;GUS staining
中图分类号:Q78
文献标识码:A
文章编号:1001-5280(2016)03-0237-04
DOI:10.16848/ j.cnki.issn.1001-5280.2016.03.01
收稿日期:2015- 12- 08
作者简介:程 姣(1995 -),女,Email:1196864786@ qq.com;并列第一作者:黄 弈(1990 -),男,硕士研究生,Email:435399406@ qq.com。*通信作者:任春梅,博士,教授,Email:rencm66@163.com。
基金项目:国家自然科学基金项目(30671121);国家级大学生研究性学习和创新性实验计划项目((G)SCX1512)。
