热胁迫对转TasHSP16.9拟南芥幼苗生长生理特性的影响
2017-02-05李静婷赵旭耀刘超凡秦永兴
李静婷++赵旭耀++刘超凡++秦永兴


doi:10.15889/j.issn.1002-1302.2016.10.027
摘要:首先研究小麦16.9 ku小分子热激蛋白(small heat shock protein,简称sHSP)基因(sHSP16.9)3′-UTR中微型反向重复转座元件(miniature inverted-repeat transposable elements,简称MITE)插入对基因表达调控的影响,结果显示:热胁迫下,具有MITE插入的基因型中sHSP16.9基因转录水平较无MITE插入的基因型明显提高,而MITE是一类特殊的DNA介导的转座子,推测其参与基因表达调控。随后研究MITE参与基因表达调控的机制,构建2种不同的植物表达载体pCAMBIA Super-1300+sHSP16.9、pCAMBIA Super-1300+sHSP16.9+MITE转化拟南芥,结果显示:sHSP16.9+MITE超表达的转基因拟南芥中,sHSP16.9基因表达量较sHSP16.9超表达的转基因拟南芥明显提高;高温胁迫下,sHSP16.9+MITE超表达的转基因拟南芥中种子发芽率、幼苗存活率、游离脯氨酸含量均较sHSP16.9超表达的转基因拟南芥明显提高,而丙二醛含量升高的幅度明显低于sHSP16.9超表达的转基因拟南芥。由结果可知,sHSP16.9+MITE超表达的转基因拟南芥耐热性水平较sHSP16.9超表达的转基因拟南芥高,推测sHSP16.9基因3′-UTR中MITE插入增强该基因的表达。
关键词:MITE;TasHSP16.9;3′-UTR;拟南芥;基因调控;小麦;耐热性;生理指标
中图分类号: S188;Q786文献标志码: A文章编号:1002-1302(2016)10-0113-03
收稿日期:2016-03-28
基金项目:国家自然科学基金(编号:31501310);平顶山学院高层次人才科研启动项目(编号:2011015G)。
作者简介:李静婷(1983—),女,内蒙古包头人,博士,讲师,主要从事小麦遗传育种学研究。E-mail:jingting_lee@163.com。在热胁迫条件下,高等植物中诱导合成大量热激蛋白,最丰富的为小分子热激蛋白(small heat shock protein,简称sHSP)。进一步研究发现,高等植物中的sHSP还可在其他环境胁迫条件(如低温、重金属、高盐、干旱等)下诱导合成,而在正常生长环境条件下表达量很低,表明sHSP可能在植物耐胁迫方面发挥重要作用[1-2]。同时,大量研究表明,将sHSP基因转入植物体后,可以显著提高植物的耐热性。Sanmiya等将番茄线粒体sHSPs基因转化烟草,显著提高了烟草的耐热性[3];张路等用灰岩皱叶报春sHSP17-1基因转化拟南芥,转基因拟南芥耐热能力明显提高[4]。热胁迫影响植物的形态结构和生理功能,发芽率、幼苗存活率、丙二醛(MDA)含量、游离脯氨酸含量等指标均能在一定程度上反映植物对高温的抗性水平。
微型反向重复转座元件(miniature inverted-repeat transposable elements,简称MITE)是一类特殊的DNA介导的转座子,经常插入到基因的编码区、内含子、启动子、非翻译区(UTR)而与基因紧密相关。但是,关于MITE插入与基因表达二者之间本质关系的研究还比较少[5-9]。笔者所在课题组前期研究中通过单倍体分析发现,小麦中存在2种单倍型的sHSP16.9基因,即在sHSP16.9基因3′-UTR存在1个 276 bp MITE的插入/缺失。克隆2种单倍型小麦的sHSP169基因全长进行比对分析发现,启动子区仅有单碱基突变差异,对关键顺式作用元件并无影响,主要差异在于3′-UTR内 276 bp MITE的插入/缺失。在高温、低温胁迫条件下,具有MITE插入的基因型中sHSP16.9基因转录水平较无MITE插入的基因型显著提高[10]。进一步分别构建2种不同的植物表达载体pCAMBIA Super-1300+sHSP16.9、pCAMBIA Super-1300+sHSP16.9+MITE转化拟南芥,经潮霉素筛选和PCR检测,获得转基因拟南芥T3代纯系[11]。
本试验利用已筛选获得的2种不同植物表达载体转化的拟南芥纯系进行热胁迫处理,测定种子发芽率、幼苗存活率、丙二醛和游离脯氨酸含量等生长生理指标,分析2种类型转基因植株的耐热能力,进而推测MITE对sHSP16.9基因表达的影响。
1 材料与方法
1.1材料
供试品种是转sHSP16.9+MITE基因拟南芥纯系、转sHSP16.9基因拟南芥纯系,由笔者所在课题组前期筛选获得;此外还有哥伦比亚野生型拟南芥(WT)。
1.2方法
1.2.1转基因拟南芥植株热胁迫条件的设定将转基因拟南芥种子用5%次氯酸钠溶液(含体积分数0.1%的 TritonX-100)处理5 min进行表面消毒,用蒸馏水冲洗6遍。4 ℃春化处理3 d后,将转基因拟南芥种子播种于含 25 μg/mL 潮霉素的MS培养基上,在温室中培养,光—暗周期为16 h—8 h,昼—夜温度周期为22 ℃—18 ℃,湿度60%。培养10 d后选取长势好的幼苗移栽到营养土中,培养4周后,选取生长一致的转基因植株进行42 ℃高温胁迫处理,处理时间分别为2、4、8、12、24 h,光—暗周期为16 h—8 h。分别以2种供试类型的正常生长条件转基因拟南芥植株为对照,每个处理组进行3次独立的生物学重复试验。
1.2.2种子萌发的热胁迫处理将消毒处理后的转基因、野生型拟南芥种子春化处理3 d后,在48 ℃水浴中处理2、3、4、5 h,分别播种在含25 μg/mL潮霉素及普通MS培养基上,于光照培养箱中培养,2周后观察种子的萌发情况,拍照并统计种子的萌发率。
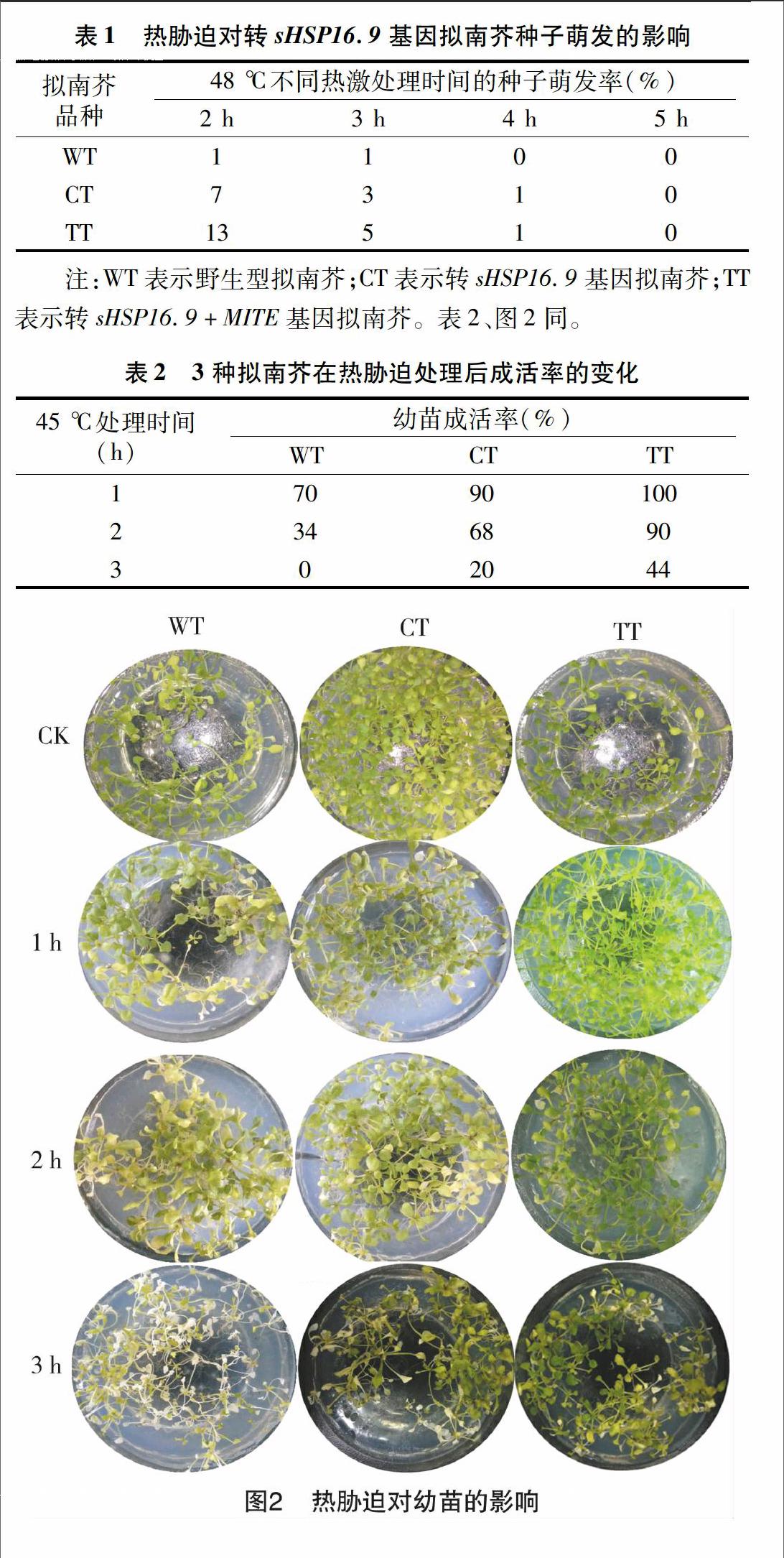
1.2.3幼苗的热胁迫处理将消毒、春化处理后的转基因、野生型拟南芥种子分别播种在含25 μg/mL潮霉素及普通MS培养基上,在组培瓶中培养3周后,对转基因、野生型拟南芥幼苗进行获得耐热性检测,即首先在38 ℃预处理2 h,随后转移至45 ℃致死高温下分别处理1、2、3 h。处理后的拟南芥仍放回光照培养箱中恢复生长6 d,观察表型并且拍照统计成活率。
1.2.4生理指标测定取上述热胁迫处理的转基因、野生型拟南芥植物的叶片进行生理指标测定,每个样品平行测定3次,取平均值。MDA含量采用硫代巴比妥酸比色法[12-13]测定;游离脯氨酸含量采用磺基水杨酸提取比色法[12-13]测定。试验数据利用Excel 2007、SPSS 18.0进行分析。
2结果与分析
2.1转基因拟南芥中sHSP16.9的表达模式
对转基因拟南芥T3代纯系进行半定量分析发现,sHSP16.9+MITE超表达的转基因拟南芥中sHSP16.9基因表达量较sHSP16.9超表达的转基因拟南芥明显提高(图1)。推测sHSP16.9基因3′-UTR中MITE插入增强了sHSP16.9基因的表达。
2.2热胁迫对种子萌发的影响
分别统计处理不同时间点的种子萌发率,由表1可以看出:在48 ℃热胁迫下,拟南芥种子的萌发受到破坏或抑制,随着热激处理时间延长,种子萌发率逐渐下降,在热激处理5 h后,2种类型转基因、野生型拟南芥种子都未萌发;在同一热激处理时间点,转sHSP16.9+MITE基因拟南芥种子萌发率最高,转sHSP16.9基因拟南芥次之,WT的萌发率最低。本试验结果表明,sHSP16.9超表达能明显提高转基因拟南芥的耐热性,而且sHSP16.9+MITE超表达的转基因拟南芥较sHSP16.9超表达的转基因拟南芥耐热性高。结果同时也表明,转sHSP16.9+MITE基因拟南芥中sHSP16.9基因表达量较转sHSP16.9基因拟南芥明显提高。
2.3热胁迫对幼苗的影响
分别统计处理不同时间点的幼苗存活率,由表2、图2可以看出:随着45 ℃热激处理时间延长,拟南芥植株成活率逐渐下降;45 ℃致死高温处理3 h,野生型拟南芥幼苗已完全白化、死亡,转基因拟南芥部分幼苗也出现白化,部分幼苗叶片大面积出现黄绿色,但仍然能够生长,转sHSP16.9+MITE基因拟南芥幼苗成活率最高。本试验结果表明:sHSP16.9超表达能明显提高转基因拟南芥的耐热性,而且转sHSP16.9+MITE基因拟南芥耐热性较转sHSP16.9基因拟南芥明显提高;同时表明,转sHSP16.9+MITE基因拟南芥中sHSP16.9基因表达量较转sHSP16.9基因拟南芥明显提高。
2.4热胁迫对转sHSP16.9基因拟南芥生理指标的影响
2.4.1高温胁迫下丙二醛含量的变化由图3可以看出,在高温胁迫下,2种类型转基因拟南芥叶片中MDA含量均明显增加,都明显高于相应对照;但是转sHSP16.9+MITE基因拟南芥中叶片MDA含量在各处理时间点都低于转sHSP16.9基因拟南芥,表明转sHSP16.9+MITE基因拟南芥的膜脂过氧化作用较小,因而具有更强的耐热能力。
在热胁迫前4 h,2种类型转基因拟南芥叶片MDA含量均升高,可能是由于高温造成植物体内的自由基代谢平衡失调、MDA积累;热胁迫8 h,MDA含量均迅速下降,可能是拟南芥内源热激蛋白被诱导大量表达,协助热变性的蛋白进行正确折叠,并保护细胞膜结构的稳定性,导致MDA含量均迅速下降;随后MDA含量均迅速上升,可能由于拟南芥诱导产生的内源热激蛋白开始降解,膜脂过氧化程度加剧,膜脂过氧化产物MDA含量迅速上升。
2.4.2高温胁迫下游离脯氨酸含量的变化由图4可以看出,高温胁迫会使拟南芥叶片游离脯氨酸含量明显提高,都明显高于对照水平,但转sHSP16.9+MITE基因拟南芥中叶片游离脯氨酸含量在各处理时间点上都高于转sHSP16.9基因拟南芥。可见转sHSP16.9+MITE基因拟南芥对高温胁迫有更积极的响应和应对,表现出较强的耐热性。在前4 h的热处理中,转sHSP16.9基因拟南芥叶片游离脯氨酸含量缓慢提高,2种类型转sHSP16.9基因拟南芥差异不明显;但是在热处理4 h以后,2种类型转sHSP16.9基因拟南芥叶片游离脯氨酸含量迅速提高,且差异明显,可能是拟南芥内源热激蛋白被诱导大量表达,提高了细胞稳定性,促使合成大量游离脯氨酸,从而提高了细胞的耐热性。
3讨论与结论
小麦是我国重要的粮食作物,在农业生产中具有重要地位,但是随着工业经济的迅速发展,温室气体大量排放,全球温度逐渐上升,严重影响了小麦的正常生长发育。由于干热风的影响,一般年份小麦减产10%~20%,严重年份减产30%以上。为此,我国育种学家一直致力于小麦耐热品种的选育和相关耐热基因的功能研究。
在逆境下,植物细胞内氧自由基平衡遭到破坏,发生膜脂过氧化作用,而丙二醛是膜脂过氧化的主要产物,可以反映细胞膜的损伤程度,丙二醛含量越高,说明质膜受损越严重。因此,逆境下的丙二醛含量可以显示质膜受损程度,反映植物的耐性大小。大量研究表明,在高温胁迫下,植物体内丙二醛含量显著增加,但是耐热品种中丙二醛含量低于热敏感品种[14-15]。在热胁迫下,报春PFsHSPs17-1转基因拟南芥叶片中丙二醛含量上升幅度低于野生型对照,表现出较高的抗膜脂过氧化能力,因而具有更强的高温适应能力[4]。
在高温胁迫下,植物为防止细胞脱水而受害,会生成并积累大量渗透调节物质,提高原生质亲水性,有助于细胞持水,保护细胞膜的完整性。游离脯氨酸便是一类重要的渗透调节物质,因此可作为植物抗逆性的一项生化指标。大量研究表明,在高温胁迫下,细胞内游离脯氨酸含量会明显增加,以增强植物的耐热性[15-16]。在高温胁迫下,报春PFsHSPs17-1转基因拟南芥叶片中游离脯氨酸含量明显高于野生型对照,转基因拟南芥对高温胁迫有更积极的响应,表现出较强的耐热性[4]。
在本试验中,转sHSP16.9+MITE基因拟南芥叶片中丙二醛含量上升幅度低于转sHSP16.9基因拟南芥,而前者游离脯氨酸含量、种子发芽率和幼苗成活率均明显高于后者,表明转sHSP16.9+MITE基因拟南芥具有更强的耐热性。同时研究表明,将sHSP转基因超表达后,可以显著提高植物的耐热性[3-4]。也证明转sHSP16.9+MITE基因拟南芥中sHSP16.9表达量高于转sHSP16.9基因拟南芥,进而推测sHSP16.9基因3′-UTR中MITE插入增强了sHSP16.9 基因的表达。同时,本试验中转sHSP16.9基因拟南芥种子发芽率、幼苗成活率均明显高于野生型拟南芥,证明sHSP对提高植物耐热性具有重要的作用,为小麦耐热性育种研究提供了新思路。
参考文献:
[1]Sato Y,Yokoya S. Enhanced tolerance to drought stress in transgenic rice plants overexpressing a small heat-shock protein,sHSP17.7[J]. Plant Cell Reports,2008,27(2):329-334.
[2]Mahmood T,Safdar W,Abbasi B H,et al. An overview on the small heat shock proteins[J]. African Journal of Biotechnology,2009,8(25):7290-7302.
[3]Sanmiya K,Suzuki K,Egawa Y,et al. Mitochondrial small heat-shock protein enhances thermos tolerance in tobacco plants[J]. FEBS Letters,2004,557(1/2/3):265-268.
[4]张路,胡伟娟,张启翔,等. 报春PF sHSP 17-1基因转化拟南芥及耐热鉴定[J]. 生物技术通报,2011(11):177-181.
[5]Yang G,Dong J,Chandrasekharan M B,et al. Kiddo,a new transposable element family closely associated with rice genes[J]. Molecular Genetics and Genomics,2001,266(3):417-424.
[6]Patel M,Jung S,Moore K,et al. High-oleate peanut mutants result from a MITE insertion into the FAD2 gene[J]. Theoretical and Applied Genetics,2004,108(8):1492-1502.
[7]Yang G,Lee Y H,Jiang Y,et al. A two-edged role for the transposable element Kiddo in the rice ubiquitin2 promoter[J]. The Plant Cell,2005,17(5):1559-1568.
[8]Magalhaes J V,Liu J,Guimares C T,et al. A gene in the multidrug
and toxic compound extrusion (MATE) family confers aluminum tolerance in sorghum[J]. Nature Genetics,2007,39(9):1156-1161.
[9] Hou J N,Long Y,Raman H,et al. A Tourist-like MITE insertion in the upstream region of the BnFLC.A10 gene is associated with vernalization requirement in rapeseed (Brassica napus L.)[J]. BMC Plant Biology,2012,12(1):463-480.
[10]Li J T,Wang Z Z,Peng H R,et al. A MITE insertion into the 3′-UTR regulates the transcription of TaHSP16.9 in common wheat[J]. Crop Journal,2014,2(6):381-387.
[11]李静婷,王健胜,杨风玲.小麦MITE转座子对sHSP基因的表达调控研究[J]. 江苏农业科学,2015,43(12):29-32.
[12]陈建勋,王晓峰.植物生理学实验指导[M]. 广州:华南理工大学出版社,2002.
[13]侯福林.植物生理学实验教程[M]. 北京:科学出版社,2004.
[14]叶凡,侯喜林,袁建玉.高温胁迫对不结球白菜幼苗抗氧化酶活性和膜脂过氧化作用的影响[J]. 江苏农业学报,2007,23(2):154-156.
[15]彭华婷,高悦,杜红梅,等. 高温胁迫对大花三色堇幼苗相关生理指标的影响[J]. 上海交通大学学报:农业科学版,2012,30(6):66-71.
[16]万里强,李向林,何峰,等. 热胁迫下两种禾草抗性生理指标的变化[J]. 西南农业学报,2012,25(4):1468-1472.陈明辉,张志录,杨雨华,等. 红豆杉种质资源遗传多样性的目标起始密码子多态性(SCoT)分析[J]. 江苏农业科学,2016,44(10):116-119.
