磁性壳聚糖微球的制备和应用
2016-07-05王楠楠董发才
王楠楠,柴 云,董发才*
(1.河南大学 生命科学学院,棉花生物学重点实验室,河南 开封 475000; 2.河南大学 化学化工学院,河南 开封 475004)
磁性壳聚糖微球的制备和应用
王楠楠1,柴云2,董发才1*
(1.河南大学 生命科学学院,棉花生物学重点实验室,河南 开封 475000;2.河南大学 化学化工学院,河南 开封 475004)
摘要:磁性壳聚糖微球是通过一定的方法用壳聚糖将磁性材料包埋而形成的磁性微球,其内核为纳米级的磁性金属微粒,外层为壳聚糖. 壳聚糖含有大量的氨基和羟基,使其具有特定的理化性质,由此奠定了壳聚糖的许多生物学特性及加工特性的基础. 另一方面,其磁性内核使磁性壳聚糖微球具有很好的顺磁性,利用外加磁场可以很方便地进行分离. 因此磁性壳聚糖在固定化酶、污水处理、食品工业和生物医药等方面具有广泛的用途,磁性壳聚糖的制备及应用的相关研究也越来越受到重视. 本文作者对磁性壳聚糖微球的制备和应用进行评述.
关键词:磁性壳聚糖微球;改性;固定化;应用
磁性高分子微球是指通过适当方法将高分子材料和磁性金属或磁性金属氧化物的超细微粒包裹起来形成的一种复合磁性微球[1],这是近年发展起来的一种新型磁性材料. 通过接枝共聚或包埋的方法使得无机磁性材料表面结合富含功能基团(如-OH、-COOH、-CHO、-NH2,等)的有机高分子材料,能够与多种物质结合,还具有超顺磁性,在外加磁场作用下可以快速分离[2]. 用于制备复合磁性微球的高分子材料有很多种,如:壳聚糖、纤维素、淀粉、明胶,聚苯乙烯、聚丙烯酰胺等. 其中壳聚糖在制备磁性高分子微球中的应用最为广泛[3-4].
壳聚糖(Chitosan,简称CS),化学名称为β-(1→4)-2-氨基-2-脱氧-D-葡萄糖. 它是自然界中储量最丰富的碱性天然多糖,可以由蟹、虾壳中的甲壳素经脱乙酰反应后得到. 其结构式如图1所示. 壳聚糖独特的分子结构使其易于进行化学修饰,同时壳聚糖无毒,具有良好的生物相容性、生物可降解和可再生等优良的特性[5], 在工业和生物医学等领域有着广泛的应用. 但壳聚糖在酸性溶液中易溶解而难以从吸附基质中分离,易被酸水解而稳定性差, 限制了壳聚糖的应用[6-7]. 将壳聚糖与磁性粒子结合制备成磁性壳聚糖微球, 不但可提高其稳定性及机械强度, 还可用简单的磁场分离方法将壳聚糖与反应介质分离, 使其在固定化酶、水处理、食品工业及医学等领域有着广阔的应用前景[8-11].
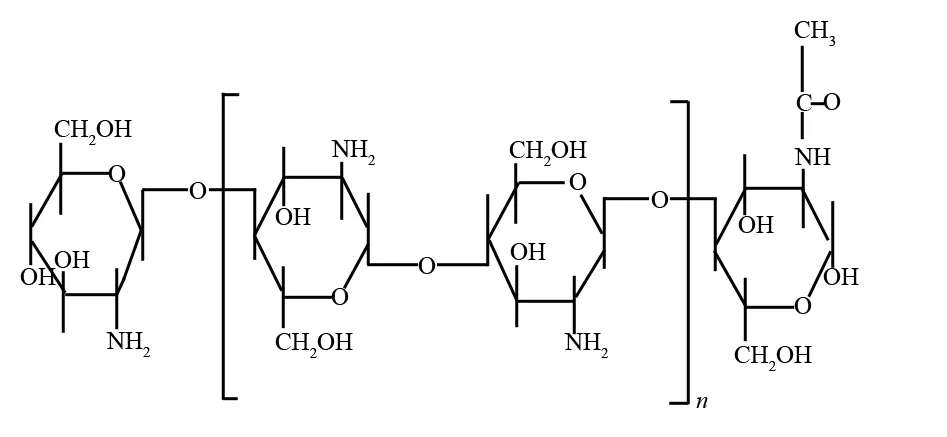
图1 壳聚糖结构式Fig.1 Structure of chitosan
1磁性氧化铁纳米粒子的制备
磁性壳聚糖微球的核心部位是磁性粒子,赋予磁性微球以快速分离功能,外层生物高分子功能基团赋予磁性微球以载体的功能. 磁性壳聚糖微球的壳层与磁核的结合主要是通过范德华力、氢键、配位键的作用.
自从20世纪70年代中期,纳米或微米级的磁性粒子就已经被应用于生物和医学领域. 磁性粒子主要有磁铁矿、Fe3O4、铁矿石、α-Fe2O3、锶铁氧体、铁磁流体和磁性钴[12],其中Fe3O4应用最为广泛. 目前,磁性氧化铁纳米粒子的制备方法主要有微乳液法[13]、化学共沉淀法[14-17]、水热法[18-19]等. 其中,微乳液法和水热法一般用来合成粒径小于30 nm 的磁性氧化铁纳米粒子.
1.1微乳液法
微乳液是由水相、油相和表面活性剂组成的体系. 油相一般称为分散介质,水称为分散相. 微乳液中存在大量微乳液滴,以微乳液滴为反应器合成物质的方法即为微乳液法.

GUPTA等[13]采用微乳液法合成了Fe3O4,表面活性剂二(2-乙基己基)琥珀酸磺酸钠和正己烷可以形成反相胶束体系,该体系具有亲水性的内核, 水溶性化合物在该体系中可以被溶解. Fe3O4在溶液中呈正电荷, 而水分子呈负电荷,Fe3O4被水分子包围, 从而使Fe3O4能够分散在反相胶束体系的内核中. 纳米材料的粒径与水合的尺寸相同, 因此可以通过改变表面活性剂、有机溶剂和水的比例进而控制水核的尺寸,从而控制纳米材料粒径的大小. 微乳液法合成的Fe3O4平均粒径小于15 nm.
使用微乳液法合成Fe3O4, 可以得到粒径较小, 分布均匀,形貌规则的Fe3O4颗粒,同时操作简单. 该法制备Fe3O4的缺点是:制备过程中使用了大量表面活性剂并且很难去除,纳米粒子的产量和纯度比较低.
1.2化学共沉淀法
化学共沉淀法合成Fe3O4的化学原理与前述相同,只是在碱性溶液中直接沉淀. 具体方法分为两种:一种是滴定水解法[14],向一定物质的量比的三价铁盐与二价铁盐混合溶液中逐滴滴入稀碱溶液,使混合液的pH值逐渐升高,当pH为6~7时水解生成磁性Fe3O4纳米粒子;另一种为Massart水解法[15],将一定摩尔比的三价铁盐与二价铁盐混合后,加入到强碱性水溶液中,铁盐在强碱性水溶液中瞬间水解结晶形成磁性铁氧体纳米粒子. ZHAO等[16]用氨水共沉淀Fe2+与Fe3+离子溶液制得Fe3O4,该粒子有较好的磁响应性,平均半径为11.4 nm,可以做靶向药物载体. KIM等[17]用滴定水解法制备了粒径为6 nm左右的Fe3O4粒子,包覆表面活性剂(油酸钠)后分散性提高.
用化学共沉淀法制备Fe3O4磁性粒子有很多优点,如:对设备的要求低、工艺流程简单、反应产物纯度高、工艺流程短. 但此法要求反应中各组分具有相同或相近的水解或沉淀条件,制备得到的Fe3O4磁性粒子团聚严重,粒径不易控制.
1.3水热法
水热法是将Fe2+溶液加入碱调节到预定pH值后,将反应体系转入高压釜中,在一定温度下或按程序升温后反应一定时间,经过分离、洗涤和干燥得到产物.
FAN等[18]用水热氧化法, 以FeSO4·7H2O和NaOH为原料, 以Na2S2O7为氧化剂,在加热条件下合成多面体Fe3O4纳米粒子. LI等[19]同样采用水热法合成了Fe3O4,不同的是他们选择FeCl2·4H2O和NaOH做原料,选择H2O2作为氧化剂. 实验表明Fe3O4粒径的大小与不同反应温度有关. 反应物的物质的量比和反应体系的pH值也会影响水热法制备Fe3O4的质量.
在水热条件下,温度和压强较高,溶液快速对流,溶质有效扩散,反应时间较短. 水热法制的磁性氧化铁纳米粒子晶型较好,颗粒粒径易于控制,粒度分布均匀,颗粒团聚现象较少. 该法也有不足,因为该法往往需要较高的温度(一般为120~160 ℃)和压力(5~7 atm),对设备的要求较高,增大了生产成本.
2磁性壳聚糖微球的制备和改性
2.1磁性壳聚糖微球的制备
壳聚糖是一种天然有机高聚物材料,通常不能和无机材料相容. 因此,必须通过特殊的方法才能把无机磁性微粒均匀分散入有机聚合物中制成高性能的无机-有机复合材料. 综合文献报道,目前磁性壳聚糖微球的制备方法主要采用包埋法[20-25].
包埋法是利用超声分散、机械搅拌等方法, 把磁性微粒均匀分散于壳聚糖溶液中, 再通过雾化、絮凝、沉积、蒸发等操作得到磁性高分子微球. 该法得到的磁性壳聚糖微球主要通过氢键、配位键等作用使壳聚糖链缠绕在Fe3O4粒子周围,进而形成包被的复合物. 壳聚糖为线性分子,它对磁性微粒包埋往往是不完全的,无机磁性微粒很容易脱落. 为了将无机磁性微粒完全包埋,形成完整的壳聚糖包被外壳,人们通过使用化学交联剂(如戊二醛)通过化学键把壳聚糖分子交联起来更好的包埋四氧化三铁颗粒[20]. 包埋法制备磁性壳聚糖微球易于进行,实验所需条件简单,但制得的磁性粒子粒径分布宽,粒径大小难以控制,形状多样.
为了制备颗粒均匀,分散性良好的磁性壳聚糖微球,通常使用表面活性剂和分散介质,形成油包水微乳液体系来制备磁性壳聚糖微球. 首先,将壳聚糖溶解到一定浓度的酸溶液中,再把Fe3O4加入到壳聚糖溶液中,在超声作用下,使磁性粒子均匀分散在壳聚糖溶液中. 然后,在混合物中加入有机溶剂,如液体石蜡,从而形成油包水的反相悬浮体系. 最后加入戊二醛等化学交联剂,壳聚糖被交联成网格状,从而将Fe3O4包裹在其中. 在用油包水微乳液体系来制备磁性壳聚糖微球的方法中,磁性微粒与壳聚糖的比例、壳聚糖溶液的浓度、交联剂的用量和搅拌速度等因素显著地影响磁性壳聚糖微球的特性[21-23].
戊二醛有一定的毒性,易造成污染,为克服这一缺点,人们选用无毒的三聚磷酸钠(TPP)交联壳聚糖,在酸性溶液中,三聚磷酸钠(TPP)的磷酸根阴离子可以与壳聚糖质子化的氨基(阳离子)通过离子交联发生粒子凝胶反应进而包埋磁性粒子得到稳定的磁性壳聚糖凝胶[24]. 陈小松等[25]使用三聚磷酸钠作为交联剂制备了不同pH下的磁性壳聚糖凝胶,pH为3时,溶液中大量的氨基被质子化与三聚磷酸钠中磷酸根阴离子通过离子作用交联,因此交联度较高,制备的磁性壳聚糖稳定性好. 而在pH为8时,质子化氨基数目较少,磷酸根离子发生解离,交联度下降,磁性壳聚糖稳定性随之下降. 该方法反应条件温和,不使用有机溶剂,反应迅速. 但是由于交联的本质是离子键结合,在使用过程中,介质的酸碱度直接影响磁性壳聚糖凝胶的稳定性.
2.2磁性壳聚糖的改性
虽然磁性壳聚糖微球有自身独特的优势并在很多领域显示了良好的应用前景,但是由于磁性壳聚糖微球表面的功能基团种类较少,很难满足各个方向的要求,其次磁性壳聚糖微球与酶等生物大分子结合时,由于空间位阻的影响,酶分子很难与底物充分结合,导致酶的利用率降低,催化效率不高. 为了提高磁性壳聚糖微球的适用范围和使用效率,人们对磁性壳聚糖微球进行改性研究. 通过对壳聚糖进行功能化改性已经成为制备新型高分子材料的重要途径.
磁性壳聚糖微球可以通过共聚、表面改性等多种方法在微球表面增加反应性功能基团. 壳聚糖的C-2氨基和C-6伯羟基化学反应性较好,可以和多种化学试剂反应,从而引入羧基、氨基和巯基等多种功能基团. 壳聚糖的C-6-OH具有一定的反应活性,容易与氯乙酸等进行反应,引入新的羧基官能团. 邢云等[26]先用交联剂戊二醛制备交联壳聚糖微球,再加入二甲亚砜和氢氧化钠,使交联壳聚糖微球与氯乙酸在碱性溶液中反应,得到交联羧甲基壳聚糖. 研究表明,羧甲基壳聚糖可用作重金属离子的良好的吸附剂.
利用乙二胺、二异丁胺和三乙烯四胺等试剂对Fe3O4/CS微球进行改性处理,可在Fe3O4/CS微球上引入更多的氨基,在重金属和有机染料污染的废水处理中有着广泛的用途[27-30]. 周利民等用反相乳液和化学交联的方法制备了Fe3O4/CS微球,并通过环氧氯丙烷处理,进一步用乙二胺对Fe3O4/CS微球进行改性,从而引入了更多的氨基. 并研究了改性Fe3O4/CS微球对Cu2+、Cd3+和Ni2+的吸附性能;结果表明, 随着溶液pH值的升高, Cu2+和Ni2+的吸附容量增加,在pH=3时,Cd3+吸附容量最佳.
LI等[31]用聚丙烯酰胺对磁性壳聚糖微球进行改性研究,用其对Cu2+、Pb2+和Hg2+进行离子吸附实验,并与未改性前的磁性壳聚糖微球进行了对比,结果发现,改性后的磁性壳聚糖微球的吸附能力高于未改性的磁性壳聚糖微球,并对 Hg2+有更高的选择性吸附. 利用硫脲等试剂对Fe3O4/CS微球进行改性处理,可在Fe3O4/CS微球上引入巯基. 巯基(Lewis碱)对Hg2+、Ag+等高极性离子(Lewis酸) 有特殊的络合能力,能形成稳定的络合结构,因此利用硫脲改性可提高壳聚糖对Hg2+等重金属离子的吸附性能[32].
磁性壳聚糖微球作为载体直接用于固定化酶或其他生物大分子时,由于空间位阻的原因,固定化率不高,同时会影响到酶与底物的结合,而大大降低酶的催化效率. 为解决这一问题,研究人员通过接臂或接枝反应,在壳聚糖的氨基或羟基上接入一定长度的间隔臂,扩大酶与磁性壳聚糖微球之间的空间距离,从而提高酶的自由度和柔性,以提高固定化酶的催化效率.
王红艳等[33]使用亲水性多乙烯多胺进行对壳聚糖接枝反应, 得到多胺柔性链改性壳聚糖载体,用其进行固定化木瓜蛋白酶的研究,并与未经多胺分子修饰的壳聚糖微球进行比较. 结果显示用多胺柔性链改性壳聚糖载体固定化木瓜蛋白酶,酶活力最高可达313 U/g,活力回收率最高达61.5%,这一结果是采用未经多胺分子修饰的壳聚糖微球固定化的2.3倍,原因是接枝后的壳聚糖微球表面存在亲水性多胺柔性链, 既减小了固定化酶的空间位阻,又提高固定酶分子的自由度. 袁春桃等使用引发剂NH2OH·HCl-H2O使壳聚糖与丙烯睛发生聚合反应, 生成接枝共聚物壳聚糖-g-丙烯腈,并以壳聚糖-g-丙烯腈为载体进行木瓜蛋白酶固定化研究;实验结果表明,壳聚糖-g-丙烯腈固定化木瓜蛋白酶和壳聚糖固定化木瓜蛋白酶,其Km分别为1.54、2.21,半衰期分别为40 d和28 d,说明接枝改性后的壳聚糖载体固定酶对底物的亲和力,及酶活力保存时间比接枝前显著提高[34].
3磁性壳聚糖微球的应用
3.1固定化酶
磁性壳聚糖微球是一种新型功能高分子材料,已作为载体被广泛应用于酶的固定化[35-36]. 作为酶固定化的载体,磁性壳聚糖微球具有其独特的优点. 首先壳聚糖分子链上有大量的羟基和氨基易于进行化学修饰,可以通过多种方法进行酶的固定化;其次,其磁性内核赋予了磁性壳聚糖微球的超顺磁性,使得固定化酶的分离和重复使用更加便利. 汤卫华等[37]制备了机械强度良好的磁性壳聚糖微球,并对β-半乳糖苷酶进行固定化研究. 测定该固定化酶的活力回收率达70.5%,同时具有良好的储存稳定性和操作稳定性. FERNNDEZ-LUCAS等[38]用他们合成的Fe3O4/CS微球为载体,进行了脱氧核糖转移酶固定化研究,结果表明,固定化脱氧核糖转移酶在40 ℃存储14 400多小时或重复使用30次,仍然保持100%的酶活力. 随着磁性壳聚糖微球合成技术和固定化技术的日臻成熟,磁性壳聚糖微球作为酶固定化载体将得到更加广泛的应用.
3.2在废水处理中的应用
重金属离子是废水中常见的污染物,对环境有很大危害,同时重金属离子通过食物链在生物体内富集,使生物体产生各种疾病,因此如何严格控制重金属离子对水体的污染是亟待解决的问题. 磁性壳聚糖微球含有大量的氨基和羟基,金属离子可以通过螯合作用被有效吸附在壳聚糖上,从而达到去除废水中重金属离子的目的[24-27,29-32, 39-40]. RORRER等[41]研究了磁性壳聚糖微球对废水中镉离子的吸附效果. 研究表明,磁性壳聚糖微球能有效吸附废水中的镉离子. 在废水中的Cd2+浓度为1 690 mg/L时,直径为1 mm的磁性壳聚糖微球因为有更大的比表面积,比直径3 mm的磁性壳聚糖微球有更好的吸附能力和更稳定的吸附平衡状态. 张显等[42]考察了磁性壳聚糖微球对Hg2+的吸附性能,结果显示,磁性壳聚糖微球对Hg2+有较强的吸附能力,最大吸附量为0.83 mmol/g,在吸附循环5次后,对Hg2+的去除率仍可达到90%. 在外加磁场作用下,吸附剂容易与反应溶液进行分离,用乙二胺四乙酸二钠(EDTA-2Na)洗脱被磁性壳聚糖微球吸附的Hg2+,使壳聚糖微球被循环利用,降低工业成本. 磁性壳聚糖微球对稀有金属离子如: La3+、Nd3+、Eu3+、Lu3+也有较大的吸附量[43].
磁性壳聚糖微球在印染和造纸等行业的污水处理中也具有广阔的应用前景[28,44-48]. HAMARAT等[47]利用戊二醛交联法制备了磁性壳聚糖微球,并用于直红23污水的处理. 研究结果表明,磁性壳聚糖微球对直红23具有很强的吸附能力,在室温和pH=4的条件下,磁性壳聚糖微球对直红23的吸附量可达到1 250 mg/g ,这一数据远远高于活性炭对直红23的吸附能力. 张万友等[48]用Fe3O4/CS微球作为絮凝剂,对造纸废水进行处理. 结果表明,在pH=8,搅拌速度为120 r/min,Fe3O4/CS微球投加量为6 mg/L,沉降时间为8 h的条件下,当进水COD为2 549.41 mg/L时,COD去除率可达到83.38%.
3.3食品活性组分的分离
食品和生物制品中有效成分的高效分离是生产上存在的主要难题之一,产品需要通过许多步骤才能得到,往往费事费力,成本较高. 采用磁分离技术,将磁颗粒与配体结合,就可以将产物有效分离,大大减少分离步骤. 如豆制品的加工过程中会产生大量乳清,工业生产中把乳清当作废液排放,既造成浪费又造成环境污染,用磁性壳聚糖微球吸附的方法来吸附大豆乳清废水中蛋白质,吸附效果好,同时吸附后磁性壳聚糖微球容易分离,可以重复使用,有效去除了大豆乳清废水中的蛋白质,提高蛋白质的回收率和纯度,有良好工业前景[49]. 磁性壳聚糖微球还可以回收马铃薯加工废水中的凝集素,回收率可达50%[50]. 该法回收效果好,回收凝集素后磁球易分离再生,是一种新的具有发展前途的废水凝集素处理方法. 苹果加工工业的主要产品是浓缩苹果汁,而被扔掉的副产物苹果渣中含有苹果多酚,苹果多酚有抗肿瘤、抗癌、防龋齿等功能. 袁亚宏等[51]制备了胺基化磁性壳聚糖微球,并对苹果渣多酚进行吸附条件优化及吸附效果的检测,结果表明,磁性壳聚糖微球对多酚物质具有良好的吸附性能,可以对多酚物质进行快速分离,解析后多酚得率可达78.73%. 磁性壳聚糖材料吸附分离苹果多酚与传统方法相比,有工艺简单、吸附快速、能耗较低、成本低、吸附后易于磁分离等优点.
3.4磁性壳聚糖微球在生物医药领域的应用
磁性氧化铁粒子在生物分离分析、分子影像、靶向药物载体等方面有良好的应用前景[52]. 但磁性纳米颗粒之间由于磁性吸引和范德华力作用易产生聚沉,将其制备成磁性壳聚糖微球则能够有效减少颗粒间的聚集沉淀,形成稳定分散的磁流体,增加其稳定性[53]. 磁性壳聚糖微球可被应用于药物载体、磁共振造影剂、临床诊断等多个生物医药领域[ 54-56]. 葛玉卿等[57]制备氧化铁磁性颗粒,并用壳聚糖对其表面进行修饰得到样品. 实验结果表明,该样品在生理pH=7.4条件下拥有较高的正电荷(10 mV),易于和细胞表面的负电荷区域作用,有利于被细胞迅速有效摄取. 该复合微球表现出超顺磁性,对驰豫时间t1、t2,尤其是t2具有很强的响应,具有作为磁共振造影剂的潜力;在双蒸馏水和含新生牛血清的培养液中具有良好的稳定性,可以进行生物医学的应用.
磁性壳聚糖微球还用于药物载体方面,壳聚糖纳米微粒可使药物分子顺利通过上皮组织,促进药物的渗透吸收. 研究表明,壳聚糖包裹磁性粒子不会引起血液凝结造成栓塞,并且能有效缩短血栓溶解的过程,提高血栓溶解的百分数[58]. 载药后的磁性壳聚糖微球可以控制药物释放、延长药物疗效、降低药物的毒副作用、提高药物的稳定性,还有改变给药途径以及增强微球的靶向给药能力等优势,已经引起很多专家学者的关注. WILSON 等[59]将治疗早老性痴呆病的药物(他克林,胆碱酯酶的抑制剂)包埋在磁性壳聚糖中,形成他克林-磁性壳聚糖复合微球,通过静脉注射的方法注射到动物体内,并将动物的头部置于磁场中,以观察药物在脑部的富集. 研究结果表明,与注射同等药量的游离他克林相比,他克林-磁性壳聚糖复合微球的使用,显著的提高了动物脑组织中他克林的浓度.
4展望
作为一种新型材料,磁性壳聚糖微球具有良好的应用前景. 它受到了各国学者的高度重视,得到了广泛的研究. 但是有关磁性壳聚糖微球的研究的报道大部份还集中在制备方法和制备条件的研究. 目前制备磁性微球的技术还没有发展得很成熟,很多问题没有得到很好地解决. 如何得到具有强磁响应性和高比表面的磁性高分子微球,如何调节磁性载体表面特性、提高固定化酶在实际操作条件下的稳定性等,都是今后研究工作的重点. 应用研究方面目前尚处于实验室阶段,有待进一步完善相关的技术和方法,将其推向应用阶段. 随着对磁性壳聚糖微球研究的深入,其应用前景会更加广阔.
参考文献:
[1] BERRY C C, CURTIS A S G. Functionalization of magnetic nanoparticles for applications in biomedicine [J]. J Phys D Appl Phys, 2003, 36: 198-206.
[2] BHATTARAI S R, BADAHUR K C R, ARYAL S, et al. N-acylated chitosan stabilized iron oxide nanoparticles as a novel nano-matrix and ceramic modification [J]. Carbohyd Polym, 2007, 69: 467-477.
[3] POSPISKOVA K, SAFARIK I. Low-cost, easy-to-prepare magnetic chitosan microparticles for enzymes immobilization [J]. Carbohyd Polym, 2013, 96(2): 545-548.
[4] DENKBA E B, KILIÇAY E, BIRLIKSEVEN C, et al. Magnetic chitosan microspheres: preparation and cha-racterization [J]. React Funct Polym, 2002, 50(3): 225-232.
[5] SARBON N M, SANDANAMSAMY S, KAMARUZAMAN S F S, et al. Chitosan extracted from mud crab (Scylla olivicea) shells: physicochemical and antioxidant properties [J]. J Food Sci Technol, 2015, 52(7): 4266-4275.
[6] WAN NGAH W S, KAMARI A, KOAY Y J. Equilibrium and kinetics studies of adsorption of copper(II) on chitosan and chitosan / PVA beads [J]. Int J Biol Macromol, 2004, 34(3): 155-161.
[7] SHAFAEI A, ZOKAEE F Z, KAGHAZCHI T. Equilibrium studies of the sorption of Hg( II) ions onto chitosan [J]. Chem Eng J, 2007, 133(1): 311-316.
[8] GHADI A, TABANDEH F, MAHJOUB S, et al. Fabrication and characterization of core-shell magnetic chitosan nanoparticles as a novel carrier for immobilization of Burkholderia cepacia lipase [J]. J Oleo Sci, 2015, 64(4): 423-430.
[9] HUANG S H, JUANG R S. Biochemical and biomedical applications of multifunctional magnetic nanoparticles: a review [J]. J Nanopart Res, 2011, 13: 4411-4430.
[10] GALHOUM A A, MAHFOUZ M G, ABDEL-REHEM S T, et al. Diethylenetriamine-functionalized chitosan magnetic nano-based particles for the sorption of rare earth metal ions [Nd(III), Dy(III) and Yb(III)] [J]. Cellulose, 2015, 22(4): 2589-2605.
[11] WANG B Q, PING J, LI F, et al. Purification of superoxide dismutase from blood erythrocyte by nano magnetic chitosan microspheres [J]. Chin J Biotech, 2014, 30(6): 990-994.
[12] AN X N, SU Z X. Characterization and application of high magnetic property chiosan particles [J]. J Appl Polym Sci, 2001, 81(5): 1l75-1181.
[13] GUPTA A, GUPTA M. Synthesis and surface engineering or iron oxide nanoparticles for biomedical applications [J]. Biomaterials, 2005, 26(18): 3995-4021.
[14] SHEN L F, LAIBINS P E, HATTON T A. Bilayer surfactant stabilized magnetic fluids: synthesis and interactions at interfaces [J]. Langmuir, 1998, 15(2): 447-453.
[15] MASSART R. Preparation of aqueous magnetic liquids in alkaline and acidic media [J]. IEEE T Magn, 1981, 17(2): 1247-1248.
[16] ZHAO Y, QIU Z, HUANG J, et al. Preparation and analysis of Fe3O4magnetic nanoparticles used as targeted-drug carriers [J]. Chin J Chem Eng, 2008, 16(3): 451-455.
[17] KIM D K, ZHANG Y, VOIT W, et al. Synthesis and characterization of surfactant coated superparamagnetic monodisperse iron oxide nanoparticles [J]. J Magn Magn Mater, 2001, 225(12): 3036.
[18] FAN R, CHEN X H, GUI Z, et al. A new simple hydrothermal preparation of nanocrystalline magnetite Fe3O4[J]. Mater Res Bull, 2001, 36(3): 497-502.
[19] LI G Y, JIANG Y R, HUANG K L, et al. Preparation and properties of magnetic Fe3O4-chitosan nanoparticles [J]. J Alloy Compd, 2008, 466(1/2): 451-456.
[20] 黄可龙, 陈洁, 刘素琴, 等. 磁性Fe3O4/壳聚糖的化学修饰及包覆机理研究[J]. 无机化学学报, 2007, 23(8):1491-1495.
[21] 傅明连, 林旺, 陈彰旭, 等. 磁性壳聚糖微球的制备及其吸附行为研究[J]. 化工新型材料, 2015, 43(1): 145-147.
[22] JIANG W, LI F S, YANG Y, et al. Preparation and characterization of magnetic chitosan microspheres for the carriers of radionuclides in therapy [J]. J Mater Sci Eng, 2004, 22(5): 660-662.
[23] MA W, DAI J D, DAI X H, et al. Core-shell molecu-larly imprinted polymers based on magnetic chitosan microspheres for chloramphenicol selective adsorption [J]. Monatsh Chem, 2015, 146(3): 465-474.
[24] NGAH W W, FATINAN S. Adsorption characterization of Pb(Ⅱ) and Cu(Ⅱ) ions onto chitosan-tripolyphosphate beads: Kinetic equilibrium and thermodynamic studies [J]. J Environ Manage, 2010, 91(4): 958-969.
[25] 陈小松, 周利民, 刘峙嵘. 三聚磷酸钠交联磁性壳聚糖树脂对铀酰离子的吸附特性[J]. 原子能科学技术, 2015, 49(6): 972-978.
[26] 邢云, 王贵芳. 交联羧甲基壳聚糖的合成及其对Pb2+、Cd2+和Co2+的吸附行为[J]. 冶金分析, 2013, 33(11):6-11.
[27] 周利民, 王一平, 黄群武, 等. 改性磁性壳聚糖微球对Cu2+、Cd3+和Ni2+的吸附性能[J]. 物理化学学报, 2007, 23(12): 1979-1984.
[28] 周利民, 尚超, 刘峙嵘, 乙二胺改性磁性壳聚糖纳米粒子对酸性染料的吸附特性[J].物理化学学报, 2011,27(3): 677-682.
[29] 娄振宁, 任富强, 王静, 等. 二异丁胺修饰的天然壳聚糖磁性微球与铼的吸附行为[J]. 应用化学, 2014, 31(9): 1031-1036.
[30] ZHOU L M, LIU Z R, LIU J H, et al. Adsorption of Hg(II) from aqueous solution by ethylenediamine-modified magnetic crosslinking chitosan microspheres [J]. Desalination, 2010, 258:41-47.
[31] LI K, WANG Y W, HUANG M, et al. Preparation of chitosan-graft-polyacrylamide magnetic composite microspheres for enhanced selective removal of mercury ions from water [J]. J Colloid Interf Sci, 2015, 455: 261-270.
[32] 周利民 黄群武 刘峙嵘. 硫脲改性磁性壳聚糖微球对Hg2+, Cu2+和Ni2+的吸附[J]. 化学反应工程与工艺, 2008, 24(6): 556-561.
[33] 王红艳, 朱建星, 张万忠, 等. 多胺柔性链改性壳聚糖微球固定化木瓜蛋白酶[J]. 食品工业科技, 2010, 31(3): 267-270.
[34] 袁春桃, 蒋先明. 壳聚糖-g-丙烯腈固定化木瓜蛋白酶的研究[J]. 应用化学, 2002, 19(9): 862-865.
[35] KRISTYNA P, IVO S. Low-cost, easy-to-prepare magnetic chitosan microparticles for enzymes immobilization [J]. Carbohyd Polym, 2013, 96(2): 545-548.
[36] TOMASZ S, MARTA Z B. Lipase-immobilized magnetic chitosan nanoparticles for kinetic resolution of (R,S)-ibuprofen [J]. J Mol Catal B-Enzym, 2013, 94: 7-14.
[37] 汤卫华, 王立晖, 殷海松, 等. 壳聚糖微球固定化β-半乳糖苷酶[J]. 食品与发酵工业, 2015, 41(5): 105-109.
[39] 黄国林, 陈中胜,梁喜珍, 等. 磁性交联壳聚糖对水溶液中铀(Ⅵ)离子的吸附行为[J]. 化工学报, 2012, 63(3): 834-840.
[40] HAN D Y, JIANG X, XIE C S, et al. Preparation and adsorption property for metal ions of crosslinked chitosan magnetic microspheres [J]. Environ Chem, 2006, 25(6): 748-751.
[41] RORRER G L, HSIEN T Y, WAY J D. Synthesis of porous-magnetic chitosan beads for removal of cadmium ions from wastewater [J]. Ind Eng Chem Res, 1993, 32(9): 2170-2178.
[42] 张显, 吴天星, 宋小平, 等. 一步溶剂热法合成磁性壳聚糖微球及其对汞离子的吸附[J]. 硅酸盐学报, 2015, 43(8): 1143-1149.
[43] LI J P, SONG L M, ZHANG S J. Rare earth metal ion adsorption capacity on cross-linked magnet chitosan [J]. J Chin Rare Earth Soc, 2002, 20(3): 219-221.
[44] CRINI G, BADOT P M. Application of chitosan, a natural aminopolysaccharide, for dye removal from aqueous solutions by adsorption processes using batch studies: A review of recent literature [J]. Prog Polym Sci, 2008, 33(4): 399-447.
[45] CHO D W, JEON B H, CHON C M, et al. Magnetic chitosan composite for adsorption of cationic and anionic dyes in aqueous solution [J]. J Ind Eng Chem, 2015, 28: 60-66.
[46] YANG H, YUAN B, LU Y B, et al. Preparation of magnetic chitosan microspheres and its applications in wastewater treatment [J]. Sci China, 2008, 52(3): 249-256.
[47] HAMARAT S S, GÜLIZ A, HABIBE Y, et al. Removal of textile dye, direct red 23, with glutaraldehyde cross-linked magnetic chitosan beads [J]. Prep Biochem Biotech, 2013, 43(2): 163-176.
[48] 张万友,米天朋,庞香蕊, 等. 磁性Fe3O4/壳聚糖复合微球处理造纸废水实验研究[J] . 工业水处理, 2014, 34(6): 36-39.
[49] 董海丽,任晓燕. 磁性壳聚糖微球对大豆乳清废水中蛋白质的吸附作用[J]. 食品科学, 2007, 28(7): 205-207.
[50] SAFARIKOVA M, SAFARIC I. One-step partial purify cation of Solanum tuberosum tuber lectin using magnetic chitosan particles [J]. Biotechnol Lett, 2000, 22(11): 941-945.
[51] 袁亚宏, 蔡露阳, 岳田利, 等. 胺基化磁性壳聚糖微球对苹果渣多酚的吸附条件优化[J]. 农业工程学报, 2012, 28(11):279-286.
[52] 周恒, 罗聪, 黄华. 医用磁性纳米粒的研究进展[J]. 中国医院药学杂志, 2010, 30(8): 689-692.
[53] YU L, LIU F, YOUSAF M Z, et al. Magnetic nanomaterials: chemical synthesis, functionalization and biomedical applications [J]. Prog Biochem Biophys, 2013, 40(10): 903-917.
[54] ARIAS J L, REDDY L H, COUVREUR P. Fe3O4/chitosan nanocomposite for magnetic drug targeting to cancer [J]. J Mater Chem, 2012, 22(15): 7622-7632.
[55] SHETE P B, PATIL R M, THORAT N D, et al. Magnetic chitosan nanocomposite for hyperthermia therapy application: Preparation, characterization and in vitro experiments [J]. Appl Surf Sci, 2014, 288(2): 149-157.
[56] TRANA N, WEBSTER T J. Magnetic nanoparticles: biomedical applications and challenges [J]. J Mater Chem, 2010, 20: 8760-8767.
[57] 葛玉卿, 张宇, 顾宁. 壳聚糖修饰氧化铁磁性纳米颗粒的制备和性能研究[J].功能材料与器件学报, 2012, 18(2): 147-152.
[58] CHEN J P, YANG P C, MA Y H, et al. Characterization of chitosan magnetic nanoparticles for in situ delivery of tissue plasminogen activator [J]. Carbohyd Polym, 2011, 84(1): 364-372.
[59] WILSON B, SAMANTA M K, SAMPATH-KUMAR K, et al. Significant delivery of tacrine into the brain using magnetic chitosan microparticles for treating Alzheimer’s disease [J]. J Neurosci Meth, 2009, 177(2): 427-433.
[责任编辑:张普玉]
收稿日期:2016-01-17.
基金项目:国家棉花生物学重点实验室基金(CB2015C26).
作者简介:王楠楠(1988-),女,在读硕士,研究方向:固定化酶.E-mail:06wangnan@163.com.
中图分类号:O636.9
文献标志码:A
文章编号:1008-1011(2016)03-0395-08
Review of preparation and application of magnetic chitosan microspheres
WANG Nannan1, CHAI Yun2, DONG Facai1*
(1.SchoolofLifeSciences,HenanUniversity,Kaifeng475004,Henan,China;2.CollegeofChemistryandChemicalEngineering,HenanUniversity,Kaifeng475004,Henan,China)
Abstract:Magnetic chitosan microspheres are magnetic microspheres which were made by a certain embedding method using chitosan and magnetic materials. The kernel of magnetic chitosan microspheres are magnetic metal particles in nanoscale and the outer layer is chitosan. On one hand, chitosan has many biological characteristics and the processing characteristics because chitosan contains a large number of amines and hydroxyls. On the other hand, magnetic chitosan microspheres have very good paramagnetism due to their magnetic kernels and can be easily separated from solutions under the action of magnetic field. Magnetic chitosan microspheres have attracted attention in various fields due to their properties. In this paper, the preparation and characterization of magnetic chitosan microspheres are reviewed. The applications of magnetic chitosan microspheres in immobilized enzyme, wastewater treatment, food engineering and biological medicine are also introduced.
Keywords:magnetic chitosan microspheres; modification; immobilization; application
