环糊精改性Fe3O4纳米微球的制备及其负载多柔比星体外释放的研究
2016-07-05郭秀丽许光宇秦丹丹白雅竹任秋颖郑林萍
郭秀丽,许光宇,秦丹丹,白雅竹,任秋颖,郑林萍*
(1.河南大学 药学院,河南 开封 475004; 2.开封市卫生学校,河南 开封 475002;3.河南大学 民生学院,河南 开封 475004)
环糊精改性Fe3O4纳米微球的制备及其负载多柔比星体外释放的研究
郭秀丽1,许光宇2,秦丹丹3,白雅竹3,任秋颖3,郑林萍1*
(1.河南大学 药学院,河南 开封 475004;2.开封市卫生学校,河南 开封 475002;3.河南大学 民生学院,河南 开封 475004)
摘要:采用柠檬酸钠作为稳定剂,通过超声辅助水相共沉淀法合成了柠檬酸修饰的Fe3O4纳米粒(Fe3O4@CA),进一步采用真空干燥法制备了β-环糊精包覆的Fe3O4纳米微球(Fe3O4@β-CD). 分别利用X射线粉末衍射仪、傅立叶变换红外光谱仪、透射电子显微镜、热重分析仪等表征手段对其进行了结构和形貌表征. 同时,以多柔比星为模型药物,考察了Fe3O4@β-CD微球对多柔比星的体外释放行为. 结果表明,Fe3O4@CA纳米粒子呈球形或类球形,平均流体力学直径为84 nm,具有顺磁性,室温下饱和磁化强度为17.5 emu·g-1,红外光谱结果表明,β-环糊精成功的包覆在Fe3O4@CA表面,Fe3O4@β-CD的平均流体力学直径为104 nm,室温下饱和磁化强度为15.7 emu·g-1. 体外释放结果表明,Fe3O4@β-CD-DOX载药系统在PBS(pH=7.4)溶液中释放缓慢,12 h累积释放率为45.5%. 结果表明,环糊精改性的Fe3O4纳米微球在体外有明显的缓释效果,有望成为理想的抗肿瘤药物载体.
关键词:Fe3O4;β-环糊精;多柔比星;体外释放
磁性Fe3O4纳米粒作为一种新型磁性纳米材料,因具有良好的生物相容性、生物可降解性、在外磁场作用下能实现靶向治疗等优点,广泛应用于生物医学工程等领域,如磁共振成像[1-2]、催化剂[3]、磁流体材料[4]、基因转导[5]、生物细胞富集和分离[6]、靶向药物传递[7-8]、肿瘤热疗[9]等领域. 目前,合成Fe3O4工艺有很多,如水相共沉淀法、微乳液法、热分解法、溶胶-凝胶法等. 如何找到一条能有效控制纳米粒的形貌、粒径大小与分布的合成方法,是当前研究的热点. 由于Fe3O4纳米粒表面积较大,容易发生团聚,因此需要在Fe3O4表面进行修饰以提高其稳定性. 其中研究较多的是在水相中加入表面活性剂以提高纳米粒子的分散性. 常用的表面活性剂有聚乙二醇(PEG)、十二烷基磺酸钠(SDS)、油酸钠(Sodium oleate)等.
当Fe3O4纳米粒子用于靶向治疗药物的载体时存在一些问题,如载药率低、药物释放存在明显突释现象等.β-环糊精作为一种常用的包合材料,是具有7个葡萄糖单元的环状聚合物,具有能容纳疏水性药物的空穴结构,其自身毒性很低,适用于提高疏水性药物的水溶性或者延缓药物释放,是一种比较理想的药物载体. 在医药和食品行业等领域中,环糊精已经得到了广泛应用[10-11]. 我们首先以超声辅助水相共沉淀法制备Fe3O4纳米粒,在控制其形貌、粒径尺寸与分布及磁性能的基础上,用生物相溶性好且带有多官能团的柠檬酸修饰Fe3O4纳米粒表面,然后进一步与β-环糊精偶联,制备了β-环糊精改性的Fe3O4纳米微球,最后以多柔比星为模型药物考察了Fe3O4@β-CD微球对多柔比星的负载及体外释放行为.
1实验部分
1.1试剂与仪器
六水合三氯化铁、七水合硫酸亚铁、氢氧化钠、柠檬酸、无水乙醇(天津科密欧化学试剂有限公司);β-环糊精、PBS(阿拉丁试剂公司);盐酸多柔比星(DOX·HCl,浙江海正药业股份有限公司);实验用水为去离子水;其他试剂均为分析纯.
DF-101S型磁力搅拌水浴锅(河南国瑞仪器有限公司);KQ3200E型超声波清洗器(昆山市超声仪器有限公司);PHS-3C型pH计(上海仪电科学仪器股份有限公司);D8 ADVANCE型X射线粉末衍射仪(美国Bruker公司);VERTEX 70型傅立叶变换红外光谱仪(美国Bruker公司);SDTA851e型热重分析仪(瑞士Mettler-Toledo公司);Tecnai G2 F20型透射电子显微镜(美国FEI公司);ZetasizerNano ZS 90型激光粒度及Zeta电位仪(英国Malvern公司);MPMS-XL-7型超导量子干涉仪(美国Quantum Design公司);7200型紫外-可见光谱仪(美国Unico公司).
1.2柠檬酸修饰Fe3O4纳米粒的制备
分别取一定量的FeCl3·6H2O、FeSO4·7H2O溶解于去离子水中,搅拌使其完全溶解,得到n(Fe3+)∶n(Fe2+)=2∶1的黄绿色铁盐溶液,记为溶液A. 另取一定量氢氧化钠和柠檬酸溶解于去离子水中,搅拌使其完全溶解,记为溶液B. 将溶液B加到250 mL三口瓶中,在超声搅拌条件下,将溶液A逐滴加入溶液B中,60 ℃下继续反应30 min,利用外加磁场收集产物,然后用去离子水和无水乙醇交替洗涤3次,60 ℃下真空干燥24 h,得到柠檬酸修饰的Fe3O4纳米粒(Fe3O4@CA).
1.3环糊精改性Fe3O4纳米微球的制备
称取Fe3O4@CA 1.0 g,加去离子水1.5 mL,再加入β-环糊精2.0 g,混合均匀后放入真空干燥箱中,在110 ℃下真空干燥3 h. 干燥后的样品用无水乙醇和去离子水反复洗3遍,用磁铁分离最终产物,在60 ℃下真空干燥24 h,制得β-环糊精改性的Fe3O4纳米微球(Fe3O4@β-CD).
1.4样品表征
利用X射线衍射仪检测样品的X射线粉末衍射(XRD);利用傅立叶变换红外光谱仪,溴化钾压片测试样品的红外光谱(FT-IR);采用透射电子显微镜观察样品的形貌,操作条件为200 kV;采用激光纳米力度仪检测样品的粒径及分布;采用热重分析仪测试样品的热稳定性,测试条件:升温速度10 ℃·min-1,温度范围为20~800 ℃;采用超导量子干涉仪测定样品的磁性能;使用紫外-可见光谱仪测试样品的紫外吸收光谱.
1.5多柔比星的负载与体外释放
将10 mg Fe3O4@β-CD分散于0.1 g·L-1多柔比星的PBS溶液中,用超声仪处理(70 kHz,300 W),处理时间分别为10、20、30、60、90 min. 将混悬液高速离心(8 000 r·min-1)5 min,测上清液紫外吸收,根据标准曲线确定上清液中多柔比星的浓度,最后确定最佳超声时间、载药量及包封率. 将离心分离得到的Fe3O4@β-CD-DOX用去离子水洗2遍后冷冻干燥,置于冰箱中密封保存. 载药量和包封率的计算公式如下:
精密称Fe3O4@β-CD-DOX 10 mg,加20 mL去离子水超声分散后装入透析袋中(截留摩尔质量14 000 g·mol-1),放入80 mL PBS(pH=7.4)缓冲液中,水浴温度37 ℃,开动磁力搅拌,每隔一段时间取2 mL溶液测紫外吸收,同时补充2 mL 新鲜的PBS缓冲液. 通过测定所取的缓冲溶液中DOX的紫外吸收可以计算出不同时间的释药率.
2结果与讨论
2.1表征
图1为Fe3O4@CA的XRD图. 从衍射谱图看,峰的位置、强度与粉末衍射PDF卡(JCPDS NO.82-1533)上的Fe3O4标准数据基本吻合,2θ=30.26°、35.61°、43.64°、53.91°、57.33°、62.84°处的6个明显衍射峰分别对应于(220),(311),(400),(422),(511)和(440)的6个晶面,这表明通过改进化学共沉淀法制备所得的产物为Fe3O4纳米粒子,并具有立方晶系结构.
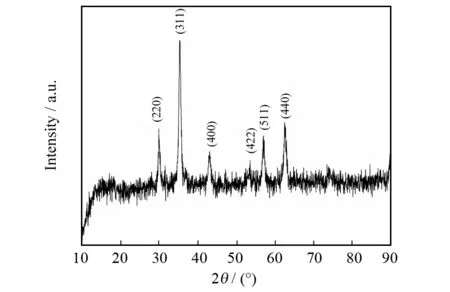
图1 Fe3O4@CA的XRD图Fig.1 XRD pattern of Fe3O4@CA
图2分别为纯Fe3O4、柠檬酸、Fe3O4@CA的红外光谱图. a曲线中586 cm-1处出现了Fe3O4特征吸收峰,3 416 cm-1为Fe3O4所含少量结晶水的吸收峰. b曲线中1 394、1 593 cm-1为羰基的碳氧振动吸收峰,3 455 cm-1为柠檬酸中羟基的氢氧伸缩振动吸收峰. c曲线1 148 cm-1是柠檬酸的羧基与Fe3O4表面羟基键合形成的酯键的振动吸收峰. 从红外谱图可以进一步证明柠檬酸分子修饰在Fe3O4纳米粒表面.
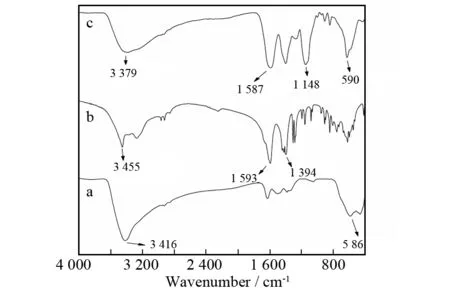
图2 纯Fe3O4(a)、柠檬酸(b)、Fe3O4@CA(c)的红外光谱图Fig.2 FT-IR spectra of pure Fe3O4(a),citric acid(b), and Fe3O4@CA(c)
图3分别为Fe3O4@CA(a)、β-CD(b)、Fe3O4@β-CD(c)的红外光谱图. b曲线1 029、1 159、2 927 cm-13个峰为β-环糊精特征吸收峰. c曲线中在1 030、2 924 cm-1出现了β-环糊精的特征吸收峰,1 154、1 590 cm-1出现了柠檬酸的特征吸收峰,说明β-环糊精的羟基与Fe3O4@CA的游离羧基形成了化学键,β-环糊精成功的包覆在Fe3O4@CA表面.

图3 Fe3O4@CA(a)、β-CD(b)、Fe3O4@β-CD(c)的红外光谱图Fig.3 FT-IR spectra of Fe3O4@CA(a),β-CD(b), and Fe3O4@β-CD(c)
图4为Fe3O4@CA(a)和Fe3O4@β-CD(b)的透射电镜图. 如图a所示,Fe3O4@CA纳米粒子近似呈球形,单个纳米粒子粒径平均在12 nm左右,纳米粒子呈簇集状态,平均簇径为80 nm左右. 从图b可以看出,Fe3O4@β-CD近似呈球性,分散较为均匀,平均簇径为100 nm左右.
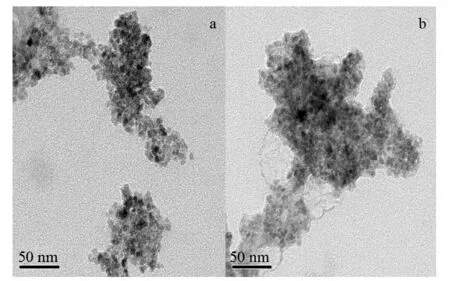
图4 Fe3O4@CA(a)和Fe3O4@β-CD(b)的透射电镜图Fig.4 TEM images of Fe3O4@CA(a) and Fe3O4@β-CD(b)
图5为Fe3O4@CA(a)和Fe3O4@β-CD(b)的热失重曲线. 从图上可以看出,曲线a中从室温到120 ℃累计失重为2.4%,是由于样品中含有的水受热蒸发. 当加热到400 ℃时,累计失重达到14.5%,由柠檬酸高温下分解造成. 400 ℃以后重量不再损失,说明柠檬酸已完全分解. 曲线b中从室温到120 ℃累计失重为3.3%,是由于样品中所含结晶水蒸发. 当加热到800 ℃时,累计失重为32.2%. 经查询Scifinder数据库,β-环糊精的熔点是293~294 ℃,在该温度下同时发生分解. b曲线是柠檬酸和β-环糊精先后发生分解形成的曲线. 热失重测试结果表明β-环糊精连接在Fe3O4@CA纳米粒上,与红外结论一致.
图6分别为Fe3O4@CA(a)和Fe3O4@β-CD(b)的平均流体力学直径分布图. 动态光散射法测得Fe3O4@CA纳米粒子的平均流体力学直径为84 nm,PDI(多分散指数)=0.194. Fe3O4@CA的Zeta电位为-40.2 mV,其绝对值大于25 mV,意味着其表面静电斥力能抵消相邻微粒间的引力,从而表明Fe3O4@CA纳米粒子在碱性溶液中能稳定存在. Fe3O4@β-CD的平均流体力学直径为104 nm,多分散指数(PDI)=0.199,相比Fe3O4@CA,其平均流体力学直径增大20 nm.
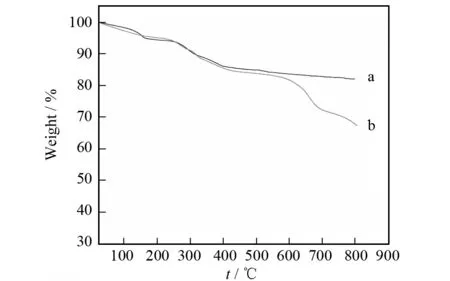
图5 Fe3O4@CA(a)和Fe3O4@β-CD(b)的热失重曲线Fig.5 TGA curves of Fe3O4@CA (a) and Fe3O4@β-CD(b)
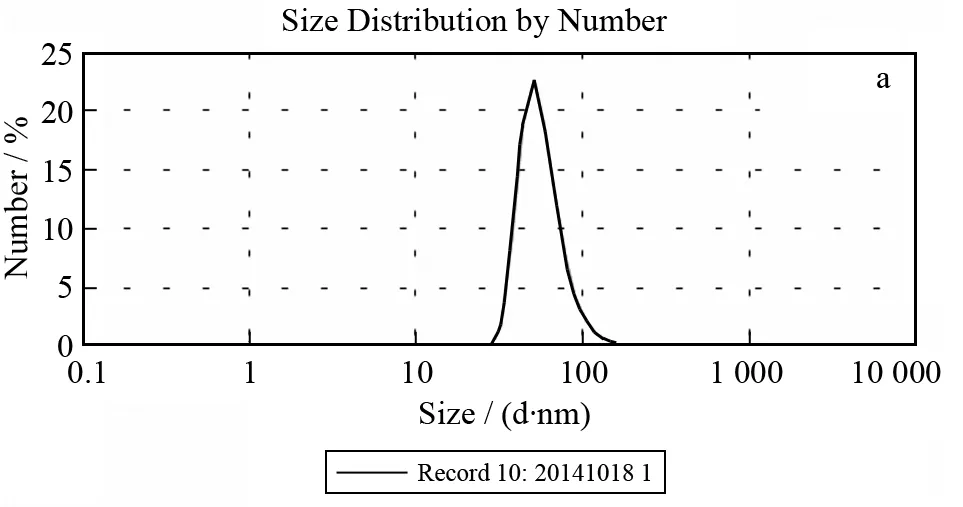

图6 Fe3O4@CA(a)和Fe3O4@β-CD(b)的平均流体力学直径分布图Fig.6 Size distribution of Fe3O4@CA(a) and Fe3O4@β-CD(b)
从图7可见,当外加磁场的强度变为零的时候,样品的磁化强度也变为零,且无剩磁. 并且在整个外加磁场的变化过程中(-20~20 kOe)没有明显的磁滞回环,说明Fe3O4@CA和Fe3O4@β-CD都具有顺磁性,饱和磁化强度Ms分别为17.5、15.7 emu·g-1. 与Fe3O4@CA相比,Fe3O4@β-CD饱和磁化强度略有降低,原因是Fe3O4@β-CD微球中Fe3O4相对含量较少.
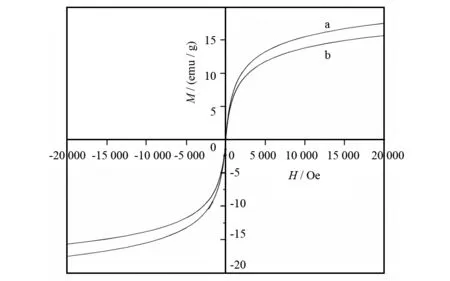
图7 Fe3O4@CA(a)和Fe3O4@β-CD(b)的磁滞曲线(T=300 K)Fig.7 Magnetization curves of Fe3O4@CA(a)and Fe3O4@β-CD(b)(T=300 K)
2.2药物的负载与释放性能研究
为了研究复合纳米微球的载药和释药性质,我们选用一种经典的抗癌药物DOX作为模型药物. 通过超声实验把DOX载入复合纳米粒子Fe3O4@β-CD中,确定最佳超声时间为30 min,所测的载药量为12%,药物包封率为30%.
如图8所示,Fe3O4@β-CD-DOX载药系统在PBS(pH=7.4)溶液中释放缓慢,12 h累积释放率45.5%,说明该复合纳米微球具有缓释效果.

图8 Fe3O4@β-CD-DOX体外释放曲线Fig.8 In vitro release profile of Fe3O4@β-CD-DOX
3结论
以FeCl3·6H2O、FeSO4·7H2O为铁源,NaOH为碱源,柠檬酸为稳定剂,采用超声辅助水相共沉淀法制备了Fe3O4@CA纳米粒. 采用真空干燥法合成了β-环糊精改性的Fe3O4纳米微球(Fe3O4@β-CD),红外光谱结果表明β-环糊精成功包覆在Fe3O4@CA表面,激光粒度仪测得其粒径比Fe3O4@CA稍偏大,磁强计测得其饱和磁化强度略有降低,原因是Fe3O4@β-CD微球中Fe3O4相对含量较少. 体外释放实验表明环糊精改性Fe3O4纳米微球有明显的缓释效果,有望成为理想的抗肿瘤药物载体.
参考文献:
[1] GAO L, XIE L S, LONG X J, et al. Efficacy of MRI visible iron oxide nanoparticles in delivering minicircle DNA into liver via intrabiliary infusion [J]. Biomaterials, 2013, 34(14): 3688-3696.
[2] WANG Y X. Superparamagnetic iron oxide based MRI contrast agents: current status of clinical application [J]. Quant Imaging Med Surg, 2011, 1(1): 35-40.
[3] ZHU Y H, STUBBS L P, HO F, et al. Magnetic nanocomposites: a new perspective in catalysis [J]. Chem Cat Chem, 2010, 2(4): 365-374.
[5] MEYERS J D, TENNYSON D, CLEMENS B, et al. Nanoparticles for imaging and treating brain cancer [J]. Nanomedicine, 2013, 8(1): 123-143.
[6] XU H Y, AGUILAR Z P, LILY Y, et al. Antibody conjugated magnetic iron oxide nanoparticles for cancer cell separation in fresh whole blood [J]. Biomaterials, 2011, 32(36): 9758-9765.
[7] MAHMOUDI M, SANT S, WANG B, et al. Superparamagnetic iron oxide nanoparticles (SPIONs): Development, surface modification and applications in chemotherapy [J]. Adv Drug Delivery Rev, 2011, 63(1/2): 24-46.
[8] MOU X B, ALI Z, LI S, et al. Applications of magnetic nanoparticles in targeted drug delivery system [J]. J Nanosci Nanotechnol, 2015, 15(15): 54-62.
[9] GLOVER A L, BENNETT J B, PRITCHETT J S, et al. Magnetic heating of iron oxide nanoparticles and magnetic micelles for cancer therapy [J]. IEEE Trans Magn, 2013, 49(1): 231-235.
[10] ANIRUDHAN T S, DIVYA P L, NIMA J. Synthesis and characterization of silane coated magnetic nanoparticles/glycidylmethacrylate-grafted-maleated cyclodextrin composite hydrogel as a drug carrier for the controlled delivery of 5-fluorouracil [J]. Mater Sci Eng C, 2015, 55: 471-481.
[11] SHEN H M, JI H B, WU H K, et al. Recent advances in the immobilization ofβ-cyclodextrin and their application [J]. Chin J Org Chem, 2014, 34(8): 1549-1572.
[责任编辑:张普玉]
收稿日期:2016-02-26.
基金项目:省教育厅科学技术研究重点项目(14A350009),河南大学民生学院大学生创新创业支持计划项目(MSCXCY2015054).
作者简介:郭秀丽(1989-),女,硕士生,研究方向为新型药物制剂. *通讯联系人,E-mail: zhenglinping2006@126.com.
中图分类号:R944
文献标志码:A
文章编号:1008-1011(2016)03-0364-05
Preparation and in vitro release study of doxorubicin-loaded cyclodextrin modified Fe3O4nanospheres
GUO Xiuli1, XU Guangyu2, QIN Dandan3, BAI Yazhu3, REN Qiuying3, ZHENG Linping1*
(1.CollegeofPharmacy,HenanUniversity,Kaifeng475004,Henan,China;2.KaifengHealthSchool,Kaifeng475002,Henan,China;3.MinshengCollege,HenanUniversity,Kaifeng475004,Henan,China)
Abstract:Fe3O4@CA nanoparticles were successfully synthesized by ultrasound-assisted coprecipitation method with citric acid as a stabilizer, and Fe3O4@β-CD nanospheres were prepared by vacuum drying. Their structure and morphology were characterized by X-ray powder diffraction, fourier-transform infrared spectroscopy, transmission electron microscopy, thermogravimetric analyzer and other characterization methods.At the same time, the in vitro release behavior of Fe3O4@β-CD microspheres to doxorubicin was investigated using doxorubicin as a model drug. Results showed that Fe3O4@CA nanoparticles were spherical or spherical like, the average hydrodynamic diameter was 84 nm,and the saturation magnetization was 17.5 emu·g-1at room temperature. Fourier-transform infrared spectroscopy results show that β-CD and Fe3O4@CA were successfully coupled and the average hydrodynamic diameter was 104 nm, magnetic properties test showed that the magnetic microspheres saturation magnetization was
15.7 emu·g-1. In vitro release studies showed that the release rate of Fe3O4@β-CD-DOX drug loading system in PBS (pH=7.4) solution was slow, and the cumulative release rate of 12 h was 45.5%. Results show that cyclodextrin modified Fe3O4microspheres have obvious sustained-release effect in vitro. It is a potential drug carrier for the delivery of antitumor drugs.
Keywords:Fe3O4; β-cyclodextrin; doxorubicin; in vitro releasation
