琼脂糖珠富集β-actin蛋白实验条件的优化
2016-07-05袁明美冯雪松
袁明美,姜 泓,冯雪松*
(1.中国医科大学 药学院,辽宁 沈阳 110122; 2.中国医科大学 公共卫生学院,辽宁 沈阳 110122)
琼脂糖珠富集β-actin蛋白实验条件的优化
袁明美1,姜泓2,冯雪松1*
(1.中国医科大学 药学院,辽宁 沈阳 110122;2.中国医科大学 公共卫生学院,辽宁 沈阳 110122)
摘要:研究不同反应条件(样品初始浓度、温度、时间)下,protein A+G agarose对小鼠脑组织中β-actin蛋白富集的影响.结果在样品初始浓度为0.5 g/L,4 ℃条件下偶联反应2 h,Protein A+G agarose对小鼠脑组织中β-actin蛋白的富集效果最好、并且稳定性与重现性良好.
关键词:琼脂糖珠;β-actin蛋白;条件优化;蛋白富集
蛋白质是生命形态中最重要的分子,对其结构、功能及含量进行研究时,常需将目的蛋白从组织或细胞等复杂生物体系中分离、纯化出来[1].琼脂糖珠作为载体介质在蛋白质的纯化过程中起着重要的作用,其原理是以免疫沉淀(IP)技术的抗体与抗原间的特异性结合为基础[2],将“靶蛋白-抗靶蛋白抗体-protein A或/和G agarose”的复合物从混合生物体系中沉淀、分离出来[3-4],经变性后,通过与聚丙烯酰胺凝胶电泳等技术结合,对靶蛋白的分子量等特性进行定性或定量研究[5].但是“靶蛋白-抗靶蛋白抗体”与agarose偶联的过程受到多种因素的影响,如样品初始浓度、偶联温度和时间等[6].本研究以protein A+G agarose对小鼠脑匀浆液中β-actin的富集为例,初步探讨样品初始浓度、偶联温度及时间对protein A+G agarose与“β-actin抗原-抗体结合物”偶联过程的影响.对于开发基于琼脂糖珠的免疫沉淀技术用于蛋白检测、纯化以及蛋白-蛋白相互作用等研究有一定的参考价值和指导意义.
1实验部分
1.1仪器与试剂
全自动化学发光图像分析系统(上海天能科技有限公司);全波长扫描酶标仪(Bio Tek仪器公司);电泳仪(上海天能科技有限公司);四维旋转混匀器(海门市其林贝尔仪器有限公司);超级恒温混匀仪(杭州奥盛仪器有限公司);超声波细胞粉碎机(宁波新芝生物科技股份有限公司);XW-80A旋涡混合器(上海精科实业有限公司);3K-18超速冷冻离心机(Sigma公司);干式恒温器(杭州奥盛仪器有限公司);protein A+G agarose珠(日本Beyotime公司);鼠抗β-actin单克隆抗体(Proteintech公司);BCA蛋白定量测定试剂盒、细胞裂解液RIPA、胰蛋白酶抑制剂PMSF、辣根过氧化物酶标记山羊抗小鼠IgG均购自北京鼎国昌盛生物技术有限公司;ECL化学发光检测试剂盒(Buckinghamsire公司);其他试剂均为市售优级纯或分析纯试剂.
1.2总蛋白样品的制备
精密称取小鼠脑组织适量,每100 mg脑组织中加入1 mL RIPA和PMSF的混合液(100∶1,体积比),冰浴下超声匀浆6 min,然后冰浴下裂解2 h,4 ℃离心(12 000 r·min-1)20 min,吸取上清液,备用.
1.3脑组织中β-actin的提取及纯化
取“1.2”项下浓度为0.5 g/L的上清液1 mL,加入10 μL浓度为1 g/L的β-actin抗体,4 ℃下摇动(750 r·min-1)30 min,使之充分偶联结合,加入protein A+G agarose 100 μL,4 ℃下摇动(750 r·min-1)2 h,然后离心(2 500 r·min-1)5 min,分别得到上清液和“β-actin-抗β-actin抗体-protein A+G agarose”偶联复合物,备用.
1.4β-actin蛋白的洗脱
取“1.3”项下的偶联复合物,加入1 mL结合洗涤液,混匀,离心(2 500 r·min-1)5 min,弃去上层清液,重复3次.然后加入100 μL 1×SDS蛋白电泳上样缓冲液,重悬偶联复合物,100 ℃加热5 min,放置室温,离心(2 500 r·min-1)5 min,取上清液,备用.
1.5不同提纯条件对β-actin蛋白提取量的影响
1.5.1样品初始浓度的影响
将“1.2”项下的样品溶液稀释成浓度为0.1、0.2、0.5、1和2 g/L的样品溶液,平行做2份,按“1.3”和“1.4”项下方法操作.
1.5.2温度的影响
取“1.2”项下浓度为0.5 g/L的样品溶液,在4 ℃和25 ℃条件下,按“1.3”和“1.4”项下方法操作.
1.5.3吸附时间的影响
取“1.2”项下浓度为0.5 g/L的样品溶液,protein A+G agarose与“β-actin-抗β-actin抗体”分别结合0.5 、1 、2 、4 和12 h.再按“1.3”和1.4“项下方法操作.
1.6β-actin含量测定
1.6.1Western blot测定β-actin的含量
取1.5项下上清液10 μL,进行SDS-PAGE电泳,转印至PVDF膜,5%脱脂奶粉室温封闭2 h,4 ℃过夜孵育一抗β-actin抗体(1∶8 000).洗膜后,加入辣根过氧化物酶标记的羊抗鼠IgG(1∶5 000),室温轻摇2 h,充分洗膜后,化学发光,胶片曝光显影,扫描灰度值[7].
1.6.2BCA法测定β-actin的含量
采用BCA试剂盒,按照试剂盒的方法测定protein A+G agarose吸附前后脑组织匀浆液中蛋白含量.protein A+G agarose吸附β-actin的量按下式计算[8]:
式中:Q:protein A+G agarose吸附量(g/g);m为protein A+G agarose的质量(mg);C0、C1分别为吸附前和吸附后蛋白浓度(g/L);V0、V1分别为吸附前和吸附后的体积(mL).
2结果与讨论
2.1样品初始浓度对β-actin蛋白提取量的影响
图1为样品初始浓度对β-actin蛋白提取量的影响.图1(a)和(b)为western blot的实验结果,由图1(b)可见,Western blot检测β-actin蛋白灰度值分析结果表明,当浓度小于0.5 g/L时,β-actin吸附量随样品浓度的增加而增多,变化趋势比较明显;当浓度大于0.5 g/L时,随浓度增加而增多的趋势渐趋平缓,说明protein A+G agarose偶联β-actin蛋白的量达到饱和,这可能与protein A+G agarose比表面积的限制有关.同时,通过图1(a)Western blot条带的深浅也可直观的证明这一点.图1(c)为BCA法检测β-actin蛋白含量的结果,变化趋势与Western blot含量测定结果一致.结果表明在样品浓度达到0.5 g/L时,protein A+G agarose偶联β-actin蛋白的量达到饱和.
2.2偶联温度对β-actin蛋白提取量的影响
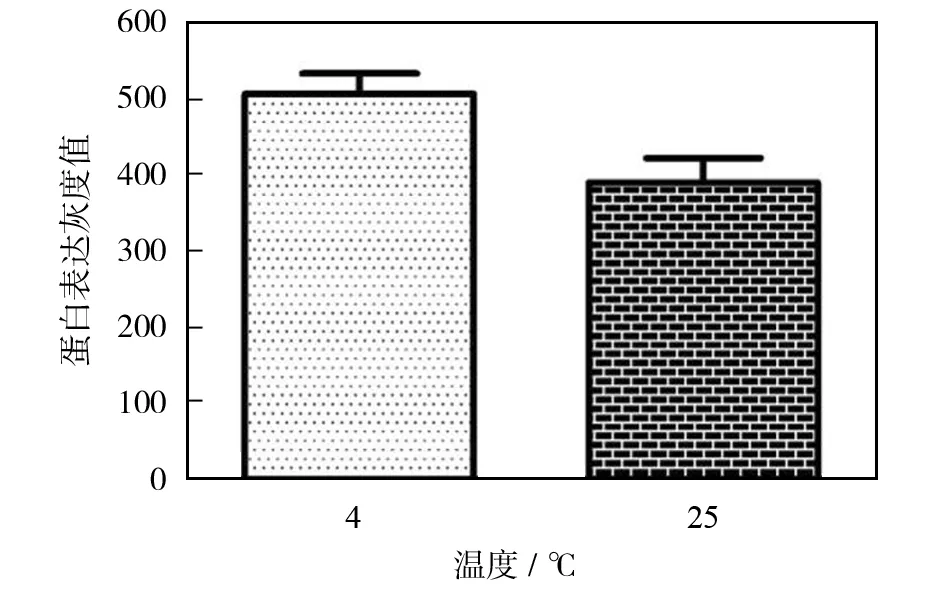
图2是偶联温度对protein A+G agarose偶联β-actin蛋白量的影响.图2(a)和(b)为western blot的实验结果,由图2(b)可知,在4 ℃条件下,protein A+G agarose提取得到的β-actin蛋白的灰度值比25 ℃时高,并且图2(a)的Western blot条带的深浅也可直观的证明这一点.图2(c)为BCA法检测β-actin蛋白含量的结果,变化趋势与Western blot含量测定结果一致.结果表明,4 ℃条件下,有益于protein A+G agarose提取到更多的β-actin蛋白.
此外,我们的实验还考察了在37 ℃条件下,protein A+G agarose对β-actin蛋白的提取情况(结果未列入本文),结果发现随温度升高,protein A+G agarose对β-actin蛋白的提取量逐渐降低,以4 ℃条件下提取效果最好.其主要原因与生物样品中存在着能降解蛋白质的酶有关.在温度较高时,酶的活性不易被酶抑制剂所抑制,进而导致蛋白降解,出现偶联蛋白量减少的情况.在较高温度下,即使分子的布朗运动增加,加大了protein A+G agarose与β-actin蛋白碰撞的机会而增加吸附偶联量,也无法抵消整体蛋白量降低所导致的吸附偶联量降低.4 ℃反应条件下,酶的活性可以较好的被抑制,同时四维旋转混悬(750 rpm/min)孵育并不会降低protein A+G agarose与β-actin蛋白接触的机会,结果表明有较好的吸附偶联效果.

(a)western blot图片
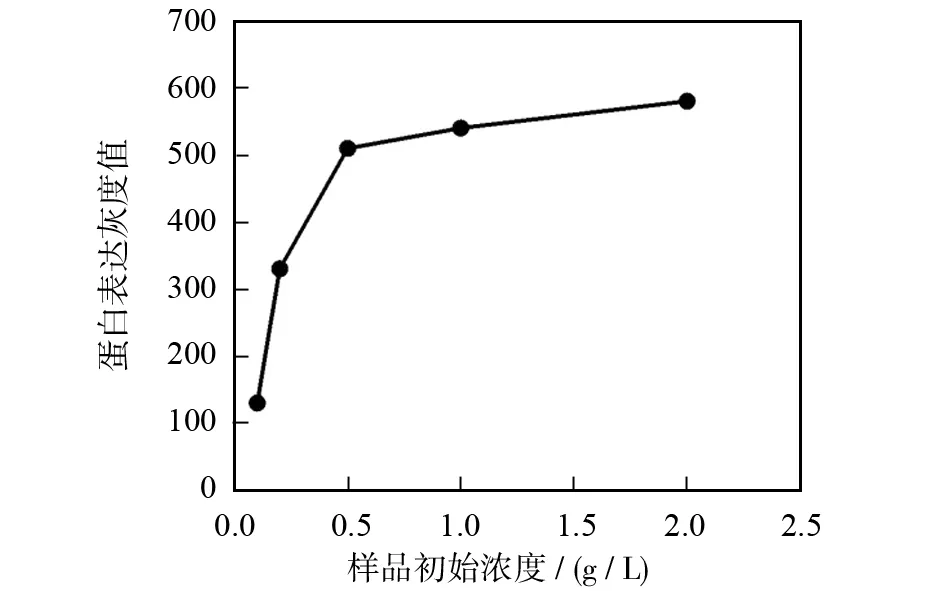
(b)western blot灰度值
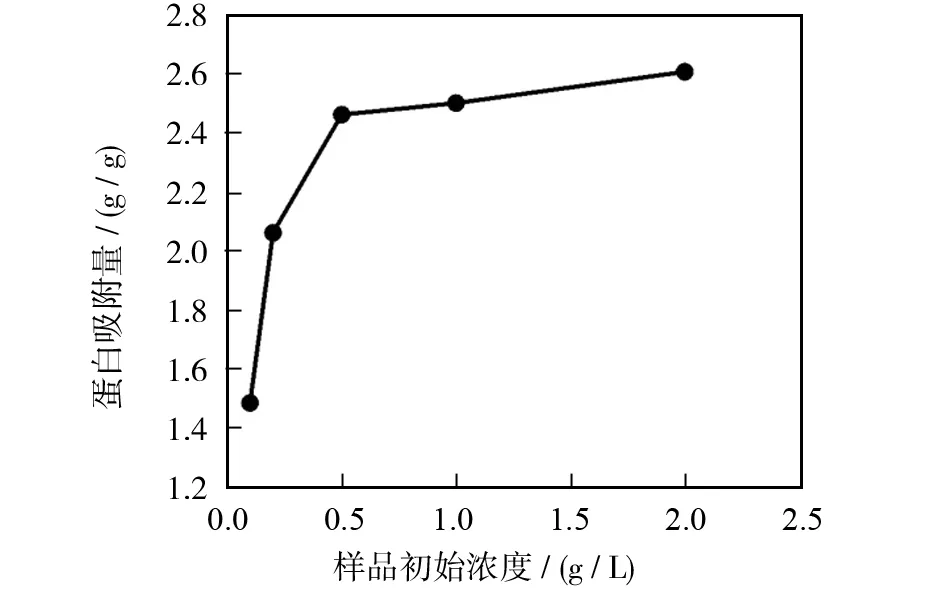
(c)BCA法测定的蛋白量图1 样品初始浓度对β-actin蛋白提取量的影响Fig.1 Effect of the initial sample concentration on the amount of β-actin protein extraction
2.3偶联时间对β-actin蛋白提取量的影响
图3是偶联时间对protein A+G agarose偶联吸附β-actin蛋白量的影响.图3(a)和(b)为western blot的实验结果,结果表明,protein A+G agarose与β-actin蛋白在4 ℃条件下反应2 h,提取β-actin蛋白的量达到峰值,但随着时间延长提取量逐渐降低.并且图3(a)的Western blot条带的深浅也可直观的证明这一点.图3(c)为BCA法检测β-actin蛋白含量的结果,变化趋势与Western blot含量测定结果一致.其主要原因是,agarose是细菌蛋白质的“protein A/G”的载体,而且尺寸很小,其对蛋白的吸附偶联主要发生在外表面,利用“protein A/G”特异性地结合到抗体(免疫球蛋白)的Fc片段,不存在内扩散现象,故不存在太大的时间依赖性.相反,时间越长生物样品中蛋白降解越严重,从而使吸附偶联效率降低.

(a)western blot图片
(b)western blot灰度值

(c)BCA法测定的蛋白量图2 反应温度对吸附总蛋白量和β-actin蛋白的影响Fig.2 Effect of reaction temperature on the amount of β-actin protein extraction
2.4重复验证实验结果
在优化的样品初始浓度、偶联温度和时间下,使用初始浓度为0.5 g/L的样品,protein A+G agarose与“β-actin-抗β-actin抗体”复合物在4 ℃条件下偶联反应2 h,平行做3份样品.由表1可知,灰度值与蛋白含量结果的RSD≤ 8.08%.说明在优化的条件下,可以保证使用protein A+G agarose富集β-actin蛋白具有良好的稳定性和重现性.
(a)western blot图片
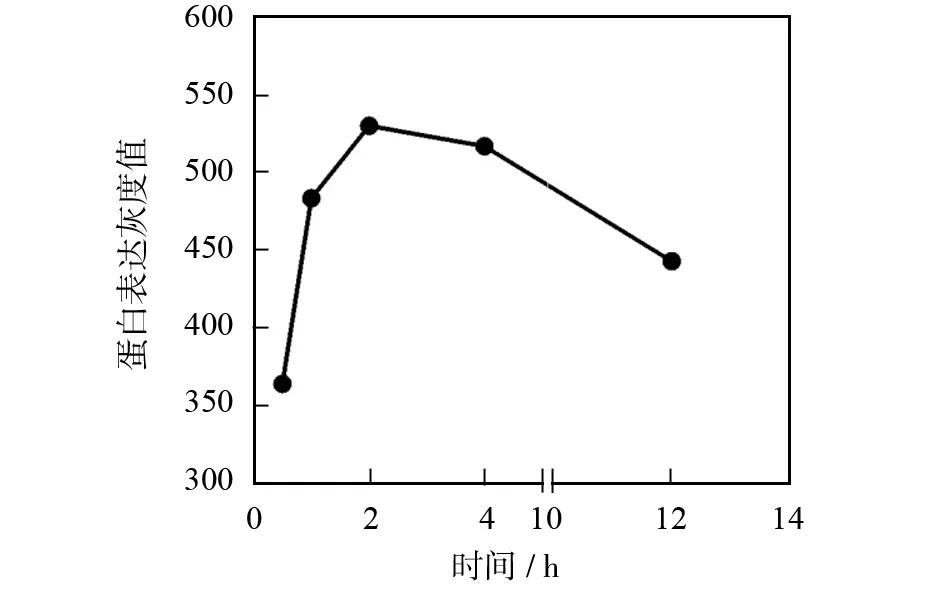
(b)western blot灰度值
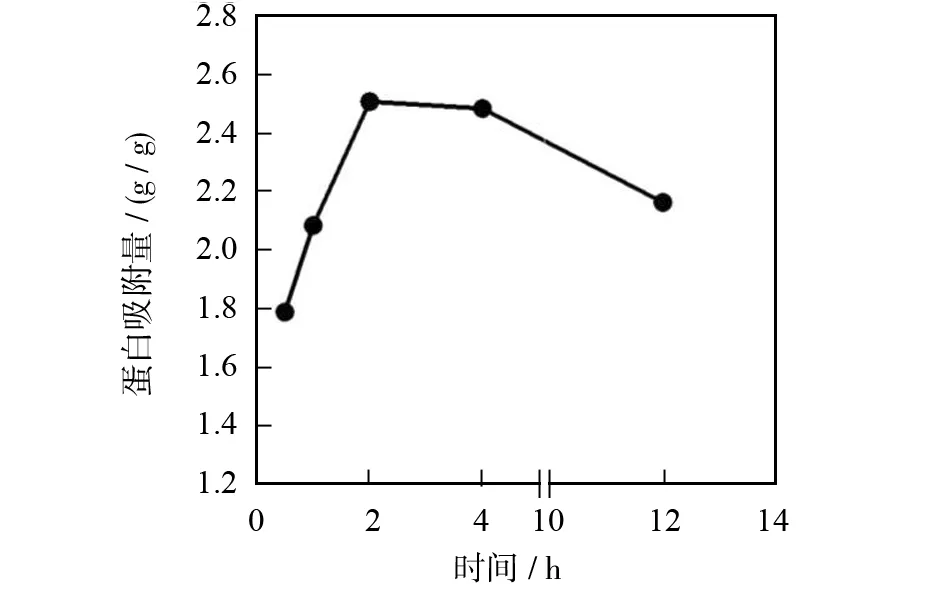
(c)BCA法测定的蛋白量图3 反应时间对吸附总蛋白量和β-actin蛋白的影响Fig.3 Effect of reaction time on the amount of β-actin protein extraction
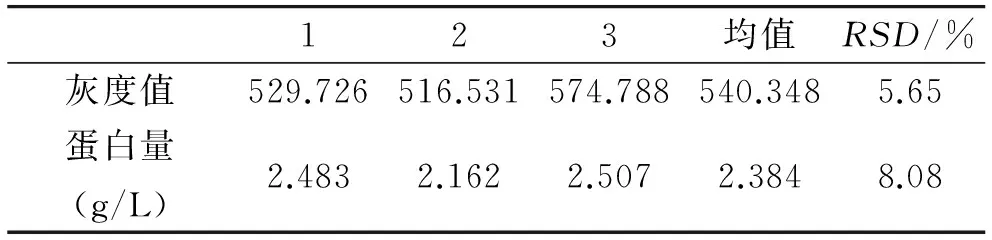
123均值RSD/%灰度值529.726516.531574.788540.3485.65蛋白量(g/L)2.4832.1622.5072.3848.08
3结论
在4 ℃反应2 h条件下,琼脂糖珠对蛋白有较好的富集作用,建立的protein A+G agarose富集β-actin蛋白的方法具有良好的稳定性和重现性.
参考文献:
[1] 陆健等. 蛋白质纯化技术及应用[M]. 北京: 化学工业出版社, 2005: 1-2.
[2] GRONENBORN A M, CLORE G M. Identification of the contact surface of a streptococcal protein G domain complexed with a human Fc fragment [J]. Mol Biol, 1993, 233(3): 331-335.
[3] 翟耀耀, 刘晓霞, 魏秀芳. 免疫沉淀技术的最新进展[J]. 现代生物医学进展, 2010, 10(10): 1997-2000.
[4] 王曦, 张磊, 周士胜, 等. 检测心肌细胞钾离子通道蛋白活化水平方法的优化[J]. 生物工程学报, 2008, 24(3): 521-524.
[5] LI Y Q,WANG J H, ZHANG H L, et al. High-sensitivity quantum dot-based fluorescence resonance energy transfer bioanalysis by capillary electrophoresis [J]. Biosensors and Bioelectronics, 2010, 25(6): 1283-1289.
[6] 初丽娜, 孟倩, 张曼. 影响磁珠共价偶联效率的因素分析[J]. 临床和实验医学杂志, 2013, 12(7): 490-492.
[7] 陈建新, 姚丽华, 王惠玲, 等. 氟西汀对慢性应激大鼠前额叶谷氨酸转运体GLT-1表达的影响[J]. 中国药理学通报, 2015, 31(2): 256-260.
[8] 林梅双, 吴晓蔓. 羧基磁珠吸附乙型肝炎病毒表面抗原的性能研究[J]. 检验医学与临床, 2013, 22(10): 2978-2981.
[责任编辑:任铁钢]
收稿日期:2015-12-15.
基金项目:国家自然科学基金项目(81473417).
作者简介:袁明美(1991-),女,硕士生,主要从事化学生物分析及作用机制研究.*通讯联系人,Email:voncedar@126.com.
中图分类号:R286.02
文献标志码:A
文章编号:1008-1011(2016)03-0345-04
Optimization of experimental conditions on agarose beads enrichingβ-actin protein
YUAN Mingmei1,JIANG Hong2,FENG Xuesong1*
(1.Collegeofpharmacy,ChinaMedicalUniversity,Shenyang110122,Liaoning,China;2.CollegeofPublicHealth,ChinaMedicalUniversity,Shenyang110122,Liaoning,China)
Abstract:The effects of different reaction conditions (initial sample concentration, temperature and time) on the amount of mice brain β-actin enriched by protein A + G agarose were studied. Results showed that 0.5 mg/mL of the initial concentration, and reaction of 2 h at 4 ℃ were the optimal experimental conditions. Protein A + G agarose could enrich the most β-actin in mice brain.The methods showed good stability and reproducibility.
Keywords:agarose beads;β-actin protein;optimization conditions;protein enrichment
