钙网织蛋白促进心脏瓣膜病患者心房重构
2016-07-05王思博
赵 飞, 王思博, 褚 鹏, 王 伟
(南京医科大学第一附属医院胸外科,江苏 南京 210029)
钙网织蛋白促进心脏瓣膜病患者心房重构
赵飞,王思博,褚鹏,王伟△
(南京医科大学第一附属医院胸外科,江苏 南京 210029)
[摘要]目的: 明确钙网织蛋白的异常表达与分布能否促进心脏瓣膜病患者心房重构的发生。方法: 从78位进行瓣膜置换手术的患者中获得左右心房的标本。患者被分为窦性节律组、阵发性房颤组和持续性房颤组(房颤持续超过6个月),检测心房组织中钙网织蛋白、整合素α5和转化生长因子β1(TGF-β1)的蛋白表达情况。同时使用免疫共沉淀法测定钙网织蛋白与钙调磷酸酶B及整合素α5的结合情况。结果: 房颤组的钙网织蛋白、整合素α5和TGF-β1的蛋白表达均高于窦性节律组,特别是在二尖瓣疾病患者的左心房中。免疫共沉淀显示钙网织蛋白可以与钙调磷酸酶B和整合素α5结合产生相互作用。整合素α5的表达水平与TGF-β1的表达具有明显相关性,钙网织蛋白表达水平与整合素α5和TGF-β1的表达水平具有明显的相关性。在相同心功能分级情况下,钙网织蛋白的表达水平在持续性房颤组明显高于窦性心律组。结论: 房颤患者心房组织中的钙网织蛋白、整合素α5和TGF-β1表达增高,并与房颤类型有关,这提示钙网织蛋白参与了心脏瓣膜病房颤患者的心房重构。
[关键词]房颤; 钙网织蛋白; 整合素α5; 转化生长因子β1; 心房纤维化
心房纤颤(atrial fibrillation,AF)简称房颤,是临床实践中最常见的心律失常[1-2]。心脏瓣膜病(valvular heart disease,VHD),包括二尖瓣或主动脉瓣病变均和房颤的发生密切相关。目前,瓣膜置换术是防止心瓣膜病患者发生心衰的较有效选择[3-4]。房颤所致的电生理重构特别是组织结构重构将进一步加剧和维持房颤的发生发展,并且使得房颤持续发展从而进入不可逆转的状态[5]。相关研究表明,结构重构是房颤进一步发展的基础[6-7]。心房纤维化则在心房结构重构中起着重要的作用[2, 8],它引起心房组织内电传导异常,产生局部折返激动和适合房颤持续发展的基础[9]。然而,房颤中有关心房纤维化的确切机制仍未阐明。
最新研究表明,在组织的纤维化过程中钙网织蛋白(calreticulin)的表达明显增高,这提示钙网织蛋白可增加细胞外基质(extracellular matrix,ECM)的生成,这一过程在纤维化过程中起着重要的作用[10]。同时,钙网织蛋白可诱导转化生长因子β1(transforming growth factor-β1,TGF-β1)表达,这一点在整个纤维化过程中也是至关重要[11]。TGF-β1和钙网织蛋白均能直接或间接地诱导纤维蛋白、纤连蛋白等基质蛋白的表达[12]。我们研究了不同类型房颤的心瓣膜病患者心房组织中钙网织蛋白、整合素α5(integrin-α5)和TGF-β1的表达和分布情况,以求明确钙网织蛋白在房颤的病理性心房组织中表达是否增高以及心房心肌细胞中钙网织蛋白是否与整合素α5和钙调磷酸酶(calcineurin)B存在相互作用。另外,我们还进行了心房组织中钙网织蛋白表达水平与TGF-β1、整合素α5表达水平之间以及TGF-β1表达水平与整合素α5表达水平之间的相关性分析。
材料和方法
1患者
选取2013年1月~2014年7月在南京医科大学第一附属医院进行瓣膜置换手术的VHD患者78例,其中包含二尖瓣、主动脉瓣或双瓣膜均有疾病的患者。根据患者术前情况将其分为3组:窦性心律(sinus rhythm,SR;n=30)组、阵发性房颤(paroxysmal AF,PaAF;n=16)组和持续性房颤(persistent AF,PeAF;n=32)组、除此之外选取10名窦性心律、接受了先天性心脏病手术的患者构成对照组(n=10)。我们选取术前右心房直径无明显差异的患者,收集了持续性房颤组的左、右心房组织和其它组的右心房组织。研究过程中排除以下4类患者:(1) 肾功能不全(血清肌酐 > 136 μmol/L)或II型糖尿病者;(2) 冠状动脉造影和超声心动图评估示确诊为冠心病的患者;(3) 70岁以上合并有相关增加房颤风险病史(如甲亢)者;(4) 术后严重并发症需要特殊治疗者。术前药物(除华法令阻凝剂和血管紧张素转化酶抑制剂外)需一直给药到手术当天清晨。术前由一名研究员评估患者术前临床特征;出院前由另一名研究员记录详细手术数据。该研究被南京医科大学伦理委员会讨论通过,所有受试者均签署知情同意书。
2心肌组织采取和储存
所有手术均由相同的心脏麻醉师、灌注师和手术团队执行。在低温(33~34 ℃)环境下对患者进行体外循环心脏手术,经灌注管顺灌冷心停搏液,同时使用冰屑局部降温,使心脏迅速停搏。冷心停搏液每20~30 min给予1次。在心脏手术体外循环开始之前,于腔静脉置管处切取约250 mg右心耳组织以及从持续性房颤组患者中切取约250 mg左心耳组织。对于风湿性瓣膜病伴持续性房颤者来说,我科多常规行左心耳组织结扎和切除术,而对其它组患者来说则没有必要进行左心耳切除,特别是对于窦性心律组。其中50 mg的左、右心耳组织固定于4%的多聚甲醛溶液中用以组织学和免疫组织化学的研究。剩余组织则快速冷冻于液氮中供后续研究所用。
3实验方法
3.1蛋白免疫印迹(Western blot)实验在组织提取的全过程中,使用含有50 mmol/L Tris-HCl (pH 7.4)、150 mmol/L NaCl、 1% Na3VO4、1% Triton X-100和0.1% SDS的裂解缓冲液对心房组织样本进行匀浆。用Lowry法检测蛋白质浓度,分光光度计测量蛋白质吸光度(UV 2540)。变性样本作如下处理:10%的SDS聚丙烯酰胺凝胶电泳分离含25 μg蛋白质的样本,然后转至NC膜上,5%的脱脂牛奶封闭薄膜上非特异抗原,然后加入抗钙网织蛋白、整合素α5和TGF-β1的抗体4 °C下孵育过夜。将与 I 抗反应后的薄膜37 °C下置于含 II 抗(在含5%的脱脂牛奶和0.1%的Tween-20的PBS中稀释羊抗兔IgG)的封闭液中反应2 h。染色后的薄膜用ECL试剂(GE Healthcare)进行化学发光检测。每个结果近似的样本至少重复3次Western blot操作。
3.2免疫沉淀法用抗钙网织蛋白、抗calcineurin B和抗整合素α5抗体对心房组织样本进行免疫共沉淀。样本置于含有50 mmol/L Tris-HCl(pH 7.4)、150 mmol/L NaCl、0.5% Na3O4和1% NP-40的裂解缓冲液中。免疫复合物通过A蛋白琼脂糖滴(Beytime Biotechnology Inc.)捕捉。过量冲洗后,使用SDS聚丙烯酰胺凝胶电泳分离蛋白质,进行Western blot操作。
3.3组织学和免疫组织化学观察在pH 7.4的PBS液中,用4%的多聚甲醛固定左、右心耳组织24 h。乙醇脱水后石蜡包埋,切片。用V-G法染色2 μm厚的连续切片并在显微镜下观察。另外在4 μm厚的石蜡组织切片上进行免疫反应对钙网织蛋白的表达进行检测。细胞或细胞膜棕染为阳性。
4统计学处理
采用GraphPad Prism Version 5.01对数据进行统计学处理。实验数据以均数±标准差(mean±SD)表示。多组间(组数≥3)的差异用单因素方差分析(one-way ANOVA)法进行检测。方差齐,则任意两组总体均数间的差异用Scheffe法检测;方差不齐,则任意两组总体均数间的差异用Mann-WhitneyU法检测。组间率的差异用Chi-square和Fisher exact检验确定。用Pearson相关分析来评估钙网织蛋白、整合素α5和TGF-β1表达水平之间的关系。以P<0.05为差异有统计学意义。
结果
1临床特征和血液动力学数据
表1为术前血液动力学和超声心动图的相关数据,数据分析显示持续性房颤组的左心房直径明显大于窦性心律组;另外,除对照组(先天性心脏病组)外,所有组的左心房直径均大于右心房直径。由于心房扩张将诱导相关蛋白表达促进心房纤维化,因此如果不去除此因素的影响将会干扰所检测指标的分析。由于各组右心房直径大小相似,心房扩张而影响心房组织重构的可能性将明显降低,所以右心房组织较为适合用于研究房颤对心房组织重构的直接影响。在各组中右心室直径、左室收缩末期尺寸和左室舒张末期尺寸并没有明显差异。
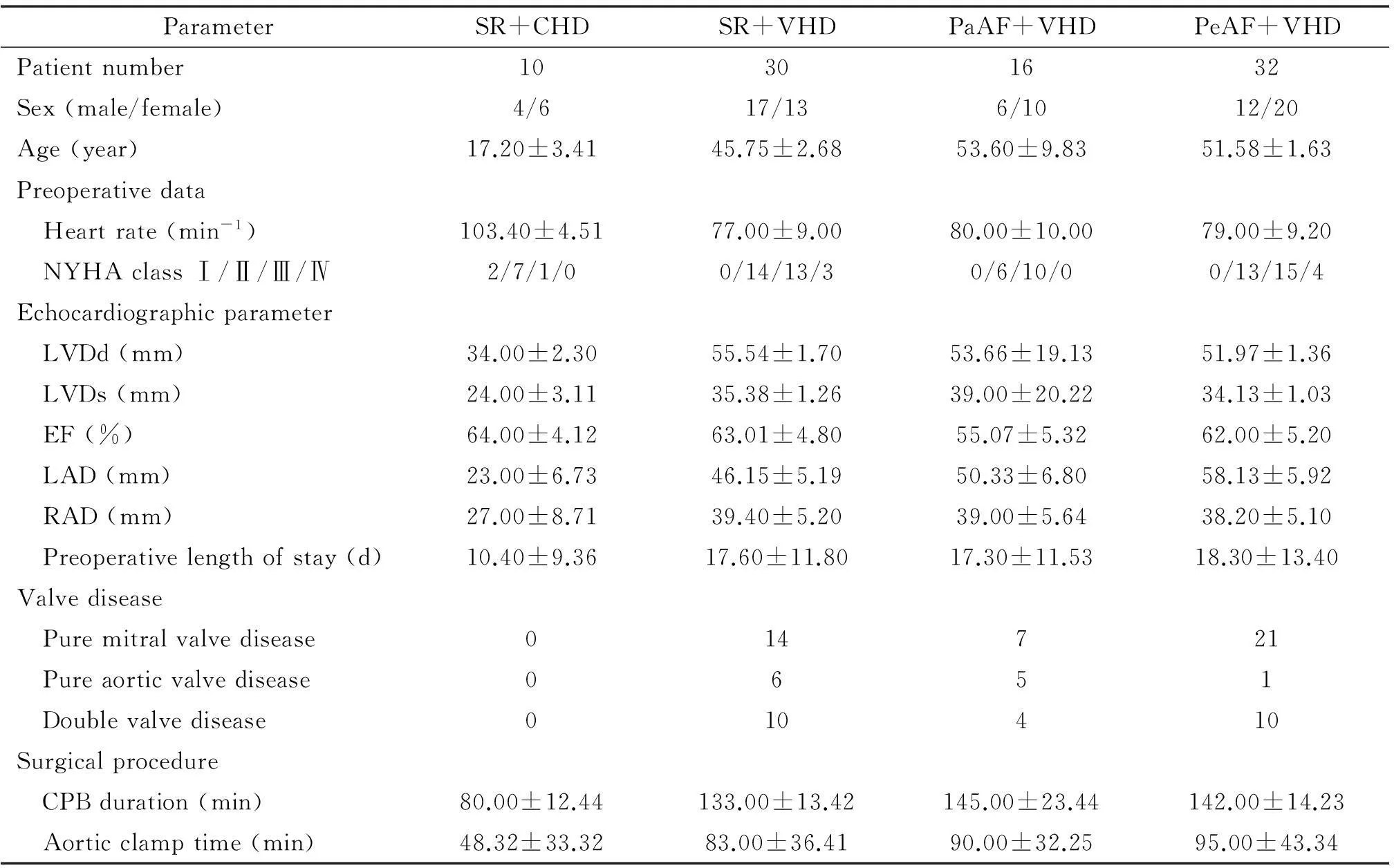
表1 各组临床指标
LVDd: left ventricular end-diastolic dimension; LVDs: left ventricular end-systolic dimension; LAD: left atrium diameter; RAD: right atrium diameter; PeAF: persistent atrial fibrillation; PaAF: paroxysmal atrial fibrillation; SR: sinus rhythm; VHD: valvular heart disease; CHD: congenital heart disease; CPB: cardiopulmonary bypass.
2在房颤组中,心房组织中的钙网织蛋白、整合素α5和TGF-β1蛋白的表达明显增高
免疫组织化学检查结果显示:持续性房颤组左心房组织中的钙网织蛋白表达水平高于右心房组织。钙网织蛋白多存在于左心房组织中的胞膜和右心房组织中的胞质。房颤组的钙网织蛋白表达水平高于窦性心律组和对照组,见图1。Western blot结果表明,房颤组中钙网织蛋白、整合素α5和TGF-β1的表达水平上调,特别是在持续性房颤组的左心房中上调更明显,见图2~4。
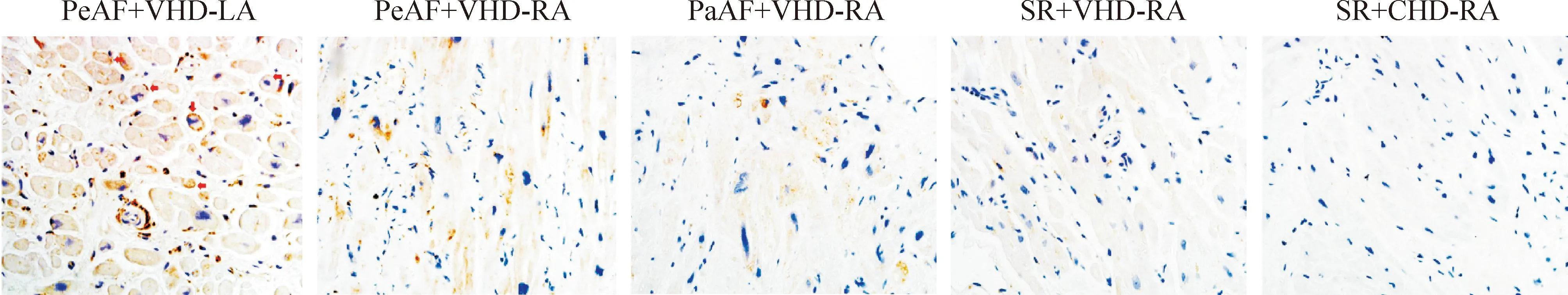
Figure 1.Immunohistochemistry for calreticulin (stained brown) in sections obtained from different groups (×400). Nuclei are in blue. Red arrows indicate a lot of calreticulin located on the myocyte membrane in left atrium in PeAF group. PeAF: persistent atrial fibrillation; PaAF: paroxysmal atrial fibrillation; SR: sinus rhythm; VHD: valvular heart disease; CHD: conge-nital heart disease; LA: left atrium; RA: right atrium.
图1各组钙网织蛋白的免疫组化结果
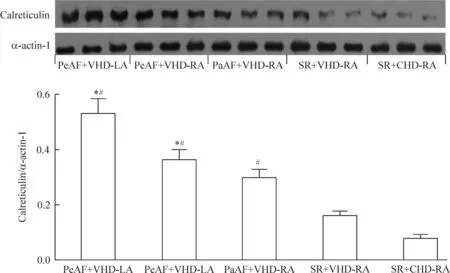
Figure 2.The protein expression of calreticulin in different groups. PeAF: persistent atrial fibrillation; PaAF: paroxysmal atrial fibrillation; SR: sinus rhythm; VHD: valvular heart disease; CHD: congenital heart disease; LA:left atrium; RA:right atrium. Mean±SD.n=10.*P<0.05vsSR+VHD-RA;#P<0.05vsSR+CHD-RA.
图2钙网织蛋白在各组的表达

Figure 3.The protein expression of integrin-α5 in different groups. PeAF: persistent atrial fibrillation; PaAF: paroxysmal atrial fibrillation; SR: sinus rhythm; VHD: valvular heart disease; CHD: congenital heart disease; LA: left atrium; RA: right atrium. Mean±SD.n=10.*P<0.05vsSR+VHD-RA and SR+CHD-RA;#P<0.05vsPeAF+VHD-RA and PaAF+VHD-RA.
图3Integrin-α5蛋白在各组的表达
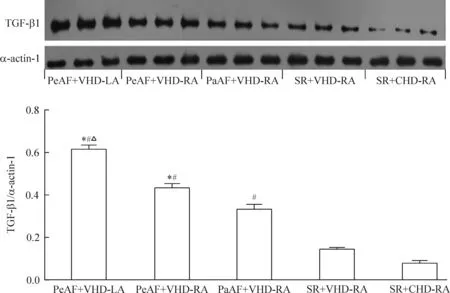
Figure 4.The protein expression of TGF-β1 in different groups. PeAF: persistent atrial fibrillation; PaAF: paroxysmal atrial fibrillation; SR: sinus rhythm; VHD: valvular heart disease; CHD: congenital heart disease; LA: left atrium; RA: right atrium. Mean±SD.n=10.*P<0.05vsSR+VHD-RA;#P<0.05vsSR+CHD-RA;△P<0.05vsPeAF+VHD-RA and PaAF+VHD-RA.
图4TGF-β1蛋白在各组的表达
3钙网织蛋白、整合素α5和TGF-β1的蛋白表达水平之间密切相关
Western blot法检测发现,钙网织蛋白和整合素α5的蛋白质表达水平之间、钙网织蛋白和TGF-β1的蛋白质表达水平之间、整合素α5和TGF-β1的蛋白质表达水平之间均有明显统计学相关性,见图5~7。
4钙网织蛋白表达水平与NYHA心功能分级之间的关系
Western blot法检测结果显示,房颤组中NYHA分级III级的患者其左、右心房中钙网织蛋白的蛋白表达水平高于NYHA II级的患者。在同一组患者中,仅当患者处于NYHA III级时,左心房钙网织蛋白的表达水平高于右心房组织,而当患者处于NYHA II级时,左心房钙网织蛋白的表达水平与右心房表达水平没有明显差异。在NYHA分级相同患者的右心房组织中,房颤组的钙网织蛋白的表达水平高于窦性心律组。另外,房颤组的左心房组织中的钙网织蛋白表达水平明显高于窦性心律组的右心房组织,见表2。
5钙网织蛋白与整合素α5和calcineurin B之间的相互作用
免疫共沉淀分析表明,持续性房颤患者左、右心房组织中钙网织蛋白与整合素α5和calcineurin B 之间存在着相互作用,见图8。
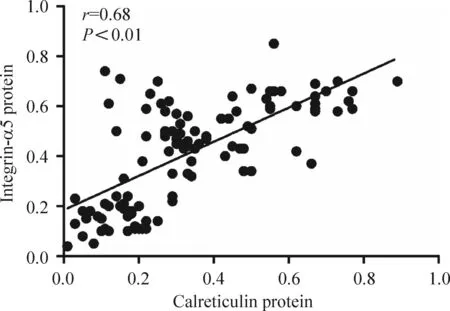
Figure 5.The relationship between protein expression of calreticulin and integrin-α5.
图5钙网织蛋白与integrin-α5的相关性分析
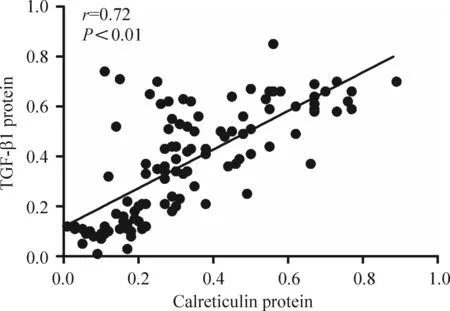
Figure 6.The relationship between protein expression of calreticulin and TGF-β1.
图6钙网织蛋白与TGF-β1的相关性分析

Figure 7.The relationship between protein expression of integrin-α5 and TGF-β1.
图7Integrin-α5与TGF-β1的相关性分析
讨论
大量研究表明,心房结构重构为房颤的发生提供了基础,维持了房颤的发生发展[13]。影响心房结构重构的相关因素已被大多数学者所确认;其中,心房纤维化和心肌肥大在结构重构中扮演着关键的角色[14]。心肌纤维化是以心肌间质成纤维细胞大量增生、细胞外基质蛋白异常堆积为特征的心脏病理性变化[15]。这些变化可能导致心肌细胞内电传导延迟,产生异常传导通路;同时也会导致异位兴奋的产生,进而形成折返回路[16]。
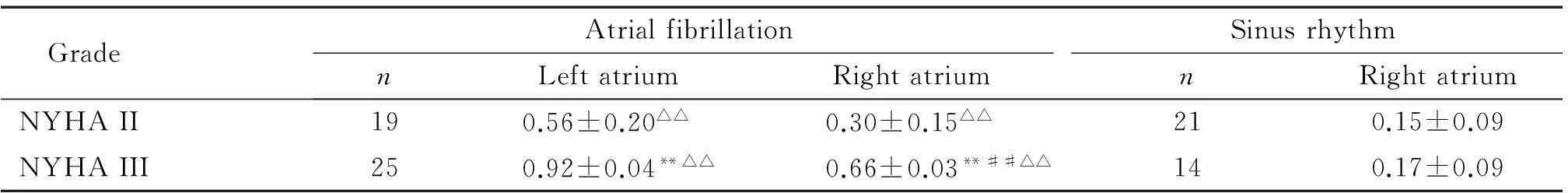
表2 对不同心脏功能钙网织蛋白表达的分析
**P<0.01vsNYHA II;##P<0.01vsleft atrium;△△P<0.01vssinus rhythm.

Figure 8.Calreticulin-specific antibody, calcineurin B/integrin-α5-specific antibody and control IgG were used for immunoprecipita-tion, and immunoblots showed that both calcineurin B and integrin-α5 co-immunoprecipitated with calreticulin.
图8钙网织蛋白分别与calcineurin B和integrin-α5的免疫共沉淀实验
钙网织蛋白是一种内质网上的钙结合蛋白,在心脏发育中发挥重要作用[17]。钙网织蛋白可分布于细胞内、细胞膜表面和细胞外间隔[18]。许多哺乳动物细胞表面均表达钙网织蛋白,这证明这种细胞内分子的作用不仅限于内质网内,它可以在内质网外对细胞产生作用[19-21]。有报道称,外源性钙网织蛋白可刺激成纤维细胞迁移[22],并上调整合素的表达。细胞外基质中表达的钙网织蛋白可改变自身结构从而作为重要的介导分子连接细胞外基质和心肌细胞,刺激心肌细胞发生重构[23-24]。正常人的心肌表达低水平的钙网织蛋白,钙网织蛋白的过度表达常见于高血压、心衰等疾病,这是心肌细胞内幼稚基因被重新激活的表现[25]。我们发现持续性房颤组NYHA III级患者的钙网织蛋白表达水平明显高于II级患者,在窦性心律组中这种差别无统计学意义。而在NYHA心功能分级相同的患者中,房颤组钙网织蛋白的表达水平明显高于窦性心律组。因此,我们认为房颤和心衰均可激活钙网织蛋白的过度表达,且房颤通过激活钙网织蛋白的过度表达诱导心房重构的能力大于心衰。我们证明了在窦性心律组相对正常的心房组织中钙网织蛋白的表达水平较低,这在先心病对照组中低表达的现象更为明显。
当细胞黏附于细胞外基质时,钙网织蛋白和整合素相互结合[26],从而使基质金属蛋白酶2、基质金属蛋白酶9和膜型基质金属蛋白酶1的表达水平明显增高[24]。钙网织蛋白作为伴随分子保证了整合素的正确折叠[27]。整合素是联系细胞外基质和心肌细胞的基本单位[28]。同时,整合素可活化TGF-β1(一种心脏纤维化过程中的重要细胞因子)[29]。TGF-β1是血管紧张素II的主要下游调节介质[2],在心脏纤维化信号通路中起着关键作用[30]。TGF-β1刺激成纤维细胞表达更多的整合素[31],而整合素的过度表达反过来也会促进TGF-β1的表达[32]。通过免疫共沉淀反应,我们发现钙网织蛋白和整合素α5相互作用,我们推测房颤患者左、右心房组织中钙网织蛋白过度表达进而诱导大量整合素的活化。我们证明了钙网织蛋白和TGF-β1、钙网织蛋白和整合素α5、整合素α5和TGF-β1之间具有明显的相关性。
心房肥大阻碍心房组织间的电传导,导致异位电活动及传导弥散,进一步可促进房颤的发生和发展。在导致心房病理性肥大多个信号通路中,Ca2+-calcineurin-nuclear factor系统被确认为关键性节点[33]。钙网织蛋白被认为是calcineurin的上游调节因子[34]。同样,通过免疫共沉淀,我们发现钙网织蛋白和calcineurin B的相互作用。我们推测房颤患者左、右心房组织中钙网织蛋白诱导了Ca2+-calcineurin-nuclear factor系统的活化。
综上所述,我们发现在房颤患者心房组织中,钙网织蛋白、整合素α5和TGF-β1参与了房颤患者的心房重构。但是,由于导致房颤的病因诸多,故钙网织蛋白在心房结构重构和电生理重构中的相关机制还有待进一步的研究。
[参考文献]
[1]Wyse DG, Gersh BJ. Atrial fibrillation: a perspective: thinking inside and outside the box[J]. Circulation, 2004, 109(25):3089-3095.
[2]Burstein B, Nattel S. Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation[J]. J Am Coll Cardiol, 2008, 51(8):802-809.
[3]Ross J Jr. Left ventricular function and the timing of surgical treatment in valvular heart disease[J]. Ann Intern Med, 1981, 94(4 Pt 1):498-504.
[4]Otto CM. Valvular aortic stenosis: disease severity and timing of intervention[J]. J Am Coll Cardiol, 2006, 47(11):2141-2151.
[5]Wyse DG, Waldo AL, DiMarco JP, et al. A comparison of rate control and rhythm control in patients with atrial fibrillation[J]. N Engl J Med, 2002, 347(23):1825-1833.
[6]Lin CS, Pan CH. Regulatory mechanisms of atrial fibrotic remodeling in atrial fibrillation[J]. Cell Mol Life Sci, 2008, 65(10):1489-1508.
[7]Kostin S, Klein G, Szalay Z, et al. Structural correlate of atrial fibrillation in human patients[J]. Cardiovasc Res, 2002, 54(2):361-379.
[8]李裕舒,罗明华. 心房颤动患者心房I型胶原重构与左心房扩大[J]. 中国病理生理杂志, 2008, 24(4):804-806.
[9]Li D, Fareh S, Leung TK, et al. Promotion of atrial fibrillation by heart failure in dogs: atrial remodeling of a different sort[J]. Circulation, 1999, 100(1):87-95.
[10]Kypreou KP, Kavvadas P, Karamessinis P, et al. Altered expression of calreticulin during the development of fibrosis[J]. Proteomics, 2008, 8(12):2407-2419.
[11]Li WY, Huang EY, Dudas M, et al. Transforming growth factor-β3affects plasminogen activator inhibitor-1 expression in fetal mice and modulates fibroblast-mediated collagen gel contraction[J]. Wound Repair Regen, 2006, 14(5):516-525.
[12]Leonard CM, Fuld HM, Frenz DA, et al. Role of transforming growth factor-beta in chondrogenic pattern formation in the embryonic limb: stimulation of mesenchymal condensation and fibronectin gene expression by exogenenous TGF-beta and evidence for endogenous TGF-beta-like activity[J]. Dev Biol, 1991, 145(1):99-109.
[13]Iwasaki YK, Nishida K, Kato T, et al. Atrial fibrillation pathophysiology: implications for management[J]. Circulation, 2011, 124(20):2264-2274.
[14]Mazzini MJ, Monahan KM. Pharmacotherapy for atrial arrhythmias: present and future[J]. Heart Rhythm, 2008, 5(10):S26-S31.
[15]何文聪,李裕舒,罗明华,等. 心房颤动患者心房纤维化与缝隙连接重构的关系[J]. 中国病理生理杂志,2008, 24(10):1943-1947.
[16]Eckstein J, Verheule S, de Groot NM, et al. Mechanisms of perpetuation of atrial fibrillation in chronically dilated atria[J]. Prog Biophys Mol Biol, 2008, 97(2-3):435-451.
[17]Mesaeli N, Nakamura K, Zvaritch E, et al. Calreticulin is essential for cardiac development[J]. J Cell Biol, 1999, 144(5):857-868.
[18]Gold LI, Eggleton P, Sweetwyne MT, et al. Calreticulin: non-endoplasmic reticulum functions in physiology and di-sease[J]. FASEB J, 2010, 24(3):665-683.
[19]Gardai SJ, McPhillips KA, Frasch SC, et al. Cell-surface calreticulin initiates clearance of viable or apoptotic cells through trans-activation of LRP on the phagocyte[J]. Cell, 2005, 123(2):321-334.
[20]Goicoechea S, Orr AW, Pallero MA, et al. Thrombospondin mediates focal adhesion disassembly through interactions with cell surface calreticulin[J]. J Biol Chem, 2000, 275(46):36358-36368.
[21]Gray AJ, Park PW, Broekelmann TJ, et al. The mitogenic effects of the Bβ chain of fibrinogen are mediated through cell surface calreticulin[J]. J Biol Chem, 1995, 270(44):26602-26606.
[22]Nanney LB, Woodrell CD, Greives MR, et al. Calreticulin enhances porcine wound repair by diverse biological effects[J]. Am J Pathol, 2008, 173(3):610-630.
[23]McDonnell JM, Jones GE, White TK, et al. Calreticulin binding affinity for glycosylated laminin[J]. J Biol Chem, 1996, 271(14):7891-7894.
[24]Wu M, Massaeli H, Durston M, et al. Differential expression and activity of matrix metalloproteinase-2 and -9 in the calreticulin deficient cells[J]. Matrix Biol, 2007, 26(6):463-472.
[25]Maass A, Leinwand LA. A role for calreticulin in the adult heart? [J]. J Clin Invest, 2001, 107(10):1223-1225.
[26]Coppolino M, Leung-Hagesteijn C, Dedhar S, et al. Inducible interaction of integrin α2β1with calreticulin. Dependence on the activation state of the integrin[J]. J Biol Chem, 1995, 270(39):23132-23138.
[27]Elton CM, Smethurst PA, Eggleton P, et al. Physical and functional interaction between cell-surface calreticulin and the collagen receptors integrin α2β1and glycoprotein VI in human platelets[J]. Thromb Haemost, 2002, 88(4):648-654.
[28]Ross RS, Borg TK. Integrins and the myocardium[J]. Circ Res, 2001, 88(11):1112-1119.
[29]Ma LJ, Yang H, Gaspert A, et al. Transforming growth factor-β-dependent and -independent pathways of induction of tubulointerstitial fibrosis in β6-/-mice[J]. Am J Pathol, 2003, 163(4):1261-1273.
[30]Lijnen PJ, Petrov VV, Fagard RH. Induction of cardiac fibrosis by transforming growth factor-β1[J]. Mol Genet Metab, 2000, 71(1-2):418-435.
[31]Dalton SL, Scharf E, Davey G, et al. Transforming growth factor-β overrides the adhesion requirement for surface expression of α5β1integrin in normal rat kidney fibroblasts. A necessary effect for induction of anchorage-independent growth[J]. J Biol Chem, 1999, 274(42):30139-30145.
[32]Wang D, Sun L, Zborowska E, et al. Control of type II transforming growth factor-beta receptor expression by integrin ligation[J]. J Biol Chem, 1999, 274(18):12840-12847.
[33]Molkentin JD, Lu JR, Antos CL, et al. A calcineurin-dependent transcriptional pathway for cardiac hypertrophy[J]. Cell, 1998, 93(2):215-228.
[34]Lynch J, Michalak M. Calreticulin is an upstream regulator of calcineurin[J]. Biochem Biophys Res Commun, 2003, 311(4):1173-1179.
(责任编辑: 卢萍, 罗森)
Over-expressed calreticulin interacts with integrin-α5 and calcineurin system to induce atrial remodeling in patients with atrial fibrillation and valvular disease
ZHAO Fei, WANG Si-bo, CHU Peng, WANG Wei
(DepartmentofThoracicSurgery,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China.E-mail:wangwei-doctor@163.com)
[ABSTRACT]AIM: To determine whether calreticulin over-expression contributes to atrial fibrosis in the patients with atrial fibrillation (AF) and valvular heart disease (VHD).METHODS: Right and left atrial specimens were obtained from 78 patients undergoing valve replacement surgery. The patients were divided into sinus rhythm (SR) group, paroxysmal AF (PaAF) group and persistent AF (PeAF, AF lasting >6 months) group. The protein expression of calreticulin, integrin-α5, and transforming growth factor-β1 (TGF-β1) was measured. Immunoprecipitation was also performed to determine whether calreticulin interacted with either calcineurin B or integrin-α5. RESULTS: The protein expression of calreticulin, integrin-α5 and TGF-β1 was increased in AF groups, especially in the left atrium of the patients with mitral valve disease as compared with SR group. Calreticulin interacted with both calcineurin B and integrin-α5. The expression level of integrin-α5 was significantly correlated with the expression level of TGF-β1, while the expression level of calreticulin was correlated with that of integrin-α5 and TGF-β1. Under similar classification of the cardiac function, the expression level of calreticulin in PeAF group was higher than that in SR group. CONCLUSION: The expression of calreticulin, integrin-α5, and TGF-β1 is increased in the atrial tissues of the AF patients and is related to the AF type, suggesting that calreticulin is involved in atrial remodeling in AF and VHD patients.
[KEY WORDS]Atrial fibrillation; Calreticulin; Integrin-α5; Transforming growth factor-β1; Atrial fibrosis
[文章编号]1000- 4718(2016)01- 0033- 08
[收稿日期]2015- 06- 08[修回日期] 2015- 09- 30
通讯作者△Tel: 025-68136049; E-mail: wangwei-doctor@163.com
[中图分类号]R541.7+5; R363.2
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.006
