一个水稻半矮化和花发育异常突变体的遗传分析和分子定位
2016-07-04初志战谢勇尧郭海滨刘耀光
初志战 ,谢勇尧 , 胡 琛, 郭海滨, 刘耀光*
(1 华南农业大学 生命科学学院,亚热带农业生物资源保护与利用重点实验室,广州 510642;2 华南农业大学 食品学院,广州 510642;3 华南农业大学 公共基础课实验教学中心, 广州 510642)
一个水稻半矮化和花发育异常突变体的遗传分析和分子定位
初志战1,谢勇尧1, 胡琛2, 郭海滨3, 刘耀光1*
(1 华南农业大学 生命科学学院,亚热带农业生物资源保护与利用重点实验室,广州 510642;2 华南农业大学 食品学院,广州 510642;3 华南农业大学 公共基础课实验教学中心, 广州 510642)
摘要:从粳稻品种‘日本晴’经60Co诱变的M2代材料中发现一个半矮化并且花发育异常突变体sd-df3,其表现为植株半矮化,分蘖增加,半包茎穗,雄蕊发育不良,无花粉。遗传分析显示,该突变体表型受1对隐性核基因控制。以杂合型突变体为母本,与广亲和品种Dular杂交,构建F2分离群体,将该基因定位在水稻第3号染色体,In/Del标记333591与333818之间的物理距离约为227 kb的范围,目前该范围内没有矮化相关基因报道。
关键词:水稻;半矮化并花发育异常;基因定位;遗传分析
株高是水稻最重要的农艺性状之一,它直接影响到水稻的高产与稳产。由于矮秆作物通常表现出抗倒伏、叶挺、穗多、增产明显等优点,因此日本在20世纪30年代末就开始粳稻品种的矮化育种研究。20世纪50年代末60年代初,半矮生基因sd1的发现,促成了综合性状好的抗倒伏品种的培育,使水稻单产提高20%~30%,引发了全球水稻生产第一次绿色革命[1]。
根据水稻的矮化效应,可以将矮化分为:矮化、半矮化和极矮化3大类。Takahashi等[2]和Takeda[3]根据水稻各节间的分布将水稻矮秆突变体分成dn、dm、sh、d6和nl型等5种类型。
引起植物矮化的因素主要有两方面,生长环境是一个重要的外在因素,矮化主效基因则是决定植株高矮的主要内在因素。目前已发现鉴定近90个水稻矮化、半矮化突变体,现已克隆的水稻矮化基因有D1[4]、D2[5]、D3[6]、D10[7]、D11[8]、D14/D88[9]、D17[10]、D18[11]、D35[12]、D61[13]、GID1[14]、GID2[15]、BRD1[16]、SD1[17-19]和OSH15[20]。众多研究表明,许多矮化基因参与到了植物激素尤其是赤霉素(GA)和油菜素类固醇(BR)的生物合成与信号转导,如D18[11]和D35[12]参与GA的合成;SD1[17-19]参与GA的信号转导,D2[5]和D11[8]参与了BR的合成,而D61[13]则通过影响BR的信号转导导致表型的产生。D3[6]、D10[7]、D14/D88[9]、D17[10]则参与到独脚金内酯(SLs,strigolactones)的合成与传导途径。独脚金内酯是一种新的植物激素,于2008年被发现,具有抑制腋芽过度伸长的功能[21]。
尽管众多的矮化材料被研究,甚至不少基因已经被克隆,但是只有sd1(d-47)在育种中得到广泛应用,但是sd1单一资源的应用,存在严重的遗传脆弱性。因此发掘、克隆和利用新的矮化基因,不仅对研究矮化作用机理有重要理论意义,对实现水稻株高的定向改良,实现水稻稳产增产也具有重要的应用价值。
花器官发育是开花植物繁衍的基础,近30年来,花发育的相关研究取得了迅猛的发展,尤其在拟南芥和金鱼草的研究中,大量的MADS-box基因的成功分离为花发育的分子生物学领域研究的一个重大突破。目前水稻中也发现有5类MADS-box基因参与了花器官的形成,水稻花器官的发育模型已从最初的“ABC”模型发展到“ABCDE”,并且还在不断补充和完善[22]。
本实验室利用60Co诱变‘日本晴’,M2代获得一个水稻半矮化并花发育异常突变体。突变体主要表现为各节间缩短,多分蘖,叶片直立,穗大部分包被于剑叶的叶鞘中,少部分露出叶鞘外,包被于叶鞘内的小穗不结实。该突变体与ddf1[23]和ddf2[24]表现相似,但为半矮化,因此将突变体暂命名为sd-df3(semi-dwarfanddeformedflower3)。遗传分析表明,该性状是由1对隐性基因控制的。本研究对该突变体进行形态特征分析,并对该突变基因进行了定位,以期为该基因的克隆与应用提供参考。
1材料和方法
1.1突变体材料
60Co诱变‘日本晴’获得稳定遗传的sd-df3突变体,秧苗按照行距25 cm,株距15 cm插植。插秧后从第3周开始每周对株高、分蘖数进行测量统计。齐穗后,剥去‘日本晴’和sd-df3主茎叶鞘后逐一测定各节节间长。
1.2方法
1.2.1定位群体的构建由于sd-df3 突变体小穂不结实,因此不能直接用于杂交,获得定位群体。因此定位群体的母本选用可分离出半矮化材料的M1群体中的正常植株,父本采用籼稻Dular,杂交后获得F1种子。播种F1后,自交繁殖获得F2种子,单株收种。分株系种植F2代,以能分离出半矮化苗的F2群体为定位群体。
1.2.2基因定位基因初步定位:采用SDS法[25]提取28株半矮化植株叶片总DNA用于基因定位。基因进一步定位:根据初步定位结果,采用快速打叶法[26]对635株定位群体植株进行两侧标记检测,并利用内部In/Del引物进一步缩小定位区间。
本研究用于基因定位的分子标记为In/Del标记:一部分为本实验室已有的,另一部分为根据已公布的水稻品种‘93-11’和‘日本晴’全基因组序列自行开发。这些标记均匀分布于水稻12条染色体,共147对。
2结果与分析
2.1突变体表型及农艺性状鉴定
由图1可以看出,与野生型相比,突变体sd-df3在拔节期就表现出明显的矮化表型,叶片短而窄,随着生育期的推移,表型愈发明显。抽穗期,突变体sd-df3株高仅为野生型的58.6%。通过节间长度调查发现,sd-df3穗下第1、2、3、4节的节间长度均缩短,分别是野生型的40.7%、51.7%、50.8%和49.1%,可以发现,各节间缩短幅度差别不大。根据节间长度缩短特点,可以将突变体sd-df3划为dn类。除了半矮化性状外,突变体sd-df3还表现小穂不结实,无花粉型(图2)。
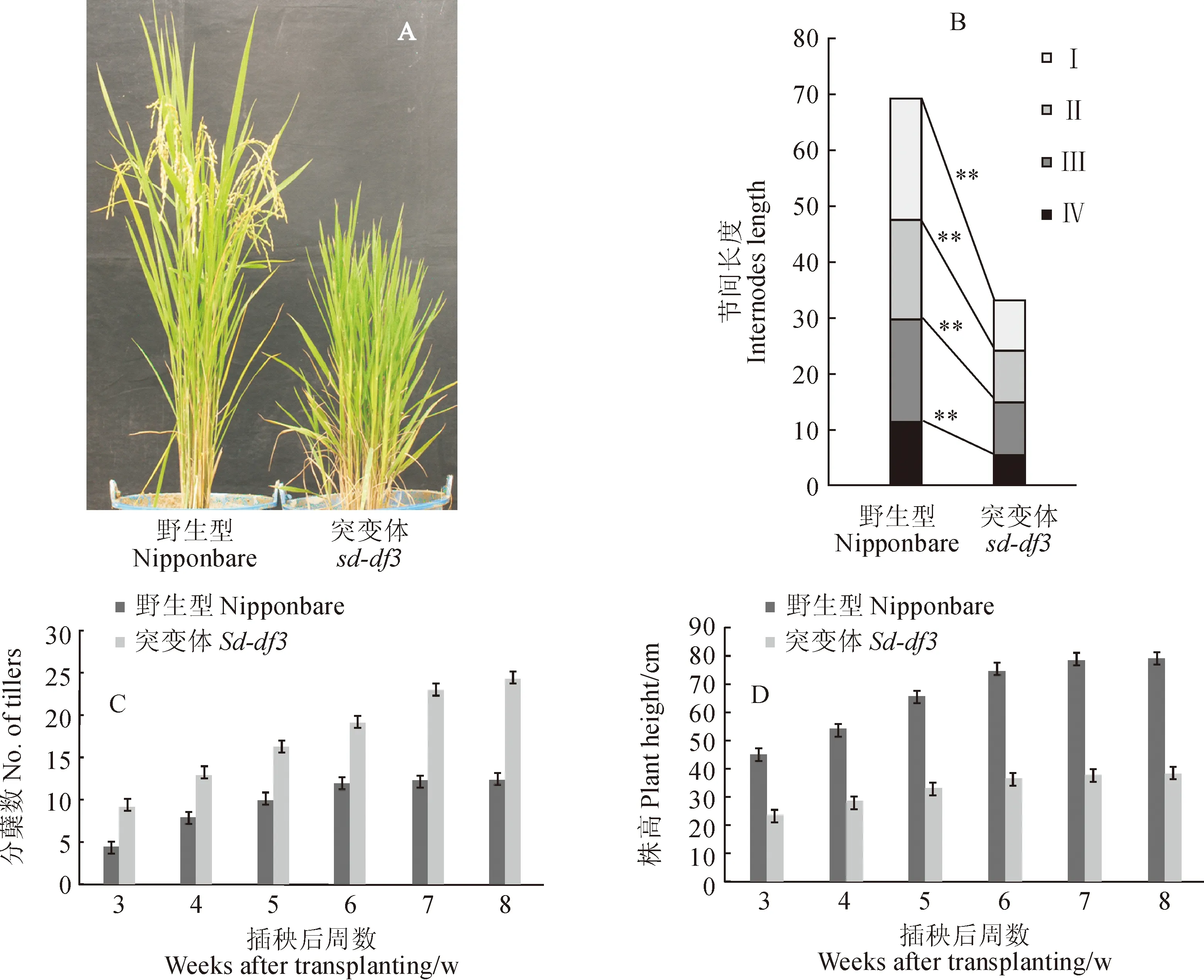
A. 成熟期野生型和突变体的植株形态; B~D. 野生型与突变体节间长度、分蘖数及株高的统计分析:Ⅰ~Ⅳ.穗下第1节至第4节;**表示该性状在0.01水平上差异极显著图1 水稻日本晴野生型和sd-df3的形态学比较特征A. Plant phenotypes of wild type and sd-df3;B-D. The comparison of internodes length, plant height and number of tillers between wild type and sd-df3 :Ⅰ-Ⅳ. The upper four internodes down panicle; ** indicate a statistically significant difference (P<0.01)Fig. 1 Comparison of morphological characters between Nipponbare and sd-df3

A. 小穗去除内外稃后的表型; B. 雄蕊经I2-KI染色后表型图2 野生型(WT)和sd-df3突变体(MT)小穗形态分析The spikelets removed lemma and palea; B. The stamen stained with I2-KIFig. 2 Phenotypes of spikelet in sd-df3 mutant (MT) and wild type (WT)
2.2突变体的遗传分析及定位结果
选取在两亲本间有多态性的In/Del标记,共有147个,均匀分布于水稻12条染色体上。用28株突变植株进行初定位,将突变基因初步定位在第3号染色体的短臂上, In/Del分子标记 333050与334307之间,物理距离约为1 257 kb的范围。

表1 F2群体株高性状分离调查

表2 用于精细定位的新In/Del标记
为了进一步缩小定位区间,选取了F2群体中635株半矮化突变植株做为精细定位群体。根据公布的粳稻‘日本晴’与籼稻‘93-11’序列,在In/Del标记333050与334307之间,目前只找到了4对在2个亲本有差异的新标记(表2),并最终将突变基因sd-df3定位在In/Del标记333591与333818之间,物理距离约为227 kb的范围(图3)。
3. 讨论
水稻是世界上最重要的粮食作物之一, 半矮生基因sd1的发现促成了综合性状好的、抗倒水稻品种的产生,使水稻产量实现了巨大突破。对中国南方稻区育成的313个籼稻品种的系谱分析表明,约75.6%具有sd1矮源血统,而粳稻品种矮生性主要来源于‘农垦58’和Balila,因此矮化基因单一,存在风险[27]。
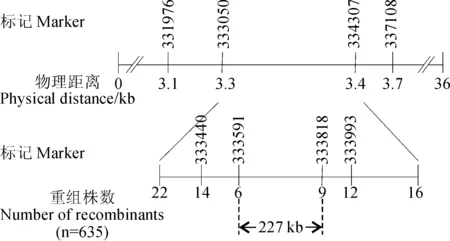
图3 sd-df3在水稻第3号染色体的定位Fig. 3 Location of sd-df3 on rice chromosome 3
本研究通过物理方法诱变获得一个半矮化突变体,从拔节期开始突变体就呈现明显的矮化特点,分蘖增多,叶片直立,穗大部分包被于剑叶的叶鞘中,并且雄蕊发育异常,无花粉,小穗不结实。由于独脚金内酯具有抑制腋芽过度伸长的功能,因此该激素导致的水稻矮化往往与分蘖增多相关联[6-9,28]。矮化引起小穗育性下降甚至不育,部分由于矮化植株营养器官如根、茎、叶等显著减小,生长弱势造成,部分由于矮化基因引起了赤霉素的表达和信号转导发生障碍[29-30],也有部分是由于某个矮化基因同时直接控制水稻茎/叶和花器官的发育,即具有“一因多效”的遗传性状表现,如ddf1[23]、ddf2[24]和dtl1[31]。本研究sd-df3突变体矮化与雄性不育共遗传,遗传分析表明该性状受单隐性基因调控,通过图位克隆将该矮化基因定位于第3号染色体,In/Del标记333591与333818之间,物理距离约为227 kb范围。目前定位于3号染色体的矮化、半矮化基因有ipd1、dlt2、d88/d14/htd2、OsTB1/fc1、OSDWARF4、Brd1、d162(t)和ssd1共8个,但它们均与sd-df3位置相差较远,更非等位基因。目前已报道的,在第3染色体控制花药发育的基因有PAIR1[32]、MEL1[33]、OsAM1[34]、OsSDS[35]、CYP704B2[36]和DPW[37],它们和sd-df3也非等位基因,表型也不同,而ddf1和ddf2分别位于第6和第11染色体,因此可以确认sd-df3为一个新的调控水稻矮化并花发育的基因。由于Dular和‘日本晴’在In/Del标记333591与333818之间难以找到新的标记,因此准备以‘黄华占’和‘93-11’为新的父本,构建新的精细定位群体。
参考文献:
[1]林世成,闵绍楷.中国水稻品种及其系谱[M].上海:上海科学技术出版社,1991: 6-9.
[2]TAKAHASHI M, TAKEDA K. Type and grouping of internode pattern in rice culm-genetical studies on rice plant[J].JournaloftheFacultyofAgriculture,HokkaidoUniversity, 1969, 7: 32-43.
[3]TAKEDA K. Internode elongation and dwarfismin some gramineous plants[J].GammaFieldSymposia, 1977, 16: 1-18.
[4]ASHIKARI M, WU J, YANO M,etal. Rice gibberellin-insensitive dwarf mutant gene Dwarf1 encodes the α-subunit of GTP binding protein[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1999, 96(18): 10 284-10 289.
[5]HONG Z, UEGUCHI-TANAKA M, UMEMURA K,etal. A rice brassinosteroid-deficient mutant, Ebisu Dwarf(D2),is caused by loss of function of a new member of cytochrome P450[J].ThePlantCell, 2003, 15(12): 2 900-2 910.
[6]ISHIKAWA S, MAEKAWA M, ARITE T,etal. Suppression of tiller bud activity in tillering dwarf mutants of rice[J].PlantCellPhysiology, 2005, 46(1): 79-86.
[7]ARITE T, IWATA H, OHSHIMA K,etal. DWARF10, an RMS1 /MAX4 /DAD1 ortholog, controls lateral bud outgrowth in rice[J].ThePlantJournal, 2007, 51(6): 1 019-1 029.
[8]TANABE S, ASHIKARI M, FUJIOKA S,etal. A novel cytochrome P450 is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf mutant, dwarf11, with reduced seed length[J].ThePlantCell, 2005, 17(3): 776-790.
[9]ZHAO L H, ZHOU X E, WU Z S,etal. Crystal structures of two phytohormone signal-transducing α / β hydrolases: karrikin-signaling KAI2 and strigolactone signaling DWARF14[J].CellResearch, 2013, 23(3): 436-439.
[10]ZOU J, ZHANG S, ZHANG W,etal. The rice HIGH-TILLERING DWARF1 encoding an ortholog ofArabidopsisMAX3 is required for negative regulation of the outgrowth of axillary buds[J].ThePlantJournal, 2006, 48(5): 687-698.
[11]ITOH H, UEGUCHI-TANAKA M, SENTOKU N,etal. Cloning and functional analysis of two gibberellin 3β-hydroxylase genes thatare differently expressed during the growth of rice[J].Proc.Natl.Acad.Sci.USA, 2001, 98(15): 8 909-8 914.
[12]ITOH H, TATSUMI T, SAKAMOTO T,etal. A rice semi-dwarf gene, Tan-Ginbozu(D35), encodes the gibberellin biosynthesis enzyme, ent-kaurene oxidase[J].PlantMolecularBiology, 2004, 54(4): 533-547.
[13]YAMAMURO C, IHARA Y, WU X,etal. Loss of function of a rice brassinosteroid insensitive1 homolog prevents internode elongation and bending of the lamina joint[J].PlantCell, 2000, 12(9): 1 591-1 605.
[14]UEGUCHI-TANAKA M, ASHIKARI M, NAKAJIMA M, et al. GIBBERELLIN INSENSITIVE DWARF1 encodes a soluble receptor for gibberellin[J].Nature, 2005, 437(7 059): 693-698.
[15]SASAKI A, ITOH H, GOMI K,etal. Accumulation of phosphorylated repressor for gibberellin signaling in an F-box mutant[J].Science, 2003, 299(5 614): 1 896-1 898.
[16]MORI M, NOMURA T, OOKA H,etal. Isolation and characterization of a rice dwarf mutant with a defect in brassinosteroid biosynthesis[J].PlantPhysiology, 2002, 130(3): 1 152-1 161.
[17]SPIEMYER W, ELLIS M H, CHANDLER P M. Semi-dwarf(sd-1),“green revolution” rice, contains a defective gibberellin 20-oxidase gene[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2002, 99(13): 9 043-9 048.
[18]SASAKI A, ASHIKARI M, UEGUCHI-TANAKA M,etal. Green revolution: a mutant gibberellin- synthesis gene in rice [J].Nature, 2002, 416(6 882): 701-702.
[19]MONNA L, KITAZAWA N, YOSHINO R,etal. Positional cloning of rice semi-dwarfing gene, sd-1: Rice “green revolution gene” encodes a mutant enzyme involved in gibberellin synthesis[J].DNAResearch, 2002, 9(1): 11-17.
[20]SATO Y, SENTOKU N, MIURA Y,etal. Loss-of-function mutations in the rice homeobox gene OSH15 affect the architecture of internodes resulting in dwarf plants[J].EMBOJournal, 1999, 18(4): 992-1 002.
[21]GOMEZ-ROLDAN V, FERMAS S, BREWER P B,etal. Strigolactone inhibition of shoot branching[J].Nature,2008,455(7 210): 189-194.
[22]肖巧珍, 江立庚, 秦华东. 水稻花发育研究进展[J]. 南方农业学报, 2012, 43(7): 913-917.
XIAO Q Z, JIANG L G, QIN H D. Advance in flower development of rice[J].JournalofSouthernAgriculture, 2012, 43(7): 913-917.
[23]DUAN Y, LI S, CHEN Z,etal. Dwarf and deformed flower 1, encoding an F-box protein, is critical for vegetative and floral development in rice (OryzasativaL.)[J].ThePlantJournal, 2012, 72(5): 829-842.
[24]张玲, 郭爽, 汪玲, 等. 水稻矮化并花发育异常突变体 dwarf and deformed flower 2 (ddf2) 的基因定位与候选基因分析[J]. 中国农业科学, 2015, 48(10): 1873-1881.
ZHANG L, GUO S, WANG L,etal. Gene mapping and candidate gene analysis of a dwarf and deformed flower 2 (ddf2)mutant in rice (oryzasativa)[J].ScientiaAgricultureSinica, 2015, 48(10): 1 873-1 881.
[25]GUILLEMAUT P, MARDCHAL-DROUARD L. Isolation of plant DNA: a fast, inexpensive, and reliable method[J].PlantMolecularBiologyReporter, 1992, 10(1): 60-65.
[26]王慧娜, 初志战, 马兴亮, 等. 高通量 PCR 模板植物基因组 DNA 制备方法[J]. 作物学报, 2013, 39(7): 1 200-1 205.
WANG H N, CHU Z Z, MA X L,etal. A high through-put protocol of plant Genomic DNA preparation for PCR[J].ActaAgronomicaSinica, 2013, 39(7): 1 200-1 205.
[27]李金华, 王丰, 廖亦龙, 等. 水稻矮生性及其相关基因的研究进展[J]. 杂交水稻, 2007, 22(3): 1-5.
LI J H, WANG F, LIAO Y L,etal. Research progress on the dwarfness and its related genes in rice[J].HybridRice, 2007, 22(3): 1-5.
[28]LIN H, WANG R, QIAN Q,etal. DWARF27, an iron-containing protein required for the biosynthesis of strigolactones, regulates rice tiller bud outgrowth[J].ThePlantCell, 2009, 21(5): 1 512-1 525.
[29]FRIDBORG I, KUUSK S, ROBERTSON M,etal. The Arabidopsis protein SHI represses gibberellin responses inArabidopsisand barley[J].PlantPhysiology, 2001, 127(3): 937-948.
[30]ERIKSSON S, BÖHLENIUS H, MORITZ T,etal. GA4 is the active gibberellin in the regulation of LEAFY transcription andArabidopsisfloral initiation[J].ThePlantCell, 2006, 18(9): 2 172-2 181.
[31]张帆涛, 方军, 孙昌辉, 等. 水稻矮秆突变体dtl1 的分离鉴定及其突变基因的精细定位[J]. 遗传, 2012, 34(1): 79-86.
ZHANG F T, FANG J, SUN C H,etal. Characterisation of a ricedwarfandtwistleaf1 (dtl1) mutant and fine mapping ofDTL1 gene][J].Hereditas(Beijing), 2012, 34(1): 79-86.
[32]NONOMURA K I, NAKANO M, FUKDA T,etal. The novel gene HOMOLOGOUS PAIRING ABERRATION IN RICE MEIOSIS1 of rice encodes a putative coiled-coil protein required for homologous chromosome pairing in meiosis[J].ThePlantCell, 2004, 16(4): 1 008-1 020.
[33]NONOMURA K I, MOROHOSHI A, NAKANO M,etal. A germ cell-specific gene of the ARGONAUTE family is essential for the progression of premeiotic mitosis and meiosis during sporogenesis in rice[J].ThePlantCell, 2007, 19(8): 2 583-2 594.
[34]CHE L, TANG D, WANG K,etal. OsAM1 is required for leptotene-zygotene transition in rice[J].Cellresearch, 2011, 21(4): 654-665.
[35]CHANG L, MA H, XUE H W. Functional conservation of the meiotic genes SDS and RCK in male meiosis in the monocot rice[J].CellResearch, 2009, 19(6): 768-782.
[36]LI H, PINOT F, SAUVEPLANE V,etal. Cytochrome P450 family member CYP704B2 catalyzes the ω-hydroxylation of fatty acids and is required for anther cutin biosynthesis and pollen exine formation in rice[J].ThePlantCell, 2010, 22(1): 173-190.
[37]SHI J, TAN H, YU X H,etal. Defective pollen wall is required for anther and microspore development in rice and encodes a fatty acyl carrier protein reductase[J].ThePlantCell, 2011, 23(6): 2 225-2 246.
(编辑:宋亚珍)
Genetic Analysis and Gene Mapping of a Semi-dwarf and Deformed Flower Mutant in Rice
CHU Zhizhan1, XIE Yongyao1, HU Chen2, GUO Haibin3, LIU Yaoguang1*
(1 College of Life Sciences, South China Agricultural University, State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Guangzhou 510642, China;2 College of Food Sciences, South China Agricultural University, Guangzhou 510642, China;3 Center of Experimental Teaching for Common Basic Course, South China Agricultural University, Guangzhou 510642, China)
Abstract:A rice semi-dwarf and deformed flower mutant, temporarily named as sd-df3, was identified from60Co γ-ray radiation mutation in japonica rice variety Nipponbare. The mutant was characterized by semi-dwarf, more tillers, semi-enclosed panicle, stamens dysplasia and non-pollen. Genetics analysis indicated that the mutant was controlled by a single recessive gene. The F2 mapping population was derived from a cross between the heterozygous sd-df3 genotype and a wide compatible variety Dular. The gene was located in a 227 kb region between the In/Del marker 333591 and 333818 on chromosome 3 in rice, which was assumed to be a new gene controlling semi-dwarf and deformed flower.
Key words:rice; semi-dwarf and deformed flower; gene mapping; genetics analysis
文章编号:1000-4025(2016)05-0910-06
doi:10.7606/j.issn.1000-4025.2016.05.0910
收稿日期:2016-02-19;修改稿收到日期:2016-04-20
基金项目:亚热带农业生物资源保护与利用国家重点实验室开放课题(SKL-CUSAb-2013-04);江西省教育厅科技计划(GJJ14707);广东省自然科学基金博士启动项目(2015A030310485)
作者简介:初志战(1977-),博士,讲师,主要从事生物化学与分子生物学研究。E-mail: chuben@scau.edu.cn; *通信作者:刘耀光,研究员,博士生导师,主要从事生物化学与分子生物学研究。E-mail: ygliu@scau.edu.cn
中图分类号:Q754;Q789
文献标志码:A
