灰树花胞外多糖的结构及免疫调节活性
2016-07-04韩丽荣程代王莉蕊王春玲
韩丽荣,程代,王莉蕊,王春玲
天津科技大学 食品工程与生物技术学院,天津 300457
灰树花胞外多糖的结构及免疫调节活性
韩丽荣,程代,王莉蕊,王春玲
天津科技大学 食品工程与生物技术学院,天津 300457
韩丽荣, 程代, 王莉蕊, 等. 灰树花胞外多糖的结构及免疫调节活性. 生物工程学报, 2016, 32(5): 648–656.
Han LR, Cheng D, Wang LR, et al. Structure and immunomodulatory activity of extracellular polysaccharide from Grifola frondosa. Chin J Biotech, 2016, 32(5): 648–656.
摘 要:对灰树花胞外多糖A组分 (EXGFP-A) 进行结构分析和免疫活性的研究。结构分析结果表明,EXGFP-A是一种主要含有葡萄糖的吡喃型中性多糖。气相结果说明EXGFP-A的单糖组成为鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖,摩尔比为0.28∶0.31∶0.30∶0.06∶7.98∶0.61。MTT(3-(4,5-Dimethylthiazol-2-yl)-2,5- diphenyltetrazo-lium bromide)比色实验表明,当EXGFP-A浓度为80 μg/mL,作用48 h时,RAW264.7细胞增殖指数达到最大值,为137.5%。吖啶橙 (AO) 染色结果表明EXGFP-A能够激活RAW264.7细胞,增强细胞内部核酸代谢水平。EXGFP-A在一定浓度范围内,可以提高RAW264.7细胞中NO的释放量,上调细胞内TNF-α、IL-1β、IL-6、IL-12、IFN-γ细胞因子以及细胞中iNOS的mRNA水平的表达。结果表明,EXGFP-A具有一定的免疫调节活性,为灰树花胞外多糖的结构分析和应用提供了科学依据。
关键词:灰树花多糖,结构分析,RAW264.7细胞,免疫活性
Received: September 15, 2015; Accepted: November 30, 2015
Supported by: Key Technologies Research and Development Program of China (No. 2012BAD33B04), Key Projects of Tianjin Natural Science Foundation (No. 13JCZDJC29800).
国家科技支撑计划 (No. 2012BAD33B04),天津应用基础重点项目 (No. 13JCZDJC29800) 资助。
网络出版时间:2016-01-07 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20160107.1443.001.html
灰树花Grifola frondosa又名贝叶多孔菌、栗蘑,俗称云蕈、日本称舞茸,属担子菌亚门层菌纲非褶菌目多孔菌科树花菌属。灰树花是一种药、食兼用的珍稀真菌,具有多种生理活性[1],如抗肿瘤[2-3]、调节血糖[4]、抗氧化[5]、抗辐射[6]及免疫调节[7]等。近年来,灰树花的保健功能及药用价值受到人们重视,并已证明灰树花多糖是灰树花中主要的活性成分[8-9],但对于灰树花多糖单一组分的结构分析及免疫活性的研究还相对较少。巨噬细胞作为一种重要的免疫细胞广泛分布于机体中,参与机体的特异性和非特异性免疫反应,可作为免疫活性的研究对象。
本文对分离纯化后的灰树花胞外多糖A组分 (EXGFP-A) 进行了基本的结构分析以及免疫活性研究,为灰树花胞外多糖的应用提供科学依据。
1 材料与方法
1.1材料
Grifola frondosa菌种:天津科技大学菌种保藏中心提供,编号39025。
RAW264.7细胞株:购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2EXGFP-A的结构分析
1.2.1EXGFP-A的红外光谱分析
1 mg EXGFP-A样品以KBr压片,室温条件下进行红外扫描测定。
1.2.2EXGFP-A的扫描电镜分析
取适量冻干的EXGFP-A粉末均匀轻薄地平铺在样品台导电胶的表面,吹去浮样,置于离子溅射仪中进行真空喷金处理,然后扫描电镜观察[10]。
1.2.3 EXGFP-A的单糖组成分析
采用糖醇乙酸酯衍生化方法对EXGFP-A的水解产物进行气相色谱测定,通过查阅相关文献,选择鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖6种单糖作为标准品单糖。气相色谱条件:色谱柱:DB-17(30 m×0.32 mm× 0.5 m);检测器:氢火焰离子化检测器 (FID);载气:N2,1 mL/min;进样口温度:280 ℃;柱温:190 ℃;检测器温度:280 ℃。
1.3EXGFP-A对RAW264.7增殖活性的影响
本实验以小鼠巨噬细胞RAW264.7为研究对象,研究EXGFP-A的免疫调节活性。采用MTT法[11]:EXGFP-A作用RAW264.7一定时间后,使用酶标仪测定570 nm波长处各孔的吸光度。细胞增殖率=OD加药/OD对照×100%[12]。
1.4EXGFP-A对RAW264.7细胞中DNA、RNA的影响
将无菌洁净的盖玻片置入6孔细胞培养板中,每孔中加入浓度为5×105个/mL的RAW264.7细胞悬液1 mL,待细胞处于完全贴壁状态后,加入终浓度分别为0、40、80、160 μg/mL 的EXGFP-A,37 ℃、5% CO2细胞培养箱中培养48 h。当RAW264.7细胞培养结束后,取出细胞爬片,PBS缓冲液洗涤,Carony’s液 (乙醇:冰醋酸:氯仿=6∶1∶3 (V/V/V)) 固定细胞10 min,以1%醋酸进行酸化,加入0.01% AO溶液进行细胞染色,避光条件下室温放置20 min,0.1 mol/L 氯化钙溶液分色30−60 s。PBS缓冲液洗涤后,将细胞爬片置于洁净的载玻片上,多功能荧光显微镜下观察并采图。
1.5EXGFP-A对RAW264.7细胞分泌NO的影响
NO的合成是巨噬细胞被激活的重要标志之一。以NO标准品的浓度为横坐标,相应吸光度值为纵坐标,完成标准曲线的绘制。然后根据标准曲线来计算各组样品中NO浓度[13]。
1.6EXGFP-A对RAW264.7细胞分泌细胞因子及对细胞内iNOS表达的影响
1.6.1RAW264.7细胞RNA提取及反转录
按照北京全式金生物技术有限公司总RNA提取试剂TransZol说明书,无菌条件下进行细胞总RNA的提取。使用北京全式金公司反转录试剂盒来进行cDNA的合成,步骤严格按照说明书进行。体系完全混匀后,于PCR仪上42 ℃孵育30 min,85 ℃加热5 min,然后反转录合成cDNA,置于–20 ℃冻存。
1.6.2聚合酶链反应 (PCR)
采用委托给上海生工生物工程公司合成的相关系列引物,以反转录合成的cDNA为模板,进行聚合酶链式反应,并以β-actin为内参。相关引物序列设计如表1所示。
本实验中聚合酶链反应体系总体积为50 μL,加样体系:cDNA 2 μL、Forward Primer 1 μL、Reverse Primer 1 μL、10×缓冲液 5 μL、2.5 mmol/L dNTPs 4 μL、TransTaq HiFi DNA聚合酶 0.5 μL,最后加入ddH2O,使体系终体积为50 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,55−60 ℃退火30 s,72 ℃延伸120 s,30−35个循环;72 ℃总延伸10 min。
1.6.3琼脂糖凝胶电泳
琼脂糖凝胶 (1%) 制备:称取0.4 g琼脂糖粉末,溶于40 mL 1×TAE溶液,微波完全融化后,冷却至50–60 ℃,加入4 μL核酸染料,充分摇匀。取5 μL PCR扩增产物和2 μL 6×DNA上样缓冲液混匀后上样。另外,Marker上样量为5 μL。电泳电压设定为80 V,电泳结束后,使用凝胶成像仪拍照分析。
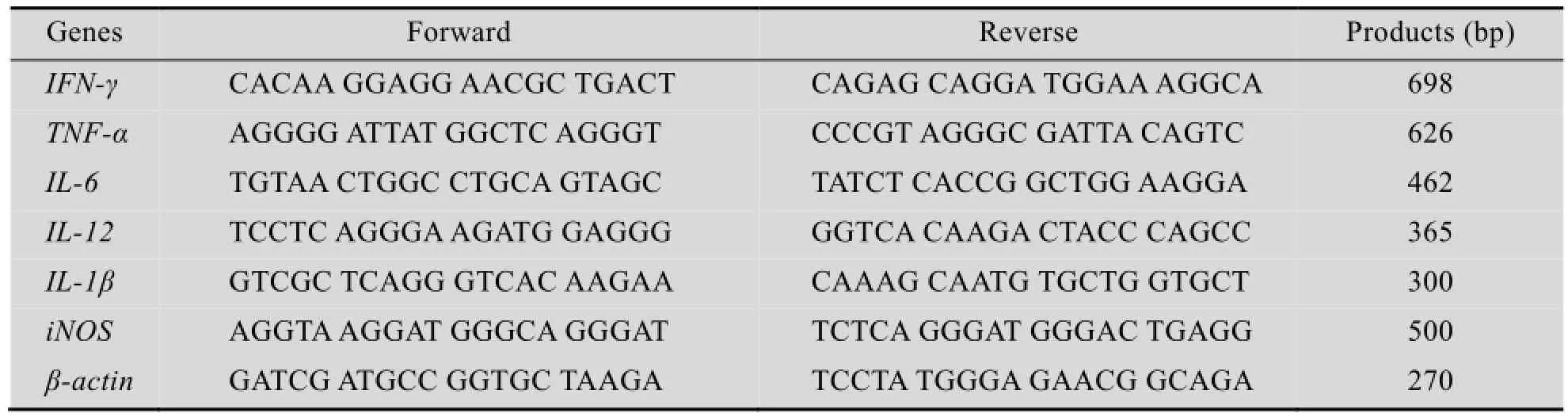
表1 PCR引物序列Table 1 Primers sequence of PCR
2 结果与讨论
2.1EXGFP-A的结构分析
2.1.1EXGFP-A的红外光谱分析
由图1可知,在3 600−3 200 cm–1出现一宽峰是O-H伸缩振动;2 934 cm–1为C-H伸缩振动;1 652 cm–1、1 400−1 200 cm–1是C-H的变角振动,以上这几处特征吸收峰证明该化合物为糖类物质[14]。而在1 700 cm–1–1 775 cm–1范围内无明显吸收峰,表明样品中不含羧基,即该多糖是一种中性糖。1 870–1 540 cm–1范围内存在的特征吸收峰是属于由C=O伸缩振动引起的。1 069 cm–1处的吸收峰表明EXGFP-A中存在3-6-内醚桥,即样品中含有3-6-内醚-半乳糖[15],而852 cm–1处形成的吸收峰表明组成的单糖为α-D-葡萄吡喃糖[16],即EXGFP-A是属于吡喃型多糖。此外,807 cm–1处的特征峰则说明在多糖分子中存在甘露糖苷键[17],619 cm–1处的吸收峰表明多糖中含有葡萄糖残基。
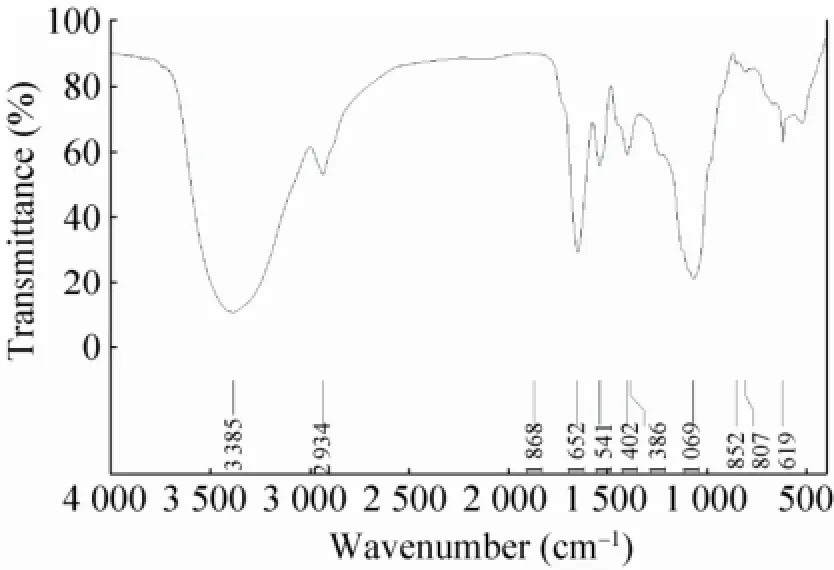
图1 EXGFP-A红外光谱分析图谱Fig. 1 IR spectroscopic analysis of EXGFP-A.
2.1.2EXGFP-A的扫描电镜分析
如图2所示,当粉末状态的EXGFP-A平铺在样品台上,经电镜扫描之后,显示出其形态多为棒状、片层状,并且这些片层结构上附有许多刺状不规则、大小不均一的碎屑。
2.1.3EXGFP-A的单糖组成分析
六种标准单糖混合物的气相色谱图如3A所示,各标准单糖的分离效果很好。EXGFP-A的气相色谱分析图如3B所示,对比EXGFP-A的出峰时间与混合标准单糖的时间,说明EXGFP-A主要是由葡萄糖所组成,同时含有鼠李糖、阿拉伯糖、木糖、半乳糖以及少量的甘露糖。根据峰面积计算出这6种单糖 (鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖) 的摩尔比为0.28∶0.31∶0.30∶0.06∶7.98∶0.61。这与文献报道[18]的灰树花均一多糖主要含有葡萄糖相吻合,而且本研究中的EXGFP-A中葡萄糖含量最高,和文献报道的研究结果也相一致。

图2 EXGFP-A的扫描电镜分析 (×500和×2 000)Fig. 2 SEM analysis of EXGFP-A (magnification: 500 and 2 000).
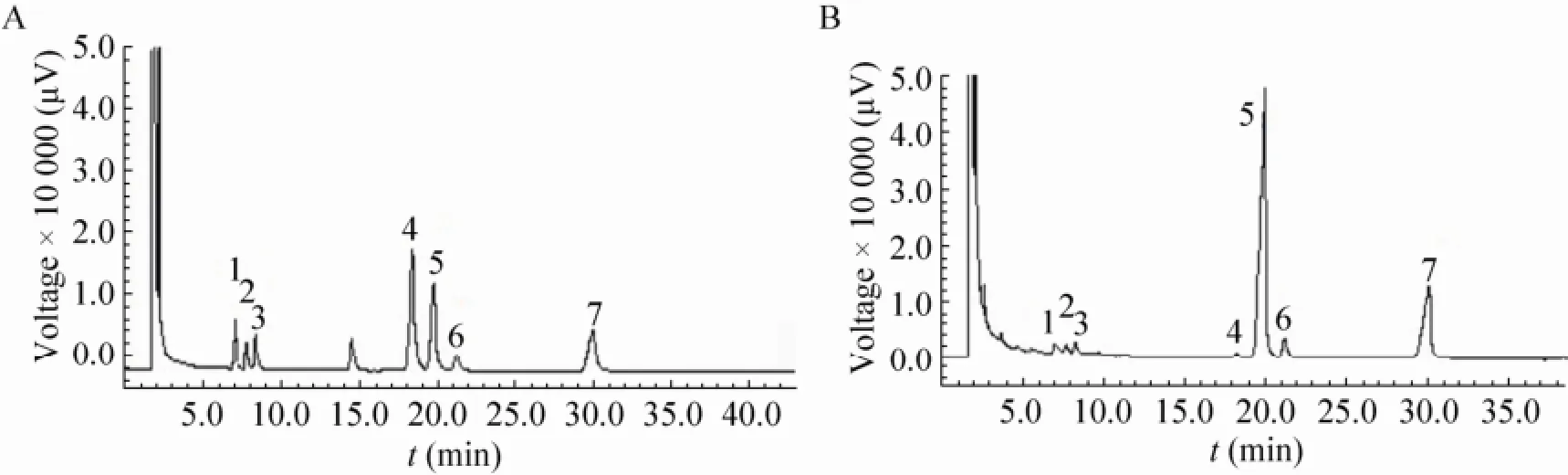
图3 气相色谱分析图Fig. 3 Gas chromatography analysis. (A) Standard sugars. (B) EXGFP-A. 1: rhamnose; 2: arab sugar; 3: xylose; 4: mannose; 5: glucose; 6: galactose; 7: inositol.
2.2EXGFP-A对RAW264.7细胞增殖指数的影响
由MTT实验[19]检测EXGFP-A作用浓度对RAW264.7细胞增殖指数的影响,结果如图4A所示,EXGFP-A在一定的浓度范围内,RAW264.7细胞的增殖活性与EXGFP-A的作用浓度呈正相关。在EXGFP-A作用浓度为80 μg/mL时,RAW264.7细胞的增殖指数达到最大值137.5%。如图4B所示,当EXGFP-A作用浓度为80 μg/mL时,通过不同培养时间 (0、12、24、36、48、72 h) 作用于RAW264.7细胞。结果表明,在EXGFP-A作用48 h内,细胞的数量呈现逐渐增加的趋势。当EXGFP-A作用时间达到48 h时,增殖效果达到最大。
以上结果说明,EXGFP-A能够增强RAW264.7细胞的增殖活性。EXGFP-A作用于RAW264.7细胞的最佳浓度为80 μg/mL,最佳作用时间为48 h。
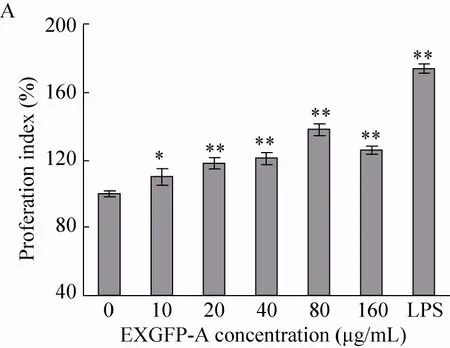
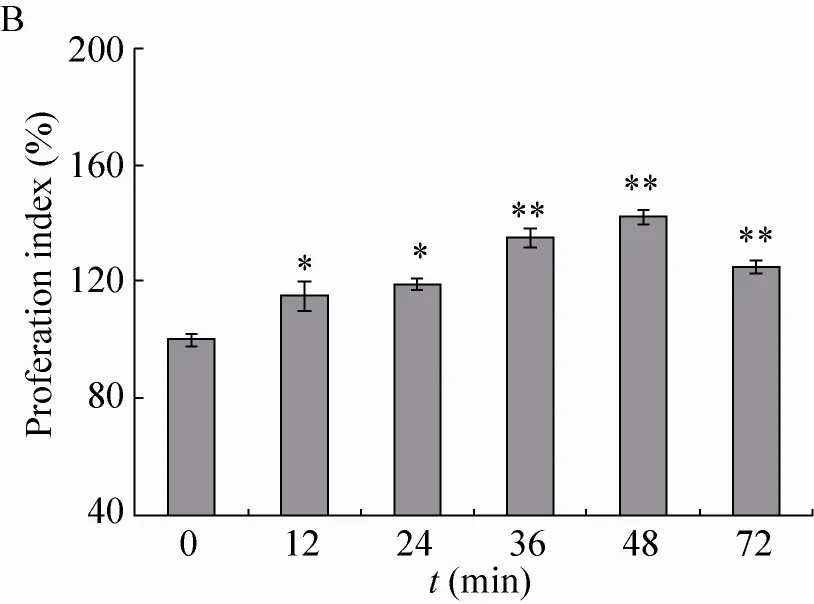
图4 EXGFP-A对RAW264.7细胞增殖指数的影响Fig. 4 Effects of EXGFP-A on proliferation index of RAW264.7 cells. (A) Concentration. (B) Time. n=6,±s, compared with the control group, *P<0.05, **P<0. 01.
2.3细胞形态学观察
吖啶橙 (AO) 是一种能和细胞中的核酸相结合并产生特异性荧光的染料。当吖啶橙与细胞核内的DNA和RNA结合,呈绿色荧光。如图5所示,加入80 μg/mL的EXGFP-A诱导细胞48 h之后,细胞处于激活状态,细胞体积变大,细胞数目也增多,细胞核区的绿色荧光亮度增强,说明80 μg/mL的EXGFP-A作用下,RAW264.7细胞被激活,核酸代谢能力增强。
2.4EXGFP-A对RAW264.7细胞产生NO的影响
巨噬细胞[20]是产生NO的重要的免疫细胞之一,在免疫系统信号转导中,NO作为一个关键介质,它的合成可作为巨噬细胞被激活的一个重要标志。
如图6所示,处于正常状态的对照组细胞产生NO浓度较低,而加入不同浓度的EXGFP-A与RAW264.7细胞共同培养48 h后,发现EXGFP-A均能够显著促进细胞分泌产生NO。结果表明,EXGFP-A能够诱导并且激活RAW264.7细胞,促进RAW264.7细胞分泌NO,通过增强RAW264.7细胞产生NO的能力,从而发挥其免疫调节作用。
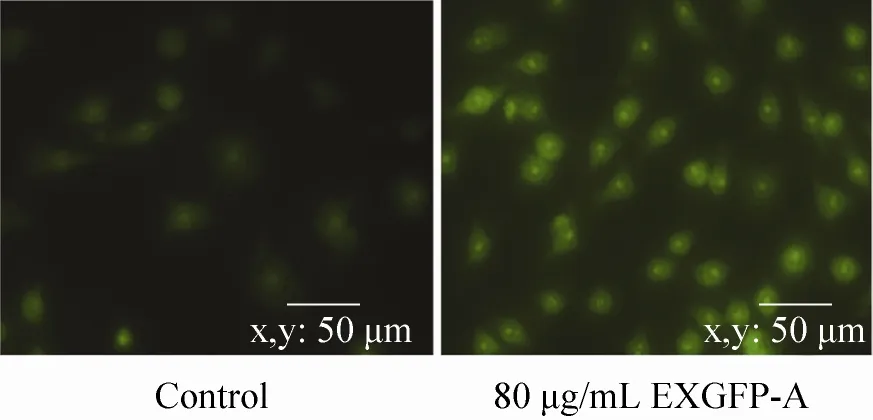
图5 EXGFP-A作用RAW264.7细胞的AO染色(×400)Fig. 5 AO staining of RAW264.7 treated with EXGFP-A (×400).
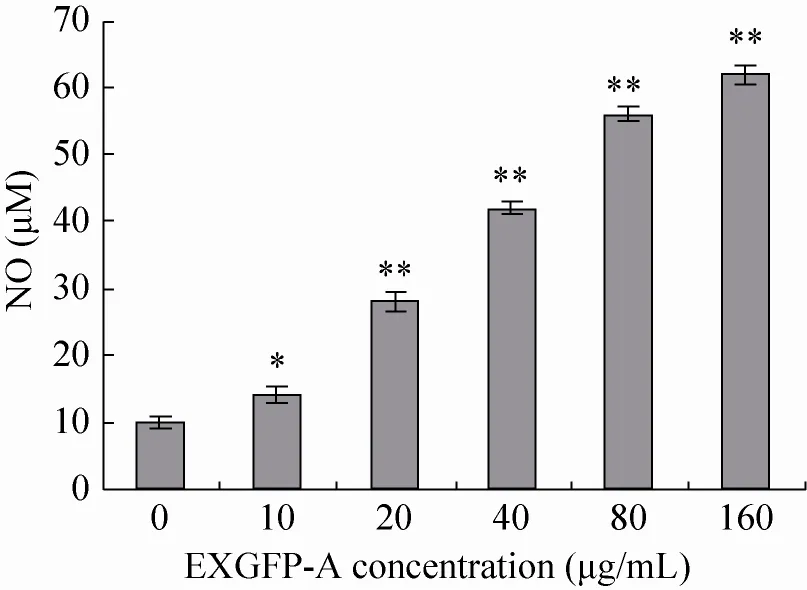
图6 EXGFP-A作用浓度对RAW264.7细胞NO表达量的影响Fig. 6 Effects of EXGFP-A concentration on the production of NO in RAW264.7 cells. n=6,± s , compared with the control group, *P<0.05, **P<0. 01.
2.5EXGFP-A对RAW264.7细胞免疫因子mRNA表达水平的影响
由上述结果可知,EXGFP-A可以促进RAW264.7细胞的增殖活性。本实验进一步从基因水平检测了EXGFP-A对 RAW264.7细胞中细胞因子TNF-α、IL-1、IL-6、IL-12以及IFN-γ[21]的影响,此外还检测了EXGFP-A对 RAW264.7细胞中iNOS[22]在mRNA水平上的影响。
RT-PCR结果如图7所示,对照组的正常细胞处于静息状态,TNF-α、IL-1、IL-6、IL-12、IFN-γ和iNOS的mRNA几乎不表达或表达量极低。不同浓度的 EXGFP-A (20、40、80、160 μg/mL) 与RAW264.7细胞共培养48 h后,发现均能显著上调TNF-α、IL-1、IL-6、IL-12、IFN-γ和iNOS的产生,在一定的浓度范围内(20–80 μg/mL),随着EXGFP-A浓度的增加,细胞产生TNF-α、IL-1、IL-6、IL-12、IFN-γ和iNOS 的mRNA的表达量均相应增加,当EXGFP-A作用浓度达到80 μg/mL时,表达量均达到最大值。
RT-PCR结果表明:EXGFP-A能够激活RAW264.7细胞,促进TNF-α、IL-1β、IL-6、IFN-γ 和IL-12等细胞因子的分泌以及上调细胞中iNOS的mRNA表达水平,并且在一定浓度范围内具有明显的浓度依赖性。证明EXGFP-A可以通过多途径激活RAW264.7细胞,增强机体的免疫活性。
3 结论
灰树花作为近年来开发研究的珍贵真菌之一,已有相关研究表明其在多种生物活性方面均有显著功效。国内外对于灰树花的研究主要集中在灰树花子实体多糖的功能学评价,而有关灰树花多糖的结构和免疫活性的研究相对较少。本文对灰树花多糖的单一组分进行结构分析,并研究其免疫活性。
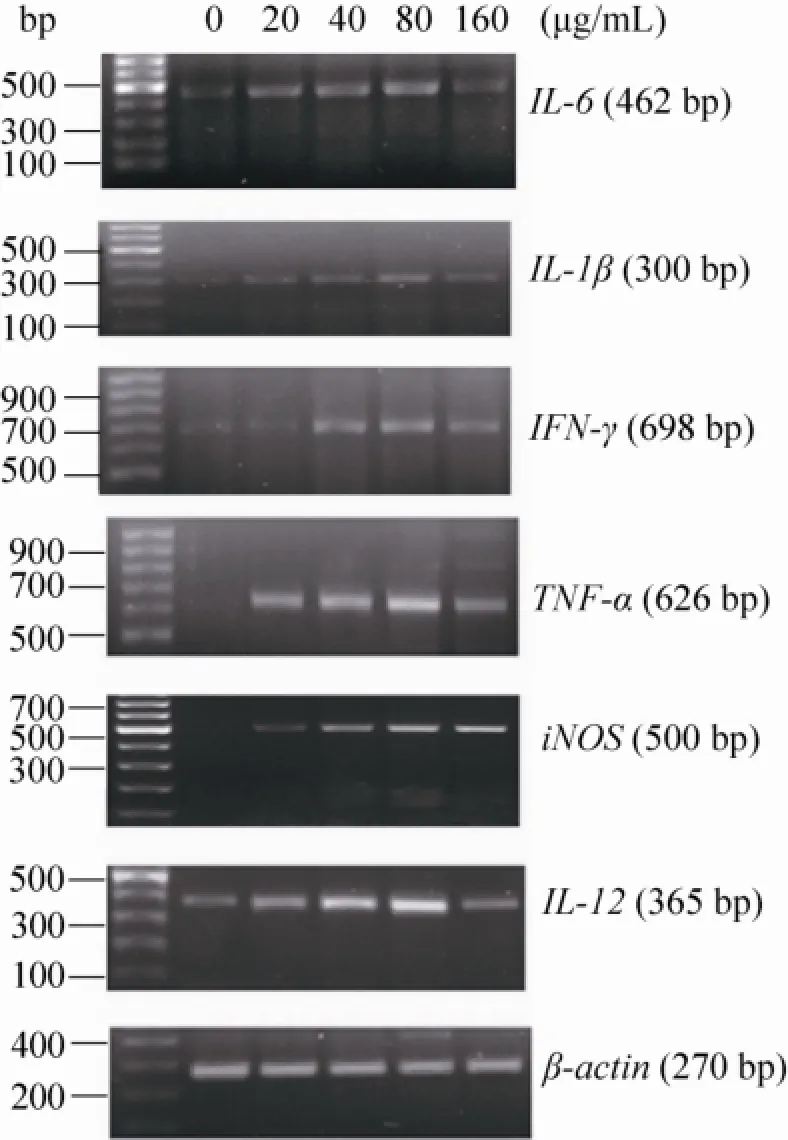
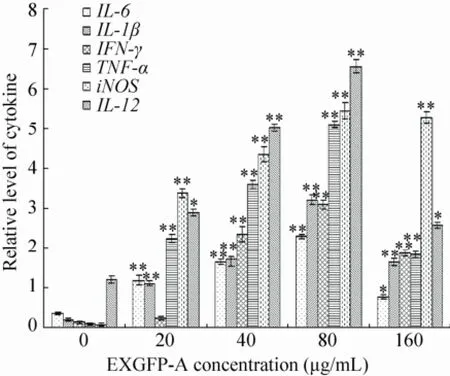
图7 EXGFP-A作用浓度对RAW264.7细胞中细胞因子表达水平的影响Fig. 7 Effects of EXGFP-A concentration on the mRNA expression of cytokine in RAW264.7 cells. n=6, x± s, compared with the control group, *P<0.05, **P<0.01.
在本研究中,灰树花胞外多糖EXGFP-A是一种主要含有葡萄糖的吡喃型中性多糖,单糖组成为鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖,摩尔比为0.28: 0.31: 0.30: 0.06: 7.98: 0.61。EXGFP-A能够增强RAW264.7的细胞增殖和吞噬活性[23],促进TNF-α、IL-1β、IL-6、IFN-γ和IL-12等细胞因子的分泌以及上调细胞中iNOS的mRNA表达水平,并且在一定浓度范围内具有明显的浓度依赖关系。以上结果说明EXGFP-A可以通过多途径激活RAW264.7细胞,增强机体的免疫活性。
多糖的糖组成和糖苷键类型对生物活性有一定的影响[24],EXGFP-A主要由α-D-葡萄吡喃糖组成,这可能与其免疫活性有着密切的关系。本文的研究结果证实了灰树花多糖EXGFP-A是一种以葡萄糖为主的吡喃型中性多糖,并具有一定的体外免疫活性,为多糖的结构与活性的研究提供了理论依据。
REFERENCES
[1] Mayell M. Maitake extracts and their therapeutic potential. Altern Med Rev, 2001, 6(1): 48−60.
[2] Kodama N, Komuta K, Nanba H. Can maitake MD fraction aid cancer patients?. Altern Med Rev, 2002, 7(3): 236–239.
[3] Hishida I, Nanba H, Kuroda H. Antitumor activity exhibited by orally administered extracted from fruit body of Grifola frondosa. Chem Pharm Bull, 1988, 36(5): 1819−1827.
[4] Kurushima H, Kodama N, Nanba H. Activities of polysaccharides obtained from Grifola frondosaon insulin-dependent diabetes mellitus induced by streptozotocin in mice. Mycoscience, 2000, 41(5): 473–480.
[5] Mau J L, Lin HC, Song SF. Antioxidant properties of several specialty mushrooms. Food Res Int, 2002, 35(6): 519–526.
[6] Jin GQ, Ye BP, Xi T. Preliminary study on the antiradiation effect of intracellular grifolan comes from Grifola frondosa. Pharm Biotechnol, 2003, 10(1): 40–42 (in Chinese).金国虔, 叶波平, 奚涛. 灰树花胞内多糖抗辐射作用的初步研究. 药物生物技术, 2003, 10(1): 40–42.
[7] Inoue A, Kodama N, Nanba H. Effect of maitake (Grifola frondosa) D-fraction on the control of T lymph node Th-1/Th-2 proportion. Bio Pharm Bull, 2002, 25(4): 536–540.
[8] Adachi Y, Okazaki M, Ohno N, et al. Enhancement of cytokine production by macrophages stimulated with (1→3)-beta-D-glucan, grifolan (GRN), isolated from Grifola frondosa. Biol Pharm Bull, 1994, 17(12): 1554–1560.
[9] Nanba H, Hamaguchi A, Kuroda H. The chemical structure of an antitumor polysaccharide in fruitbodies of Grifola frondosa (maitake). Chem Pharm Bull, 1987, 35(3): 1162–1168.
[10] Ni DJ, Chen YQ, Xie BJ, et al. Spectrum, M or phological and thermal characteristics of OTPS 2–1 in polysaccharides from Oolong Tea. Chem J Chin Univ, 2004, 25(12): 2263–2268 (in Chinese).倪德江, 陈玉琼, 谢笔钧, 等. 乌龙茶多糖OTPS 2-1的光谱特性、形貌特征及热特性研究.高等学校化学学报, 2004, 25(12): 2263–2268.
[11] Peng Y, Li ZJ. Immunostimulating effect and signal pathway of fungal polysaccharides on macrophages and dendritic cells. J Food Sci, 2012, 33(15): 318–323 (in Chinese).彭颖, 李宗军. 菌物多糖对巨噬细胞和树突状细胞的免疫刺激作用及信号通路. 食品科学, 2012, 33(15): 318–323.
[12] Seewaldt VL, Kim JH, Parker MB, et al. Dysregulated expression of cyclin D1 in normal human mammary epithelial cells inhibits all-trans-retinoic acid-mediated G0/G1-phase arrest and differentiation in vitro. Exp Cell Res, 1999, 249(1): 70–85.
[13] Hibbs JB Jr, Taintor RR, Vavrin Z, et al. Nitricoxide: a cytotoxic activated macrophage effector molecule. Biochem Biophys Res Commun, 1988, 157(1): 87–94.
[14] Liu H, Zhang J. Determination of molecular structure of carboxymethyl pumpkin polysaccharide by gas chromatography and IR spectroscopy. Chin J Spectr Lab, 2008, 25(3): 313–318 (in Chinese).柳红, 张静. 用气相色谱和红外光谱对羧甲基化南瓜多糖结构的研究. 光谱实验室, 2008, 25(3): 313–318.
[15] Chiovitti A, Bacic A, Craik DJ, et al. A pyruvated carrageenan from australian specimens of the red alga Sarconema filiforme. Carbohydr Res, 1998, 310(1/2):77–83.
[16] Sheng JR, Zeng LH, Zhai C, et al. The extraction, isolation and structure analysis of polysaccharids. J Guangxi Teach Coll: Nat Sci Ed, 1999, 16(4): 49-54 (in Chinese).盛家荣,曾令辉,翟春,等. 多糖的提取、分离及结构分析. 广西师院学报: 自然科学版, 1999, 16(4): 49–54.
[17] Xia CH, Dai Q, Fang W, et al. Research on the IR spectrscopy of kinds of polysaccharide. J Wuhan Univ Technol, 2007, 29(1): 45–47 (in Chinese).夏朝红, 戴奇, 房韦, 等. 几种多糖的红外光谱研究. 武汉理工大学学报, 2007, 29(1): 45–47.
[18] Xu H, Liu JH, Shen ZY, et al. Analysis of chemical composition, structure of Grifola frondosa polysaccharides and its effect on skin TNF-α levels, lgG content, T lymphocytes rate and caspase-3 mRNA. Carbohydr Polym, 2010, 82(3): 687–691.
[19] Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods, 1983, 65(1-2): 55–63.
[20] Wang YF, Zhang LN, Zhang YL, et al. Correlation of structure to antitumor activities of five derivatives of a β-glucan from Poria cocos sclerotium. Carbohydr Res, 2004, 339(15): 2567–2574.
[21] Boehm U, Klamp T, Groot M, et al. Cellular responses to interferon-gamma. Annu Rev Immunol, 1997, 15: 749–795.
[22] Commins SP, Borish L, Steinke JW. Immunologic messenger molecules: cytokines, interferons, and chemokines. J Allergy Clin Immunol, 2010, 125(S2): S53–S72.
[23] Oh JY, Cho KJ, Chung SH, et al. Activation of macrophages by GLB, a protein-polysaccharide of the growing tips of Ganoderma lucidum. Yakh Hoeji, 1998, 42(3): 302–306.
[24] Wang XJ, Wei CW, Xu SY, et al. Progress in polysaccharides chemical structure and structure-activity. Guangzhou Chem Ind, 2004, 32(1): 6–10 (in Chinese).王晓娟, 魏传晚, 徐淑永, 等. 生物活性多糖结构与功效关系的研究进展. 广州化工, 2004, 32(1): 6–10.
(本文责编 陈宏宇)
Structure and immunomodulatory activity of extracellular polysaccharide from Grifola frondosa
Lirong Han, Dai Cheng, Lirui Wang, and Chunling Wang
College of Food Engineering and Biological Technology, Tianjin University of Science & Technology, Tianjin 300457, China
Abstract:We aimed at analyzing the structure of extracellular polysaccharide A from Grifola frondosa (EXGFP-A) and testing its immunomodulatory activity. Structural analysis shows that EXGFP-A was a contained α-D-glucoside bond and pyranose ring. GC analysis reveals that EXGFP-A was mainly composed of rhamnose, arabinose, xylose, mannose, glucose, galactose, by the molar ratio of 0.28:0.31:0.30:0.06:7.98:0.61. The results of MTT(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) assay indicates when EXGFP-A was at a concentration of 80 μg/mL and treatment time of 48 h, RAW264.7 cells proliferation index reached a maximum of 137.5%. Meanwhile, the AO staining showed that EXGFP-A activated RAW264.7 cells and improved the level of intracellular nucleic acid metabolism. In addition, in a certain range of concentration, EXGFP-A was able to increase the release of NO in RAW264.7 cells, and upregulate the mRNA expression of immunological factor TNF-α, IL-1β, IL-6, IL-12, IFN-γ and iNOS of RAW264.7 cells. Our results confirm that EXGFP-A had immunomodulatory activity. Our findings provided scientific basis for the structural analysis and application of Grifola frondosa polysaccharide.
Keywords:Grifola frondosa polysaccharide, structural analysis, RAW264.7 cells, immunomodulatory activity
Corresponding author:Chunling Wang. Fax/Tel: +86-22-60912421; E-mail: wangchunling@tust.edu.cn
