转基因大豆豆粕外源基因和蛋白在SD大鼠体内消化吸收分析
2016-07-04袁建琴常泓赵江河史宗勇王俊东
袁建琴,常泓,赵江河,史宗勇,王俊东
1 山西农业大学 生命科学学院,山西 太谷 0308012 山西农业大学 动物科技学院,山西 太谷 030801
转基因大豆豆粕外源基因和蛋白在SD大鼠体内消化吸收分析
袁建琴1,常泓1,赵江河1,史宗勇1,王俊东2
1 山西农业大学 生命科学学院,山西 太谷 030801
2 山西农业大学 动物科技学院,山西 太谷 030801
袁建琴, 常泓, 赵江河, 等. 转基因大豆豆粕外源基因和蛋白在SD大鼠体内消化吸收分析. 生物工程学报, 2016, 32(5): 657–668.
Yuan JQ, Chang H, Zhao JH, et al. Analysis of exogenous gene and protein digestion and absorption of SD rats (Rattus norvegicus) fed roundup ready soybean meal. Chin J Biotech, 2016, 32(5): 657–668.
摘 要:为了评估转基因抗草甘膦除草剂大豆的食用安全性,以20%的比例将转基因抗草甘膦除草剂大豆GTS40-3-2和其亲本非转基因大豆A5403豆粕分别添加到基础饲料中喂养两代Sprague-Dawley (SD) 大鼠,采用定性、定量PCR和ELISA方法检测转基因大豆成分相关基因和蛋白在长期饲喂的大鼠体内代谢残留状况。结果表明,大鼠喂养转基因大豆豆粕后,除了大鼠肠粪和盲肠内容物检测到有转基因成分的残留,肠道菌群和实质脏器均未发现相关基因和蛋白。结果提示,长期饲喂转基因抗草甘膦除草剂大豆GTS40-3-2与亲本A5403大豆豆粕对SD大鼠具有同样的食用安全性。
关键词:抗草甘膦除草剂,转基因大豆GTS40-3-2,SD大鼠,外源基因和蛋白,消化吸收
Received: December 13, 2015; Accepted: March 16, 2016
Supported by: Key Projects in the National Science and Technology Pillar Program during the Twelfth Five-Year Plan Period of China (No. 2012BAD12B06-2), Science and Technology Key Program of Shanxi Province (No. 20140311025-3), Natural Science Foundation of Shanxi Province (No. 2013011028-2), Higher School Teaching Reform Project of Shanxi Province (No. J2012026).
“十二五”国家科技支撑计划 (No. 2012BAD12B06-2),山西省科技攻关项目 (No. 20140311025-3),山西省自然科学基金 (No. 2013011028-2),山西省高等学校教学改革项目 (No. J2012026) 资助。
生物安全性问题从转基因作物诞生之日起就与之相伴,其争论从未停止过[1]。譬如,受体的遗传特性是否会受到外源目的基因导入的操作而造成影响;生物多态性、周围生态环境、靶标生物及与之相关联的生物的种群是否会被广泛种植的转基因作物造成不良影响;转基因作物是否改变了转基因产品的营养学特性和农艺学特性;导入的目的基因及其表达产物是否会对人类健康及动物造成危害,农畜产品中是否会残留导入的目的基因及其表达产物;自然界中是否会有目的基因的漂移等一系列人们所疑问和关心的问题[2-6]。转基因技术的应用如当今抗生素给人类带来的各种难题一样,同样也可能会给人类带来各种各样的问题,因转基因作物毕竟不是通过自然进化得来的[1-3]。如今,公众对于转基因作物及其产品安全问题的担忧和关注会随着科学研究的不断深入而更趋于科学和理性[7-9]。随着越来越多的转基因作物产品在人们日常生活中的不断应用,转基因作物及其产品的安全性也越来越受到人们的关注。目前,国内外已有一系列的营养研究报告表明动物食用转基因饲料对其健康和副产品没有不良影响,但对其食用安全性的评估,大多为90 d实验,其毒理学研究属于亚慢性的研究[5-12],长期的研究还较少。特别是转基因饲料对两代大鼠长期系统的研究未见报道。本研究参照“转基因植物及其产品大鼠90 d喂养试验”的设计原则[13],通过以20%的比例将转基因抗草甘膦除草剂大豆GTS40-3-2[6,9,14]和其亲本非转基因大豆A5403豆粕分别添加到基础饲料中喂养两代Sprague Dawley (SD) 大鼠,对大鼠肠道菌群和脏器组织等材料进行定性、定量PCR和ELISA蛋白检测,以研究转基因大豆GTS40-3-2的相关内外源基因及蛋白在SD大鼠体内的转移情况,判定其食用安全性。
1 材料与方法
1.1材料
1.1.1试验动物
选用由山西医科大学实验动物中心提供的24只出生后5周龄体重在80-100 g清洁级健康SD大鼠。首先,给予5 d的常规基础饲料,后将其随机分成4组 (按体重):GMF组 (8只) 和GMM组 (4只) 分别为喂食转基因大豆豆粕加工饲料的雌性大鼠组和雄性大鼠组;non-GMF 组 (8只) 和non-GMM (4只) 组分别为喂食非转基因大豆豆粕加工饲料的雌性大鼠组和雄性大鼠组。试验期间,大鼠自由地摄取饲料和水;动物房内的光照时间为人工控制:12 h白天和12 h黑夜交替;房内维持温度23 ℃±1 ℃,相对湿度维持55%±15%。喂食相应组别的饲料6周,即大鼠3月龄时,在每晚8:00按雌性:雄性为2∶1比例进行同笼,次日清晨进行雌鼠阴道的检查, 及时取出查到阴栓的雌鼠,后雌/雄大鼠分笼喂养,约21 d雌性大鼠先后产仔 (二代大鼠)。在二代大鼠长到3周龄时 (期间雌性母鼠一直喂食相应组别的饲料) 离乳分笼。二周后(二代大鼠5周龄时),选用40只体重80-100 g健康二代大鼠,随机分为4组 (每组10只,从离乳到分组也一直喂食相应组别的饲料),适应1周后即大鼠6周龄时称重并开始记录数据,90 d后宰杀所有大鼠。
1.1.2标准物质和大鼠饲料
阳性标准物质10%转基因抗草甘膦除草剂大豆GTS40-3-2购自欧盟委员会联合研究中心标准物质与测量研究院 (IRMM) (Catalog Number:ERM-BF410GK)。所用豆粕 (转基因抗草甘膦除草剂大豆GTS40-3-2 (孟山都公司),对照组豆粕为其亲本非转基因大豆A5403) 经农业部转基因生物产品成分监督检验测试中心(太原) PCR方法检测验证无误,委托山西医科大学实验动物中心根据大鼠的不同发育期按比例加工成大鼠饲料 (大豆豆粕含量为20%)[14]。
1.1.3主要试剂
磁珠法细菌基因组DNA抽提试剂盒购自生工生物工程 (上海) 股份有限公司;TransTaq-T DNA Polymerase购自北京全式金生物技术有限公司;TaKaRa MiniBest Universal Genomic DNA Extraction kit ver 5.0、Premix Ex TaqTM(Probe qPCR) 和DL2 000 DNA Marker购自TaKaRa宝生物工程 (大连) 有限公司;ELISA CP4 EPSPS Roundup检测试剂盒购自美国Agdia公司;定性、定量PCR引物及TaqMan探针:由北京擎科新业生物技术有限公司合成。
1.1.4菌种
大肠埃希氏杆菌菌种Escherichia coli ATCC 25922和嗜酸乳杆菌菌种Lactobacillus acidophilus ATCC 314,由山西农业大学唐中伟老师惠赠。
1.1.5检测转基因大豆定性PCR相关引物
检测转基因大豆GTS40-3-2的定性PCR引物,见表1[15-16]。
1.1.6检测大鼠肠道菌群相关引物
针对大鼠肠道内总菌群16S rRNA和乳酸杆菌分别设计了检测大鼠肠道菌群的特异性引物zx338f和rg7f (zx338f检测总菌群,rg7f检测乳酸杆菌)[17-19],见表2。
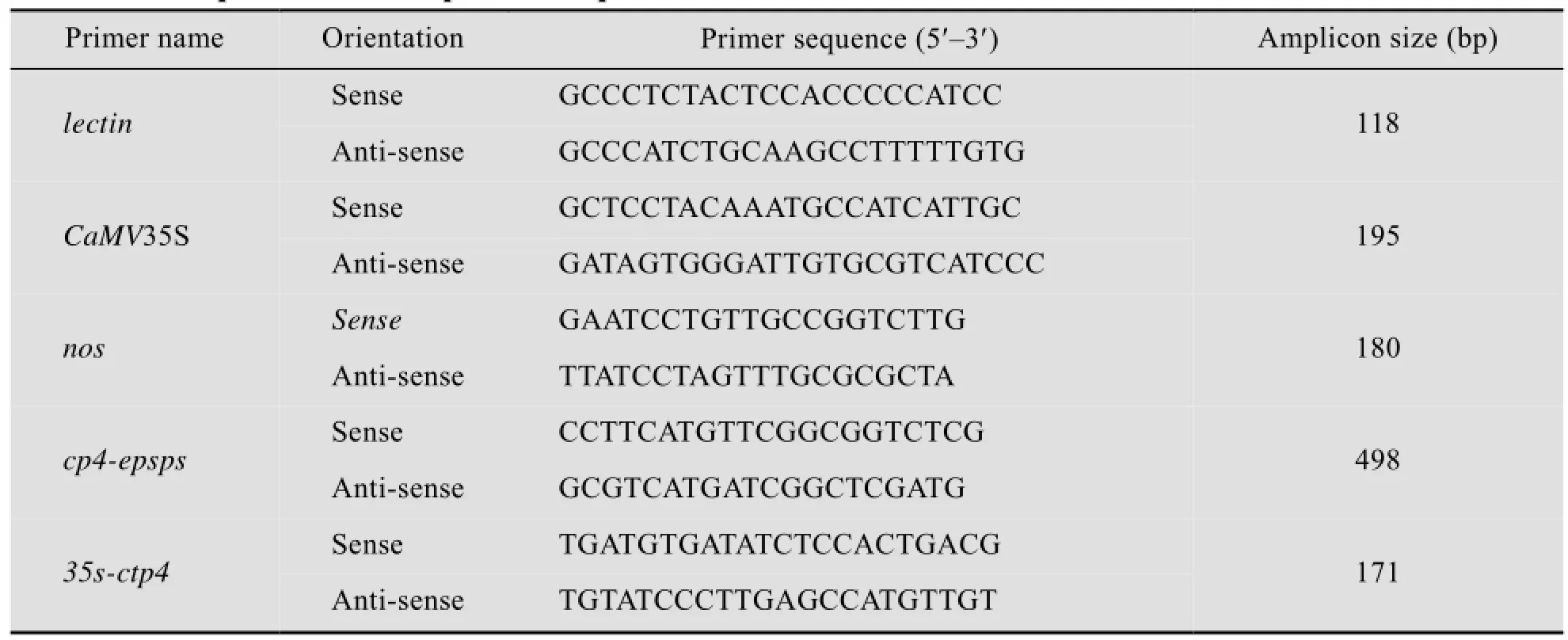
表1 定性PCR引物序列Table 1 The qualitative PCR primers sequences
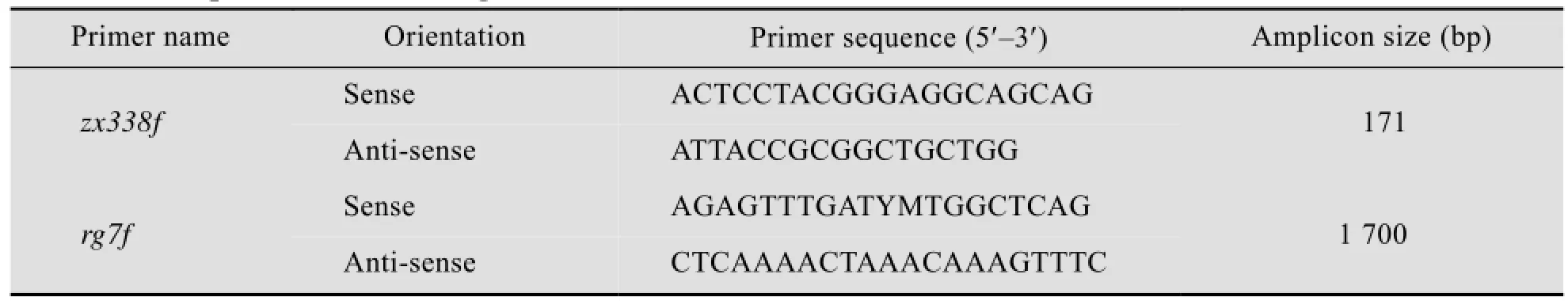
表2 检测SD大鼠肠道菌群引物Table 2 The primers of detecting SD rat intestinal bacteria
1.1.7实时荧光定量PCR引物与探针
检测大鼠肠道菌群和脏器组织所用引物与探针序列[20],见表3。
1.2方法
1.2.1SD大鼠肠道菌群转基因成分相关基因的检测
分别提起4组大鼠的尾巴,从肛门用镊子夹取大鼠肠粪,电子天平准确称取粪便5 g。将粪便溶解、梯度稀释和接种涂布,之后进行培养:牛肉膏蛋白胨琼脂培养基37 ℃需氧恒温培养48 h;LBS琼脂培养基37 ℃厌氧恒温培养48 h。针对每种培养基依次编号,LBS培养基用于培养肠粪中的乳酸杆菌 (1–4号,依次为GMM组、GMF组、non-GMM组和non-GMF 组),牛肉膏蛋白胨用于培养肠粪中的肠道总菌群 (5–8号,依次为GMM组、GMF组、non-GMM组和non–GMF组)。肠粪菌群DNA提取和检测分别参照磁珠法细菌基因组DNA抽提试剂盒和TransTaq-T DNA Polymerase说明书进行。
1.2.2大鼠脏器组织转基因成分外源蛋白CP4-EPSPS ELISA测定 (酶联免疫吸附试验)
四组大鼠宰杀后分别取样,见表4。依据ELISA CP4 EPSPS Roundup检测试剂盒进行大鼠脏器组织转基因成分外源蛋白CP4-EPSPS的检测。
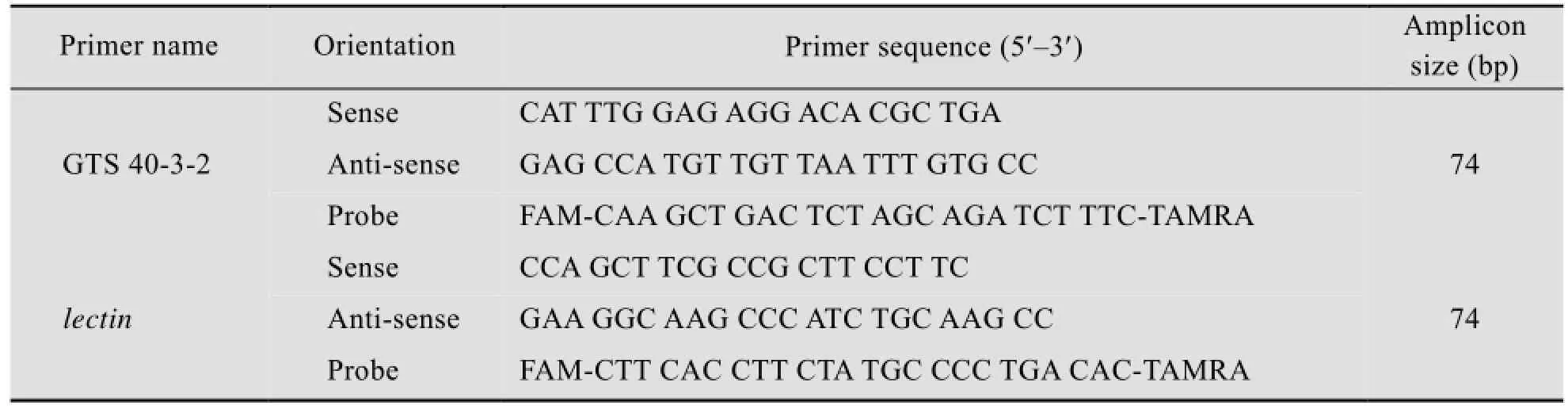
表3 实时荧光定量PCR引物序列Table 3 Real-time PCR primer sequences
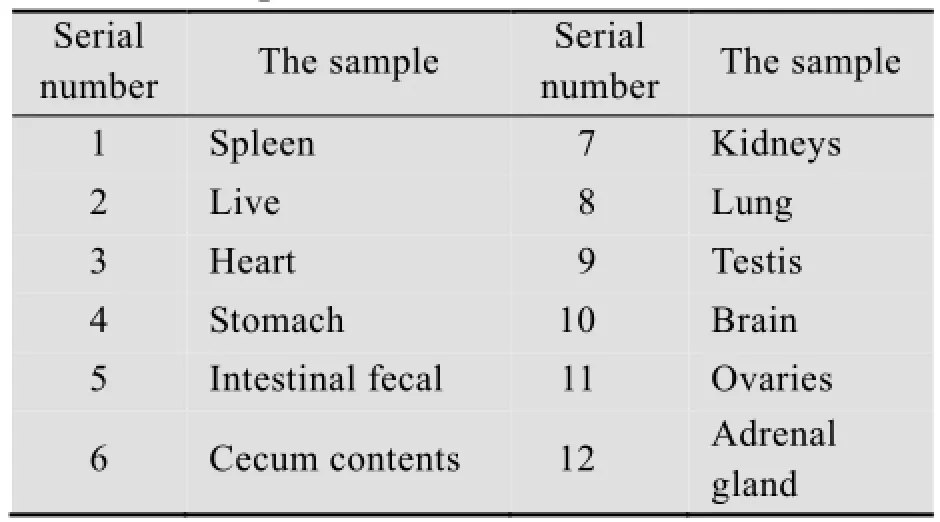
表4 样品编号Table 4 Sample serial number
1.2.3SD大鼠脏器组织转基因成分相关基因定性PCR检测
试验所取大鼠脏器组织如表4所示。SD大鼠脏器组织的裂解、DNA提取和检测依照TaKaRa MiniBest Universal Genomic DNA Extraction kit ver 5.0和TransTaq-T DNA Polymerase说明书进行,之后对阳性扩增片段进行测序。
1.2.4SD大鼠的脏器转基因成分相关基因实时荧光定量PCR检测
应用1.2.3所获得的DNA,依据Premix Ex TaqTM(Probe qPCR) 试剂盒,建立大豆内标准基因lectin基因和转基因大豆GTS40-3-2特异基因GTS40-3-2的标准曲线,获得各样本基因的相应拷贝数,同时计算转基因大豆GTS40-3-2转化体含量。
2 结果与分析
2.1SD大鼠肠道菌群转基因成分相关基因的检测
提取SD大鼠肠道菌群DNA,获得的DNA浓度为234.4-1346.3 μg/mL,所提DNA的质量(OD260/280为1.89-2.00,OD260/230为2.02-2.92)较好。在此基础上进行了转基因大豆GTS40-3-2内外源基因在SD大鼠肠道菌群DNA中的消化吸收代谢残留检测。
2.1.1大鼠肠道菌群DNA特异基因定性PCR检测
对所提取的大鼠肠道菌群DNA进行rg7f和zx338f基因检测,zx338f的阳性对照为标准大肠埃希氏杆菌菌种ATCC 25922,rg7f的阳性对照为嗜酸乳酸杆菌ATCC 314,结果见图1。图1A结果表明,1–4号样品,均扩增出1.7 kb的肠道乳酸杆菌rg7f基因,5–8号样品,均未扩增出相应大小的条带。图1B结果表明,所提取的8个DNA样品,都扩增出了171 bp的肠道总菌群zx338f 基因。图1A和B每个图都检测8个样品,每个样品2次重复。以上结果说明,无论是针对肠道乳酸杆菌DNA,还是肠道菌群DNA,均扩增出相应大小的条带,表明所提取的DNA质量可靠。
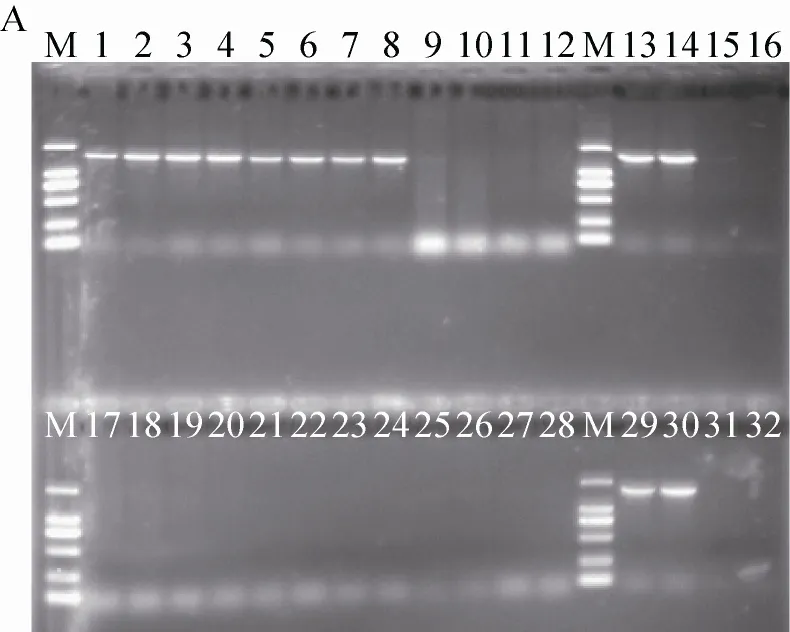
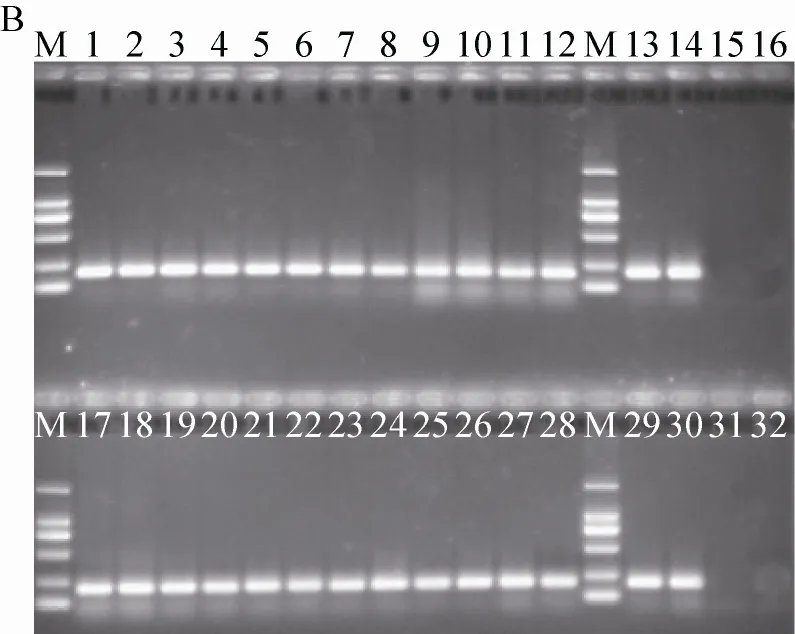
图 1 rg7f和zx338f基因PCR扩增产物电泳图Fig. 1 The electrophoretogram of PCR products of rg7f and zx338f genes. The electrophoregram A and B respectively on behalf of detecting rg7f and zx338f genes. 1, 2, 9, 10 lanes: 1, 5 samples (GMM group); 3, 4, 11, 12 lanes: 2, 6 samples (GMF group); 5, 6, 17, 18 lanes: 3, 7 samples (non-GMM group); 7, 8, 19, 20 lanes: 4, 8 samples (non-GMF)); 13, 14, 29 and 30 lanes: positive control; 15, 16, 31 and 32 lanes: negative control; M: DL2 000 DNA marker (2 000 bp, 1 000 bp, 750 bp, 500 bp, 250 bp, 100 bp).
2.1.2转基因大豆GTS40-3-2内外源基因的电泳检测
采用PCR基因扩增和琼脂糖凝胶电泳检测转基因大豆GTS40-3-2内外源基因在SD大鼠肠道菌群DNA中的转移。检测结果表明,所有8个样品均未检出转基因大豆GTS40-3-2相关内标准基因lectin、启动子CaMV35S、nos终止子、外源基因35s-ctp4和cp4-epsps (表5)。
2.1.3实时荧光定量PCR
对所提取的8个肠道菌群DNA样本进行了转基因大豆内标准基因lectin 和特异基因GTS40-3-2实时荧光定量PCR检测,均未出现典型扩增曲线 (表6)。
2.2SD大鼠脏器组织ELISA检测结果
表5 转基因大豆GTS40-3-2内外源基因检测电泳结果Table 5 Electrophoresis results of GM soybeans GTS40-3-2 internal and external source genes

表6 肠道菌群实时荧光定量PCR检测结果Table 6 Real-time PCR detection results of intestinal flora

表7 结果分析参考对照Table 7 Result analyse contrast
根据ELISA CP4 EPSPS Roundup检测试剂盒说明书所介绍的样品阳性与阴性的判定标准(表7),通过酶标仪在650 nm波长下测定各孔的OD值,阳性质控物吸光度值为0.629±0.023,大于阳性标准0.3,呈阳性,阴性质控物吸光度值为0.069±0.012,小于阴性标准0.1,试验结果可靠,可进行样品数据的判定。最终样品8号和9 号 (肠粪和盲肠内容物) 数值分别为0.237±0.010 和0.238±0.030,位于0.1和0.3之间,结果可疑,进行以下相关基因检测验证,其余样品吸光度值均小于阴性标准0.1,未检出转基因大豆外源蛋白CP4-EPSPS残留。
2.3SD大鼠脏器组织转基因成分相关基因检测
对提取的SD大鼠脏器组织DNA进行定性与定量PCR检测。
2.3.1SD大鼠脏器组织DNA定性PCR检测
对提取的12个SD大鼠脏器DNA进行转基因抗草甘膦除草剂大豆GTS40-3-2内外源相关基因定性PCR检测,每个样品2次重复。除了大鼠肠粪和盲肠内容物扩增出了118 bp的大豆内标准lectin基因、195 bp的CaMV35S启动子、180 bp 的nos终止子、498 bp的 cp4-epsps和171 bp 的35s-ctp4外源基因外,其他SD大鼠实质脏器组织均未扩增出相应条带 (图2)。对上述肠粪和盲肠内容物的PCR产物测序,5个基因的序列与文献报道序列一致[15–16]。
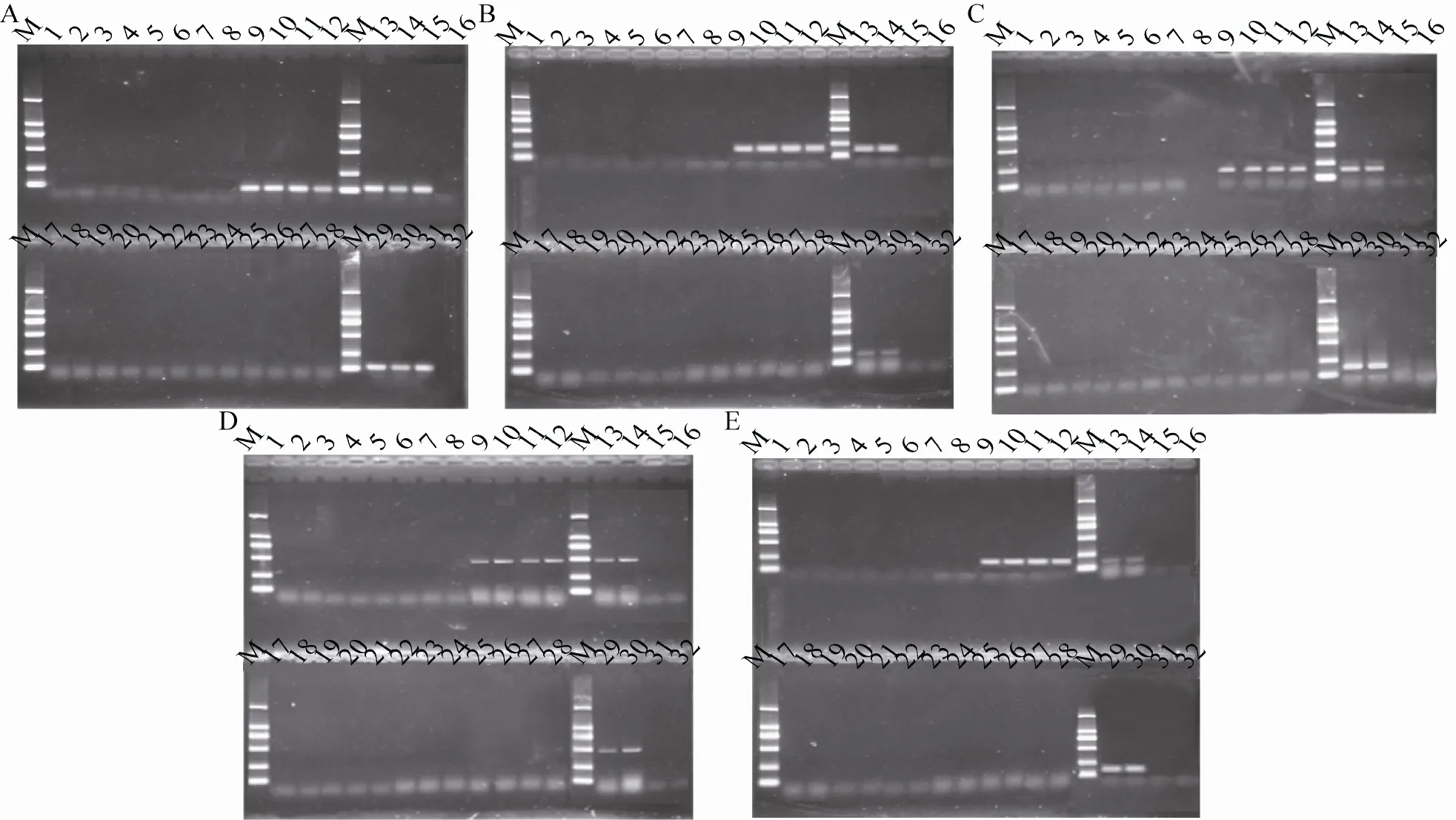
图2 Lectin、CaMV35S、nos、cp4-epsps和35s-ctp4扩增产物电泳图Fig. 2 The electrophoretogram of PCR products of lectin, CaMV35S, nos, cp4-epsps and 35s-ctp4 genes. The electrophoregram A, B, C, D and E respectively on behalf of detecting lectin, CaMV35S, nos, cp4-epsps and 35s-ctp4 genes; 1-12 and 17-28 lanes: samples (1 and 2 lanes: spleen; 3 and 4 lanes: live; 5 and 6 lanes: heart; 7 and 8 lanes: stomach; 9 and 10 lanes: intestinal fecal; 11 and 12 lanes: cecum contents; 17 and 18 lanes: kidneys; 19 and 20 lanes: lung; 21 and 22 lanes: testis; 23 and 24 lanes: brain; 25 and 26 lanes: ovaries; 27 and 28 lanes: adrenal gland); 13, 14, 29 and 30 lanes: positive control; 15, 31 lanes: negative control; 16, 32 lanes: blank; M: DL2 000 DNA marker (2 000 bp, 1 000 bp, 750 bp, 500 bp, 250 bp, 100 bp).
2.3.2 SD大鼠脏器组织DNA 实时荧光定量PCR检测
对上述所提取的12个SD大鼠脏器组织DNA进行了大豆内标准基因lectin实时荧光定量PCR检测,得到lectin基因标准曲线和扩增曲线图 (图3)。由图3可知,标准品的lectin基因具有典型的扩增曲线,其扩增效率为97.4%,R2为0.991>0.98,标准曲线斜率为-3.385 (>-3.6,<-3.1),而以鲑鱼精子DNA作为阴性对照和以水作为空白对照的lectin基因扩增均无典型的扩增曲线,说明扩增体系正确,可以进行大鼠脏器组织样品的判定。最终,从生成的扩增曲线可知,SD大鼠肠粪和盲肠内容物DNA的内标准基因lectin有典型扩增曲线,肠粪Ct值平均为35.70,拷贝数平均为401/2 μL;盲肠内容物Ct值平均为37.02,拷贝数平均为97/2 μL;其他10个大鼠脏器组织未出现典型扩增曲线。
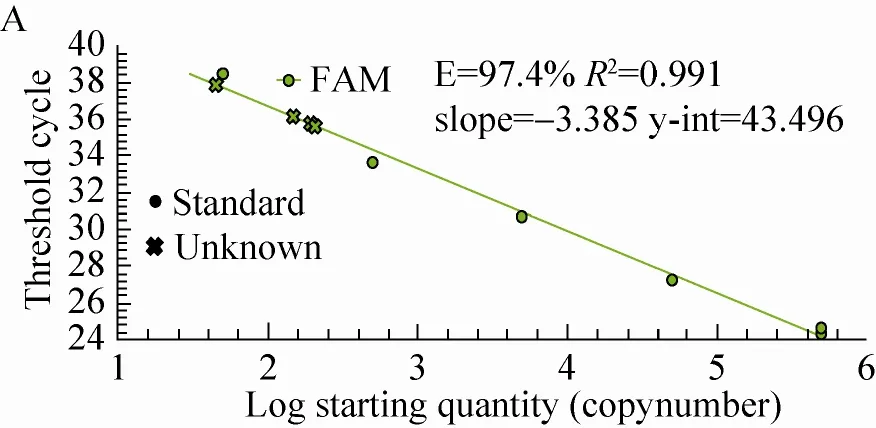
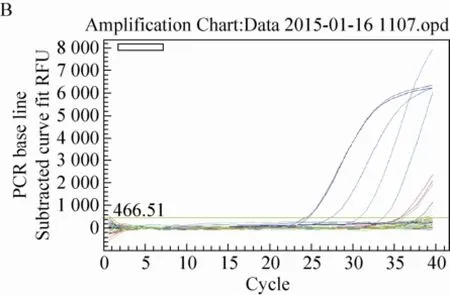
图3 Lectin基因标准曲线图和扩增曲线图Fig. 3 The standard and amplification curves of lectin gene. The curve A and B respectively on behalf of the standard and amplification curves of lectin gene.
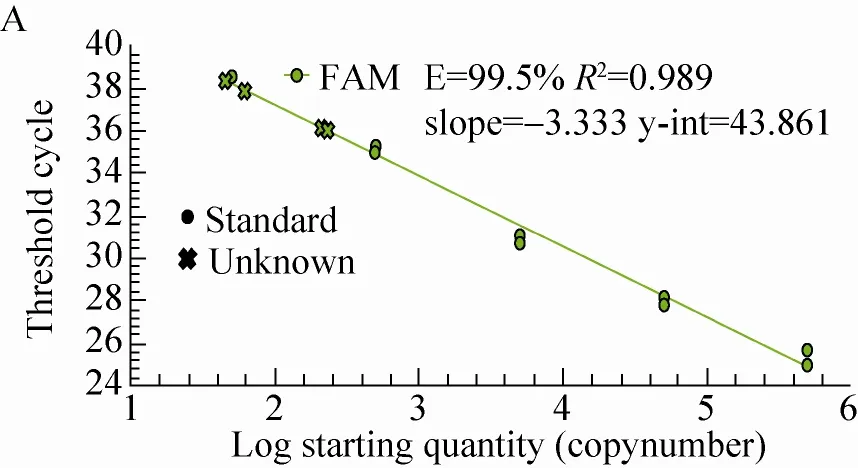
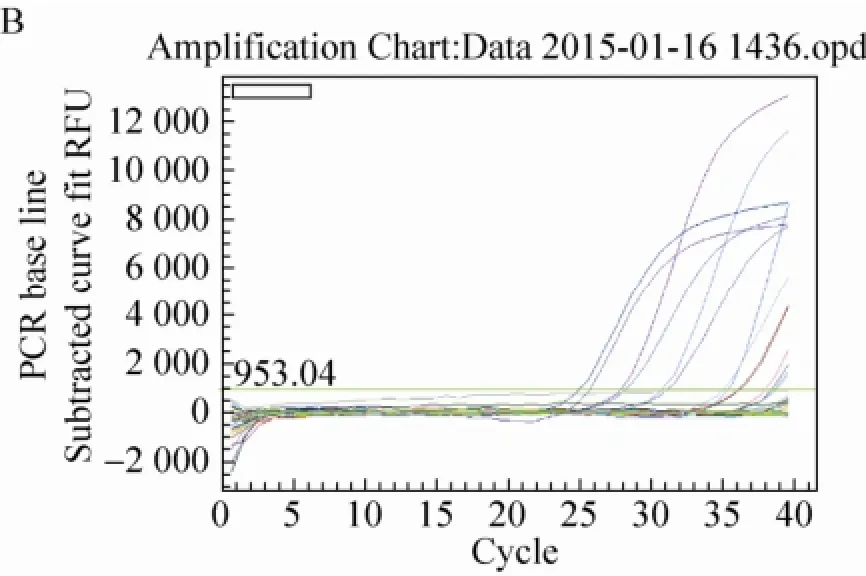
图4 GTS40-3-2基因标准曲线图和扩增曲线图Fig. 4 The standard and amplification curves of GTS40-3-2 gene. The curve A and B respectively on behalf of the standard and amplification curves of GTS40-3-2 gene.
试验对上述所提取的12个SD大鼠脏器DNA进行了GTS40-3-2基因实时荧光定量PCR检测,所得GTS40-3-2基因标准曲线和扩增曲线图,见图4。由图4可知,标准品的GTS40-3-2基因具有典型扩增曲线,其扩增效率为99.5%,R2为0.989>0.98,标准曲线斜率-3.333 (>-3.6,<-3.1),以鲑鱼精子DNA作为阴性对照和以水作为空白对照的GTS40-3-2基因扩增均无典型的扩增曲线,说明扩增体系正确,可以进行大鼠脏器组织样品的判定。从生成的扩增曲线可知,SD大鼠肠粪和盲肠内容物DNA的GTS40-3-2基因有典型扩增曲线,肠粪的Ct值平均为36.05,拷贝数平均为222/2 μL;盲肠内容物的Ct值平均为38.11,拷贝数平均为53.9/2 μL;其他10个SD大鼠脏器组织未出现典型扩增曲线。
SD大鼠脏器中GTS40-3-2转化体的含量按下列公式计算:代表样品中所含转基因大豆GTS40-3-2基因的拷贝数,nlectin代表样品中所含大豆内标准lectin基因的拷贝数)。通过上述公式计算,可得SD大鼠肠粪中GTS40-3-2转化体含量 (拷贝数的比值) 为55.4%,盲肠内容物中GTS40-3-2转化体含量 (拷贝数的比值) 为55.6%。
3 讨论
肠道微生物群落与宿主个体的健康和疾病状况息息相关。肠道微生物群落不仅能降解食物中不易消化的营养成分,提供给宿主氨基酸和维生素等营养物质,还能够调节宿主能量存储与代谢、激活肠道免疫系统以及促进肠道上皮细胞的分化与成熟[7]。肠道中微生物菌群对动物机体的健康和疾病具有重要的影响,越来越受到人们的关注[21-22]。由于在动物粪便中便于非损伤型取样,且含有大量的肠道菌群相关信息,是较好的分子生物学研究材料[17-19,23]。目前,已有许多研究人员开展了从不同动物的粪便样品中提取DNA并进行相关方面的研究[17-19]。本研究中,从定性和定量PCR基因检测结果看,大鼠肠道菌群如期检测到了相关菌群的特异性基因,说明所提取的DNA质量可靠,但SD大鼠肠道菌群未检测到转基因豆粕的相关内外源基因,即相关豆粕转基因成分在大鼠肠道菌群无残留。
近些年,有关转基因作物毒理学方面的评价越来越多。2004年Alexander等使用实时荧光定量PCR和常规PCR评估了抗农达油菜cp4 epsps基因在绵羊肠道、瘤胃、粪便内容物中的稳定性,研究表明,消化的植物材料所释放的转基因DNA可以在绵羊小肠中发现。然而, 在中性pH中DNA迅速降解,从而减少了完整转基因DNA通过绵羊集合淋巴结的补丁回肠末端吸收的可能性[24]。2008年Bakke-McKellep等通过对西洋鲑鱼喂食抗农达转基因全脂大豆粉和转基因玉米,发现在商业化的饲料中含有约6%转基因玉米和大豆是安全的[25]。2009年,Sissener等研究发现转基因大豆未造成任何不利大西洋鲑鱼器官形态或应激反应的现象[26]。2011年,谭建庄等应用苏木素伊红染色法和酶联免疫吸附试验未发现转基因大豆豆粕对肉仔肠载膜免疫屏障产生不良影响[8]。2012年,Chukwudebe等喂食含转基因大豆CV127饲料的大鼠,通过91 d的实验发现CV127大豆与其传统对照大豆在系统性影响和营养价值方面具有等同性[27]。本研究也得到上述文献类似的结论。在ELISA CP4-EPSPS蛋白检测中,大鼠的实质脏器组织未检测到含有CP4-EPSPS蛋白。但大鼠的肠粪和盲肠内容物无论是肉眼观察还是酶标仪检测,都显示含有转基因大豆GTS40-3-2外源CP4-EPSPS蛋白 (大鼠肠粪OD630检测数值为0.237±0.010,盲肠内容物OD630检测数值为0.238±0.030) 残留。2个样品的OD630检测数值都小于0.3,但大于0.1,研究采用定性与定量PCR检测转基因大豆GTS40-3-2的内外源基因在SD大鼠体内的消化吸收情况,进行了相关基因检测进一步验证。定性PCR检测中,只有大鼠的肠粪和盲肠内容物检测出了大豆内标准基因lectin、启动子CaMV35S、nos终止子、外源基因35s-ctp4和cp4-epsps 5个基因(定性PCR检出cp4-epsps基因与ELISA蛋白检测含有CP4-EPSPS蛋白相吻合),其余大鼠脏器组织均未检测到相关基因。实时荧光定量PCR检测也只有大鼠的肠粪和盲肠内容物lectin、GTS40-3-2有典型扩增曲线(GTS40-3-2转化体含量分别为55.4%和55.6%),其余样品均无典型扩增曲线。大鼠肠粪和盲肠内容物中检测到转基因成分很正常,因饲料经过大鼠消化系统的消化与吸收,会有一部分饲料未完全被消化,因而会有残留,但大鼠的实质脏器组织均未检出有转基因大豆GTS40-3-2成分相关基因的转移。
4 结论
通过添加含有20%的转基因抗草甘膦除草剂GTS40-3-2大豆豆粕作为饲料喂养二代SD大鼠,针对大鼠的肠道菌群和实质脏器进行了与饲料相关基因和蛋白的定性、定量PCR和ELISA检测,均未发现有转基因成分的转移和残留,表明转基因抗草甘膦除草剂GTS40-3-2大豆与其亲本A5403具有实质性的等同。
REFERENCES
[1] Huang DF. Review of transgenic crop breeding in China. Chin J Biotech, 2015, 31(6): 892–900 (in Chinese).黄大昉. 我国转基因作物育种发展回顾与思考.生物工程学报, 2015, 31(6): 892–900.
[2] Guo JC. Development of new DNA-based methods for analysis of genetically modified plants and their derived products [D]. Shanghai: Shanghai Jiao Tong University, 2011 (in Chinese).郭金超. 转基因植物及产品核酸检测新技术研究[D]. 上海: 上海交通大学, 2011.
[3] Tan JZ. The feed safety assessment of glyphosate-tolerant soybean meal in broilers [D]. Beijing: Chinese Academy of Agriculture Sciences, 2011 (in Chinese).谭建庄. 抗草甘膦转基因豆粕对肉仔鸡的饲用安全性评定 [D]. 北京: 中国农业科学院, 2011.
[4] James C. Global status of commercialized Biotech/GM crops: 2014. China Biotech, 2015, 35(1): 1–14 (in Chinese). James C. 2014年全球生物技术/转基因作物商业化发展态势. 中国生物工程杂志, 2015, 35(1): 1–14.
[5] Zhu YZ, Yin JD, Li DF, et al. Study on metabolism of exogenous DNA from transgenic soybean meal in grower pigs. Acta Vet Zootech Sin, 2005, 36(10): 1083–1086 (in Chinese).朱元招, 尹靖东, 李德发, 等. 生长猪对转基因豆粕外源DNA的代谢研究. 畜牧兽医学报, 2005, 36(10): 1083–1086.
[6] Zhao ZH, Yang LT, Ai XJ, et al. Analysis of the influence on physiological metabolism and genetic horizontal transformation of rats fed roundup ready soybean meal. J Nanjing Agr Univ, 2006, 29(1): 77–80 (in Chinese).赵志辉, 杨立桃, 艾晓杰, 等. 转基因抗草苷膦大豆对大鼠生理代谢的影响及外源基因水平转移研究. 南京农业大学学报, 2006, 29(1): 77–80.
[7] Lu CB, Zhang W, Liu B. Effects of transgenic soybean feed on proliferation of spleen lymphocyte in male mice. Soy Sci, 2012, 31(2): 291–294 (in Chinese).芦春斌, 张伟, 刘标. 抗草甘膦转基因大豆饲料对雄性小鼠脾淋巴细胞体外增殖的影响. 大豆科学, 2012, 31(2): 291–294.
[8] Tan JZ, Liu SS, Sun Z, et al. Effects of glyphosate-tolerant soybean meal on intestinal mucosal immunity in broilers. Chin J Anim Nutr, 2011, 23(5): 836–841 (in Chinese).谭建庄, 刘莎莎, 孙哲, 等. 抗草甘膦转基因豆粕对肉仔鸡肠黏膜免疫的影响. 动物营养学报, 2011, 23(5): 836–841.
[9] Lu CB, Cai J, Qi QL, et al. Effects of glyphosate-resistant transgenic soybean on malemice testis. J Jinan Univ: Nat Sci Med Ed, 2014, 35(3): 245–259 (in Chinese).芦春斌, 蔡娟, 戚青林, 等. 抗草甘膦转基因大豆对雄鼠睾丸的影响. 暨南大学学报: 自然科学与医学版, 2014, 35(3): 245–259.
[10] Zhu YX, He XY, Luo YB, et al. A 90-day feeding study of glyphosate-tolerant maize with the G2-aroA gene in Sprague-Dawley rats. Food Chem Toxicol, 2013, 51: 280–287.
[11] Demerlis CC, Schoneker DR, Borzelleca JF. Safety of PVAP and PVAP-T including a 90-day dietary toxicity study in rats and genotoxicity tests with polyvinyl acetate phthalate (PVAP). Food Chem Toxicol, 2014, 70: 231–240.
[12] Chen DL, Zhang SM, Zou SY, et al. A 90-day subchronic feeding study of transgenic glyphosate herbicide-resistant maize CC-2 in Sprague-Dawley rats (Rattus norvegicus). J Agr Biotech, 2013, 21(12): 1448–1457 (in Chinese).陈德龙, 张莳眉, 邹世颖, 等. 转基因耐草甘膦除草剂玉米CC-2喂养SD大鼠90天亚慢性毒性研究. 农业生物技术学报, 2013, 21(12): 1448–1457.
[13] Ministry of Agriculture of the People's Republic of China. NY/T 1102-2006 Safety assessment of genetically modified plant and derived products 90-day feeding test in rats. Beijing: China Standards Press, 2006 (in Chinese).中华人民共和国农业部. NY/T 1102-2006 转基因植物及其产品食用安全检测 大鼠90天喂养试验. 北京: 中国标准出版社, 2006.
[14] General Administration of quality supervision, inspection and Quarantine of the People's Republic of China, China National Standardization Management Committee. GB 14924.3-2010. Laboratory animals-nutrients for formula feeds. Beijing: China Standards Press, 2011 (in Chinese).中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 14924.3-2010 实验动物 配合饲料营养成分. 北京: 中国标准出版社, 2011.
[15] Ministry of Agriculture of the People's Republic of China. Chinese Standard Agriculture Department Public Announcement No.1782-3-2012 detection of genetically modified plants and derived products. Qualitative PCR method for the regulatory elements CaMV 35S promoter, FMV 35S promoter, NOS promoter, NOS terminator and CaMV 35S terminator. Beijing: China Agriculture Press (in Chinese).中华人民共和国农业部. 农业部1782号令-3-2012 转基因植物及其产品成分检测 调控元件CaMV 35S启动子、FMV 35S启动子、NOS启动子、NOS终止子和CaMV 35S终止子定性PCR方法. 北京: 中国农业出版社, 2012.
[16] Ministry of Agriculture of the People's Republic of China. Chinese Standard Agriculture Department Public Announcement No.1861-2-2012 detection of genetically modified plants and derived products. Qualitative PCR method for herbicide-tolerant soybean GTS 40-3-2 and its derivates. Beijing: China Agriculture Press, 2013 (in Chinese).中华人民共和国农业部. 农业部1861号令-2-2012 转基因植物及其产品成分检测 耐除草剂大豆GTS 40-3-2及其衍生品种定性PCR方法.北京: 中国农业出版社, 2013.
[17] Li LT, Xu WT, Guo X, et al. An effective method for genomic DNA extraction from rat intestinal microflora. J Chin Cereals Oils Assoc, 2010, 25(1): 22–127 (in Chinese).李丽婷, 许文涛, 郭星, 等. 提取鼠肠道内微生物基因组DNA的方法研究. 中国粮油学报, 2010, 25(1): 122–127.
[18] Gong Q, Guan DM, Wang YB, et al. Methods extracted Escherichia coli genomic DNA using the fast ways. Mar Environ Sci, 2005, 24(4): 63–66 (in Chinese).宫强, 关道明, 王耀兵, 等. 大肠杆菌总DNA快速提取方法的比较研究. 海洋环境科学, 2005, 24(4): 63–66.
[19] Zhang SL, Liu YX, Zhang HQ, et al. Development of a genus-specific T-RFLP technique for differentiating Lactobacillus community. Microbiol China, 2012, 39(8): 1179–1189 (in Chinese).张思璐, 刘云霄, 张浩琪, 等. 属特异性T-RFLP技术用于乳酸杆菌的群落分析. 微生物学通报,2012, 39(8): 1179–1189.
[20] General Administration of Quality Supervision, Inspection and Quarantine. GB/T 19495.5-2004 detection of genetically modified organisms and derived products-quantitative nucleic acid based methods. Beijing: China Standards Press, 2004 (in Chinese).国家质量监督检验检疫总局. GB/T 19495.5-2004转基因产品检测 核酸定量PCR 检测方法. 北京: 中国标准出版社, 2004.
[21] Nicholson JK, Holmes E, Wilson ID. Gut microorganisms, mammalian metabolism and personalized health care. Nat Rev Microbiol, 2005, 3(5): 431–438.
[22] Ji X, Zheng WJ, Zou XT, et al. Analysis of antibiotic and copper resistance of Escherichia coli isolated from feces of sows and piglets before and after weaning. Acta Vet Zootech Sin, 2015, 46(3): 482–490 (in Chinese).计徐, 郑卫江, 邹雪婷, 等. 断奶前后仔猪和母猪粪便源大肠杆菌耐药性和铜抗性的分析. 畜牧兽医学报, 2015, 46(3): 482–490.
[23] Zheng G, Chen JR, Hu BW, et al. Genomic DNA extraction from rat faecal and intestinal microflora based on DGGE analysis. Food Sci, 2011, 32(17): 215–218 (in Chinese).郑刚, 陈己任, 胡博文, 等. 基于DGGE分析的大鼠粪便及肠道细菌DNA提取方法研究. 食品科学, 2011, 32(17): 215–218.
[24] Alexander TW, Sharma R, Deng MY, et al. Use of quantitative real-time and conventional PCR to assess the stability of the cp4 epsps transgene from Roundup Ready® canola in the intestinal, ruminal, and fecal contents of sheep. J Biotechnol, 2004, 112(3): 255–266.
[25] Bakke-McKellep AM, Sanden M, Danieli A, et al. Atlantic salmon (Salmo salar L.) parr fed genetically modified soybeans and maize: histological, digestive, metabolic, and immunological investigations. Res Vet Sci, 2008, 84(3): 395–408.
[26] Sissener NH, Bakke AM, Gu J, et al. An assessment of organ and intestinal histomorphology and cellular stress response in Atlantic salmon (Salmo salar L.) fed genetically modified Roundup Ready® soy. Aquaculture, 2009, 298(1/2): 101–110.
[27] Chukwudebe A, Privalle L, Reed A, et al. Health and nutritional status of Wistar rats following subchronic exposure to CV127 soybeans. Food Chem Toxicol, 2012, 50(3/4): 956–971.
(本文责编 郝丽芳)
医学与免疫生物技术
Analysis of exogenous gene and protein digestion and absorption of SD rats (Rattus norvegicus) fed roundup ready soybean meal
Jianqin Yuan1, Hong Chang1, Jianghe Zhao1, Zongyong Shi1, and Jundong Wang2
1 College of Life Science, Shanxi Agricultural University, Taigu 030801, Shanxi, China
2 College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, Shanxi, China
Abstract:Metabolism and deposition of exogenous gene and protein from transgenic glyphosate herbicide-tolerant soybean meal in SD rats were studied in the experiment. The transgenic soybean GTS40-3-2 meal and its non-transgenic counterpart (parent A5403) were fed to the generation and the second generation Sprague-Dawley (SD) rats (Rattus norvegicus). The study added the genetically modified (GM) soybean meal and its non-transgenic control soybean meal (parent A5403) in a ratio of 20% respectively to the feeds. By using qualitative, quantitative PCR and ELISA methods to detect transgenic soybean residues of metabolism ingredients in rats, the safety and influence of GM soybean were evaluated. The results showed that the intestinal fecal and cecum contents of rats were detected with residues of GM ingredients, intestinal flora and organs were not found related genes and protein. These results indicated that transgenic glyphosate herbicide-tolerant soybean GTS40-3-2 meal was as safe as its non-GM soybean meal in long-term feeding study.
Keywords:glyphosate-resistance herbicide, GM soybeans GTS40-3-2, SD rats, exogenous gene and protein, digestion and absorption
Corresponding author:Jundong Wang. Tel: +86-354-6288206; fax: +86-354-6222942; E-mail: wangjd53@outlook.com
