黄芪注射液对大鼠脑缺血再灌注损伤VEGF及VEGFR2表达的影响
2016-07-04李海燕
李 艳 ,王 岭 ,孙 丽,陈 晶 ,李海燕 ,王 超 ,房 雷
黄芪注射液对大鼠脑缺血再灌注损伤VEGF及VEGFR2表达的影响
李艳 ,王岭 ,孙丽,陈晶 ,李海燕 ,王超 ,房雷
青岛大学医学院第二附属医院(山东青岛 266042)
摘要:目的探讨黄芪注射液对大鼠脑缺血/再灌注损伤后细胞凋亡和血管内皮生长因子(VEGF)及其受体(VEGFR2)表达的影响。方法应用线栓法建立大鼠大脑中动脉缺血再灌注(MCAO/R)模型,经腹腔注射黄芪注射液(6 mL/kg)干预治疗。Longa法评价大鼠神经行为功能,苏木精-伊红染色观察大脑皮质神经元形态结构,原位末端标记法检测细胞凋亡,免疫组化和蛋白印迹法定性和定量检测VEGF及VEGFR2蛋白表达,荧光定量PCR检测VEGF及VEGFR2基因的表达。结果经黄芪注射液治疗后,大鼠大脑皮质区VEGF及VEGFR2蛋白和VEGF及VEGFR2 mRNA表达较对照组明显增强,细胞凋亡显著减少,动物神经行为功能显著改善。结论黄芪注射液可通过上调VEGF及VEGFR2的表达而抑制细胞凋亡,促进受损的神经细胞修复,改善动物的神经行为功能。
关键词:脑缺血;再灌注损伤;凋亡;黄芪注射液;血管内皮生长因子;血管内皮生长因子受体;大鼠
血管内皮生长因子(VEGF)具有促进内皮细胞有丝分裂和新血管生成的作用[1]。何佳等[2]研究发现,脑缺血再灌注损伤时VEGF活化刺激VEGF受体(VEGFR2) 表达上调,促进血管内皮细胞增殖,加速新生血管形成。许多证据表明,VEGF具有神经营养、神经保护、抗凋亡、促进神经干细胞增殖和存活等生物学作用[3-4]。Yang等[5]研究发现,缺血3 h以内应用VEGF治疗能够减少脑缺血/再灌注后神经元损伤,可用于人类急性脑卒中的治疗。Li等[6]研究指出,VEGFR2介导的信号传导通路在促进缺血后神经血管的重塑中起着重要作用,并且将血管发生和神经形成联系在一起。因此,增加脑缺血/再灌注损伤后VEGF及VEGFR的表达,可能成为缺血缺氧性脑损伤治疗的重要途径。
中药黄芪具有补气升阳、利水退肿等功效,黄芪甲苷是中药黄芪中提取皂苷的主要成分,在临床上用于治疗冠心病、心肌炎等疾病具有良好的疗效[7]。黄鑫等[8]研究发现,黄芪甲苷可以促进内皮祖细胞(EPCs)的增殖和黏附能力,对EPCs具有保护作用。余勤等[9]研究指出,黄芪注射液能够诱导骨髓干细胞分化为神经元细胞并能协同骨髓干细胞促进脊髓损伤的修复。曲友直等[10-11]研究表明,黄芪注射液的主要成分黄芪甲苷能减少大鼠脑缺血/再灌注后脑组织中细胞浸润,减轻炎症反应和脑水肿,但脑保护作用的机制还不十分清楚[12-13]。本实验拟观察黄芪注射液对脑缺血/再灌注损伤后神经元凋亡和VEGF及其受体VEGFR2表达的影响,进一步探讨其神经保护作用机制。
1材料与方法
1.1动物模型和分组成年雄性Wistar大鼠40只(SPF级,体重230 g~250 g),由青岛市药物检验所实验动物中心提供(SCXK20090007)。动物置实验室环境适应7 d,自由饮食。随机选择10只为对照组,其余30只应用线栓法经右侧颈外-颈内动脉插线建立MCAO/R模型[14],缺血2 h后退出插线实现再灌注。对照组手术步骤相同,但插线进入颈内动脉10 mm后即刻退出。动物苏醒后出现右侧Horner征,提尾左前肢内收屈曲、爬行时向右侧划圈者为成功模型。将造模不成功及术后2 h死亡的10只动物剔除,成功的20只再随机分为模型组(10只)和治疗组(10只)。
1.2治疗方案黄芪注射液(国药准字Z31020084)。在刘莎莎等[15]报道的剂量上加以改进,治疗组动物在造模成功后2 h,经腹腔注射黄芪注射液6 mL/kg,之后每隔24 h给药1次,给药2次。对照组和模型组同步给予等量生理盐水。
1.3评级指标
1.3.1神经行为功能评分末次给药24 h后,所有大鼠(n=30)参照Longa评分标准[16]进行神经行为功能评分,评分越高表示神经行为功能损伤越严重。
1.3.2苏木精-伊红(HE)染色末次给药24 h后,每组随机选取5只动物以10%水合氯醛3 mL/kg腹腔注射麻醉,依次经心脏灌注生理盐水250 mL和4%多聚甲醛溶液250 mL,断头取脑,置4%多聚甲醛溶液固定2 h,蒸馏水浸泡4 h。常规梯度乙醇脱水、二甲苯透明、石蜡包埋。石蜡切片常规脱蜡水化,苏木精伊红染色。显微镜下观察皮质区神经元形态改变。
1.3.3TUNEL检测细胞凋亡按照TUNEL细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司,中国)说明操作。石蜡切片常规脱蜡水化,以新配制的1%TritonX-100通透液促渗(3~5)min,新配制的3% HO2封闭液室温下封闭10 min。每个样本上滴加100 μL稀释的蛋白酶K工作液(Proteinase K),37 ℃消化10 min。滴加TdT酶反应液,37 ℃避光反应60 min,滴加Streptavidin-FITC标记工作液,37℃避光反应30 min,进行荧光标记。配制POD-conjugated Anti-FITC 工作液,滴加到每张切片上37 ℃避光反应30 min,进行POD标记。DAB显色1 min,光学显微镜(Olympus CK2,Japan)下观察。细胞核呈棕黄色为阳性细胞,阴性对照不加TdT,不出现阳兴着色。每只动物取4张切片,高倍镜下(400倍)随机选取皮质区不重叠的4个视野细胞计数,以阳性细胞占细胞总数的比例为凋亡指数。
1.3.4免疫组化检测VEGF、VEGFR2蛋白表达应用兔抗鼠VEGF单克隆抗体(Millipore)、VEGFR2单克隆抗体(abcam)和SABC试剂盒(武汉博士德生物工程公司,中国)。镜下观察细胞质呈棕黄色为阳性染色。紫外分光光度仪测定细胞VEGF和VEGFR2表达产物的吸光度值。以细胞层吸光度值减去背景吸光度值表示神经细胞VEGF和VEGFR2表达强度。每只大鼠选取4张切片,每张切片选取脑组织4个不重叠视野。
1.3.5Western blot定量检测VEGF、VEGFR2蛋白表达末次给药24 h后,取脑组织100 mg,按100 mg组织1 mL RIPA组织裂解液∶1 μL PMSF的比例加入组织裂解液(北京盖宁科技有限公司),取上清液于EP管中,取100 μL用BCA蛋白浓度试剂盒(北京索莱宝公司)测定样品总蛋白浓度。以凝胶成像系统显影,Quantity one软件分析条带灰度值。以同一标本β-actin的灰度值作为内参照,校正目的蛋白的灰度值,按公式计算相对值,重复测定3次。
1.3.6荧光定量PCR(Real-Time PCR)检测VEGF、VEGFR2基因表达取上述缺血侧脑组织100 mg,Trizol法抽提总RNA,紫外分光光度计测定RNA纯度。由软件分析目的基因(VEGF、VEGFR2)和GAPDH基因的扩增曲线,得到各试验孔的Ct值,并以同一样本中的GAPDH Ct值作为内参,按照公式2-ΔΔCt=2-[(实验组目的基因Ct-实验组GAPDH Ct)-(对照组目的基因Ct-对照组GAPDH Ct)]计算各实验组的2-ΔΔCt值,将对照组的2-ΔΔCt值设为1,实验组与之相比,进行相对定量。
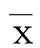
2结果
2.1神经行为功能评分对照组动物Longa法评分0分,模型组动物评分(2.33±0.52)分,较对照组显著升高(t=11.06,P<0.05),治疗组动物Longa法评分(1.67±0.41)为较模型组显著降低(t=2.24,P<0.05)。
2.2组织病理改变HE染色显示,对照组大脑皮质神经元排列整齐,层次清楚,着色均匀。模型组神经元排列紊乱,部分细胞固缩、着色加深,变性坏死。治疗组变性神经元数量较模型组明显减少。
2.3神经元凋亡TUNEL染色显示,对照组大脑皮质可见少量凋亡神经元,模型组神经元凋亡指数较对照组明显增高(t=6.20,P<0.05),药物干预治疗后神经元凋亡指数较模型组明显减低(t=5.18,P<0.05)。详见表1。

表1 各组大脑皮质区神经元细胞凋亡和VEGF、VEGFR2表达强度比较(±s)
2.4免疫组化检测VEGF、VEGFR2蛋白表达免疫组化显示VEGF主要在皮质区表达,对照组皮质神经元细胞VEGF呈微弱表达,缺血/再灌注损伤后VEGF表达较对照组明显增强(t=5.94,P<0.05);治疗组VEGF表达较模型组明显增强(t=4.83,P<0.05)。 对照组皮质神经元细胞VEGFR2呈微弱表达,缺血/再灌注损伤后VEGFR2表达较对照组明显增强(t=4.29,P<0.05);治疗组VEGFR2表达较模型组明显增强(t=3.87,P<0.05)。详见表1。
2.5Western blot法检测VEGF、VEGFR2蛋白表达Western blot法显示,对照组VEGF蛋白形成较弱55kD片段;模型组VEGF蛋白表达较对照组增强(t=6.77,P<0.05);治疗组VEGF蛋白表达较模型组明显增强(t=3.42,P<0.05)。对照组VEGFR2蛋白形成较弱152kD片段;模型组VEGFR2蛋白表达较对照A组增强(t=5.81,P<0.05);治疗组VEGFR2蛋白表达较模型组明显增强(t=2.92,P<0.05)。详见图1。

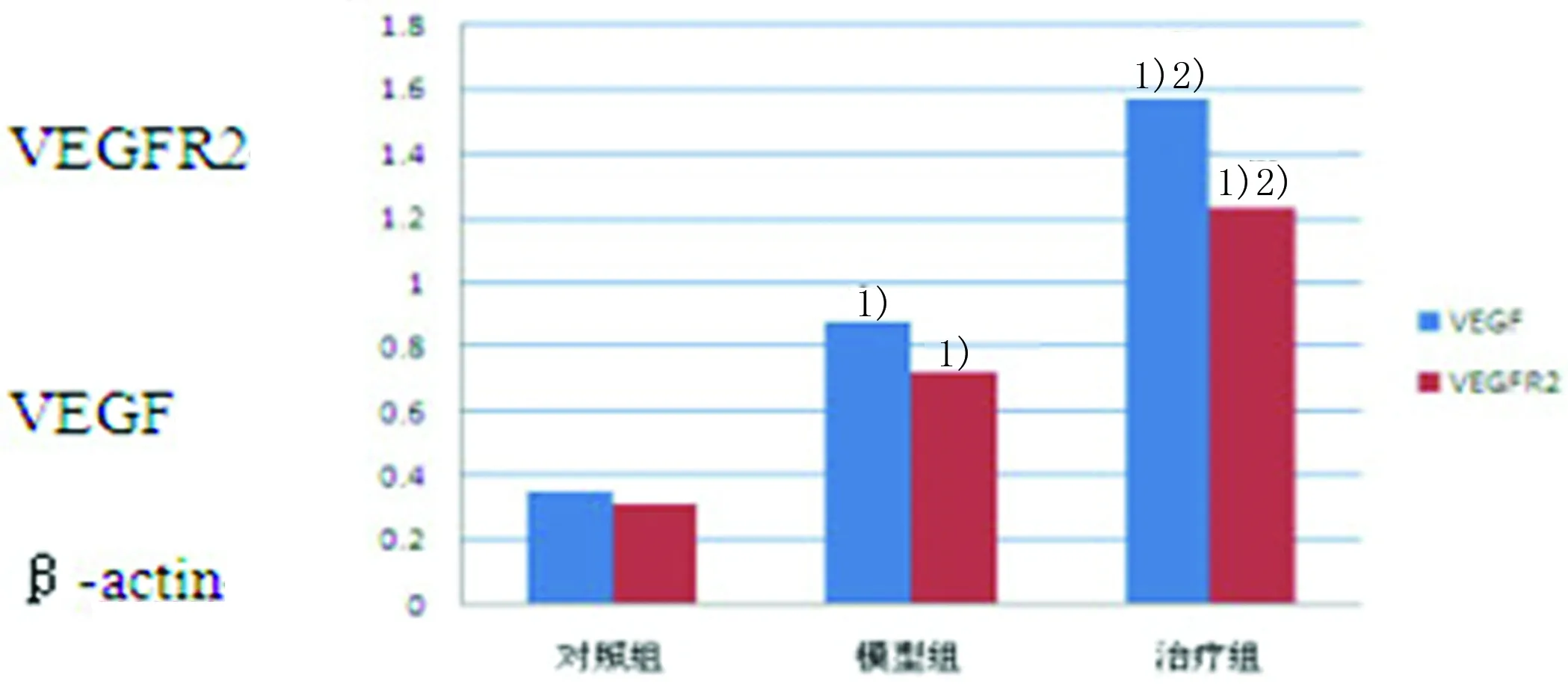
与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
图1Western blot法检测VEGF、VEGFR2蛋白表达
2.6VEGF、VEGFR2基因的表达RT-PCR显示,对照组VEGF mRNA(154 bp)表达较弱,将对照组的2-ΔΔCt值设为1,模型组和治疗组分别与之相比,进行相对定量,模型组VEGF mRNA表达较对照组显著增强(t=4.86,P<0.05),治疗组VEGF mRNA表达较模型组显著增强(t=3.21,P<0.05)。对照组VEGFR2 mRNA(151bp)表达较弱,将对照组的2-ΔΔCt值设为1,模型组和治疗组分别与之相比,进行相对定量,模型组VEGFR2 mRNA表达较对照组显著增强(t=3.20,P<0.05),治疗组VEGFR2 mRNA表达较模型组显著增强(t=2.40,P<0.05)。详见表2。

表2 各组大鼠神经元细胞VEGFmRNA和
3讨论
缺血再灌注性脑损伤是导致死亡和残疾的重要原因,黄芪注射液具有抗细胞凋亡和神经保护的作用,可能成为治疗缺血性脑损伤的一种新途径[17-18]。Liu等[19]研究发现,黄芪注射液能通过下调JNK3基因的表达,抑制神经细胞凋亡,减少梗死面积,改善神经行为功能。Zhang等[20]研究证实,黄芪注射液可通过促进内皮细胞依赖的与VEGF受体相关的磷脂酰肌醇3激酶/Akt途径,刺激体外培养的人脐静脉内皮细胞(HUVE)增殖,促进血管生成。Jin等[21]研究发现,VEGF是一种具有神经营养和神经保护作用的血管生成蛋白,通过与VEGFR2受体相互作用刺激神经发生。
本研究结果表明,大鼠大脑缺血再灌注损伤后,大脑皮质区神经元变性,神经细胞凋亡,大鼠表现为行为功能障碍。同时大脑皮质区VEGF及其受体VEGFR2蛋白和VEGF mRNA及VEGFR2 mRNA表达均增强,经黄芪注射液治疗后,大脑皮质区VEGF及其受体VEGFR2蛋白和VEGF mRNA及VEGFR2 mRNA表达较对照组明显增加,细胞凋亡显著减少,动物神经行为功能明显改善。
黄芪注射液可通过增强VEGF和VEGFR2的表达,减少神经细胞凋亡,改善动物的神经行为功能,这可能与VEGF、VEGFR2以及VEGF和VEGFR2之间的相互作用,诱导EPCs增殖与迁移,抑制缺血缺氧神经细胞的凋亡或坏死,促进神经和血管新生,改善神经细胞的生存环境,促进神经细胞的功能恢复,诱导神经细胞分化成熟的功能有关,有望为治疗脑缺血/再灌注损伤提供新的方法和途径。
参考文献:
[1]Li R,Nauth A,Li C,et al.Expression of VEGF gene isoforms in a rat segmental bone defect model treated with EPCs[J].J Orthop Trauma,2012,26(12):689-692.
[2]何佳,丁凤菲,刘敏珍,等.VEGF/VEGFR 在脑缺血再灌注损伤中的神经保护作用[J].神经损伤与功能重建,2013,8(3):177-180.
[3]Mackenzie F,Ruhrberg C.Diverse roles for VEGF-A in the nervous system [J].Development,2012,139(8):1371-1380.
[4]Namiecińska M,Marciniak K,Nowak JZ.VEGF as an angiogenic,neurotrophic,and neuroprotective factor[J].Postepy Hig Med Dosw (Online),2005,59:573-583.
[5]Yang J,Guo L,Liu R,et al.Neuroprotective effects of VEGF administration after focal cerebral ischemia/reperfusion:dose response and time window[J].Neurochemistry Intemational,2012,60(6):592-596.
[6]Li WL,Fraser JL,Yu SP,et al.The role of VEGF/VEGFR2 signaling in peripheral stimulation-induced cerebral neurovascular regeneration after ischemic stroke in mice[J].Exp Brain Res,2011,214(4):503-513.
[7]潘燕,张硕,张岫美.黄芪的药理作用与临床应用研究进展[J].食品与药品,2006,8:5-7.
[8]黄鑫,郭力恒,王磊,等.黄芪甲苷对人外周血内皮祖细胞的保护作用[J].中药药理与临床,2012,28:25-28.
[9]余勤,白丹双,林洁,等.黄芪注射液联合间质干细胞对大鼠脊髓损伤修复作用的实验研究[J].中国中西医结合杂志,2010,30(4):393-397.
[10]曲友直,李敏,高国栋.黄芪注射液对大鼠脑缺血/再灌注后血脑屏障的保护作用及其机制研究[J].中国中西医结合急救杂志,2011,18(5):263-266.
[11]Zhuo M,Chen H L,Cai N L,et al.A study on clinical effects and immunological mechanism of intravenous Astragalus injection therapy in neonates with hypoxic ischemic encephalopathy[J].Chin J TCM WM Crit Care,2008,15(1):13-15.
[12]梁顺利,徐彬,张宇燕.黄芪注射液对大鼠缺血性损伤神经细胞凋亡的影响[J].浙江中西医结合杂志,2011,21(3):159-161.
[13]Qu YZ,Li M,Gao GD.Protective effects of astragus injection on blood-brain barrier and expressions of occludin and zonula occludens protein-1 after cerebral ischemia and reperfusion in rats[J].Chin J TCM WM Crit Care,2011,18(5):263-265.
[14]Longa EZ,Weinstein PR,Corlson S,et al.Reversible middle cerebral artery occlusion without craniotomy in rats [J].Stroke,1989,20(1):84-91.
[15]刘莎莎,高维娟,钱涛,等.黄芪注射液对脑缺血/再灌注大鼠海马组织JNK-3 表达的影响[J].中国药理学通报,2012,28(5):665-670.
[16]Sun W,Gould TW,Newbern J,et al.Phosphorylation of c-Jun in avian and mammalian motoneurons in vivo during apoptosis: an early reversible event in the apoptotic cascade [J].Neuroscience,2005,25(23):5595-5603.
[17]梁顺利,徐彬,张宇燕.黄芪注射液对大鼠缺血性脑损伤神经细胞凋亡的影响[J].浙江中西医结合杂志,2011,21:159-161.
[18]曲友直,李敏,高国栋.黄芪注射液对脑缺血再灌注后血脑屏障的保护作用及ZO-1蛋白表达的影响[J].中国中医急症,2012,21:47-48.
[19]Liu G,Song J,Guo Y,et al.Astragalus injection protects cerebral ischemic injury by inhibiting neuronal apoptosis and the expression of JNK3 after cerebral ischemia reperfusion in rats[J].Behav Brain Funct,2013,1:9-36.
[20]Zhang Y,Hu G,Lin HC,et al.Radix Astragali extract promotes angiogenesis involving vascular endothelial growth factor receptor-related phosphatidylinositol 3-kinase/Akt-dependent pathway in human endothelial cells[J].Phytother Res,2009 ,23(9):1205-1213.
[21]Jin K,Zhu Y,Sun Y,et al.Vascular endothelial growth factor (VEGF) stimulates neurogenesis in vitro and in vivo[J].Proc Natl Acad Sci USA.2002,99(18): 11946-11950.
(本文编辑王雅洁)
Effects of Astragalus Injection on the Expression of VEGF and VEGFR2 in Rats with Cerebral Ischemia Reperfusion Injury
Li Yan,Wang Ling,Sun Li,Chen Jing,Li Haiyan,Wang Chao,Fang Lei
The Second Affiliated Hospital of Medical College,Qingdao University,Qingdao 266003,Shandong,China
Abstract:ObjectiveTo investigate the effects of astragalus injection on neuronal apoptosis and the expressions of vascular endothelial growth factor (VEGF) and vascular endothelial growth factor receptor 2 (VEGFR2) in rats with cerebral ischemia reperfusion injury. MethodsThe middle cerebral artery occlusion reperfusion (MCAO/R) rat models were established by inserting a filament suture from right external-internal carotid artery and treated with injecting astragalus injection (6 mL/kg) intraperitoneally. The neurobehavioral function of rats was evaluated with Longa’s test,the structural changes of neurons in the cortex was observed by hematoxylin-eosin (HE) staining,neuronal apoptosis was detected by TUNEL staining. Using immunohistochemistry as the quality analysis method and Western blot as the quantity analysis method to detect the expressions of VEGF and VEGFR2. The expressions of VEGF and VEGFR2 mRNA was determined by real-time PCR. ResultsAfter the treatment with astragalus injection,the expressions of VEGF and VEGFR2 proteins,VEGF and VEGFR2 mRNA in the cortex increased significantly than those in the control group,neuronal apoptosis was significantly reduced and the animal neurobehavioral function improved significantly. ConclusionAstragalus injection could inhibit apoptosis,promote the nerve repair and improve the neurobehavioral function of animas by up-regulated the expressions of VEGF and VEGFR2.
Key words:cerebral ischemia;reperfusion injury;apoptosis;astragalus injection;vascular endothelial growth factor;vascular endothelial growth factor receptor 2;rats
基金项目:山东省医药卫生科技发展计划(No.2011HW034)
通讯作者:孙丽,E-mail:sunli_qd@163.com
中图分类号:R743R289
文献标识码:A
doi:10.3969/j.issn.1672-1349.2016.01.007
文章编号:1672-1349(2016)01-0025-04
Corresponding Author:Sun Li
(收稿日期:2015-01-25)
