生姜辛香物质合成途径关键基因ZoHMGR的克隆及表达
2016-07-03张绍彬唐海芹陈德碧兰建彬
张绍彬,唐海芹,陈德碧,兰建彬
(1.重庆文理学院林学与生命科学学院,重庆402160;2.重庆文理学院特色植物研究院,重庆402160)
园艺·中药材
生姜辛香物质合成途径关键基因ZoHMGR的克隆及表达
张绍彬1,唐海芹1,陈德碧1,兰建彬2*
(1.重庆文理学院林学与生命科学学院,重庆402160;2.重庆文理学院特色植物研究院,重庆402160)
为探明3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMGR)在生姜(Zingiber officinale Roscoe)倍半萜合成途径的调节作用,根据在竹根姜转录组数据库中HMGR不同转录本序列,经比对分析后利用RT-PCR技术克隆HMGR基因的全长cDNA序列,并对其进行生物信息学分析;再利用荧光定量PCR技术检测目的基因在竹根姜不同组织和叶组织在不同诱导条件下的表达特性,同时分析其生成的倍半萜物质。结果表明:克隆的竹根姜ZoHMGR基因编码562个氨基酸,其与姜科植物阳春砂的亲缘关系最近。ZoHMGR基因主要在根茎中表达,其次是叶,而茎和根中的表达量最低,符合生姜不同组织中倍半萜物质的含量特征;该基因同时受物理伤害和茉莉酸甲酯处理的诱导,分别在6h和12h达最高表达水平,同时有倍半萜类物质生成。
生姜;倍半萜;HMGR基因
生姜(Zingiber officinale Roscoe)为姜科多年生草本宿根植物,原产东南亚。自古以来,中国和印度将其作为一种重要的蔬菜和药材[1]。倍半萜类物质是生姜根茎部位辛香物质最重要成分之一,同时也是其精油的主要成分[2-3]。植物体内的倍半萜物质生物合成通常存在两条途径:包括丙酮酸(MEP)途径和甲羟戊酸(MVA)途径。倍半萜生物合成中C5单位主要来源于甲羟戊酸途径[4],但两条途径存在一定程度地交叉[5]。在富含萜类物质的器官和组织中,有部分倍半萜类物质的合成前体底物在丙酮酸(MEP)途径生成[4,6]。在MVA途径中,5种酶依次参与催化acetylCoA生成IPP,分别为HMGS、 HMGR、MVK、MVD和PMK。其中,3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR,EC:1.1.1.34)催化3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)形成甲羟戊酸。因此,HMGR被认为是在MVA途径中第1个限速关键酶,是倍半萜类化合物合成中的重要调控节点之一[7-8]。
多数研究表明,植物体内的HMGR基因表达呈现组织和器官特异性,如橡胶HbHMGR1主要在其乳胶中进行大量表达[9],而大戟EpHMGR1主要在根中大量表达[10],同样丹参SmHMGR主要在根部表达[11],这些组织中主要富含相应的萜类化合物。在不同诱导条件下,植物体内HMGR基因的表达水平呈上升趋势,同时发现其对应的倍半萜类物质生成量也随之显著提高,表明其含量变化与HMGR活性呈正相关[12-13]。此外,利用转基因技术将HMGR基因转化目标植物能提高有效成分的产量[10-11]。
目前,对生姜根茎中倍半萜类物质的提取和鉴定研究报道较多[14-15]。但尚未见对生姜倍半萜的生物合成途径中关键基因的分子调控机制的研究报道。因此,解析关键基因在生姜倍半萜物质的生物合成途径调控作用,能为揭示其辛香品质形成分子调节机制的奠定基础。笔者在课题组利用最新的转录组测序技术对生姜(竹根姜品种)不同组织的转录组进行了鉴定分析。笔者在此研究的基础上,经过进一步的序列比对和分析,采用RT-PCR的方法克隆竹根姜ZoHMGR基因的全长序列,并分析其在不同组织中及叶组织诱导条件下的表达特性与其对应的倍半萜物质含量变化情况,为后续深入研究其在竹根姜倍半萜物质合成途径的分子调控机制奠定基础。
1 材料与方法
1.1 试验材料
重庆文理学院花卉研究所大棚栽培的当年生竹根姜的根、茎、嫩叶及根状茎。
1.2 RNA处理及倍半萜物质的提取
提取总RNA和分离倍半萜物质,检测ZoHMGR基因的组织表达特异性和倍半萜物质含量特性。对竹根姜当年生嫩叶进行机械伤害和茉莉酸甲酯处理,分别于处理后2h、4h、6h、8h、12h 和6h、12h、24h取样,用于提取相应的总RNA,检测目的基因在不同处理条件下的表达差异。以吐温-80为助溶剂,配制20μmol/L浓度的溶液[16]。对叶中表达量最高时6h和12h,取样收集倍半萜物质,用GC-MS鉴定和分析倍半萜类物质[17]。
1.3 ZoHMGR基因全长的分离
根据序列分析的ZoHMGR基因的ORF序列,利用Primer 5.0软件设计1对全长引物:F(5′-AC CACCATGTACCTCCGTCGTC-3′)和R(5′-GAT CGGTTAGGGGGCAACTTTG-3′),以反转录的单链cDNA为模板,PCR验证拼接序列的正确性。扩增产物电泳检测、回收、克隆和测序验证[17]。
1.4 ZoHMGR的相关生物信息学分析
目的基因编码蛋白的理化性质预测采用ExPASy Proteomics Server提供在线工具Protparam (http://www.expasy.ch/tools/protparam.html)进行,采用TMHMM 2.0软件进行跨膜结构域预测,同时采用SWISS-MODEL(http://swissmodel.expasy.org/)的保守结构域作图工具中,以人类的HMGR (PDB No.:2q6bA)为参照对象,对ZoHMGR编码蛋白进行三维结构建模。
1.5 ZoHMGR的进化树分析
将ZoHMGR与GenBank中19种不同物种,包括12种植物的HMGR蛋白进行比对,进行进化树和聚类关系的分析,进一步通过MEGA 4软件分析构建Neighbor-joining系统进化树。
1.6 实时荧光定量PCR(real-time PCR)
利用荧光定量PCR分析检测目的基因在不同组织及叶组织中不同伤害处理下的表达量。荧光引物:F(5′-GCGTAAAGGGTGCAAACC-3′)和R(5′-CCTCCCATCACAGCTATAAAC-3′)。PCR反应以生姜肌动蛋白基因(ZoActin)为内参引物:F(5′-CTTGCTGGTCGTGATCTTACAG-3′)和R(5′-GAAAAGAACCTCTGGGCATCTA-3′)引物[17]。
2 结果与分析
2.1 ZoHMGR基因全长cDNA的克隆和序列
在竹根姜的转录组数据中有不同转录本被注释为HMGR基因。经序列分析和比对发现,该数据能组装成含有1个完整的开放阅读框(open reading frame,ORF)。经扩增获得1条长为1 695bp的序列,测序结果与拼接序列完全一致。将该基因命名为ZoHMGR,该基因与已经克隆姜科植物阳春砂的AvHMGR的蛋白同源性为86%。经BLAST显示,该蛋白与其他物种的HMGR家族蛋白具有较高的同源性,ZoHMGR与海枣(Phoenix dactylifera)、高粱(Sorghum bicolor)、烟草(Nicotiana tabacum)和葡萄(Vitis vinifera)中HMGR蛋白分别有78%、75%、68%和68%的相似性。ZoHMGR与其他物种的HMGRs相同,均具有HMG-CoA结合基序和2个NADP(H)结合基序(图1)。其中,TTEGCLVA的谷氨酸(G)对HMGR蛋白的催化作用至关重要。ZoHMGR起催化作用的活性中心是其功能主要作用部位,在高等植物中具有很高的保守性。

图1 ZoHMGR与其他物种HMGR合成酶基因的氨基酸序列Fig.1 The amino acid sequence of ZoHMGRand HMGR from other species
2.2 ZoHMGR的生物信息学性质
2.2.1 理化性质ZoHMGR蛋白质的分子式为C2631H4263N719O799S26,分子量为59.58kD,等电点pI为6.23。负电残基(Asp+Glu)为54,带正电残基(Arg+Lys)为51。表明,该蛋白的不稳定系数为46.37,脂肪系数为101.39,亲水性系数为0.183。2.2.2跨膜区及三维结构预测 该蛋白含有2个跨膜螺旋结构,分别位于31~53位和74~96位氨基酸间。由图2可见,ZoHMGR编码的蛋白与新智人类的HMGR具有53.6%的序列同一性的类似空间结构。
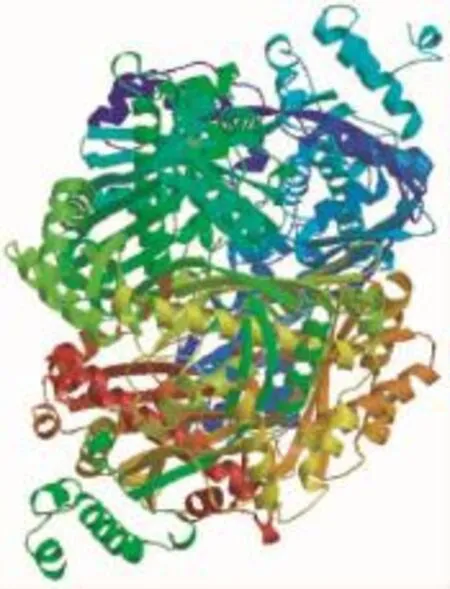
图2 生姜ZoHMGR编码蛋白的三级结构Fig.2 The tertiary structure of ZoHMGRencoded protein
2.2.3 信号肽、亚细胞定位及跨膜区ZoHMGR蛋白自身不具有信号肽。绿体定位系数为10.0 (chlo:9.0);内质网定位系数为3.0(E.R.:3.0),表明该蛋白最可能定位在叶绿体或内质网上。该基因编码蛋白具有2个跨膜区的结构。
2.2.4 分子系统进化树 由图3可见,目的蛋白与姜科植物阳春砂(A.villosum)的HMGR聚为一类[18],说明二者的亲缘关系最近,和高粱等同属于单子叶植物一类。
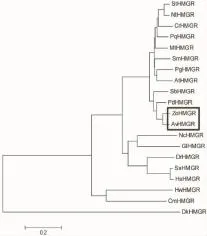
图3 生姜ZoHMGR与其他物种HMGR合成酶基因系统进化树分析Fig.3 The phylogenetic tree of ZoHMGR and HMGR from other species
2.3 ZoHMGR基因不同组织表达的特异性
由图4A可见,目的基因在根状茎中的表达量最高,其次为叶、在茎和根中表达最低。结合其不同组织中倍半萜物质的总含量(图4B),说明ZoHMGR可能主要在根状茎中发挥基因自身的生物学功能。

图4 不同组织中ZoHMGR基因表达量和倍半萜物质含量Fig.4 Expression of ZoHMGRand sesquiterpenes content in different tissues
2.4 ZoHMGR基因响应不同伤害处理的表达特性
正常生长的竹根姜叶组织中,只含有少量的倍半萜物质,当受到外界伤害后生成一定量的倍半萜类物质(图5)。由图5A表明,ZoHMGR基因均能受机械伤害和茉莉酸甲酯处理的诱导,且二者呈现相似的诱导表达模式。但经机械伤害,目的基因表达升高较快,且在6h时达最高的表达水平,而后呈现缓慢下降趋势,但仍高于对照条件下的表达量;茉莉酸甲酯处理对ZoHMGR基因的诱导时间比物理伤害迟,表达在12h时到最大,然后保持较高的水平。

图5 叶组织中不同条件处理下ZoHMGR基因表达量和倍半萜物质含量Fig.5 Expression of ZoHMGRand sesquiterpenes content in leaves under different treatments
3 结论与讨论
生姜倍半萜类物质是其辛香品质形成的主要成分之一,解析生姜倍半萜类物质合成途径中关键基因的功能及其调节机制,是阐明其辛香品质形成机制和建立分子调控机制的基础。高通量测序技术是对富含次生代谢物质的非模式植物中调控次生代谢合成关键基因挖掘的有效手段之一,在诸多研究中已有报道,如积雪草和沉香[19-20]。本课题组前期对竹根姜不同组织进行了转录组测序和分析,从中获得大量倍半萜合成途径中关键合成酶基因的相关序列。而HMGR基因是植物萜类合成中甲羟戊酸途径的第1个关键限速酶,R决定“碳硫”的流向。本研究根据测序得到的HMGR基因的部分转录本信息,成功从竹根姜根茎中克隆了1个HMGR基因的全长cDNA(ZoHMGR),同时对其进行相关的生物信息学分析。结果表明,竹根姜的ZoHMGR和其他植物中HMGR具有较高的同源性和相类似的理化特性,说明克隆获得的目的基因属于HMGR基因家族。目前已发现欧榛、银杏和丹参等多种植物,在HMGR的氨基酸序列中包含2个HMGHMG-CoA结合基序和2个NADP(H)结合基序;这4个区域在HMGR蛋白中具有重要功能并高度保守[11,13]。在基因组水平上对玉米、雷蒙德氏棉、杨树和大豆等物种的HMGR基因进行研究发现,HMGR基因家族的功能和进化上在植物界中相当保守[21]。
大量研究表明,植物中HMGR基因的表达具有组织器官特异性,且这些组织中含有大量相关的萜类物质,特别是在重要药食两用植物丹参、甘草和红豆杉中[9-11,20-21]。ZoHMGR组织表达分析显示,该基因在根茎中表达量最高,其次在叶组织中低表达,而在根和茎中表达量最低,说明ZoHMGR可能主要在生姜的根茎和叶组织中发挥其本身的生物学功能,这也与生姜倍半萜类物质的形成部位特性相符[3,15],推测其可能与倍半萜物质的形成相关。植物的HMGR基因通常受到细胞和环境信号的调节,如光照、植物激素、病菌及外部伤害[22]。人参HMGR的启动子活性在拟南芥中能被黑暗处理诱导[23]。生姜根茎的生长通常在黑暗条件下,其倍半萜物质的合成与大戟的抗肿瘤和丹参的丹参酮等相关萜类物质主要在根中存在[10-11],而人参的三萜类物质人参皂苷主要在根组织中[23],表明在黑暗条件下能诱导植物的HMGR参与相关萜类物质的合成。
在正常生长的姜科植物白姜花的叶组织只有少量倍半萜类物质,只有受到伤害后才能被诱导产生大量的倍半萜类物质,同时倍半萜途径中另一关键基因的HcFPPS受机械伤害和虫害的诱导表达,表明HcFPPS在叶组织中可能起一定的生态功能[17]。本研究采用典型的物理伤害两种方法处理健康的叶组织,检测目的基因在叶组织中的表达变化情况时发现,ZoHMGR基因和其对应的倍半萜物质生成显著受这2种伤害的诱导,该研究结果能进一步揭示目的基因在竹根姜的倍半萜类物质形成中可能参与调控作用。在其他植物中,如白木香的AsHMGR1与AsHMGR2同样具有相似的组织表达和诱导表达特异性,且与其目的萜类物质的生产对应,说明二者可能共同协调其生长发育和次生代谢物质合成[24-25]。本研究为进一步鉴定ZoHMGR基因在竹根姜倍半萜合成中的调控机制及后续分子育种奠定基础。
[1]李录久,刘荣乐,陈 防,等.生姜的功效及利用研究进展[J].安徽农业科学,2009,37(30):14656-14657.
[2]Onyenekwe P C,Hashimoto S.The composition of the essential oil of dried Nigerian ginger(Zingiber officinale Roscoe)[J].Eur Food Res Technol,1999,209:407-410.
[3]Pino J A,Marbo R,Rosado A,et al.Chemical composition of the essential oil of Zingiber officinale Roscoe L.from Cuba[J].Journal of Essential Oil Research,2004,16(3):186-188.
[4]Natalia D,Susanna A,Irina O,et al.The nonmevalonate pathway supports both monoterpene and sesquiterpene formation in snapdragon flowers[J].Proc Natl Acad Sci USA,2005,102:933-938.
[5]Aule O,Furholz A,Chang H S,et al.Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynthesis in Arabidopsis thaliana[J].Proc Natl Acad Sci USA,2003,100:6866-6871.
[6]Huang M S,Abel C,Sohrabi R,et al.Variation of Herbivore-Induced Volatile Terpenes among Arabidopsis Ecotypes Depends on Allelic Differences and Subcellular Targeting of Two Terpene Synthases,TPS02and TPS03[J].Plant Physiology,2010,153:1293-1310.
[7]Chappell J,Wolf F,Proulx J,et al.Is the reaction catalyzed by 3-hydroxy-3-methylglutaryl coenzyme A reductase a rate-limiting step for isoprenoid biosynthesis in plants[J].Plant Physioly,1995,109(4):1337-1343.
[8]Aquil S,Husaini A M,Abdin M Z,et al.Overexpression of the HMG-CoA reductase gene leads to enhanced artemisinin biosynthesis in transgenic Artemisia annua plants[J].Planta,2009,75:1453-1458.
[9]Venkatachalam P,Priya P,Jayashree R,et al.Molecular cloning and characterization of a 3-hydroxy-3-methylglutaryl-coenzyme A reductase1(hmgr1)gene from rubber tree(Hevea brasiliensis Muell.Arg.):a key gene involved in isoprenoid biosynthesis[J].Physiol Mol Biol Plants,2009,15:133-143.
[10]Cao X Y,Zong Z M,Ju X Y,et al.Molecular cloning,characterization and functional analysis of the gene encoding HMG-CoA reductase from Euphorbia pekkinensis Rupr[J].Molecular Biology Reports,2010,37:1559-1567.
[11]Dai Z B,Cui G H,Zhou S F,et al.Cloning and characterization of a novel 3-hydroxy-3-methylglutaryl-coenzyme A reductase gene from Salvia miltiorrhiza involved in diterpenoid tanshinone accumulation[J].J Plant Physioly,2011,168:148-157.
[12]Alam P,Abdin M Z.Over-expression of HMG-CoA reductase and amorpha-4,11-diene synthase genes in Artemisia annua L.and its influence on artemisinin content[J].Plant Cell Rep,2011,30:1919-1928.
[13]Wang Y Y,Jing F Y,Yu S Y,et al.Co-overexpression of the HMGR and FPS genes enhances artemisinin content in Artemisia annua L[J].J Med Plants Res,2011,5:3396-3403.
[14]林 茂,阚建全.鲜姜和干姜精油成分的GC-MS研究[J].食品科学,2008,29(1):283-285.
[15]熊运海,彭小平.不同产地生姜挥发油共有成分的气-质联用及化学计量学分析[J].食品科学,2013,34 (16):288-292.
[16]魏洁书,杨锦芬,凌 敏,等.茉莉酸甲酯调控阳春砂HMGR,DXR和DXS基因表达[J].广州中医药大学学报,2013,30(1):88-92.
[17]Lan J B,Yu R C,Yu Y Y,et al.Molecular cloning and expression of Hedychium coronarium farnesyl pyrophosphate synthase gene and its possible involve-ment in the biosynthesis of floral and wounding/herbivory induced leaf volatile sesquiterpenoids[J].Gene,2013,518:360-367.
[18]杨锦芬,何国振,阿迪卡利,等.阳春砂3-羟基-3-甲基戊二酰辅酶A还原酶基因的克隆及分析[J].时珍国医国药,2010,21(8):1893-1897.
[19]Rajender S S,Sandhya T J.De novosequencing and assembly of Centella asiatica leaf transcriptome for mapping of structural,functional and regulatory genes with special reference to secondary metabolism[J].Gene,2013,525:58-76.
[20]刘雨佳,张夏楠,程琪庆,等.药用植物萜类生物合成HMGR基因研究进展[J].中国中药杂志,2013,38 (19):3226-3233.
[21]Li W,Liu W,Wei H L,et al.Species-Specific Expansion and Molecular Evolution of the 3-hydroxy-3-methylglutaryl Coenzyme A Reductase(HMGR)Gene Family in Plants[J].PLOS ONE,2014,9:1-10.
[22]Stermer B A,Bianchini G M,Korth K L.Regulation of HMG-CoA reductase activity in plants[J].J Lipid Res,1994,35:1133-1140.
[23]Kim Y J,Lee O R,Oh J Y,et al.Functional analysis of 3-hydroxy-3-methylglutaryl coenzyme A reductase encoding genes in triterpene saponin producing ginseng[J].Plant Physiology,2014,165(1):373-387.
[24]Xu Y H,Zhang Z,Wang M X,et al.Identification of genes related to agarwood formation:transcriptome analysis of healthy and wounded tissues of Aquilaria sinensis[J].BMC Genomics,2013,14:227-243.
[25]Song A A-L,Abdullah J O,Abdullah M P,et al.Overexpressing 3-Hydroxy-3-Methylglutaryl Coenzyme A Reductase(HMGR)in the Lactococcal Mevalonate Pathway for Heterologous Plant Sesquiterpene Production[J].PLOS ONE,2012,109:e51444.
(责任编辑:刘忠丽)
Cloning and Expression of ZoHMGR(a Key Gene for Synthesis of Spicy Substance)in Zingiber officinale
ZHANG Shaobin1,TANG Haiqin1,CHEN Debi1,LAN Jianbin2*
(1,College of Life Science &Forestry,Chongqing University of Arts and Science,Chongqing402160;2,Institute of Characteristics Plant,Chongqing University of Arts and Science,Chongqing 402160,China)
The bioinformatics of full-length cDNA of ZoHMGR cloned by RT-PCR technology according to different transcript sequence of HMGR in the transcriptome database is analyzed.The expression characteristics of the target gene in different tissues and leaf of Zingiber officinale is detected by real-time PCR under different induction conditions and the synthetic sesquiterpene material is determined to explore the regulating effect of 3-Hydroxy-3-methylglutaryl-coenzyme A reductase(HMGR)in sesquiterpene synthesis of Zingiber officinale.Results:The cloned ZoHMGRhas 562amino acids,which is close to Amomum villosum.ZoHMGRexpresses in rhizome mainly,followed by leaves.The expression quantity of ZoHMGRin stem and roots is minimum,which accords with the characteristics of sesquiterpenes content in different tissues of Zingiber officinale.The maximum expression level of ZoHMGRtreated by wound and MeJA induction is at 6hand 12hrespectively and the sesquiterpenes material is synthesized at the same time.
Zingiber officinale;sesquiterpenes;HMGRgene
S632.5
A
1001-3601(2016)08-0344-0076-04
2016-03-03;2016-07-30修回
重庆市教委项目“利用转录组测序挖掘合成生姜辛香和辛辣品质次生代谢物质关键基因”(KJ1401104);重庆文理学院校级项目“生姜辛香和辛辣品质相关的次生代谢物质测定与分析”(Z2013LX13);重庆文理学院校级人才引进项目“生姜辛香品质形成的分子调控机制”(R2012LS02)
张绍彬(1983-),男,助理实验师,硕士,从事园艺植物品质分析研究。E-mail:232400209@qq.com
*通讯作者:兰建彬(1979-),男,副教授,博士,从事植物次生代谢分子生物学研究。E-mail:lanjb1013@163.com
