葡萄杂交后代抗炭疽病筛选鉴定
2016-07-02高晓铭樊秀彩张国海姜建福孙海生刘崇怀
高晓铭,樊秀彩,张国海,张 颖,姜建福,孙海生,刘崇怀
(1. 河南科技大学 林学院,河南洛阳 471000 ;2. 中国农业科学院 郑州果树研究所,郑州 450009)
葡萄杂交后代抗炭疽病筛选鉴定
高晓铭1,樊秀彩2,张国海1,张颖2,姜建福2,孙海生2,刘崇怀2
(1. 河南科技大学 林学院,河南洛阳471000 ;2. 中国农业科学院 郑州果树研究所,郑州450009)
摘要探讨葡萄炭疽病的抗性鉴定方法,对杂交后代的抗性单株进行有效选择,可以服务于葡萄炭疽病抗性育种。选用对葡萄炭疽病具有较高抗性的中国野生刺葡萄‘黑珍珠’和对葡萄炭疽病敏感的欧亚种葡萄‘里扎马特’为亲本进行远缘杂交,获得杂交群体,分别用离体叶片、果实、果实浸提液3种材料,采用不同接种方法,对亲本材料和杂交后代单株的炭疽病抗性进行鉴定。结果表明,菌液接种法更适用于葡萄叶片和果实的抗性鉴定;φ=70%乙醇或丙酮均可作为浸提剂用于果实浸提液的抗性鉴定。后代群体中对葡萄炭疽病的高抗、抗、中抗、敏感以及高感单株的比例分别30.77%、35.90%、12.82%、15.38%、5.12%。
关键词葡萄;葡萄炭疽病;抗性;鉴定方法
葡萄是世界上种植面积最广的果树之一,也是中国栽培最广泛的果树之一[1]。2012年中国葡萄栽培面积已达55.2万hm2,葡萄产量843万t[2]。葡萄炭疽病是危害葡萄生产的四大病害之一,严重影响葡萄的质量及产量[3-4],一般造成葡萄减产10%~20%[5]。葡萄炭疽病在夏季危害严重,主要在着色期或成熟期的果实上发生,葡萄进入着色期开始盛发,高温多雨的年份和地区发病严重,病穗率高达50%~70%[6],高湿环境持续时间越长病情越严重[7]。炭疽病是一种真菌性病害,引起葡萄炭疽病的是胶胞炭疽菌[C.gloeosporioides( Penz.) Sacc.],其菌落多变,主要以分生孢子侵染[8]。目前,对葡萄炭疽病防治多用化学药剂防治。葡萄资源中不乏抗炭疽病的种质资源,因此,选育抗性品种是根本的解决途径,也是防治该病最经济、有效、安全的方法。
品质优良的欧亚种和欧美杂交种葡萄是中国主要的栽培种类,但其对葡萄炭疽病的抗性较弱[9]。而中国野生葡萄资源相当丰富,前人的研究表明,这些野生种蕴含大量宝贵的抗性资源[10]。中国原产的野生葡萄中刺葡萄、毛葡萄、山葡萄、华东葡萄、蘡薁葡萄对炭疽病有很强的抗性[11],但这些抗病的野生葡萄品质低劣,不宜直接利用。本研究选用野生刺葡萄‘黑珍珠’与品质优异的欧亚种‘里扎马特’进行种间杂交,以期得到炭疽病抗性强的优质杂交新品种或新材料,同时摸索出一套适合葡萄炭疽病抗性鉴定的方法。
1材料与方法
1.1材 料
1.1.1试验材料材料均采自郑州果树研究所国家果树种质葡萄资源圃,亲本‘黑珍珠’‘里扎马特’及其杂交后代,对照品种‘巨峰’‘美人指’‘洪江刺09’及‘刺葡萄雄株’。
叶片抗性鉴定材料:选取试验品种健康枝条中上部的成熟叶片。
果实抗性鉴定材料:果实成熟期,选择大小一致的健康果实,进行离体果实抗性鉴定。
果实浸提液抗性鉴定材料:成熟果实,去皮去籽,果肉保存于-80 ℃备用。
1.1.2病菌培养葡萄炭疽病病原菌(胶胞炭疽菌)由北京市农林科学院植物保护环境保护研究所李兴红研究员惠赠,胶胞炭疽菌菌种编号为GZAASS.08601。菌种在4 ℃保存备用,在-80 ℃长期保存。将病菌接种于PDA固体培养基上,28 ℃下黑暗培养,待菌丝布满后,用接种针划伤菌丝促进产生孢子。
1.1.3菌液制备在产生孢子的培养皿中加入适量无菌水,淹没菌丝体静置10 min,再用灭菌的接种环在菌丝表面轻轻来回刮动,使游动孢子充分释放到水中,将孢子悬浮液吸到三角瓶中,用血球计数板测定每毫升孢子悬浮液中的孢子数。将制备的孢子悬浮液稀释至孢子数为104~105mL-1后用于叶片和果实接种鉴定,稀释至孢子数为103~104mL-1后用于果实浸提液接种鉴定。
1.2叶片抗性鉴定
1.2.1菌饼接种法参考张颖等[9]的方法并进行改良。选取健康叶片,每个处理3个叶片,正面刺伤(避开叶片主脉),菌饼分别接种刺伤处,每个叶片接种4~6处,分布于叶片的不同位置。在28 ℃恒温培养箱黑暗培养,24 h调查1次。以接种120 h后的病斑大小为鉴定数据。
1.2.2菌液接种法参考沈会芳等[12]的方法并进行改良。选取健康叶片,清水冲洗后用φ=70%酒精擦拭一遍,自然晾干后用于接种,每个处理3个叶片。对叶片进行正面一针刺伤,刺伤时避开叶片主脉。在刺伤处滴30 μL孢子菌悬液,每个叶片接种4~6处,置于28 ℃恒温培养箱黑暗培养,每隔24 h调查1次,以接种120 h后的病斑大小为鉴定数据。
1.2.3病斑纯化鉴定切取叶片上的病斑组织,用w=0.5%次氯酸钠溶液短时浸泡,然后在PDA培养基上进行纯化培养。纯化培养至产生孢子,观察孢子形态,确认是否胶胞炭疽菌引起炭疽病所致的病斑。
1.3果实抗性鉴定
1.3.1菌液接种法参考赵远征等[13]的方法并进行改良。用清水冲洗果实,再放入φ=70%乙醇溶液中浸泡1 min进行表面快速消毒,在超净工作台晾干。每个单株的果实30粒左右,在果实表面喷洒孢子悬浮液。置于28 ℃黑暗培养,48 h调查1次,以接种144 h后的病斑大小为鉴定数据。
1.3.2涂抹接种法对果实进行表面快速消毒,用接种环刮取病菌涂抹于果实表面,用滤纸进行保湿,置于28 ℃恒温培养箱黑暗培养,每隔48 h调查1次,以接种144 h后的病斑大小为鉴定数据。
对果实抗性进行鉴定,在保湿条件下,部分葡萄果实易裂果,因此2种接种方法均每12 h对滤纸喷1次水,保持沾湿但不滴水状态,以保证在满足湿度要求的条件下不发生裂果。
1.4果实浸提液抗性鉴定
1.4.1果实浸提液的提取称取5 g超低温保存的果肉,加入等量浸提剂,浸提剂分别为φ=70%乙醇、丙酮,室温下浸提24 h,离心弃去残渣,取上清液。通过旋转蒸发仪将上清液浓缩,制成浓缩原液,即1 mL提取液中含有1 g试验材料的提取物,4 ℃冰箱保存备用。
1.4.2处理方法用滤纸片扩散法进行鉴定。用打孔器将滤纸片制成直径6 mm的圆形滤纸片,121 ℃高温灭菌,用于滤纸片扩散鉴定。在无菌培养皿中加入融化的PDA培养基15 mL,凝固待用。移液枪吸取孢子数为103~104mL-1的孢子悬浮液200 μL,加入平板培养基,涂布均匀待用。
将已灭菌的圆形滤纸片在果实浸提液中完全浸透,再将滤纸片放置到接种菌液的培养基上,每个培养基放置3个,使其均匀分布。每个品种设置3个重复。以只接种菌液的培养基为对照,28 ℃黑暗培养。接种48 h后,观测并记录抑菌圈直径,取平均值,作为浸提液抗性鉴定数据。
1.5抗性分级标准的制定
根据鉴定结果分别根据叶片、果实、果实浸提液发病情况划分抗性等级。
2结果与分析
2.1不同接种方法比较分析
2.1.1叶片上不同接种方法比较炭疽病是葡萄果实的主要病害,在叶片上也有发生。采用菌液接种法和菌饼法接种法对‘里扎马特’和杂交单株‘7-1-4’的叶片进行接种鉴定,从感染的病斑可明显看出,在同一品种叶片上,菌液接种法发病病斑大小较为均匀一致,而菌饼法接种的同一品种的同一叶片上病斑大小不够均匀(图1)。因此,利用葡萄叶片作为材料进行抗炭疽病鉴定,采用叶片菌液接种法较为适宜。
利用菌饼法在欧亚种品种‘里扎马特’和刺葡萄品种‘黑珍珠’的叶片上接种炭疽病病原菌,2个品种叶片产生的病斑大小的组内方差值远大于菌液法,表明菌饼法接种,一组重复内的病斑大小差异显著,影响对抗性等级的划分和抗性程度的判断。菌液法接种引起的病斑在一组重复内差异不显著,更适宜于叶片炭疽病抗性鉴定(表1)。

图1 菌饼接种法(A1、B1)与菌液接种法(A2、B2)叶片发病情况
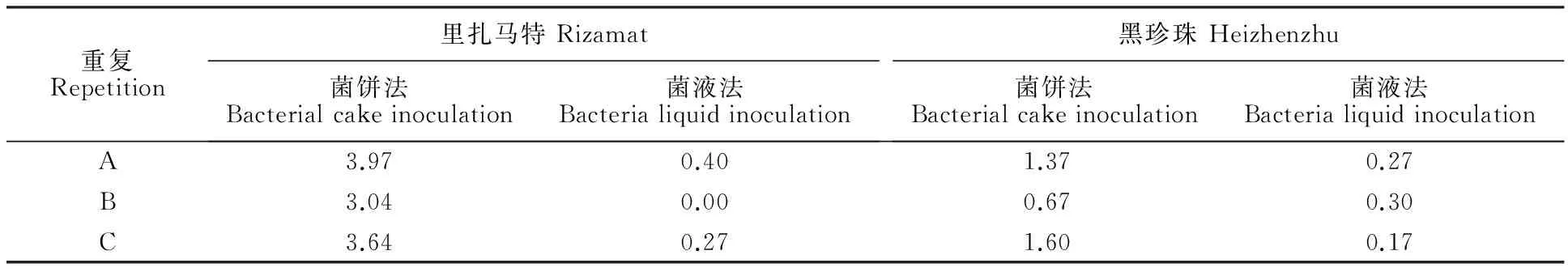
重复Repetition里扎马特Rizamat菌饼法Bacterialcakeinoculation菌液法Bacterialiquidinoculation黑珍珠Heizhenzhu菌饼法Bacterialcakeinoculation菌液法BacterialiquidinoculationA3.970.401.370.27B3.040.000.670.30C3.640.271.600.17
注:每重复内病斑大小的方差值越大,则重复内差异越大,反之差异越小。
Note:The greater the variance values of disease spot size within each repetition,the greater the difference,on the contrary,the smaller the difference.
2.1.2果实上不同接种方法比较在果实上采用菌液接种法和涂抹接种法进行接种,接种48 h后果实均没有表现明显发病症状;接种96 h后和接种144 h后,一部分不发病的果实,2种接种方法均不发病;另一部分果实显现出发病症状,且用2种方法接种的同一单株的果实发病病斑均匀一致。利用葡萄果实为炭疽病抗性鉴定材料,这2个接种方法均能诱发葡萄果实发病,致病力相同。但菌液法操作更为简便,且在接种以后培养阶段更易控制湿度。因此,利用葡萄果实作为材料进行抗炭疽病鉴定,采用果实菌液接种法较为适宜。
2.1.3不同浸提剂提取的果实浸提液抗性鉴定结果比较使用φ=70%乙醇、丙酮作为浸提剂分别提取‘里扎马特’‘黑珍珠’‘7-1-1’‘7-1-6’‘7-1-9’‘7-1-2’‘7-3-2’‘7-3-3’果实获得浸提液,进行抑菌试验,其浸提液的抑菌圈直径差异不显著,同一品种的不同浸提液表现出相同的抑菌效果。不同抗性品种之间,表现出不同抑菌效果,‘里扎马特’‘7-1-6’‘7-3-2’没有产生抑菌圈,对葡萄炭疽病病原菌没有抗性;‘黑珍珠’‘7-1-1’‘7-1-9’‘7-1-2’‘7-3-3’均产生大小不同的抑菌圈,表现出对葡萄炭疽病病原菌不同程度的抗性(图2)。用φ=70%乙醇或丙酮作为浸提剂提取果实均可对其浸提液进行炭疽病抗性的鉴定。
2.2抗性鉴定结果
对亲本、对照品种和杂交后代群体,分别采用叶片菌液接种法、果实菌液接种法和果实浸提液抑菌圈试验法进行炭疽病抗性鉴定。根据鉴定结果制定抗性鉴定标准,并对后代群体进行葡萄炭疽病抗性分级。
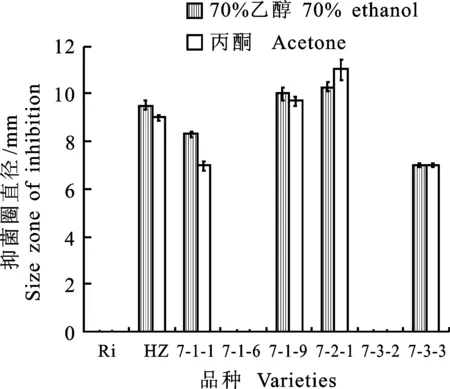
Ri.里扎马特 Rizamat;HZ. 黑珍珠 Heizhenzhu
2.2.1抗性分级标准以接种120 h后的病斑大小为鉴定数据,根据亲本、对照品种、后代群体的叶片鉴定结果划分其抗性等级。叶片葡萄炭疽病抗性分级标准见表2。
以接种144 h后的病斑大小为鉴定数据,根据亲本、对照品种、后代群体的果实鉴定结果划分果实葡萄炭疽病抗性等级。果实葡萄炭疽病抗性分级标准见表3。
以接种48 h后的抑菌圈直径为鉴定数据,根据亲本、对照品种、后代群体的果实浸提液鉴定结果划分其抗性等级,抗性分级标准见表4。

表2 叶片葡萄炭疽病抗性分级标准

表3 果实葡萄炭疽病抗性分级标准

表4 果实浸提液葡萄炭疽病抗性分级标准
2.2.2鉴定结果及分析根据叶片、果实、果实浸提液对葡萄炭疽病的抗性分级标准,对后代群体的抗性等级进行划分。鉴定结果显示叶片炭疽病抗性鉴定结果与果实炭疽病抗性鉴定结果一致性达到95.45%(表5)。这一结果表明,叶片的炭疽病抗性鉴定结果与果实炭疽病的抗性鉴定结果较为一致。叶片抗性鉴定与果实浸提液的抗性鉴定结果基本一致,仅在‘7-1-1’‘7-3-3’和‘7-1-9’单株上的抗性等级有所不同(表6)。
对‘里扎马特’和‘黑珍珠’的杂交后代进行叶片炭疽病抗性鉴定,后代群体中对葡萄炭疽病的高抗(HR)单株、抗性(R)单株、中抗(MR)单株、敏感(S)单株以及炭疽病高感(HS)单株分别占参试群体的30.77%、35.90%、12.82%、15.38%、5.12%,后代群体对葡萄炭疽病的不同抗性等级表现为连续分布。

表5 叶片和果实对葡萄炭疽病的抗性鉴定结果

表6 浸提液对葡萄炭疽病的抗性鉴定结果
3讨 论
在筛选葡萄抗炭疽病单株的过程中,合适的鉴定材料和有效的抗性鉴定方法是抗性育种的关键。葡萄炭疽病抗性的研究多采用离体果实进行鉴定[12-13],有研究发现葡萄炭疽病菌不仅侵染浆果,也可以侵染葡萄的当年生绿色组织[14]。因此,本研究用叶片、果实、果实浸提液分别进行葡萄炭疽病抗性鉴定,结果显示,叶片的抗性鉴定结果与果实、果实浸提液炭疽病的抗性鉴定结果较为一致,叶片鉴定结果具有一定代表性。并且采用离体接种叶片的鉴定方法快速、易操作,因此,可用叶片作为葡萄炭疽病抗性鉴定的材料。
叶片作为抗病性鉴定材料时,常用的鉴定方法有菌饼接种法[9,15]和菌液接种法[12,16]。本研究对2种方法进行比较,发现在同一品种叶片上,用菌液法接种比用菌饼法接种的叶片发病病斑均匀。虽然接种叶片所用菌饼来自同一菌种培养皿,但无法保证各菌饼的带菌量完全一致,进而导致不同菌饼块的致病力不同,这可能是造成同一叶片上的病斑大小不均匀的原因之一。因此,菌液法更适用于葡萄叶片和果实的抗性鉴定。
对‘里扎马特’和‘黑珍珠’及其杂交后代进行叶片炭疽病抗性鉴定,杂交后代抗性不同等级的连续分布表现出数量性状遗传的特征,因此,推测葡萄炭疽病抗性是由多基因控制的,杂交后代群体的炭疽病抗性主要取决于炭疽病抗性强的野生刺葡萄‘黑珍珠’,同时也受炭疽病敏感的欧亚种‘里扎马特’的影响。这一研究结果与田莉莉等[17]认为葡萄炭疽病抗性是由多基因控制的,且在野生种中存在抗炭疽病的主效基因,在欧亚种中存在抗性的微效基因的观点一致。
张军科等[18]在研究葡萄白粉病抗性中发现,感病品种表皮组织排列较疏松,抗性品种表皮栅栏组织和海绵组织排列紧密,因此,推测不同品种叶片表面的蜡质层,以及叶片解剖结构的不同可能在不同程度上影响叶片的抗病性。姜建福等[19]研究表明,中国野生葡萄的许多种在叶片组织紧密度等方面均高于北美种群的河岸葡萄和沙地葡萄,具有更高的抗性基础。然而Waqar等[20]在用葡萄叶片提取液抑制某些致病菌株的试验中发现,叶片提取液中含有抗菌物质。本试验中叶片经过一针轻刺伤处理,刺伤可能会破坏表皮组织结构削弱其对炭疽病菌的免疫力。而研究结果表明叶片抗性鉴定结果与果实、果实浸提液抗性鉴定结果无显著差异,因此推测,参试种质叶片的炭疽病抗性不仅与其表皮结构有关,也可能与其内部免疫物质有关。
王跃进等[21]研究表明,刺葡萄果实的表皮细胞层和角质层明显厚于欧洲葡萄品种‘佳利酿’,而且野生种葡萄表皮细胞排列紧密,有利于保护其免受病菌侵染。余旦华等[22]在研究葡萄果皮微结构和抗炭疽病之间的关系过程中发现,果皮的小孔密度与感染炭疽病的程度呈显著直线正相关关系。在本研究果实鉴定中发现,有果粉且果皮较厚的后代株系对炭疽病抗性较强,而果皮较薄、易裂果的后代株系抗性较弱。由此推测,特殊的果皮结构可能会提高果实对葡萄炭疽病病菌的免疫能力。
参考文献Reference:
[1]SUNG K H,WAN G K,HAE K Y,etal.Morphological variations,genetic diversity and pathogenicity ofColletotrichumspecies causing grape ripe rot in Korea[J].ThePlantPathologyJournal,2008,24(3):269-278.
[2]孙兆军.中国葡萄栽培面积已达55.2万公顷[J].中国果业信息,2012,29(1):53.
SUN ZH J.Grape cultivation in China has reached 552 000 hectares[J].ChinaFruitNews,2012,29(1):53(in Chinese).
[3]尚晶晶.中国葡萄炭疽病病原菌的鉴定及种群分化的研究[D].内蒙古:内蒙古农业大学,2010.
SHANG J J.Indentification and pulation differentiation of pathogen caused grape anthracnose in China[D].Inner Mongolia:Inner Mongolia Agricultural University,2010(in Chinese).
[4]ALLEWELDR G,POSSINGHAM J V.Progress in grapevine breeding[J].TheoreticalandAppliedGeneties,1988,75(5):669-673.
[5]WHARTON P S,SCHILDER A C.Novel infection strategies ofColletotrichumacutatumon ripe blueberry fruit[J].PlantPathology,2008,57(1): 122-134.
[6]赵奎华.葡萄病虫害原色图鉴[M].北京:中国农业出版社,2012:9-13.
ZHAO K H.A Color Atlas of Grape Diseases and Pests[M].Beijing:China Agriculture Press,2012:9-13(in Chinese).
[7]毛爱军,胡洽,耿三省.辣椒炭疽病抗病性鉴定技术及利用[J].华北农学报,2004,19(2):87-91.
MAO A J,HU Q,GENG S SH.Studies on the inoculation technique for resistant varieties of pepper to anthraenose and the application[J].ActaAgriculturaeBorea-sinica,2004,19(2):87-91(in Chinese with English abstract).
[8]SUTTON B C.Colletotrichum:Biology,Pathology,and Control[M].UK:CAB International,Wallingford,1992:1-26.
[9]张颖,孙海生,樊秀彩,等.中国野生葡萄资源抗白腐病鉴定及抗性种质筛选[J].果树学报,2013(2):191-196.
ZHANG Y,SUN H SH,FAN X C,etal.Identification and evaluation of resistance ofVitisto grape white rot [J].JournalofFruitScience,2013(2):191-196(in Chinese with English abstract).
[10]贺普超,王跃进,王国英,等.中国葡萄属野生种抗病性的研究[J].中国农业科学,1991,24(3):50-56.
HE P CH,WANG Y J,WANG G Y,etal.The studies on the disease-resistance of wildVitisspecies originated in China[J].ScientiaAgriculturaSinica,1991,24(3):50-56(in Chinese with English abstract).
[11]贺普超,任治邦.我国葡萄属野生种对炭疽病抗性的研究[J].果树科学,1990(1):7-12.
HE P CH,REN ZH B.Studies of resistance to anthracnose for Chinese wildVitis[J].JournalofFruitScience,1990(1):7-12(in Chinese with English abstract).
[12]沈会芳,林壁润,蒲小明,等.应用离体叶片法鉴定菠萝资源心腐病抗性[J].广东农业科学,2014,41(7):80-82,87.
SHEN H F,LIN B R,PU X M,etal.Identification of resistance toPhytophthoranicotianaein some pineapple materials by in vitro leaf method[J].GuangdongAgriculturalSciences,2014,41(7):80-82,87(in Chinese with English abstract).
[13]赵远征,刘志恒,李俞涛,等.大樱桃黑斑病病原鉴定及其致病性研究[J].园艺学报,2013,40(8):1560-1566.
ZHAO Y ZH,LIU ZH H,LI Y T,etal.Studies on identification and pathogenicity of cherry black spot caused byAlternariaalternata[J].ActaHorticulturaeSinica,2013,40(8):1560-1566(in Chinese with English abstract).
[14]陈子文,余旦华,王保良,等.葡萄炭疽病的潜伏侵染与葡萄杂种实生苗抗炭疽病性状的早期鉴定[J].中国果树,1985(1):46-49.
CHEN Z W,YU D H,WANG B L,etal.Grape anthracnose of latent infection and early identification for anthracnose resistance traits of grape hybrid seeding[J].ChinaFruit,1985(1):46-49(in Chinese with English abstract).
[15]韦洁玲,黄丽丽,郜佐鹏,等.苹果树腐烂病室内快速评价方法的研究[J].植物病理学报,2010,40(1):14-20.
WEI J L,HUANG L L,GAO Z P,etal.Laboratory evaluation methods of appleValsacanker disease caused byValsacerato sperma sensu Kobayash[J].ActaPhytopathologicaSinica,2010,40(1):14-20(in Chinese with English abstract).
[16]罗睿雄,黄建峰,张欣,等.229份杧果种质对炭疽病抗性初步评价[J].热带农业科学,2013,33(3):36-40,49.
LUO R X,HUANG J F,ZHANG X,etal.Preliminary assessment on 229 accessions of mango germplasm for resistance to anthracnose[J].ChineseJournalofTropicalAgriculture,2013,33(3):36-40,49(in Chinese with English abstract).
[17]田莉莉,贺普超.葡萄属种间杂交一代果实炭疽病抗性遗传的研究[J].西北农业大学学报,1999,27(6):69-73.
TIAN L L,HE P CH.Studies on fruit resistance to anthracnose ofVitisinterspecific hybrid generation[J].JournalofNorthwestSci-TechUniversityAgricultureandForestry,1999,27(6):69-73(in Chinese with English abstract).
[18]张军科,罗世杏,李小伟,等.白粉菌在不同抗病性葡萄叶片上的侵染过程比较[J].西北农林科技大学学报(自然科学版),2008,36(3):161-165,170.
ZHANG J K,LUO SH X,LI X W,etal.Comparisons on theUncinulanecatorinvasion procedure of resistant and susceptible grapes[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2008,36(3):161-165,170(in Chinese with English abstract).
[19]姜建福,张颖,田智硕,等.葡萄属植物叶片显微和超微结构观察[J].西北植物学报,2012,32(7):1365-1371.
JIANG J F,ZHANG Y,TIAN ZH SH,etal.Observation on microtructure and ultrastructure of leaves inVitisL.[J].ActaBotanicaBoreali-occidentaliaSinica,2012,32(7):1365-1371(in Chinese with English abstract).
[20]WAQAR AHMAD,MUHAMMAD ILYAS KHAN,MUHAMMAD WAQAR,etal.In vitro antibacterial activity ofVitisviniferaleaf extracts against some pathogenic bacterial strains[J].AdvancesinBiologicalResearch,2014,8(2):62-67.
[21]王跃进,贺普超.中国葡萄属野生种抗白腐病机制研究[J].北方园艺,1988(1):5-8.
WANG Y J,HE P CH.Study on the mechanism of wild species of genus Chinese grape white rot resistant [J].NorthernHorticulture,1988(1):1-5(in Chinese with English abstract).
[22]余旦华,王保良,叶永刚,等.葡萄果皮的微结构与抗葡萄炭疽病的关系[J].葡萄栽培与酿酒,1984(2):1-5,57.
YU D H,WANG B L,YE Y G,etal.The relationship between grape peel microstructure and grape anthracnose resistance[J].ViticultureandEnology,1984(2):1-5,57(in Chinese with English abstract).
Received 2015-04-02Returned2015-06-25
First authorGAO Xiaoming,female,master.Research area:germplasm resources of fruit. E-mail:15137189298@163.com
(责任编辑:成敏Responsible editor:CHENG Min)
Identification and Screening of Hybrid Progenies with Resistance to Grape Anthracnose
GAO Xiaoming1, FAN Xiucai2, ZHANG Guohai1, ZHANG Ying2,JIANG Jianfu2,SUN Haisheng1and LIU Chonghuai2
(1.College of Forestry, Henan University of Science and Technology, Luoyang Henan 471000, China;2.Zhengzhou Fruit Research Institute,Chinese Academy of Agricultural Sciences,Zhengzhou 450009, China)
AbstractInvestigate the methods of identification for grape anthracnose resistance, to effectively select resistant individual plant of hybrid offspring, which can serve grape anthracnose resistance breeding. In this study, wild Vitis davidii var.davidii ‘Heizhenzhu’ which with high resistance to grape anthracnose was hybridized with V.vinifera L. cv. ‘Rizamat’ which was susceptible to grape anthracnose. Using extracts of in vitro leaf, fruit and fruit separately, and different inoculation methods, grape anthracnose resistance of parent materials and hybrids were identified. The results showed that bacteria liquid method was more suitable for the resistance identification of grape leaves and fruit to grape anthracnos, either 70% ethyl alcohol or acetone could be used as leach liquor to identify the resistance of fruit extracts. The hybrid progenies of HR, R, MR, S, HS to grape anthracnose resistance accounted for 30.77%, 35.90%, 12.82%, 15.38% and 5.12%, respectively.
Key wordsGrape; Grape anthracnose; Disease resistance; Identification
收稿日期:2015-04-02修回日期:2015-06-25
基金项目:“十二五”国家科技支撑计划(2013BAD01B04-20)。
通信作者:刘崇怀,男,博士,研究员,主要从事果树种质资源研究。 E-mail:liuchonghuai@caas.net.cn
中图分类号S663.1
文献标志码A
文章编号1004-1389(2016)06-882-07
Foundation itemThe “12th Five-year Plan” National Science and Technology Support Program(No. 2013BAD01B04-20). LIU Chonghuai,male,Ph.D,researcher.Research area:germplasm resources of fruit. E-mail:liuchonghuai@caas.net.cn
网络出版日期:2016-06-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160601.0919.028.html
第一作者:高晓铭,女,硕士研究生,从事果树种质资源研究。E-mail:15137189298@163.com
