氮化碳自组装包裹对SnO2TiO2复合锂离子电池负极材料电化学性能的影响
2016-07-01黄丽华崔立峰
丁 翔, 黄丽华, 纪 敏, 崔立峰
(上海理工大学 环境与建筑学院, 上海 200093)

丁翔,黄丽华,纪敏,崔立峰
(上海理工大学 环境与建筑学院, 上海200093)
摘要:通过简单的石墨相氮化碳(g-C3N4)纳米片自组装沉积法,制备了g-C3N4包裹的SnO2-TiO2纳米复合材料.扫描电子显微镜观察显示,g-C3N4均匀地包裹在SnO2-TiO2纳米颗粒上.SnO2-TiO2-C3N4纳米复合材料被用作锂离子电池的负极材料,在0.2C的倍率下循环20次后,比容量达到380.2 mA·h·g-1,明显高于未经g-C3N4包裹的纯的SnO2(51.6 mA·h·g-1)和SnO2-TiO2纳米复合材料.在0.1~0.5C的倍率充放电测试中,SnO2-TiO2-C3N4纳米复合材料的比容量仅从490 mA·h·g-1衰减到330 mA·h·g-1,高倍率下抗衰减性能优于同类材料.材料优异的电化学性能归功于g-C3N4的包裹处理,这不仅增强了固体电解质界面(SEI)的稳定性,也抑制了锂离子嵌入-脱出时SnO2和TiO2纳米颗粒的体积变化.
关键词:SnO2; TiO2; 石墨相氮化碳; 自组装包裹; 锂离子电池; 负极材料
现代社会面临着能源挑战和环境问题,因此特别需要发展能替代化石燃料的绿色能源.为了达到这一目的,有必要大力发展电能储存和输送的方式.锂离子电池由于其良好的通用性和可扩展性,可运用于便携式电子设备和运输设备上,是电能存储的最佳选择之一[1].近年来,人们一直致力于扩大锂离子电池(LIBS)在电动车、电网储能等大功耗中的应用[2].为了拓宽大功率锂离子电池器件的应用,急需发展具有高能量密度、稳定的循环寿命和快速充放电性能高的锂离子电池.LIBS的电化学性能是由电极材料的物理化学性质决定的,所以如何设计新的电极材料受到了越来越多的关注[3-5].目前,石墨碳常被用作商用锂二次电池的负极材料.然而,当锂原子插入石墨烯层之间的石墨中,一个六碳环只能容纳一个锂原子形成LiC6,石墨碳只能提供相对较低的理论比容量(372 mA·h·g-1).因此,有必要开发更高比容量的锂离子电池负极材料[6-7].在各种具有一定应用前景的替代负极材料中,二氧化锡(SnO2)具有一定的优势,因为SnO2具有高达782 mA·h·g-1的理论比容量(按完全锂化状态Li4.4Sn化学计量)、低的放电电位和低毒性等优点[8-10].迄今为止,采用各种方法设计和合成不同纳米结构,以及不同复合体系的SnO2材料的研究已经有较多的报道,然而,对SnO2负极材料的性能仍不满意.这主要是因为,SnO2负极材料中锂的存储主要依赖于从初始氧化物不可逆还原产生的金属锡和锂之间的可逆嵌入-脱出反应[11-14],但是反复嵌入-脱出反应在负极SnO2中产生较大的体积变化和严重的机械应力,这种反应机制在反复嵌入-脱出反应过程中导致负极材料严重的粉化和剥离[15-16].因此,有必要设计一种复合材料来抑制负极SnO2在充放电过程中的体积变化.
二氧化钛(TiO2)是一种成本低,环境友好的重要过渡金属氧化物,它良好的高倍率性能和安全性能,已经成为有吸引力的负极材料[17-19].不同相的TiO2,如金红石[20]、锐钛矿[21]和板钛矿作为锂离子电池负极材料的电性能已得到广泛的研究[22-26].锐钛矿型TiO2可以将锂带入其晶体结构的空位,该空位被看作是高度扭曲边缘共享的TiO6八面体[27]锯齿链堆叠形成的,这一机理与其167.5 mA·h·g-1的理论比容量[28]和3%~4%可忽略的体积变化一致.但是,相对较低的比容量和差的循环性能限定了TiO2负极材料的应用.然而,因为其在锂离子嵌入期间非常低的体积膨胀,TiO2已被许多研究者用作(如Si、Sn、Fe2O3等)充放电过程中体积变化较大的负极材料的缓冲材料.SnO2-TiO2纳米复合材料的研究是将来锂离子电池负极材料的较好选择之一.然而,SnO2-TiO2复合材料的循环稳定性和倍率性能仍然不够理想.因此,SnO2-TiO2纳米复合材料的电化学性能和稳定性的进一步改善,对可再生能源的发展有重大的研究意义.
石墨相氮化碳(g-C3N4)是一种类似于石墨碳,具有共轭π结构的层状氮化碳聚合物.由于碳和氮之间的强共价键,g-C3N4热稳定性极高,且耐酸碱溶液腐蚀.目前,g-C3N4复合材料是一种理想的可提高材料稳定性的非金属助剂,在Friedel-Crafts反应[29]、氢化反应[30]和光降解染料[31-37]的催化材料中有广泛的应用.由于其结构的稳定性,g-C3N4还被广泛用于其他大体积变化的负极材料的缓冲材料的研究,所以g-C3N4作为锂离子负极材料研究也引起了广泛关注.
综上考虑,SnO2,TiO2和g-C3N4纳米复合材料作为高性能锂离子负极材料的可控合成大有希望.在此,本研究提出通过简单的煅烧和液相自组装包裹方法制备g-C3N4包裹的SnO2-TiO2纳米复合材料.在此三体纳米复合材料系统中,SnO2可提供高的比容量,而TiO2和g-C3N4同时作为活性材料和缓冲材料,可以缓解其中高比容量的SnO2的体积膨胀问题.相比纯SnO2和SnO2-TiO2纳米复合材料,SnO2-TiO2-C3N4纳米复合材料展示了显著改善的可逆性和可循环性,这可归因于TiO2和g-C3N4包裹对SnO2大体积变化的缓冲作用.
1试验
1.1试验原料及设备仪器
用于合成锂离子电池负极材料的试验原料有二水合二氯化锡(SnCl2·2H2O)、四氯化钛(TiCl4)、丙酮、巴比妥酸(BA)、双氰胺和氢氧化钠,均为分析纯,在上海国药购买,试验用水为二次去离子水.试验仪器有D8 Advance型X射线衍射仪(XRD,德国Bruker公司)、扫描电子显微镜(SEM,VEGA3 SBH,10 kV)、STA 8000热重分析仪(美国Perkin Elmer公司)、新威电池测试仪(NEWARE,中国).1.2复合材料的制备
SnO2-TiO2纳米复合材料是以SnCl2·2H2O和TiCl4作为前驱物制备的.首先,SnCl2·2H2O(20 mmol)作为Sn的来源直接溶解在20 mL的丙酮溶液中,持续磁力搅拌下得到澄清的溶液后,将TiCl4(10 mmol)加入上述液体中,室温下持续搅拌形成均一的液体.接着,把混合液移入一个干净的平玻璃皿(半径8 cm)中蒸发多余的丙酮.之后,把上述混合液放入氧化铝坩埚中,空气氛围中以2 ℃/min的速率加热到550 ℃并保温3 h,再以同样的速率降到室温,得到SnO2-TiO2复合物.
用上述相同的方法(不加入TiCl4),直接将SnCl2·2H2O在550 ℃煅烧制备纯的SnO2.
g-C3N4的制备过程是共聚作用的过程[38].将3 g的双氰胺和0.15 g的巴比妥酸混合溶解在15 mL的去离子水中,然后放入油浴锅中保持90 ℃持续搅拌,直到水分全部蒸发变成白色的固体.再把剩余的白色固体放入马弗炉中以2 ℃/min的速率加热到550 ℃并保温4 h,再以同样的速率降到室温得到块状的g-C3N4.为了得到纳米片层的g-C3N4,将块状的g-C3N4研磨成细粉再加入甲醇,超声30 min后,就会剥脱成薄的片状分解在均匀的悬浮液中.SnO2-TiO2-C3N4纳米复合材料是通过自组装过程制备而成的.将上述合成好的SnO2-TiO2纳米复合材料分散在g-C3N4悬浮液中,室温下搅拌24 h,之后将混合物放入真空干燥箱中,60 ℃干燥6 h,最后得到SnO2-TiO2-C3N4纳米复合材料的样品.1.3锂离子电池的制备
SnO2,SnO2-TiO2和SnO2-TiO2-C3N4纳米复合材料的电化学性能以锂金属作为参比电极手工制成CR2016纽扣电池,随后在室温下进行电化学性能评价.工作电极制作时,先按照质量分数为75%的活性物质、15%导电剂(碳黑)和15%聚偏二氟乙烯(PVDF)黏合剂的配比,以N-甲基-2-吡咯烷酮(NMP)为溶剂进行机械搅拌配制成均匀的浆液.将所得浆液立即均匀地涂到铜箔上,在真空烘箱中以120 ℃干燥10 h,然后在室温下放置12 h.采用微孔聚乙烯膜(Celgard2400)为隔膜.电解质为1 M的LiPF6,以碳酸乙酯(EC)/碳酸二甲酯(DMC)/碳酸甲乙酯(EMC)(1∶1∶1,体积比)为电解质添加剂.电池组装在Ar氛围下的手套箱中操作,其中氧和水分含量均保持在10-6mL·m-3以下.
2结果与分析
图1为SnO2,SnO2-TiO2和SnO2-TiO2-C3N4纳米复合材料的XRD图谱.在SnO2的衍射图中,所有的强衍射峰都能很好地对应结晶的SnO2(JCPDS编号41~1445).此外,可明显地观察到,不存在对应于SnCl2,Sn或其他杂质的衍射峰.在SnO2-TiO2衍射图中,只观测到锐钛矿相TiO2(JCPDS编号21~1276),并没有出现SnO2晶体结构.主要原因是SnO2的衍射峰的位置非常接近TiO2,其中,TiO2晶体的高峰强度更容易实现.在TiO2的导入过程中,SnO2粒子充分地分散,致使SnO2晶体的峰强度与TiO2相比更弱.类似的结果也在SnO2-TiO2-C3N4纳米复合材料衍射图中出现(除了一个在27.6°对应g-C3N4(002)的衍射峰).这意味着在两步自组装过程后,g-C3N4被成功地引入到复合结构中.在SnO2-TiO2-C3N4纳米复合材料的XRD图谱中发现峰宽变宽,说明结晶度降低和晶粒尺寸变小.

图1 三种纳米复合材料的XRD图谱
图2为SnO2-TiO2-C3N4纳米复合材料的热重(TG)曲线,是在空气氛围下,以10 ℃/min的加热速率,从50 ℃升高到950 ℃下进行测试得到的.从图2中可以明显观察到质量损失的3个温度区间:低于500 ℃的区间,这部分质量损失是由于样品中吸收的水分蒸发和前驱物中无机成分的分解;主要的质量损失是在550~750 ℃区间,可以清楚地看出,SnO2-TiO2-C3N4纳米复合材料的质量迅速下降,由于SnO2和TiO2在此温度范围是不会分解的,所以该段质量对应g-C3N4的损失,进一步证实了SnO2-TiO2-C3N4纳米复合材料中18%g-C3N4(%,质量分数)的存在;在最后1个区域中,TG曲线变得平坦,这表明该样品的质量在750 ℃后基本稳定,没有发生任何相变.可以得出结论,煅烧后的SnO2-TiO2-C3N4纳米复合材料具有较高的热稳定性,且g-C3N4成功地包裹到SnO2-TiO2-C3N4纳米复合材料的表面上,可以作为一个保护层防止SnO2纳米颗粒的聚合.

图2 SnO2-TiO2-C3N4纳米复合材料TG曲线
图3为SnO2,SnO2-TiO2和SnO2-TiO2-C3N4纳米复合材料的表面形态的SEM图.从SnO2的SEM图中可以看出,纯的SnO2样品尺寸较大,严重结块,趋于不规则的形貌,而且没有游离颗粒.在图3中,可以发现所制备的SnO2-TiO2纳米复合材料是由尺寸为0.10~0.25 μm的微球形纳米颗粒组成,纳米颗粒以更大的簇状聚集在一起,这也意味着在SnO2-TiO2纳米复合材料中成功引入了TiO2;此外,SnO2-TiO2纳米复合材料的表面变得粗糙.结合图1中SnO2-TiO2纳米复合材料的XRD结果分析推断,SnO2纳米颗粒最可能被包裹在TiO2纳米颗粒内,从而在反复充放电过程中,SnO2的体积变化可因TiO2纳米颗粒的缓冲作用在很大程度上得到抑制.通过比较SnO2和SnO2-TiO2的SEM图,可以观察到经由两步自组装过程获得的SnO2-TiO2-C3N4纳米复合材料,虽然形态没有显著改变,但材料的表面变得光滑.这表明g-C3N4层均匀包裹在纳米颗粒的表面上,没有观察到单独的纳米颗粒.因此,g-C3N4层通过防止纳米颗粒的结块有效地促进锂离子的扩散,从而提高材料的可逆性.

图3 三种纳米复合材料的SEM图
图4为SnO2,SnO2-TiO2和SnO2-TiO2-C3N4纳米复合材料第1,2,5,10次循环的充放电电压曲线.所有电极的这些电压曲线都是在0~2.5 V的范围内以相同的倍率0.1C进行比较的.SnO2,SnO2-TiO2和SnO2-TiO2-C3N4纳米复合材料的初期放电比容量分别是863,662和853 mA·h·g-1,可以看出SnO2的比容量最高,因为其高的理论比容量,这也表明电极的比容量主要来源于SnO2.而它们在第1次循环中的充电比容量分别是327,318和555 mA·h·g-1,3个电极第1次循环的充放电都有不可逆的比容量损失.这是因为在第1次充放电过程中,Li2O和固体电解质界面(SEI)膜的形成.
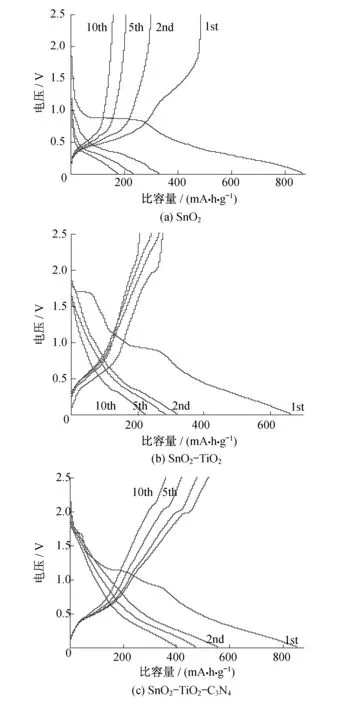
图4 三种纳米复合材料在0.1C时第1,2,5,10次
图4(a)中SnO2的初始电位平台从1.10 V到0.50 V,对应的是在第1步放电过程中锂离子在SnO2上嵌入和脱出的经典转化反应,从而形成Sn和Li2O.而图4(b)中的SnO2-TiO2充放电曲线,第1次充电过程可以观察到两个不同平台:电压在0.50~1.10 V之间,完全类似于纯SnO2的平台;另一个平台是在1.75 V的位置,这是在TiO2中脱/嵌锂的典型特征.对于SnO2-TiO2-C3N4纳米复合材料,除了SnO2和TiO2的充放电平台,在1.0 V以上有明显的电压平台,这可能是因为引入了g-C3N4.然而,从第2个循环开始,就很难区分不同的锂离子的嵌入过程.经过10次循环后,SnO2-TiO2-C3N4纳米复合材料比容量缓慢下降,而SnO2和SnO2-TiO2纳米复合材料经过反复循环后比容量衰减更快.因此,相比SnO2和SnO2-TiO2纳米复合材料,SnO2-TiO2-C3N4纳米复合材料表现出更慢的比容量损失和明显改善的循环性能.这可能与TiO2和g-C3N4包裹对SnO2的体积变化的缓冲作用有关.为了证明SnO2-TiO2-C3N4纳米复合材料倍率性能的提高,图5是SnO2-TiO2-C3N4纳米复合材料在不同倍率下的性能测试,在0.1C,0.2C,0.5C各循环5次,再回到0.1C循环5次.

图5 SnO2-TiO2-C3N4纳米复合材料
从图5中可以看出,在0.1C的放电比容量是490 mA·h·g-1,在0.2C和0.5C分别减少到390和330 mA·h·g-1.在高电流密度循环后,再次返回到初始电流密度0.1C,可以明显观察到比容量恢复到约350 mA·h·g-1,占0.1C初始比容量的71%.这表明所制备的样品可经受各种电流密度的变化,且保持良好的稳定性.这个结果证实了引入TiO2和g-C3N4成功获得SnO2-TiO2-C3N4纳米复合材料,它们可以一起发挥作用,防止纳米粒子的团聚.该结构也显著促进了锂离子的扩散,从而增大了活性SnO2的利用率.同时,TiO2也有助于提高重复循环过程中的电化学活性.
图6是SnO2,SnO2-TiO2和SnO2-TiO2-C3N4纳米复合材料在0.2C倍率下,充放电电压在0.5~2.5 V范围内20个周期的循环特征.对比发现,所有的负极材料中,SnO2-TiO2-C3N4纳米复合材料的循环性能最好,在20个周期后仍表现出非常稳定的比容量(380.2 mA·h·g-1).20次循环后,SnO2,SnO2-TiO2和SnO2-TiO2-C3N4纳米复合材料的比容量保持率分别是6%,17%和44%.纯SnO2纳米复合材料循环性能差的主要原因是由于纳米SnO2在充放电循环过程中仍不可避免集聚,导致电极材料体积的急剧变化.这与SnO2-TiO2-C3N4纳米复合材料形成了鲜明的对比,SnO2-TiO2-C3N4纳米复合材料表现出了更小的比容量损失,且循环性能明显优于SnO2和SnO2-TiO2纳米复合材料.

图6 三种纳米复合材料电极在0.2C下的
3结论
(1) 采用液相沉积法,将g-C3N4均匀地包裹在SnO2-TiO2纳米复合材料表面,得到SnO2-TiO2-C3N4纳米复合材料.在0.2C下20次循环后,与纯SnO2(51.6 mA·h·g-1)和SnO2-TiO2纳米复合材料(114.1 mA·h·g-1)相比,SnO2-TiO2-C3N4纳米复合材料表现出更高的比容量(380.2 mA·h·g-1);在0.1~0.5C的范围内,放电比容量衰减也较小(从490 mA·h·g-1到330 mA·h·g-1).这种显著增强的电化学性能主要归功于g-C3N4和TiO2独特的缓冲作用,更有利于充放电循环过程中锂离子的嵌入和脱出.
(2) g-C3N4,TiO2和SnO2纳米粒子之间的孔道为锂离子的储存提供更多的活性位点,这是材料电化学性能改进的另一个因素.
参考文献:
[1]Etacheri V,Marom R,Elazari R,etal.Challenges in the development of advanced Li-ion batteries:a review[J].Energy and Environmental Science,2011,4(9):3243-3262.
[2]Kang B,Ceder G,Battery materials for ultrafast charging and discharging[J].Nature,2009,458(7235):190-193.
[3]Fu L J,Liu H,Zhang H P,etal.Synthesis and electrochemical performance of novel core/shell structured nanocomposites[J].Electrochemistry Communications,2006,8(1):1-4.
[4]Chen J S,Archer L A,Lou X W.SnO2hollow structures and TiO2nanosheets for lithium-ion batteries[J].Journal of Materials Chemistry,2011,21(27):9912-9924.
[5]Wang Z,Zhou L,Lou X W.Metal oxide hollow nanostructures for lithium-ion batteries[J].Advanced Materials,2012,24(14):1903-1911.
[6]Huggins R A.Lithium alloy negative electrodes[J].Journal of Power Sources,1999,81-82:13-19.
[7]Winter M,Besenhard J O,Spahr M E,etal.Insertion electrode materials for rechargeable lithium batteries[J].Advanced Materials,1998,10(10):725-763.
[8]Wang C,Du G H,Ståhl K,etal.Ultrathin SnO2nanosheets:oriented attachment mechanism,nonstoichiometric defects,and enhanced lithium-ion battery performances[J].The Journal of Physical Chemistry C,2012,116(6):4000-4011.
[9]Wang Z Y,Luan D Y,Boey F Y C,etal.Fast formation of SnO2nanoboxes with enhanced lithium storage capability[J].Journal of the American Chemical Society,2011,133(13):4738-4741.
[10]Paek S M,Yoo E J,Honma I.Enhanced cyclic performance and lithium storage capacity of SnO2/graphene nanoporous electrodes with three-dimensionally delaminated flexible structure[J].Nano Letters,2009,9(1):72-75.
[11]Ji L W,Lin Z,Alcoutlabi M,etal.Recent developments in nanostructured anode materials for rechargeable lithium-ion batteries[J].Energy and Environmental Science,2011,4(8):2682-2699.
[12]Yang Z X,Du G D,Feng C Q,etal.Synthesis of uniform polycrystalline tin dioxide nanofibers and electrochemical application in lithium-ion batteries[J].Electrochimica Acta,2010,55(19):5485-5491.
[13]Chen J S,Lou X W.SnO2and TiO2nanosheets for lithium-ion batteries[J].Materials Today,2012,15(6):246-254.
[14]Wang D C,Choi D,Li J,etal.Self-assembled TiO2-graphene hybrid nanostructures for enhanced Li-ion insertion[J].ACS Nano,2009,3(4):907-914.
[15]Yang S B,Feng X L,Müllen K.Sandwich-like,graphene-based titania nanosheets with high surface area for fast lithium storage[J].Advanced Materials,2011,23(31):3575-3579.
[16]Shin J Y,Samuelis D,Maier J.Sustained lithium-storage performance of hierarchical,nanoporous anatase TiO2at high rates:emphasis on interfacial storage phenomena[J].Advanced Functional Materials,2011,21(18):3464-3472.
[17]Hu Y S,Kienle L,Guo Y G,etal.High lithium electroactivity of nanometer-sized rutile TiO2[J].Advanced Materials,2006,18(11):1421-1426.
[18]Guo Y G,Hu Y S,Sigle W,etal.Superior electrode performance of nanostructured mesoporous TiO2(anatase)through efficient hierarchical mixed conducting networks[J].Advanced Materials,2007,19(16):2087-2091.
[19]Ren Y,Liu Z,Pourpoint F,etal.Nanoparticulate TiO2(B):an anode for lithium-ion batteries[J].Angewandte Chemie(International Edition),2012,51(9):2164-2167.
[20]Liu S H,Jia H P,Han L,etal.Nanosheet-constructed porous TiO2-B for advanced lithium ion batteries[J].Advanced Materials,2012,24(24):3201-3204.
[21]Liu H S,Bi Z H,Sun X G,etal.Mesoporous TiO2-B microspheres with superior rate performance for lithium ion batteries[J].Advanced Materials,2011,23(30):3450-3454.
[22]Dylla A G,Xiao P H,Henkelman G,etal.Morphological dependence of lithium insertion in nanocrystalline TiO2(B) nanoparticles and nanosheets[J].The Journal of Physical Chemistry Letters,2012,3(15):2015-2019.
[23]Shin K,Kim H J,Choi J M,etal.Controlled synthesis of skein shaped TiO2-B nanotube cluster particles with outstanding rate capability[J].Chemical Communications,2013,49(23):2326-2328.
[24]Nuspl G,Yoshizawa K,Yamabe T.Lithium intercalation in TiO2modifications[J].Journal of Materials Chemistry,1997,7(12):2529-2536.
[25]Rahman M M,Wang J Z,Hassan M F,etal.Amorphous carbon coated high grain boundary density dual phase Li4Ti5O12-TiO2:a nanocomposite anode material for Li-ion batteries[J].Advanced Energy Materials,2011,1(2):212-220.
[26]Goettmann F,Fischer A,Antonietti M,etal.Metal-free catalysis of sustainable Friedel-Crafts reactions:direct activation of benzene by carbon nitrides to avoid the use of metal chlorides and halogenated compounds[J].Chemical Communications,2006(43):4530-4532.[27]Wang Y,Yao J,Li H R,etal.Highly selective hydrogenation of phenol and derivatives over a Pd@carbon nitride catalyst in aqueous media[J].Journal of the American Chemical Society,2011,133(8):2362-2365.[28]Yan S C,Li Z S,Zou Z G.Photodegradation performance of g-C3N4fabricated by directly heating melamine[J].Langmuir,2009,25(17):10397-10401.
[29]Yan S C,Lv S B,Li Z S,etal.Organic-inorganic composite photocatalyst of g-C3N4and TaON with improved visible light photocatalytic activities[J].Dalton Transactions,2010,39(6):1488-1491.
[30]Yan S C,Li Z S,Zou Z G.Photodegradation of rhodamine B and methyl orange over boron-doped g-C3N4under visible light irradiation[J].Langmuir,2010,26(6):3894-3901.
[31]Guo Y,Chu S,Yan S C,etal.Developing a polymeric semiconductor photocatalyst with visible light response[J].Chemical Communications,2010,46(39):7325-7327.
[32]Zhang Y J,Antonietti M.Photocurrent generation by polymeric carbon nitride solids:an initial step towards a novel photovoltaic system[J].Chemistry-An Asian Journal,2010,5(6):1307-1311.
[33]Döblinger M,Lotsch B V,Wack J,etal.Structure elucidation of polyheptazine imide by electron diffraction-a templated 2D carbon nitride network[J].Chemical Communications,2009(12):1541-1543.
[34]Zhang Y J,Thomas A,Antonietti M,etal.Activation of carbon nitride solids by protonation:morphology changes,enhanced ionic conductivity,and photoconduction experiments[J].Journal of the American Chemical Society,2009,131(1):50-51.
[35]Zhang J S,Chen X F,Takanabe K,etal.Synthesis of a carbon nitride structure for visible-light catalysis by copolymerization[J].Angewandte Chemie International Edition,2010,49(2):441-444.
[36]Shenouda A Y,Murali K R.Electrochemical properties of doped lithium titanate compounds and their performance in lithium rechargeable batteries[J].Journal of Power Sources,2008,176(1):332-339.
[37]Yu Y,Zhang J J,Xue L G,etal.Carbon-coated SiO2nanoparticles as anode material for lithium ion batteries[J].Journal of Power Sources,2011,196(23):10240-10243.
[38]Wijeratne K,Akilavasan J,Thelakkat M,etal.Enhancing the solar cell efficiency through pristine 1-dimentional SnO2nanostructures:comparison of charge transport and carrier lifetime of SnO2particles vs.nanorods[J].Electrochimica Acta,2012,72:192-198.
Critical Influence of Carbon Nitride Self-assembly Coating onthe Electrochemical Performance of SnO2-TiO2NanocompositeAnode Material for Lithium Ion Battery
DING Xiang,HUANG Lihua,JI Min,CUI Lifeng
(School of Environment and Architecture, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:Graphitic carbon nitride(g-C3N4) coated SnO2-TiO2 nanocomposite was prepared by simple self-assembly deposition of g-C3N4 nanosheets on synthesized SnO2-TiO2 nanocomposite.Scanning electron microscopy reveals that g-C3N4 was uniformly coated on SnO2-TiO2 nanoparticles.The SnO2-TiO2-C3N4 nanocomposite was used as high capacity anode material for lithium ion battery and displayed remarkable higher capacity(380.2 mA·h·g-1) compared to both pure SnO2(51.6 mA·h·g-1) and SnO2-TiO2 nanocomposite(114.1 mA·h·g-1) at 0.2C rate after 20 cycles.Rate test of SnO2-TiO2-C3N4 nanocomposite implied a slight fading of specific discharge capacities from 490 mA·h·g-1to 330 mA·h·g-1at current rate range of 0.1-0.5C.The significantly improved electrochemical properties of SnO2-TiO2-C3N4 nanocomposites can be attributed to g-C3N4 coating treatment,which not only enhanced the stability of the solid-electrolyte-interface(SEI) film but also act as a buffer layer for the large volume change of SnO2-TiO2 nanoparticles during lithium intercalation.
Keywords:SnO2; TiO2; graphitic carbon nitride; self-assembly coating; lithium ion battery; anode material
文章编号:1005-2046(2016)02-0001-07
DOI:10.13258/j.cnki.nmme.2016.02.001
收稿日期:2016-03-03
基金项目:国家自然科学基金海外港澳学者合作研究基金项目(51528202)
作者简介:丁翔(1991—),女,硕士研究生,主要从事锂离子电池电极材料的研究.E-mail:296634351@qq.com 通信作者: 崔立峰(1980—),男,教授,主要从事锂离子电池电极材料的研究. E-mail:cuilifeng_usst@163.com
中图分类号:TM 911.18
文献标志码:A
