关节软骨的荧光显微检测方法研究
2016-06-30王潇吴曰超何俊豪毛之华张学喜蔡金洋王强尹建华
王潇,吴曰超,何俊豪,毛之华,张学喜,蔡金洋,王强,尹建华*
(1.南京航空航天大学自动化学院生物医学工程系,南京 211106;2.南京医科大学生殖医学国家重点实验室,南京 210029)
关节软骨的荧光显微检测方法研究
王潇1,吴曰超1,何俊豪1,毛之华1,张学喜1,蔡金洋2,王强2,尹建华1*
(1.南京航空航天大学自动化学院生物医学工程系,南京211106;2.南京医科大学生殖医学国家重点实验室,南京210029)
摘要:基于关节软骨组织中胶原蛋白的自发荧光特性,对软骨组织的荧光显微检测方法进行研究。首先基于荧光图像的统计处理,揭示健康样本与病变样本的差异。其次基于荧光的偏振敏感特性,利用线性二色性方法揭示了软骨组织存在的荧光各向异性特性,为利用荧光各向异性方法研究生物组织结构奠定基础。与传统的显微方法检测软骨组织的形态和超结构相比,利用荧光特性的荧光显微检测方法具有获取软骨组织结构的能力。本文的研究结果为开辟新的骨关节疾病诊断方法提供基础。
关键词:关节软骨;荧光显微;各向异性
1引言
关节软骨(articular cartilage,AC)是一种透明的结缔组织,覆盖在骨关节的连接表面(几百微米到几毫米厚度)。其表面光滑,辅以关节滑液,有利于减少相邻两骨的摩擦,使人体得以自由运动。然而当关节软骨随年龄增长或者受外界的影响(如外伤、过承重、低温等)时,则会发生组织功能性退变甚至骨关节炎(osteoarthritis,OA)等各种形式的关节疾病。该病的后期阶段则会出现不可逆的大范围的软骨损坏,从而最终导致整个关节功能和关节置换的丧失。因此,对软骨疾病进行早期诊断意义重大。
在过去的关节软骨研究中,人们采用的检测手段主要是生物化学分析[1]、磁共振成像[1]、生物力学测量[2]等。生物化学和生物力学能探测大块组织或者较厚的平行切片,却受限于分辨率。 磁共振成像成功测量软骨的蛋白多糖含量,但难于探测胶原蛋白的含量信息。传统光学显微镜、扫描和透射显微镜可以对组织的形态学和超结构进行成像,但缺少成分浓度以及细微组织结构信息[3-6]。傅里叶变换红外(Fourier transform infrared imaging,FTIRI)光谱成像技术亦被用于关节软骨分析检测,并取得了一定的进展[7-8]。
与此同时,在过去的几十年中荧光技术因其各种特性和优点迅速发展,极大地丰富了生命科学研究手段,回答了生物学和医学领域复杂的科学问题。其中以荧光辐射光强为对比机制的显微技术因可直接反映荧光基团的位置和浓度,应用最为广泛。除此之外荧光本身所具有的波长,寿命和偏振特性也被广泛应用到生物检测领域。波长特性为荧光光谱方法和多色荧光图像提供了物理基础;而荧光寿命则对对荧光基团所处环境敏感;同时荧光的偏振敏感性则被用于研究生物分子方向信息以及组织结构特性[9-11]。而基于荧光光谱和荧光寿命的检测技术已经被成功应用于软骨组织的研究和骨关节炎的诊断中[12-13]。
本文基于关节软骨中胶原蛋白的自发荧光特性,对软骨组织的荧光显微特性进行研究,为探索软骨组织荧光检测方法提供基础。主要包括两个方面,首先基于荧光的光强特性,分析正常软骨和病变软骨的荧光图像差别,用荧光图像处理的方法来检测软骨组织。由于软骨组织中胶原蛋白的自发荧光特性,可以对软骨组织不做标记进行自发荧光显微成像。胶原蛋白形成纤维网络,保证关节软骨可承受机械压力和拉力,同时固定蛋白多糖,而蛋白多糖保证软骨的弹性、吸收运动时产生的震动。红外光谱成像方法的研究结果表明,病变软骨组织会有大量蛋白多糖的流失,进而引起组织基质的改变[14]。因此健康样本和病变样本的荧光图像在形态特征上存在区别。为此对两种样本进行荧光显微成像,通过比较其荧光图像并分析其图像差别。
其次基于荧光的偏振敏感特性,利用线性二色性方法研究软骨组织的荧光偏振响应特性,从各项异性信息检测方面为生物组织的研究提供基础。其中所谓的线性二色性(LD-linear dichroism)方法是基于荧光吸收过程中吸收效率对激发光偏振方向的敏感性(吸收效率)提出的,每个荧光分子都有其极性方向,而受激发时的吸收效率正比于其极性方向与激发光偏振方向夹角余弦的平方,基于该原理提出的LD法已成功用于研究细胞膜磷脂分子排列分布[15]以及淀粉纤维组织结构[16]。而软骨组织中胶原纤维的各向异性结构作为表征能够区分健康和病变组织。因此本文基于胶原纤维的自发荧光特性,利用该方法,揭示其软骨组织的各向异性结构,为用荧光偏振检测软骨组织结构提供基础。
2软骨组织荧光显微检测实验
2.1荧光显微图像实验
在实验中,为保证所获取荧光图像具有更好的轴向分辨力,去除骨碎末等杂质对图像的影响,采用激光共聚焦荧光显微系统(ZEISS LSM700)获取荧光图像,激发波长为491 nm波段的蓝光,每个像素点驻留时间为3 ms。利用该共焦系统的20倍放大倍率,对健康样本和病变样本分别进行荧光成像。
2.2荧光偏振检测实验
实验采用奥林巴斯倒置荧光显微镜(IX51),配置MicroPublisher3.3RTV 型号CCD,采集软骨样品荧光强度数据。激发光的偏振方向改变通过起偏器的旋转实现。具体的光路如图1所示,卤素灯发出的白光经滤光片后成为激发光光源,经起偏器改变偏振方向a,然后被二色棱镜反射进入显微物镜,激发样本。在该偏振方向下,辐射荧光经过显微物镜最后曝光成像在与样本平面共轭的CCD。改变激发光偏振方向a,在每个偏振方向a下,CCD记录其对应的荧光图像,最终产生一个偏振荧光图像序列。从该图像序列中,对每个像素点沿偏振方向a这个维度可以获取随a变化的荧光辐射光强。
2.3样本制备
实验所用健康样本和病变样本均为犬后膝关节软骨,犬后膝关节软骨取自2条成年狗(1 条健康,1条患有关节炎)。OA样本为实施了前十字韧带(anterior cruciate ligament,ACL)截断术后饲养两年的成年狗,该ACL横切的犬模型已成为OA动物研究的黄金标准,其可导致关节运动失真和软骨损伤,类似于在人OA中的组织变化。软骨样本从半月板覆盖着的胫骨上切下,软骨骨块的大小约为 2 mm×2 mm×2 mm。随后用盐水洗涤样本并用液氮快速冷冻,在低温切片机(Leica CM 1950,Germany)零下20摄氏度的环境中被切成10微米厚的切片。 软骨切片附着在载玻片上,并在空气中干燥。切割方向垂直于软骨表面,即从浅表区(SZ)、过渡区(TZ)到放射区(RZ)[17]。
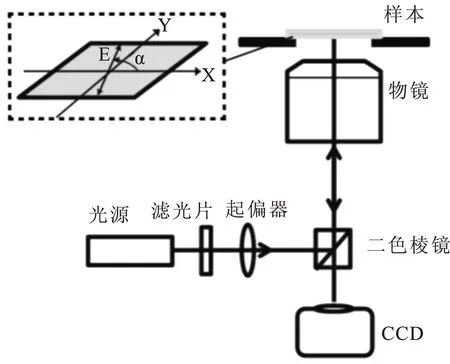
Fig.1The setup of polarized fluorescence microscopic
3实验结果分析
3.1软骨组织的荧光显微图像分析
利用2.1所述的激光共聚焦荧光显微系统(ZEISS LSM700)对正常样本和病变样本(各3片),进行荧光成像,从荧光图像直观上看所有正常样本图像特征相似,所有病变样本图像特征相似,而两种样本的荧光图像特征差异明显。共聚焦图2展示了实验所测量的样本中一个健康样本和一个病变样本的荧光图像及其强度统计直方图,从图中可以直观看出,与健康样本相比病变软骨发生如下变化:首先病变样本浅表层被破坏不再平滑;其次软骨组织基质发生变化,蛋白多糖流失造成过渡区附着的细胞数目明显减少,胶原纤维直接显露出来,这与红外光谱成像方法所得结果符合[14]。进一步对两个样本的前半部分和后半部分,进行荧光图像直方图统计的比较,如图2(c)(f)所示,从图像统计上给出健康样本和病变样本的差异。由于蛋白多糖的流失,造成病变样本组织基质和附着细胞的减少,胶原纤维裸露造成的空洞使得病变样本的直方图分布更偏向暗部,前半部分和后半部分的强度分布中心都处在50~70左右,而健康样本前半部分和后半部分的强度分布中心都处在100~120左右。对其他两个正常样本和病变样本进行处理,得到相似的结果,该结果表明病变软骨的荧光强度分布发生了明显的改变,由此可见直方图统计特征可以作为辨别软骨组织的一个重要标识,进而为病变软骨的荧光显微检测提供了新的方法。

Fig.2Fluorescence microscopic images(a,b)and fluorescence intensity histograms(c)of the first half part of the healthy and osteoarthritic cartilages,respectively,as well as the corresponding graphs(d,e,f)of the latter half part of the both cartilages.The fluorescence intensity histograms of the healthy and osteoarthritic cartilages are respectively indicated by grey and black in(c)and(f)
3.2软骨组织的荧光偏振检测
利用图1所示荧光偏振检测装置,对健康样本进行测量。实验中起偏器从0°到180°,以10°为间隔进行旋转,保证激发光的偏振方向a进行相应的旋转,CCD依次曝光记录每个激发光偏振方向a下对应的荧光图像。从19帧的荧光图像系列中,对每个像素点可以提取受激发光偏振方向a调制的荧光变化曲线。图3展示了一个健康样本的测量结果,其中图3(a)为a=0°时CCD所记录的荧光图像。图3(b)为软骨组织表层区A点位置随偏振方向a变化的归一化荧光强度和对其拟合后的荧光强度变化曲线。在数据拟合中,由于辐射光强正比于偏振方向与荧光偶极子方向夹角余弦的平方,所以设计拟合函数为I(α)=A×cos2(α+B)+C,其中I为辐射光强,A为幅度代表了各向异性特性,B为角度平移代表了组织结构的平均取向,C为背景光强。利用Matlab根据所设计的拟合函数对所记录的荧光强度进行拟合,得到拟合后的荧光变化曲线。从拟合结果可以看出,拟合曲线匹配实验数据,拟合系数为0.87,表明荧光强度变化曲线符合理论上吸收效率随a变化的正弦规律。由于表层区域纤维排列平行于表面,因此当偏振方向与表面垂直时(即偏振方向α=90°),吸收最小,辐射荧光光强接近最低值,与红外光谱方法所得结果符合[18]。为避免单个数据的偶然性,进一步沿表层区水平方向随机选取8个点(包括点A),叠加这8个点的荧光强度,并对叠加后的荧光强度随α变化的数据进行拟合,其结果如图3(c)所示。由于表层区各位置胶原纤维的排列性质基本相同,都沿水平方向,所以多点的统计结果与单点A的结果相似。该结果为利用荧光偏振技术检测和诊断软骨组织结构提供了方法基础。在下一步的工作中,荧光各向异性信息与组织病变之间的关系会进行更为详细的研究。
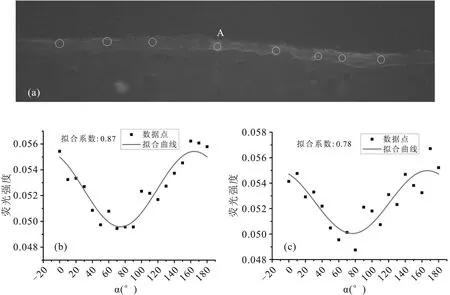
Fig.3(a)The polarized fluorescence microscopic image of healthy articular cartilage,(b)the polarized fluorescence intensity and the fitted profile of the corresponding point A with the fitting coefficient of 0.87,(c)the statistical polarized fluorescence intensity and the fitted profile for points indicated by white circles in(a)with the fitting coefficient of 0.78
4结论
本文以软骨组织胶原蛋白自发荧光特性为基础,结合荧光显微技术这一强大光学检测手段,研究了利用自发荧光图像进行组织的检测,以及利用荧光的偏振特性研究其组织结构的各向异性信息,为利用荧光技术进行软骨组织诊断提供新的理念和方法基础。进一步基于荧光偏振特性研究各向异性信息与病变组织之间的关系,是接下来要继续深入进行的工作。而荧光显微自身所具有的无损、便捷、高灵敏和高准确性必将在软骨组织检测方向展示出其优点。
参考文献
[1]Zheng S,Xia Y,Bidthanapally A,etal.Damages to the extracellular matrix in articular cartilage due to cryopreservation by microscopic magnetic resonance imaging and biochemistry[J].Magn Reson Imaging,2009,27(5):648-655.
[2]Wilson W,Huyghe J M,van Donkelaar C C.Depth-dependent compressive equilibrium properties of articular cartilage explained by its composition[J].Biomech Model Mechanobiol,2007,6(1):43-35.
[3]Chen S S,Falcovitz Y H,Schneiderman R,etal.Depth-dependent compressive properties of normal aged human femoral head articular cartilage:relationship to fixed charge density[J].Osteoarth Cart,2001,9(6):561-569.
[4]Xia Y,Alhadlaq H,Ramakrishnan N,etal.Molecular and morphological adaptations in compressed articular cartilage by polarized light microscopy and Fourier-transform infrared imaging[J].J Struct Biol,2008,164(1):88-95.
[5]Tan A H C,Mitra A K,Chang P C C,etal.Assessment of blood-induced cartilage damage in rabbit knees using scanning electron microscopy[J].J Orthop Surg,2004,12(2):199-204.
[6]Yamamoto K,Shishido T,Masaoka T,etal.Morphological studies on the ageing and osteoarthritis of the articular cartilage in C57 black mice[J].J Orthopaedic Surg,2005,13(1):8-18.
[7]Camacho N P,West P,Torzilli P A,etal.FTIR microscopic imaging of collagen and proteoglycan in bovine cartilage [J].Biopolymers,2001,62(1):1-8.
[8]Zhang X X,Yin J H,Mao Z H,etal.Discrimination of healthy and osteoarthritic articular cartilages by Fourier transform infrared imaging and partial least squares-discriminant analysis[J].J Biomed Opt,2015,20( 6):060501 .
[9]Axelrod D.Carbocyanine dye orientation in red-cell membrane studied by microscopic fluorescence polarization[J].Biophys J,1979,26(3):557-573.
[10]Vrabioiu A M,Mitchison T J.Structural insights into yeast septin organization from polarized fluorescence microscopy[J].Nature,2006,443(7110):466-469.
[11]Benninger R K,Vanherberghen B,Young S,etal.Live cell linear dichroism imaging reveals extensive membrane ruffling within the docking structure of natural killer cell immune synapses[J].Biophys J,2009,96(2):L13-L15.
[12]Gibson G J,Verner J J,Nelson F R T,etal.Degradation of the cartilage collagen matrix associated with changes in chondrocytes in osteoarthrosis.Assessment by loss of background fluorescence and immunodetection of matrix components[J].J Orthopaedic Res,2001,19(1):33-42.
[13]Talbot C B,Lever M J,Benninger R K P,etal.Fluorescence lifetime imaging of articular cartilage[J].Inter J Exp Pathol,2004,85(1):A31-A32.
[14]Yin J H,Xia Y,Lu M.Concentration profiles of collagen and proteoglycan in articular cartilage by Fourier transform infrared imaging and principal component regression[J].Spectrochim Acta,Part A,2012,88:90-96.
[15]Kress A,Wang X,Ranchon H,etal.Mapping the local organization of cell membranes using excitation-polarization-resolved confocal fluorescence microscopy[J].Biophys J,2013,105(1):127-136.
[16]Duboisset J,Ferrand P,He W,etal.Thioflavine-T and Congo Red reveal the polymorphism of insulin amyloid fibrils when probed by polarization-resolved fluorescence microscopy[J].J Phys Chem B,2013,117(3):784-788 .
[17]Zhang X X,Mao Z H,Yin J H,etal.Determination of collagen and proteoglycan concentration in osteoarthritic and healthy articular cartilage by Fourier transform infrared imaging and partial least square[J].Vib Spectrosc,2015,78:49-53.
[18]Yin J H,Xia Y,Ramakrishnan N.Depth-dependent anisotropy of proteoglycan in articular cartilage by Fourier transform infrared imaging [J].Vib Spectrosc,2011,57:338-341.
A Study on Fluorescence Microscopy Measurement Method of Articular Cartilage
XIAO Wang1,WU Yue-chao1,HE Jun-hao1,MAO Zhi-hua1,ZHANG Xue-xi1,CAI Jin-yang2,WANG Qiang2,YIN Jian-hua1*
(1.DepartmentofBiomedicalEngineering,NanjingUniversityofAeronauticsandAstronautics,Nanjing210016,China;2.StateKeyLaboratoryofReproductiveMedicine,NanjingMedicalUniversity,Nanjing210029,China)
Abstract:Based on the auto-fluorescence property of collagen in articular cartilage,the research on fluorescence microscopy measurement method of articular cartilage was carried out.First,the difference between the healthy and pathological samples was revealed by statistical comparison of fluorescence images.Second,based on the polarization property of fluorescence,the fluorescence anisotropy of the cartilage was presented by the linear dichroism method,which lays foundation for research on structure of articular cartilage using fluorescence anisotropy method.Compared to traditional microscopic measurement techniques that supply the morphology and the super-structure of cartilage tissues,fluorescence microscopy measurement methods are able to obtain the information about the structure of cartilage tissues.The results presented in this paper open the door for developing new diagnostic method for articular cartilage diseases.
Key words:articular cartilage;fluorescence microscopy;anisotropy
收稿日期:2015-08-08; 修改稿日期:2015-10-30
基金项目:国家自然科学基金(61378087)和江苏省自然科学基金(BK20150752)
作者简介:王潇(1985-),男,讲师,研究方向:生物光子学,光学显微成像,生物成像,生物光谱学。 E-mail:xiao.wang@nuaa.edu.cn 通讯作者:尹建华,E-mail:yin@nuaa.edu.cn
文章编号:1004-5929(2016)02-0185-05
中图分类号:O433;O657.3;Q-3
文献标志码:A
doi:10.13883/j.issn1004-5929.201602016
