苗药头花蓼含药血清对巨噬细胞释放炎症因子的影响*
2016-06-30赵菲菲徐国波廖尚高
徐 丹, 赵菲菲, 杨 馨, 刘 俊, 李 靖, 徐国波, 廖尚高*
(1.贵州医科大学 药学院 民族药与中药开发应用教育部工程研究中心, 贵州 贵阳 550004; 2.贵州医科大学 贵州省药物制剂重点实验室, 贵州 贵阳 550004)
·基础研究·
苗药头花蓼含药血清对巨噬细胞释放炎症因子的影响*
徐丹1**, 赵菲菲1,2, 杨馨1,2, 刘俊1, 李靖1, 徐国波1, 廖尚高1***
(1.贵州医科大学 药学院 民族药与中药开发应用教育部工程研究中心, 贵州 贵阳550004; 2.贵州医科大学 贵州省药物制剂重点实验室, 贵州 贵阳550004)
[摘要]目的: 探讨苗药头花蓼对脂多糖(LPS)诱导小鼠单核巨噬细胞(RAW264.7)释放炎症因子的影响。方法: 制备苗药头花蓼水提醇沉提取物的含药血清( PCWEPS ), 采用10 μg/L脂多糖(LPS)建立RAW264.7细胞炎症损伤模型,Griess试剂法检测细胞上清液中一氧化氮(NO)的含量,酶联免疫吸附法(ELISA)检测细胞上清液中肿瘤坏死因子α(TNF-α)和白介素6(IL-6)的表达,实时荧光定量PCR法(Real Time-PCR)检测TNF-α及IL-6 mRNA的表达水平,Western blot 法检测NF-κB通路中I-κBα蛋白和p-I-κBα蛋白表达水平。结果: 与模型组比较,3种给药剂量的PCWEPS均显著抑制LPS诱导的RAW264.7 细胞释放NO,TNF-α和IL-6 (P<0.001);PCWEPS能够显著降低TNF-α和IL-6 mRNA的表达水平(P<0.001),下调p-I-κBα蛋白的表达(P<0.001),降低NF-κB通路中I-κBα蛋白的磷酸化。结论: 头花蓼抑制巨噬细胞中炎症因子释放,可能与抑制NF-κB通路中I-κBα的磷酸化有关。
[关键词]植物药; 头花蓼; 单核巨噬细胞; 炎症因子; NF-κB通路
头花蓼(polygonumcapitatumBuch-Ham. ex D. Don)为蓼科蓼属植物头花蓼的干燥全草具有利尿通淋之功效,临床上主要用于泌尿系统感染疾病的治疗[1]。研究表明,头花蓼水提物及70%乙醇提取物具有显著的抗炎活性[4],其中的三萜、甾体和黄酮类化合物与抗炎活性密切相关[5],但头花蓼的抗炎机制尚不明确。活化的单核-巨噬细胞是炎症反应中细胞因子的重要来源,当受到刺激时,单核细胞会转移至血管外组织成为巨噬细胞,激活后的巨噬细胞产生一氧化氮(NO)、肿瘤坏死因子α(TNF-α)和白介素6(IL-6)等细胞因子,对机体环境中的内皮细胞、上皮细胞和间质细胞产生影响,并对宿主的免疫反应、组织重建修复等发挥重要作用[6-7]。脂多糖(lipopolysaccharide,LPS)是诱导巨噬细胞释放炎症介质的有效物质,诱导巨噬细胞释放炎症因子模型被广泛用于抗炎药物的筛选评价[8-9]。本研究通过考察头花蓼水提醇沉提取物含药血清(PCWEPS)对LPS诱导的RAW264.7细胞释放炎症因子的影响,探讨头花蓼的抗炎作用及其作用机制。
1材料与方法
1.1试药与试剂
头花蓼药材(贵州省施秉县头花蓼GAP种植基地),阳性对照药醋酸地塞米松磷酸钠注射液(贵州光正制药有限责任公司产品,国药准字H52020793,批号130315)。DMEM高糖培养基(Gibco公司,批号 8114410),胎牛血清(Hyclone公司,批号 NZE1145),LPS(Sigma公司,批号102M4017V),MTT(Sigma公司,批号 M1959);磺胺(批号 30172216),N-(1-萘基)-乙二胺(批号 80088013),DMSO(批号 302A0323),均购于国药集团。小鼠TNF-α 、IL-6ELISA试剂盒(RayBio公司,批号 0313150430、0313150413),AxyPrep总RNA小量制备试剂盒(康宁生命科学有限公司,批号 12213KD1),PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,批号 AK2802),SYBR Premix Ex TaqTMⅡ(TaKaRa,批号 AK6101),引物(上海生物工程公司),SDS-PAGE凝胶快速配制试剂盒(碧云天,批号 P0012AC),哺乳动物蛋白抽提试剂盒(康为世纪,批号 CW0889),BCA蛋白浓度测定试剂盒(Solarbio,批号 PC0020),TRIS(Solarbio,批号 1128Q0713),Glycine(Sigma,批号 WXBB6513V),SDS(Sigma,批号 L-5750),I-κBα单克隆抗体(美国abcam公司,批号 GR181745-8),p-I-κBα单克隆抗体(美国abcam公司,批号 GR98748-15),羊抗兔IgG抗体(美国abcam公司,批号 GR209629-7)。
1.2动物与分组
Wistar大鼠30只,雌雄各半,体质量(200±20)g,SPF级,由贵州医科大学实验动物中心提供,动物合格证号SCXK(黔)2012-0001。根据灌胃剂量将小鼠随机分为18、54、162 g/(kg·d)头花蓼水提醇沉提取物组(PCWEP,分别对应头花蓼单方制剂热淋清颗粒临床剂量的3、9和27倍),每组10只。灌胃前12 h禁食不禁水,尾静脉采集空白血,然后按不同剂量灌胃PCWEP,2次/d,连续4 d,末次给药后90 min尾静脉取血[10]。以2 000 r/min,4 ℃离心10 min分离上层血清,合并同组血清,过滤除菌,分装,-20 ℃保存备用。
1.3方法及考察指标
1.3.1RAW264.7细胞活性RAW264.7细胞培养于含10%胎牛血清,100 mg/L青霉素及100 mg/L链霉素的DMEM细胞培养液中,置于温度为37 ℃,5% CO2培养箱中培养。取对数生长期细胞,用0.25%胰蛋白酶消化,以2×105个/mL 的浓度接种于96孔培养板中,每孔体积100 μL,细胞培养24 h后,弃去上清液。实验分为对照组:无大鼠血清的培养基,实验组:不同体积分数(0.5%、1.0%、1.5%及2.0%,V/V)的空白血清或PCWEPS,培养24 h后,每孔加入2.5 g/L MTT 10 μL,继续孵育4 h,吸弃上清液,加入DMSO 100 μL,振荡10 min后,在酶标仪上于490 nm波长处测定吸光度(A),每组设6个平行孔。按照公式计算:细胞存活率=实验组A/对照组A平均值×100%。
1.3.2RAW264.7细胞释放NO的检测前期研究发现,当空白血清体积(V/V)为1.5% 时,既不影响RAW264.7细胞的生长,也不影响LPS刺激所产生的NO释放的检测,因此确定实验中含药血清的添加体积(V/V)为1.5%。参照1.3.1项,实验分为对照组(无大鼠血清的培养基)、模型组(终浓度为10 μg/L的LPS溶液)、DEXA组(终浓度为50 mg/L的地塞米松和10 μg/L的LPS混合液)及不同剂量PCWEPS组(终浓度为10 μg/L的LPS和体积分数(V/V)为1.5%的不同剂量含药血清,与细胞共培养,每组设6个平行孔)。计算NO释放量。
1.3.3RAW264.7细胞释放TNF-α及IL-6的检测参照1.3.2项,收集RAW264.7细胞上清液,每组设6个平行孔,TNF-α和IL-6的释放量采用ELISA试剂盒提供的方法进行测定,根据标准曲线计算TNF-α和IL-6 的释放量。
1.3.4RAW264.7细胞TNF-α和IL-6 mRNA表达水平取对数生长期RAW264.7细胞,用0.25%的胰蛋白酶消化,以2×105个/mL的浓度接种于6孔培养板中,每孔体积2 mL,细胞培养24 h后,弃去上清液。参照1.3.2项,培养24 h后,采用AxyPrep总RNA小量制备试剂盒提取总RNA,TaKaRa试剂盒反转录为cDNA,按照SYBR Green试剂盒说明扩增TNF-α及IL-6目的条带,每组设3个平行孔。引物由上海生物工程公司合成,TNF-α上游引物5′-CAGGCGGTGCCTATGTCTC-3′,下游引物5′-CGATCACCCCGAAGTTCAGTAG-3′;IL-6上游引物5′-CTGCAAGAGACTTCCAYCCAG-3′,下游引物5′-AGTGGTATAGACAGGTCTGTTGG-3′。内参照为甘油醛-3-磷酸脱氢酶(GAPDH)引物,上游引物5′-AGTATGACTCCACTCACGGCAAAT-3′,下游引物5′-GTCTCGCTCCTGGAAGATGGT-3′。根据2-△△Ct,以GAPDH为参照,进行TNF-αmRNA及IL-6 mRNA相对定量分析。
1.3.5RAW264.7细胞I-κBα和p-I-κBα蛋白表达参照1.3.4项,RAW264.7细胞培养6 h后,哺乳动物蛋白抽提试剂盒提取蛋白样本,BCA蛋白浓度测定试剂盒测定蛋白浓度后定量,每孔为40 μg上样。采用两步法进行实验,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离总蛋白,通过蛋白快速转印仪将蛋白转移至聚偏氟乙烯膜(PVDF膜)上,TBST洗涤3次,5%牛血清白蛋白(BSA)封闭2 h,TBST洗涤3次,用封闭液分别按1∶1 000和1∶10 000稀释I-κBα和p-IκBα抗体,室温震荡孵育2 h, 4 ℃过夜,TBST洗涤3次,用TBST按1∶5 000稀释羊抗兔IgG抗体,室温震荡孵育2 h,TBST洗涤3次,用ECL超敏发光液显影,于凝胶成像仪中曝光并记录结果,使用Quantity One v4.62软件对条带进行定量分析,并以β-actin为内参标化蛋白电泳条带的灰度值。
1.4数据分析
2结果
2.1RAW264.7细胞活性
当空白血清及不同剂量PCWEPS体积分数(V/V)为0.5%~1.5%作用于RAW264.7细胞24 h时,与对照组比较,RAW264.7细胞存活率无显著性差异,提示在此体积范围内空白血清及含药血清对于RAW264.7细胞本身的生长无显著影响;超过此添加量,随着血清体积的增加,RAW264.7细胞的生长受到显著影响。为有效反映药物的药效,在后续实验中,血清体积分数(V/V)设定为1.5%。见表1。
2.2对RAW264.7细胞释放NO的影响
与对照组比较,模型组显著刺激RAW264.7细胞释放NO(P<0.001);与模型组比较,不同剂量的PCWEPS均能抑制RAW264.7细胞释放NO,且呈剂量依赖性(P<0.001)。见表2。
2.3RAW264.7细胞释放TNF-α及IL-6
与对照组比较,模型组显著刺激RAW264.7细胞释放TNF-α和IL-6(P<0.001);与模型组比较,不同给药剂量的PCWEPS均能抑制RAW264.7细胞释放TNF-α和IL-6,且呈剂量依赖性(P<0.001)。见表3。
2.4RAW264.7细胞TNF-α,IL-6 mRNA表达
与对照组比较,模型组显著提高了RAW264.7细胞TNF-α和IL-6 mRNA的表达水平(P<0.001);与模型组比较,不同给药剂量的PCWEPS均能降低RAW264.7细胞中TNF-α和IL-6 mRNA的表达水平,且呈剂量依赖性(P<0.001)。见表4。
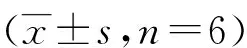
表1 空白血清及PCWEPS对细胞活性的影响
(1)与对照组比较,P<0.001
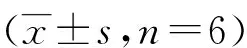
表2 PCWEPS对RAW264.7细胞释放NO的影响
(1)与对照组比较,P<0.001;(2)与模型组比较,P<0.001
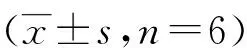
表3 PCWEPS对RAW264.7细胞释放TNF-α和IL-6的影响
(1)与对照组比较,P<0.001;(2)与模型组比较,P<0.001
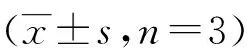
表4 PCWEPS对RAW264.7细胞TNF-α mRNA和IL-6 mRNA表达的影响
(1)与对照组比较,P<0.001;(2)与模型组比较,P<0.001
2.5RAW264.7细胞I-κBα蛋白及p-I-κBα蛋白表达
以β-actin作为内参照,RAW264.7细胞经LPS干预6 h后,与对照组比较,模型组p-I-κBα蛋白表达显著升高(P<0.001);与模型组比较,各给药组含药血清均能抑制RAW264.7细胞p-I-κBα蛋白的表达,且呈剂量依赖性(P<0.001)。见图1,表5。

图1 PCWEPS对RAW264.7细胞I-κBα蛋白表达的影响Fig.1 Effect of PCWEPS on I-κBα protein expressions in RAW264.7 cells 表5 PCWEPS对RAW264.7细胞I-κBα蛋白表达的影响
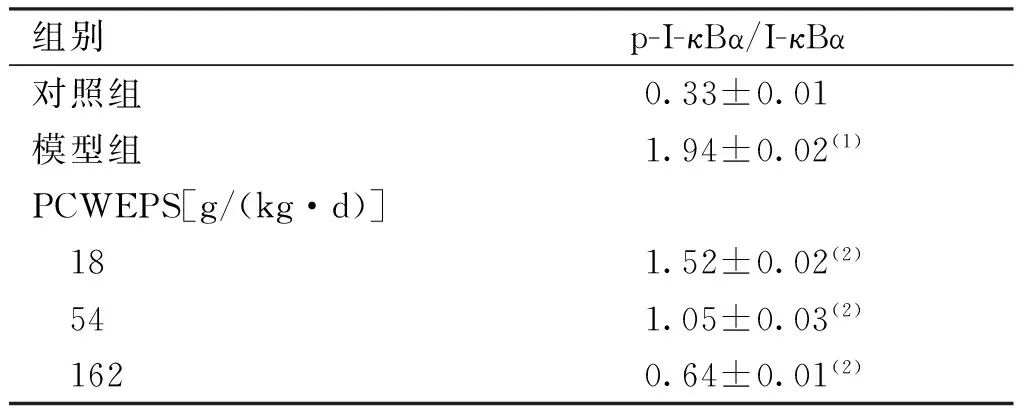
组别p-I-κBα/I-κBα对照组0.33±0.01模型组1.94±0.02(1)PCWEPS[g/(kg·d)] 181.52±0.02(2) 541.05±0.03(2) 1620.64±0.01(2)
(1)与对照组比较,P<0.001;(2)与模型组比较,P<0.001
3讨论
头花蓼是贵州苗族民间常用药材,是治疗泌尿系统感染的良药,具有突出的抗菌和抗炎作用。由于其化学成分复杂,因此在本研究中,采用头花蓼含药血清,研究其对LPS诱导巨噬细胞炎症因子的影响,代替中药粗提物作为药物载体既避免了药物的物理化学性质对实验结果的影响,又能够更好的模拟药物在体内发挥作用的过程[11]。巨噬细胞是机体炎症反应的一个重要参与者,在被感染过程中,被激活的巨噬细胞能释放致炎因子NO,IL-6和TNF-α等炎症因子,促进组织的重建修复;但过量炎症因子的释放会加重炎症反应,导致组织损伤、并产生病理变化[12-13]。脂多糖是革兰氏阴性菌菌壁的主要活性成分,是诱导巨噬细胞释放炎症介质最强烈、最有效的激活物,在革兰氏阴性菌感染中发挥重要作用[14]。因此,抑制巨噬细胞中NO,IL-6和TNF-α等致炎因子的过度释放对抗炎治疗意义重大。本研究结果证实,LPS诱导巨噬细胞炎症因子释放增加,PCWEPS能显著降低TNF-α和IL-6 mRNA的水平,并抑制巨噬细胞中NO,TNF-α和IL-6的释放。
NF-κB是早期核转录因子,在静息状态下,NF-κB和I-κB形成复合体存在于胞浆中。I-κB有多种亚型,包括I-κBα、I-κBβ、I-κBγ、I-κBδ、I-κBε、p100、p105和Bcl-3,其中I-κBα尤为关键,它在核内对NF-κB的抑制作用最强[15],因此在本研究中选取I-κBα为考察指标,在细菌感染下,LPS等外源性诱导剂使I-κB激酶(IKK)活化,活化后的IKK将I-κB磷酸化(生成p-I-κBα),使NF-κB和I-κB解离,游离的NF-κB迅速移位到细胞核,启动基因如TNF-α,iNOS的转录和表达,导致炎症的发生[16]。本研究发现,LPS能够通过显著促进RAW264.7细胞中I-κBα的磷酸化从而激活NF-κB信号通路,但PCWEPS能够有效地抑制这一过程,提示头花蓼含药血清能够通过抑制I-κBα的磷酸化调控NF-κB信号通路,进而抑制炎症因子NO,TNF-α及IL-6的释放。
综上,头花蓼的抗炎作用可能与其调控NF-κB信号通路,降低TNF-α和IL-6 mRNA的水平,抑制炎症因子NO,TNF-α和IL-6的释放有关。研究结果为深入探讨头花蓼在泌尿系统感染中的作用奠定了基础,也为头花蓼的进一步开发应用提供了依据。
4参考文献
[1] 张丽娟,王永林,王珍,等.头花蓼活性组分化学成分研究[J].中药材, 2012(9):1425-1428.
[2] Goran B,BjornW,Catharina S,et al.Escherichiacoli,fimbriae,bacterial persistence and host response induction in the human urinary tract[J].Int J Med Microbiol, 2005(6):487-502.
[3] Anju B,Sanjay C,Kusum H.Pseudomonas quinolone signaling system:A component of quorum sensing cascade is a crucial player in the acute urinary tract infection caused byPseudomonasaeruginosa[J].Int J Med Microbiol, 2014(8):1199-1208.
[4] 于明.黑果腺肋花楸和头花蓼的化学成分及其生物活性的研究[D].沈阳:沈阳药科大学, 2006:101.
[5] Liao SG,Zhang LJ,Sun F,et al.Antibacterial and anti-inflammatory effects of extracts and fractions fromPolygonumcapitatum[J].J Ethnopharmacol, 2011(3):1006-1009.
[6] Yona S,Jung S.Monocytes:subsets,origins,fates and functions[J].Curr Opin Hematol, 2010(1):53-59.
[7] 徐霄龙,何莎莎,万长荣,等.安石榴苷通过抑制TLR4/MAPKs/NF-κB信号通路的激活降低脂多糖诱导的巨噬细胞炎症反应[C].中国畜牧兽医学会中兽医学分会全国代表大会及学术年会, 2014:252-264.
[8] 张馨方,王强松,崔元璐.痹祺胶囊提取物对RAW264.7细胞模型的抗炎作用[J].中成药, 2014(1):26-30.
[9] Gao SY,Li J,Wang L,et al.Ethanol but not aqueous extracts of tubers ofSauromatumGiganteum(Engl.)CusimanoandHettinhibit cancer cell proliferation[J].Asian Pac J Cancer Pre, 2014(24):10613-10619.
[10]田友清,尚靖,何婷,等.基于中药血清化学及血清药理学方法探讨香青兰保护心肌细胞缺氧/复氧损伤物质基础[J].中国中药杂志, 2012(5):620-624.
[11]Yin JJ,Luo YQ,Deng HL,et al.HuganQingzhi medication ameliorates hepatic steatosis by activating AMPK and PPARα pathways in L02 cells and HepG2 cells[J].J Ethnopharmacol, 2014(1):229-239.
[12]代艳文,杨莉,万静枝,等.竹节参醇提物对LPS诱导RAW264.7细胞炎症的保护作用[J].中国实验方剂学杂志, 2014(2):163-166.
[13]奉有才,邓耀良,陶之伟,等.高迁移率族蛋白B1对磷酸钙诱导巨噬细胞释放炎症因子的协同作用[J].中国组织工程研究, 2014(33):5317-5322.
[14]倪志宇.CCK-8对炎症反应中促炎及抗炎性细胞因子表达的调控机制研究[D].石家庄:河北医科大学, 2005:54.
[15]刘辉,姚咏明.细胞内炎症信号通路交汇作用研究进展[J].中国病理生理杂志, 2005(8):1607-1613.
[16]Wang ZQ,Jiang W,Zhang Z,et al.Nitidine chloride inhibits LPS-induced inflammatory cytokines production via MAPK and NF-kappaB pathway in RAW 264.7 cells[J].J Ethnopharmacol, 2012(1):145-150.
(2016-03-11收稿,2016-05-28修回)
中文编辑: 潘娅; 英文编辑: 刘华
Effect of the Drug-containing Serum of Miao MedicinePolygonumcapitatumon Inflammatory Cytokines in Macrophages
XU Dan1,2, ZHAO Feifei1,3, YANG Xin1,3, LIU Jun1,2, LI Jing1,2, XU Guobo1,2, LIAO Shanggao1,2
(1.SchoolofPharmacy,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.EngineeringResearchCenterfortheDevelopmentandApplicationofEthnicMedicinesandTCM,MinistryofEducation,Guiyang550004,Guizhou,China;3.GuizhouProvincialKeyLaboratoryofPharmaceutics,Guiyang550004,Guizhou,China)
[Abstract]Objective: To investigate the effect of Miao medicine Polygonum capitatum on inflammatory cytokines released from Lipopolysaccharide (LPS)-induced monocyte macrophage (RAW264.7) in mice. Methods: The drug-containing serum (PCWEPS) of Polygonum capitatum was prepared by classical water extraction and alcohol precipitation method. The inflammatory damage model of RAW264.7 cells was established by 10 g/L lipopolysaccharide (LPS). NO content was detected by the Griess assay, the protein expression of TNF-α and IL-6 expression were detected by ELISA in the cell culture supernatant, the mRNA expression of TNF-α and IL-6 were determined by Real Time-PCR, and the protein expressions of I-κBα and p-I-κBα in NF-κB pathway were measured by Western blot. Results: Compared with the model group, the PCWEPS of 3 kinds of different doses could significantly inhibit the release of NO, TNF-α and IL-6 in LPS-induced RAW264.7 cells (P<0.001). In addition, PCWEPS could significantly decrease the mRNA expression levels of TNF-α and IL-6 (P<0.001), down-regulated the protein expression of p-I-κBα protein (P<0.001) and decrease phosphorylation of I-κBα protein in NF-κB pathway (P<0.001). Conclusion: P. capitatum can inhibit the inflammatory cytokines release from the macrophage cells, and the mechanism may be related to its inhibition of phosphorylation of I-κBα protein in NF-κB pathway.
[Key words]plant medicine; Polygonum capitatum; mononuclear macrophage; inflammatory factors; NF-κB pathway
*[基金项目]国家自然科学基金(81160516;81560570;81260688)
[中图分类号]R965.2
[文献标识码]A
[文章编号]1000-2707(2016)06-0635-05
DOI:10.19367/j.cnki.1000-2707.2016.06.004
**贵州医科大学2013级硕士研究生
***通信作者 E-mail:lshangg@163.com
网络出版时间:2016-06-1网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160616.1725.050.html
