头花蓼对H.pylori感染大鼠模式识别分子DC-SIGN、TLR4表达的影响*
2016-06-30任艳君赵书琴江明礼孙朝琴
任艳君, 莫 非*, 何 芸, 赵书琴, 江明礼, 孙朝琴
(贵州医科大学 临床检验教研室, 贵州 贵阳 550004)
头花蓼对H.pylori感染大鼠模式识别分子DC-SIGN、TLR4表达的影响*
任艳君**, 莫非***, 何芸, 赵书琴, 江明礼, 孙朝琴
(贵州医科大学 临床检验教研室, 贵州 贵阳550004)
[摘要]目的: 观察头花蓼对幽门螺杆菌(H. pylori)感染SD大鼠对免疫应答模式识别受体DC-SIGN、TLR4蛋白和mRNA表达的影响,探讨头花蓼抗H.pylori可能的机制和调节作用。方法: SD大鼠分为空白组、模型组、药物组及药物空白组,模型组及药物组用1×1011cfu/L H.pylori菌液进行灌胃,空白组和药物空白组用脑心浸液肉汤灌胃,8周后,取大鼠胃黏膜显微镜观察组织学改变,鉴定造模是否成功;造模成功后,药物组和药物空白组大鼠取头花蓼灌胃处理,空白组和模型组给予生理盐水灌胃;采用免疫组织化学法和实时荧光定量PCR法(real-time PCR)测定大鼠胃黏膜中DC-SIGN、TLR4蛋白和mRNA表达,观察各组大鼠胃黏不同部位的表达情况。结果: 大鼠感染H.pylori后,胃黏膜腺体排列不规则,黏膜下层可见血管充血及大量淋巴细胞浸润,表明造模成功;免疫组织化学和real-time PCR结果显示 H.pylori上调了TLR4 、DC-SIGN的表达(P<0.05),经头花蓼处理后,表达明显下调(P<0.05);TLR4、DC-SIGN主要在胃黏膜上皮细胞胞浆中表达,H.pylori感染大鼠后TLR4 、DC-SIGN表达强阳性。结论: H.pylori感染可上调大鼠胃黏膜上皮细胞DC-SIGN、TLR4的表达,头花蓼处理后,其表达水平降低。
[关键词]螺杆菌,幽门; 基因表达; 免疫; Toll样受体; C型凝集素受体; 头花蓼
幽门螺杆菌是一种螺旋形、多鞭毛、微需氧的革兰阴性细菌,可以引发H.pylori相关性胃炎、消化性溃疡及胃癌等[1-4]。以C型凝集素受体(CLR)及Toll样受体(TLR)为代表的固有免疫分子,它们能识别相应抗原进而通过不同的方式进行抗原呈递,CLR 中的DC-SIGN(dendritic cell-specific inter-cellular adhesion molecule-3-grabbing non-integrin, CD209)属Ⅱ型跨膜蛋白,具有模式识别受体功能,在针对病原微生物的免疫反应中,可通过协同Toll样受体参与免疫反应;TLR4作为TLR家族主要成员,是机体激活固有免疫和适应性免疫对抗病原微生物的重要因素[5-6]。本研究通过检测H.pylori感染SD大鼠及经头花蓼处理后大鼠胃黏膜中TLR4、DC-SIGN蛋白和mRNA表达变化,探讨H.pylori引起的固有免疫平衡调节机制。
1材料与方法
1.1试剂及仪器
苗药头花蓼浸膏,批号14196 ,由浙江众益药业有限公司提供。SPF级SD大鼠,6~8周龄,150~180 g,购买于第三军医大学实验动物中心,批号SCXK(军)2012-0011。H.pylori国际标准测序株SS2000,由中国疾病控制中心传染病所张建中教授惠赠。哥伦比亚血琼脂(购于OXOID公司)、万古霉素、两性霉素、 多粘菌素B、TMP(购于上海生工生物)、兔抗DC-SIGN抗体(Bioss公司)、TLR4单克隆抗体(abcam公司)、二抗试剂盒(中杉)、PBS缓冲、柠檬酸缓冲液(C6H8O7·H2)、DAB显色剂、二甲苯、中性树胶、无水乙醇、苏木素、DAB显色液、Omega RNA提取试剂盒、ROCHE LightCycler480 荧光定量PCR仪。
1.2方法
1.2.1H.pylori培养按照文献[7],从-80 ℃冰箱中取出H.pyloriSS2000,待室温溶解后,倾倒于哥伦比亚血琼脂平皿内涂抹均匀,三气培养箱内培养72 h(37 ℃、5% O2、10% CO2、85% N2,相对湿度>95%),观察细菌生长情况,稳定传代3次后进行H.pylori鉴定(尿素酶、触酶、氧化酶阳性)。
1.2.2动物模型复制及头花蓼处理将52只SD大鼠随机分为造模组和对照组,造模组分为模型组(16只)和药物组(10只),对照组分为空白组(16只)和药物空白组(10只)。各种大鼠禁食不禁水12 h,用5 g/L的NaHCO3和消炎痛混合液按体质量给雄鼠1.0 mL/只,雌鼠0.5 mL/只进行灌胃预处理1次;预处理后继续禁食不禁水,6 h后模型组及药物组给予1×1011cfu/LH.pylori标准菌株SS2000菌液1.5 mL灌胃,灌胃后需禁食禁水4 h,隔天1次,共5次;空白组及药物空白组以等量的无菌脑心浸液肉汤灌胃。末次灌胃8周后,模型组、空白组随机抽取6只大鼠,鉴定其造模是否成功,大鼠胃黏膜有H.pylori定植且胃黏膜出现慢性炎症病理学改变判断为造模成功[8-9]。造模成功后,药物组及药物空白组大鼠参考文献[7]每天给予头花蓼灌胃处理(1.58 g生药/d),空白组和模型组给予等量无菌生理盐水灌胃,1次/d,连续给药2周。末次灌胃结束后,正常饲养4周,处死大鼠,取胃黏膜组织进行石包埋或-80 ℃冻存备用。
1.2.3DC-SIGN、TLR4蛋白表达采用免疫组织化学 (S-P )法检测,石蜡切片常规脱蜡,柠檬酸盐缓冲液微波修复,3% H2O2溶液孵育37 ℃孵育10 min,PBS液冲洗,分别滴加DC-SIGN(Bioss公司)、TLR4(abcam公司)一抗 ,4 ℃孵育过夜;次日取出至室温,PBS 液冲洗,滴加二抗,室温孵育30 min,PBS液冲洗,应用DAB溶液(现配)显色,PBS冲洗,苏木素轻度复染20 s,自来水冲洗,脱水,透明,中性树脂封片。DC-SIGN、TLR4蛋白的阳性表达为细胞质内出现棕黄色颗粒,选取5个高倍镜视野,Image pro- Plus 6.0软件测量各组阳性产物的平均光密度值作为DC-SIGN、TLR4蛋白的阳性表达量。
1.2.4DC-SIGN、TLR4 mRNA表达采用Real-Time PCR检测,Omega试剂盒提取样品的总RNA,将RNA逆转录为cDNA,以β-actin作为内参基因,采用Real-Time PCR检测DC-SIGN、TLR4 mRNA表达水平。采用primer 5 设计DC-SIGN、TLR4 扩增引物(见表1)。反应条件为: 95 ℃ 3 min,95 ℃ 7 s、 57 ℃ 10 s、75 ℃ 15 s, 40个循环。每组做3个生物重复,采用2-ΔΔCT法对目标基因的表达差异进行分析。

表1 PCR扩增引物序列
1.3统计学方法
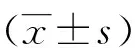
2结果
2.1H.pylori及动物模型
H.pylori经培养后,在哥伦比亚血平板上呈半透明,针尖状细小菌落。触酶、尿素酶、氧化酶鉴定呈阳性反应,革兰染色呈弧形、螺旋状、S形的革兰阴性杆菌(图1A)。H.pylori感染SD大鼠8周后,取大鼠胃黏膜进行细菌微需氧培养结果显示H.pylori定植密度约为105cfu/g;空白对照组大鼠胃黏膜完整,腺体排列规则,无异常黏膜肌层(图1B),模型组H.pylori感染后的胃黏膜腺体排列不规则,胃黏膜下层可见血管内充血及大量淋巴细胞浸润(图1C)。
2.2DC-SIGN、TLR4蛋白表达
在胃黏膜上皮细胞胞浆可见DC-SIGN、TLR4蛋白表达,免疫组织化学染色见棕黄或棕褐色颗粒。在空白组中,上皮细胞构成规则的腺体,基本未见DC-SIGN、TLR4蛋白表达。模型组中,DC-SIGN及TLR4表达强阳性,胃腺松散,排列不规则,药物组经头花蓼处理后,表达减弱,其平均光密度值比较,模型组高于空白组和药物组(P<0.05),药物空白组与空白组比较,差异无统计学意义(P>0.05),见图2。
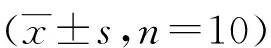
表2 各组大鼠DC-SIGN、TLR4蛋白表达平均光密度值
(1)与空白组比较,P<0.05;(2)与模型组比较,P<0.05
2.3DC-SIGN、TLR4 mRNA表达
结果显示,H.pylori刺激后,模型组的TLR4、DC-SIGN mRNA明显高于空白组 (P<0.05),药物组经头花蓼处理后,TLR4 、DC-SIGN mRNA的表达水平下降 (P<0.05),而药物空白组与空白组TLR4 、DC-SIGN mRNA的表达水平比较,差异无统计学意义(P>0.05),见图3。
3讨论
H.pylori作为一种模式致病菌,其细胞壁主要成分为脂多糖,含有病原体相关模式分子,而胃上皮细胞表面具有的模式识别受体可调控前者识别H.pylori,行使抗原提呈细胞功能,募集的炎症细胞相互作用和协调,形成固有免疫局部防御乃至调节后续的适应性免疫反应[10-12]。林凯等[12]研究表明,在H.pylori感染下,胃黏膜上皮细胞表达树突状细胞表型DC-SIGN,系CLR的重要成员,在针对病原微生物的免疫反应中,具有模式识别受体的功能,可通过协同Toll样受体参与免疫反应,TLR4可在人类胃上皮细胞上表达,TLR4作为LPS的优先受体,H.Pylori及其菌体成分LPS等刺激均可使TLR4的表达上调,进而激活NF-κB,促进细胞因子的合成与释放,引发炎症免疫反应。DC-SIGN、TLR4作为重要的识别模式受体,通过激活一系列的信号转到途径,调控着诸多细胞生物学行为,在H.pylori感染后的免疫反应中,发挥着重要的调节作用,SD大鼠在受到H.pylori刺激时,模式识别受体发挥着关键的作用,识别模式受体TLR4、DC-SIGN通过识别病原菌相关分子脂多糖,引起炎性因子的分泌,诱导机体免疫应答反应清除外来抗原,构成了机体免疫反应的天然屏障。但是,H.pylori的持续作用,引起过度的炎症反应,会对组织、器官造成严重的损害或导致其他相关疾病,如重症细菌感染导致TLR4通路持续活化,引起过度的炎症反应,造成败血症、TLR4信号通路过度激活从而介导激素性股骨头坏死的发生[13-14]。因此,免疫平衡的调节在免疫反应中及其重要。林凯[12]研究认为H.pylori可刺激TLR4、DC-SIGN的表达,产生炎症和免疫反应。本次研究与Castano-Rodriguez和林凯结果一致,免疫组化结果发现,感染H.pylori后,上皮细胞DC-SIGN、TLR4表达明显上调,头花蓼可能通过转录和翻译水平调节着免疫平衡。多数研究表明,中药对LPS介导的TLR4信号通路的抗炎作用,是通过影响TLR4/NF-κB的信号转导,调控释放相关炎性因子来完成的。谢毅等[15]研究发现TLR4在肝组织的表达量在加味大柴胡汤的作用下有所减少。李卿姬等[16]研究发现,人类脐静脉内皮细胞受LPS刺激后,TLR4表达升高,补阳还五汤治疗后,TLR4明显下降;本研究中在药物头花蓼作用后,DC-SIGN、TLR4的表达下调,转录和翻译水平下调一致,头花蓼的主要成分之一为黄酮,黄酮能抑制NF-κB的核转位,它的单体黄芪皂苷可以抑制LPS的核转位,头花蓼可能通过相同的作用抑制TLR4、DC-SIGN的表达,也推测头花蓼可能形成稳定的黏膜屏障,通过改变胃黏膜周围的微环境,抑制了TLR、CLR的表达,进而减少TNF-α、IL-6等炎性因子的产生以及切断了部分信号转导通路[17]。在感染H.pylori引起的固有免疫中,TLR4、DC-SIGN一方面促进免疫细胞膜表面有关免疫分子的表达和促进免疫细胞的成熟,另一方面可促进细胞因子的合成和释放,引发一系列的炎症反应,头花蓼可能通过调节TLR4和DC-SIGN的表达水平来平衡机体的反应,TLR与CLR的识别与LPS介导的信号通路以及基因多态性以及收到岩藻糖基转移酶等诸多因素影响,因此,头花蓼在模式识别过程中具体如何调控,该机制有待深入研究。
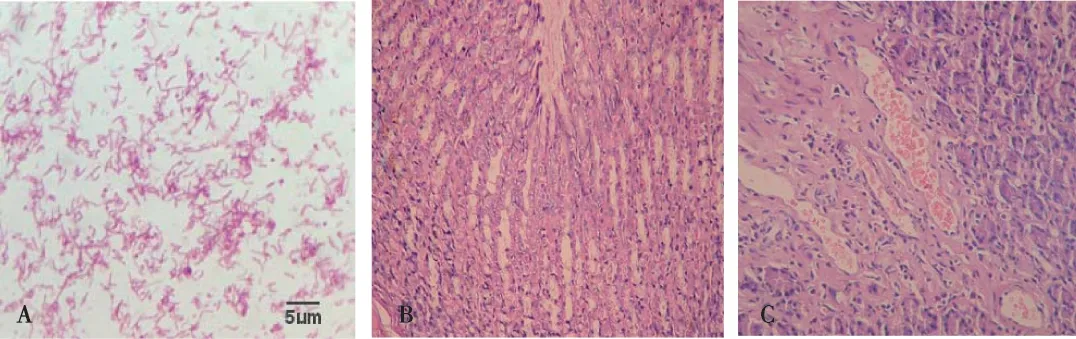
注:A为H.pylori培养(100×),B为空白组大鼠胃黏膜(HE,×400),C为模型组大鼠胃黏膜(HE,×400)图1 H.pylori培养及各组大鼠胃黏膜Fig.1 H.pylori culture and rats' gastric mucosa
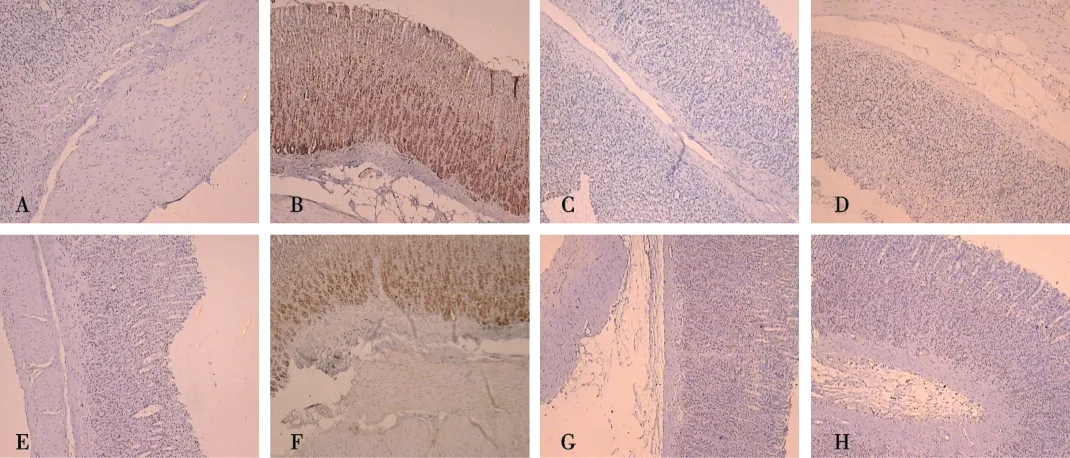
注:A、B、C及D分别为空白组、模型组、药物组及药物空白组的DC-SIGN表达E、F、G及H分别为空白组、模型组、药物组及药物空白组的TLR4表达图2 各组大鼠胃黏膜DC-SIGN及TLR4蛋白表达(SP,×40)Fig.2 Immunohistochemical staining of G cells gastric antrum(SP,×40)
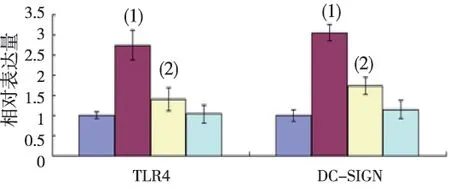
(1)与空白组比较, P<0.05;(2)与模型组比较P<0.05图3 头花蓼对H.pylori感染SD大鼠胃黏膜TLR4和DC-SIGN mRNA表达的影响Fig.3 Effect of Polygonum Capitatum on TLR4 mRNA and DC-SIGN mRNA expression of gastric mucosa of Hp infected rats
4参考文献
[1] Heyl KA, Fischer AG,Bel UB,et al.Inhibition ofHelicobacterpyloriurease activity in vivo by the synthetic nickel binding protein Hpn[J].Eur J Microbiol Immunol, 2013(3): 77-80.
[2] Pachathundikandi SK, Tegtmeyer N, Backert S. Signal transduction ofHelicobacterpyloriduring interaction with host cell protein receptors of epithelial and immune cells[J]. Gut Microbes, 2013(4): 454-474.
[3] Diesing AK, Nossol C, Faber-Zuschratter H,et al. Rapid interaction ofHelicobacterpyloriwith microvilli of the polar human gastric epithelial cell line NCI-N87[J]. Anat Rec (Hoboken), 2013(296): 1800-1805.
[4] Hongying F, Xianbo W, Fang Y, et al. Oral immunization with recombinant Lactobacil-lus acidophilus expressing the adhesin Hp0410 ofHelicobacterpyloriinduces mucosal and sys-temic immune responses[J]. Clin Vaccine Immunol, 2014(21): 126-132.
[5] Soilleux EJ, Morris LS, Leslie G, et al. Constitutive and 1080 induced expression of DC-SIGN on dendritic cell and macrophage subpopulations in situ and in vitro[J]. Leukoc Biol, 2002 (3): 445-450.
[6] Engering A, Van Vliet SJ, Hebeda K, et al. Dynamic populations of dendritic cell-specific ICAM-3 grabbing nonintegrin-positive immature dendritic cells and liver lymph node-specific ICAM-3 grabbing nonintegrin- positive endothelial cells in the outer zones of the paracortex of human lymph nodes[J]. Am J Pathol, 2004(5): 1587-1590.
[7] 黄继汉,黄晓辉.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学, 2004(9):1069-1072.
[8] Alm RA,Trust TJ.Analysis of the genetic diversity of Helicobater pylori :the tale of two genomes[J],J Mol Med, 1999 (1):834-846.
[9] Heyl KA, Fischer A, Göbel UB,et al. Inhibition ofHelicobacterpyloriurease activity in vivo by the synthetic nickel binding protein Hpn[J]. European Journal Microbiology and Immunology, 2013(1): 77-80.
[10]Wessler S,Backert S.Molecular mechanisms of epithelial-barrier disruption byHelicobacterpylori[J].Trends Micro-biol, 2008(16):397-405.
[11]Wroblewski LE,Shen L,Ogden S,et al.Helicobacterpyloridysregulation of gastric epithelial tight junctions by urease-mediated myosinⅡactivation[J].Gastroenterology, 2009(136):236-246.
[12]林凯,曾敬清,刘伟,等.固有免疫分子DC-SIGN在幽门螺杆菌感染胃黏膜上皮细胞表达意义[J].现代免疫学, 2011(1):101-103.
[13]魏滨,王红艳.巨噬细胞表面血管内皮生长因子受体-3抑制TLR4-NF-kB信号通路,抵抗内毒素休克[J].科学新闻, 2014(4):501-514.
[14]田雷,周东生,孙水,等.Toll样受体4信号通路过度激活在大鼠激素性股骨头坏死中的作用[J].西安交通大学学报:医学版, 2014(5):623-625.
[15]谢毅,陈明,谈燚,等.加味大柴胡汤对阻塞性黄疸大鼠TLR4 mRNA表达的影响[J].苏州大学学报:医学版, 2009(1):88-90.
[16]李卿姬,姜华,姜玉姬.补阳还五汤含药血清对Toll样受体4信号转导通路及氧化低密度脂蛋白受体-1表达的影响[J].中国实验方剂学杂志, 2012(1):364-366.
[17]陈浩,王军,武海阔,等.中药干预对TLR4表达影响的研究进展[J].陕西中医, 2014(1):382-384.
(2016-03-28收稿,2016-05-27修回)
中文编辑: 吴昌学; 英文编辑: 刘华
Effect ofPolygonumCapitatumon Pattern Recognition Molecules DC-SIGN, TLR4
REN Yanjun, MO Fei, HE Yun, ZHAO Shuqin, JIANG Mingli, SUN Chaoqin
(DepartmentofClinicalLaboratory,GuihzouMedicalUniversity,Guiyang550004,Guihzou,China)
[Abstract]Objective: To observe the effect of Polygonum capitatum on protein and mRNA expression of immune response pattern recognition receptor DC-SIGN, TLR4, and to investigate the possible mechanism and regulation role of Polygonum capitatum anti H.pylori. Methods: SD rats were divided into blank group, model group, drug group and drug blank group. Model group and drug group received intragastric administration of 1×1011cfu/L H.pylori bacteria solution while blank group and drug blank group received intragastric administration of brain heart infusion broth. 8 weeks later, the microscope was used to observe the histological changes of gastric mucosa of rats in order to identify whether the model was successful to. After modeling was successful, drug group and drug blank group were treated with Polygonum capitatum by intragastric administration while blank group and model group received physiological saline by intragastric administration. Immunohistochemistry and real-time PCR were adopted to detect the protein and mRNA expression of in gastric mucosa of rats. The expression of different parts of gastric mucosa of rats in each group was observed. Results: After rats were infected with H.pylori, the gastric mucosal glands showed irregular arrangement, with visible vascular congestion and a large number of lymphocytes infiltration in the submucosal layer, which proved that model was established successfully. The results of Immunohistochemistry and real-time PCR showed that H.pylori up-regulated TLR4, DC-SIGN expression level (P<0.05). After the treatment of Polygonum capitatum, TLR4 and DC-SIGN expression level significantly down-regulated (P<0.05). TLR4, DC-SIGN were mainly expressed in cytoplasm of gastric mucosal epithelial cells. After rats were infected with H.pylori, TLR4, DC-SIGN showed strongly positive expression. Conclusion: H.pylori infection can up-regulate DC-SIGN and TLR4 expression level in gastric mucosa epithelial cells, but after treatment of Polygonum capitatum their expression levels significantly decrease.
[Key words]Helicobacter pylori; gene expression; immune; Toll like receptor; type C lectin receptor; Polygonum capitatum
*[基金项目]高等学校特色专业建设点[No(2010)15]; 贵州省科技计划课题[黔科合J字(20142027)号]; 贵州省科技合作计划基金[黔科合LH(2015)7417号]; 贵州省卫生计生委科学技术基金[gzwjkj2015-1-003]; 贵阳市科技计划项目 [筑科合同(20141001)号]
[中图分类号]R961.1
[文献标识码]A
[文章编号]1000-2707(2016)06-0640-05
DOI:10.19367/j.cnki.1000-2707.2016.06.005
**贵州医科大学2013级临床检验诊断学硕士研究生
***通信作者 E-mail:354406804@qq.com
网络出版时间:2016-06-16网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160616.1647.022.html
