三疣梭子蟹fps克隆及其在卵巢发育中的表达分析
2016-06-29朱冬发邱锡尔周彦琦柳志业
朱 韬, 朱冬发, 邱锡尔, 周彦琦, 柳志业, 谢 熙
(宁波大学 海洋学院, 宁波 315211)
三疣梭子蟹fps克隆及其在卵巢发育中的表达分析
朱韬, 朱冬发, 邱锡尔, 周彦琦, 柳志业, 谢熙
(宁波大学 海洋学院, 宁波 315211)
摘要法尼基焦磷酸合成酶(FPS)是类异戊二烯生物合成途径中的关键酶,参与甲壳动物甲基法尼酯(MF)等萜类激素的合成。为研究FPS在甲壳动物卵巢发育中的调控作用,采用RT-PCR和cDNA末端快速扩增技术(RACE技术)克隆得到了三疣梭子蟹fps(Ptfps)的序列全长(GenBank登录号:KM013803)。结果显示:Ptfps cDNA全长为2 360 bp,开放阅读框长1 290 bp,编码429个氨基酸。生物信息学分析发现PtFPS具有7个异戊烯基转移酶的保守结构域,与已公布的内华达古白蚁FPS同源性最高(达到58%)。实时荧光定量PCR分析结果显示:fps主要在大颚器(MO)中表达,远高于其它组织的表达水平 (P<0.01);在第1次卵巢发育过程中, fps的表达水平在Ⅳ期显著升高(P<0.05),之后略有下降;在第2次卵巢发育过程中,fps的表达水平在Ⅲ期显著升高(P<0.05),并在IV期达到最大。以上结果表明fps可能参与三疣梭子蟹卵巢发育的调控。
关键词三疣梭子蟹;法尼基焦磷酸合成酶;克隆;卵巢发育;表达水平
法尼基焦磷酸合成酶(farnesyl diphosphate synthase,FPS)是一种异戊烯基转移酶,催化牻牛儿基焦磷酸(geranyl pyrophophate,GPP)与异戊烯基焦磷酸(isopentenyl diphosphate,IPP)头尾缩合生成法尼基焦磷酸(farnesyl pyrophophate,FPP)[1]。产物FPP是多种类异戊二烯物质的前体化合物,包括长萜醇、泛醇、类固醇和其他异戊烯蛋白等[2]。与脊椎动物不同,甲壳动物和昆虫在合成FPP后,由于缺乏羊毛脂固醇合成酶和鲨烯合成酶而无法合成胆固醇[3],取而代之的是倍半萜类物质。甲基法尼酯(methyl farnesoate,MF)就是FPP经催化生成的一种重要的类倍半萜烯激素。从1958年起,科学家研究并证明了MF是昆虫保幼激素Ⅲ(Juvenile hormone Ⅲ,JH Ⅲ)的前体类似物,其结构和功能与之相似,在甲壳动物的蜕皮、变态、应激性调节和卵巢发育等生理活动方面有重要作用[4]。
一般认为昆虫的JH是由咽侧体(corpora allata,CA)合成后直接分泌进入血淋巴的, 但也有研究报道其他器官参与JH的合成[5]。科学家们已经在一些昆虫中鉴定出了fps的编码序列,包括球菜夜蛾(Agrotisipsilon)[6]、冈比亚按蚊(Anophelesgambiae)[2]等,且在CA中有大量表达[7]。水生甲壳动物的大颚器(mandibular organ,MO)与昆虫CA同源[8],均起源于外胚层,并且是MF合成和分泌的唯一场所[4]。此外,甲壳动物MO分泌的MF被认为是一种性腺刺激激素,具有启动和加速卵黄发生,促进卵黄蛋白原(vitellogenin,Vg)合成的功能[9]。但是也有一些研究表达了不同的观点:Abdu等[10]在对克氏原螯虾(Procambarusclarkii)的研究中发现高浓度的MF会导致其死亡;Medesani等[11]对红螯螯虾(Cheraxquadricarinatus)的研究表明,MF对肝胰腺中vg的表达没有明显的影响。MF对卵巢发育的调控作用还有待进一步阐明。
FPS作为类异戊二烯合成途径中的重要催化酶,已经在许多生物中有所研究,但在甲壳动物中尚未有研究报道。本研究以三疣梭子蟹(Portunustrituberculatus)为材料,克隆获得了三疣梭子蟹fps的全长cDNA序列,并运用实时荧光定量PCR(quantitative real-time PCR)对其在不同组织和卵巢发育过程中表达量的变化情况进行了分析,旨在阐明fps在三疣梭子蟹卵巢发育中的调控作用,丰富和完善甲壳动物卵巢发育的内分泌调节机制。
1 材料与方法
1.1 实验材料
野生三疣梭子蟹暂养于宁波市宁海县得水育苗场,每日喂养鲜活蛏子。于2014年10月中旬,采集蜕皮间期雌性三疣梭子蟹(头胸甲宽:14.8~16.3 cm;体质量:166~254 g)的表皮、心脏、肝胰腺、Y器、大颚器、X器、卵巢和胸神经节用于组织表达差异性分析。于2014年8月至2015年3月,采集第1次卵巢发育Ⅰ~Ⅴ期[12]三疣梭子蟹(头胸甲宽:12~18 cm;体质量:90~335 g);于2015年4月至5月,采集第2次卵巢发育Ⅰ~Ⅳ期[13]三疣梭子蟹(头胸甲宽:14.3~18.3 cm;体质量:175~455 g) 的MO用于分析其中FPS的表达水平变化。组织剥离后存放在RNA保存液中,于-20℃保存。
1.2 实验方法
总RNA提取 将上述组织样品按照Trizol试剂盒(上海生工)说明进行总RNA提取。总RNA用DNaseI (Takara)去除基因组DNA后,用琼脂糖凝胶电泳检测其完整性,并用超微量分光光度计Nanodrop 2 000 (Thermo scientific)进行纯度分析。
1.3 基因克隆与序列分析
采用RT-PCR进行fps核心片段的扩增。模板cDNA由MO总RNA通过 PrimeScript®RT reagent Kit试剂盒(Takara)反转录获得,扩增引物设计自三疣梭子蟹转录组数据库中fps的同源序列 (表1)。根据得到的核心序列设计基因特异性引物,并利用RACE技术分别对Ptfps的3′和5′端进行巢式PCR扩增(表1)。其中,3′RACE-cDNA时将接头引物AP替换上述试剂盒中的OligodTprimer和Random 6 mers后用相同的方法进行制备,5′ RACE-cDNA按照 SMARTerTMRACE cDNA Amplification Kit试剂盒(Clontech)进行合成(表1)。以上PCR均在25 μL体系下进行反应,反应条件如下:94℃预变性3 min;94℃变性30 s,57℃退火30 s,72℃延伸30 s,33个循环;72℃再延伸10 min。所有PCR产物经琼脂糖电泳后,用DNA回收试剂盒(上海生工)进行回收和连接,经扩大培养后选取阳性克隆菌落交由上海生工生物工程有限公司进行测序。得到测序结果后用VectorNTI 10.0对序列进行拼接,获得三疣梭子蟹fps(Ptfps)的全长cDNA序列,并参照邱锡尔等[14]的方法进行序列分析。

表1 fps扩增及表达所用引物
1.4 实时荧光定量(qRT-PCR)
取1.0 μg各个组织总RNA 用PrimeScript RT reagent Kit试剂盒反转录得到cDNA。根据fpscDNA全长设计一对特异性引物YG-F和YG-R(表 1),以actin-F 和actin-R(表 1)作为内参引物进行实时荧光定量测定fps在不同组织和卵巢发育中的表达量。qRT-PCR的反应条件:95℃预变性2 min;95℃变性5 s,58.2℃退火20 s,68℃延伸20 s,共40个循环;95℃变性15 s,55℃退火15 s、升温25 min,95℃延伸15 s。最后用SPSS17. 0统计分析软件对获得的数据进行分析。
2结果与分析
2.1 三疣梭子蟹fps的生物信息学分析
将测序结果进行拼接获得2 360 bp的fpscDNA全长序列(图1),GenBank登录号:KM013803(表2)。5′端非编码区为87 bp,3′端非编码区为983 bp,开放阅读框(Open reading frame,ORF)长度为1 290 bp,编码429个氨基酸。利用ExPASy(http://ca.expasy.org/)网站在线ProtParam tool预测该序列编码的蛋白质分子式为C2146H3367N587O614S19,分子质量约为47.8 ku,等电点为8.97; TMHMM工具分析发现该氨基酸序列无跨膜结构。利用在线软件Signal 3.0 Server分析该氨基酸序列,发现存在信号肽结构,说明该序列编码的蛋白属于分泌蛋白。

图1 三疣梭子蟹fps的cDNA核苷酸序列和编码区氨基酸序列
起始密码子和终止密码子用黑体表示;保守区域用阴影表示;富含天冬氨酸的序列用方框表示;芳香族残基(FF)用加粗斜体表示
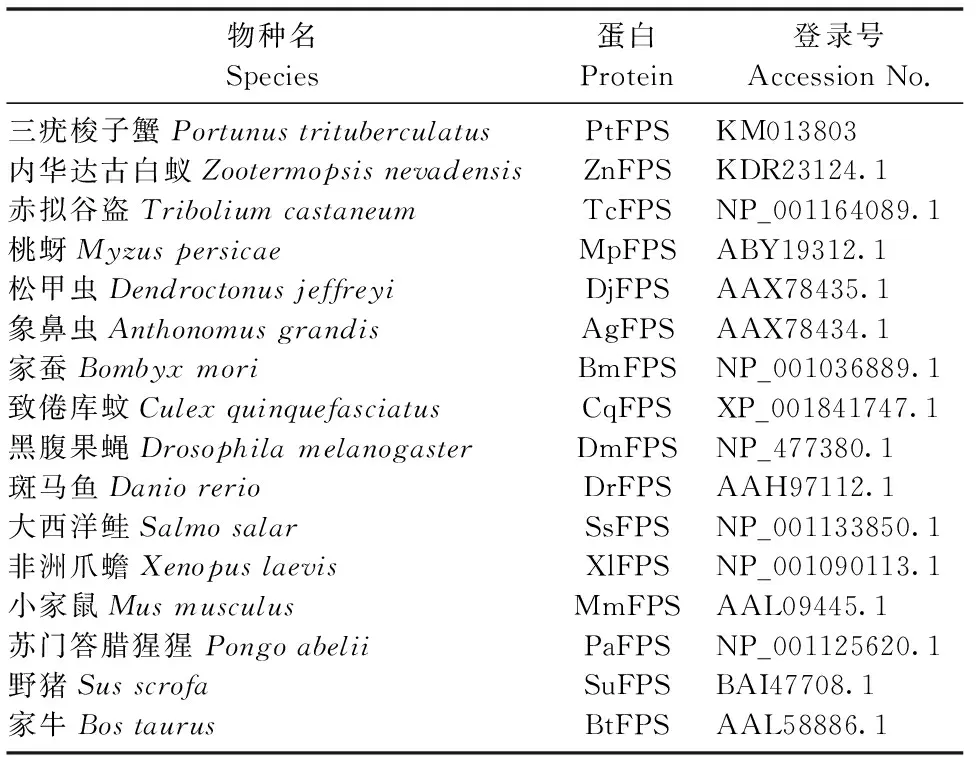
表2 用于氨基酸序列比对及进化树构建的fps登录号
利用NCBI上的BLASTp功能,搜索PtFPS的同源序列,未见其它甲壳动物FPS氨基酸序列。PtFPS与内华达古白蚁(Z.nevadensis)FPS氨基酸序列同源性最高,达到58%,与赤拟谷盗(T.castaneum)FPS氨基酸序列同源性为55%,与桃蚜(M.persicae)、家蚕(B.mori)FPS氨基酸序列同源性均为50%。因此在昆虫中选择同源性较高的4个不同物种:内华达古白蚁、赤拟谷盗、桃蚜和松甲虫(D.jeffreyi),用ClustalX软件将这些物种的FPS氨基酸序列与PtFPS氨基酸序列进行多序列比对(图2)。结果发现PtFPS氨基酸序列也具有异戊烯基转移酶的7个保守结构域,并且在结构域Ⅱ和结构域Ⅵ中都找到了高度保守的富含天冬氨酸的序列(DDXXD)。因此,本次实验克隆所得的序列为三疣梭子蟹fps(Ptfps)。
在NCBI数据库中搜索到不同物种的FPS氨基酸序列,用MEGA 4.0软件的邻接距离法构建进化树(图3)。结果显示,三疣梭子蟹FPS(PtFPS)与昆虫聚为一支,脊椎动物则单独聚为一支。
2.2fps在雌性三疣梭子蟹不同组织中的表达差异
实时荧光定量测定结果表明,fps在雌性三疣梭子蟹各组织中均有不同程度的表达(图4),但在MO中表达量远高于其他组织,差异极显著(P<0.01)。
2.3三疣梭子蟹fps在卵巢发育中的表达水平变化
实时荧光定量测定结果显示,fps在第1次卵巢发育的Ⅰ、Ⅱ和Ⅲ期表达量较低,呈缓慢上升趋势,Ⅳ期表达量显著增大(P<0.05),Ⅴ期略有下降(图5)。在第2次卵巢发育中fps的相对表达量随卵巢成熟逐步升高,其中Ⅱ期与Ⅲ期间差异显著(P<0.05),在Ⅳ期达到最大值(图6)。

图2 三疣梭子蟹FPS氨基酸多序列比对结果
7个异戊烯基转移酶的保守区域用罗马字母和下划线标出;2个天冬氨酸富集区用方框表示
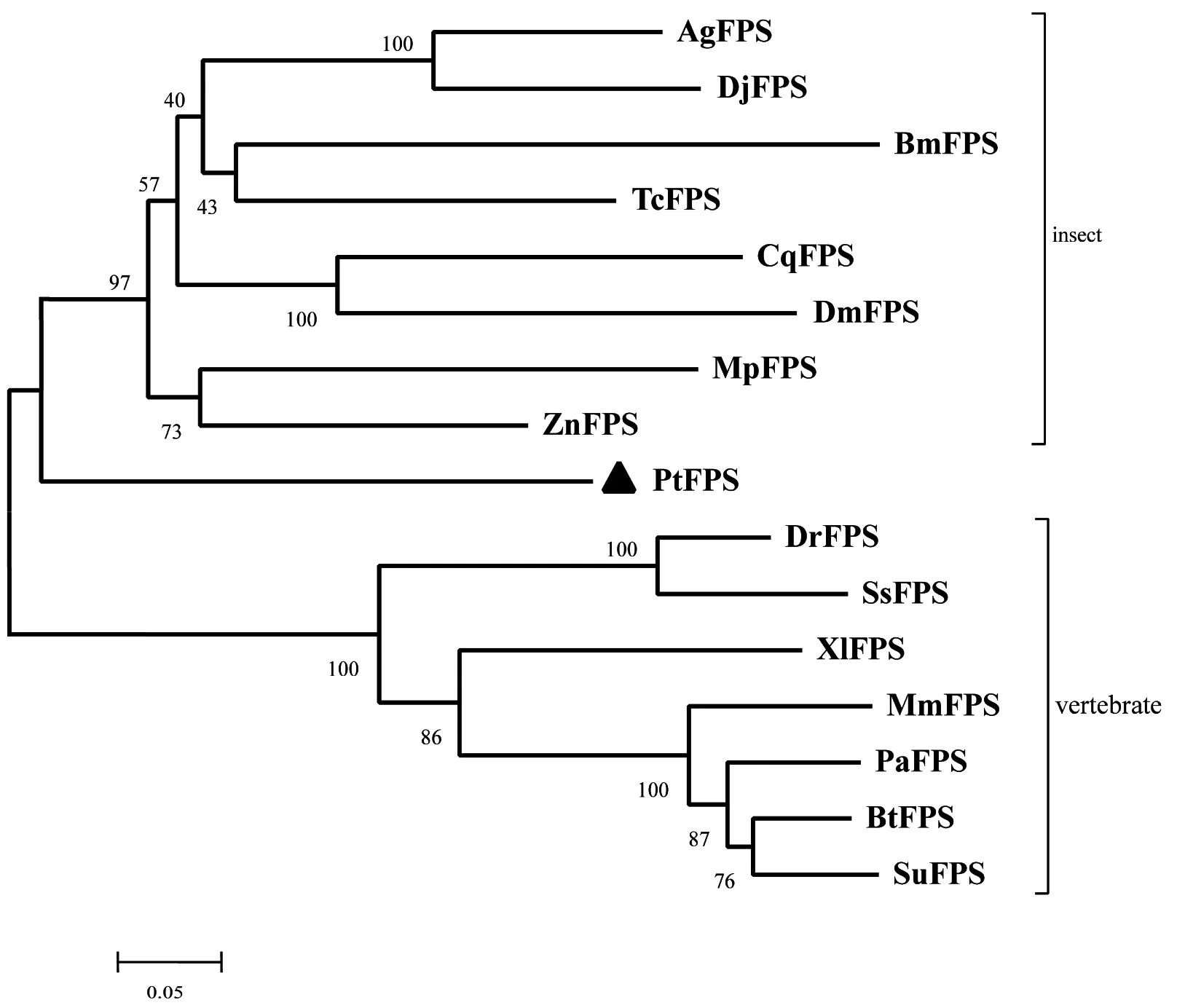
图3 FPS氨基酸序列的系统进化树
FPS氨基酸序列登录号详见表2
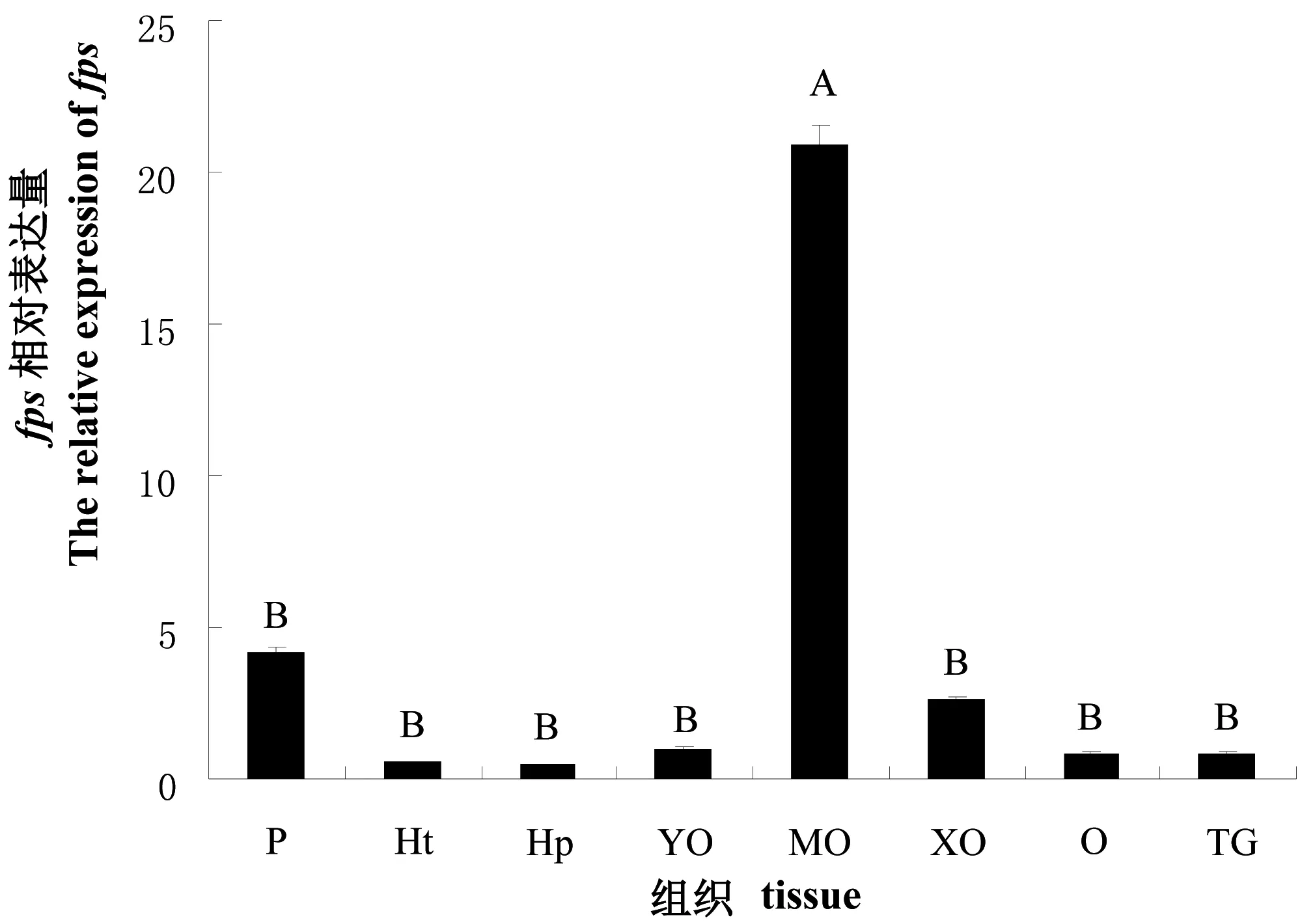
图4 fps在三疣梭子蟹不同组织里的相对表达量
P:表皮;Ht:心脏;Hp:肝胰腺; YO:Y器;MO:大颚器;XO:X器;O:卵巢;TG:胸神经节。不同大写字母表示有极显著差异(P<0.01)
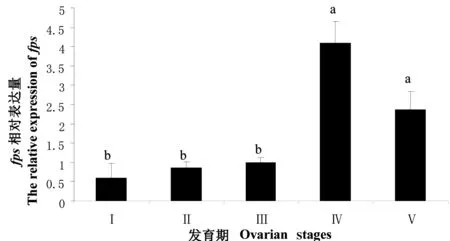
图5 三疣梭子蟹第1次卵巢发育中fps在大颚器中的相对表达量
不同小写字母表示有显著差异(P<0.05)
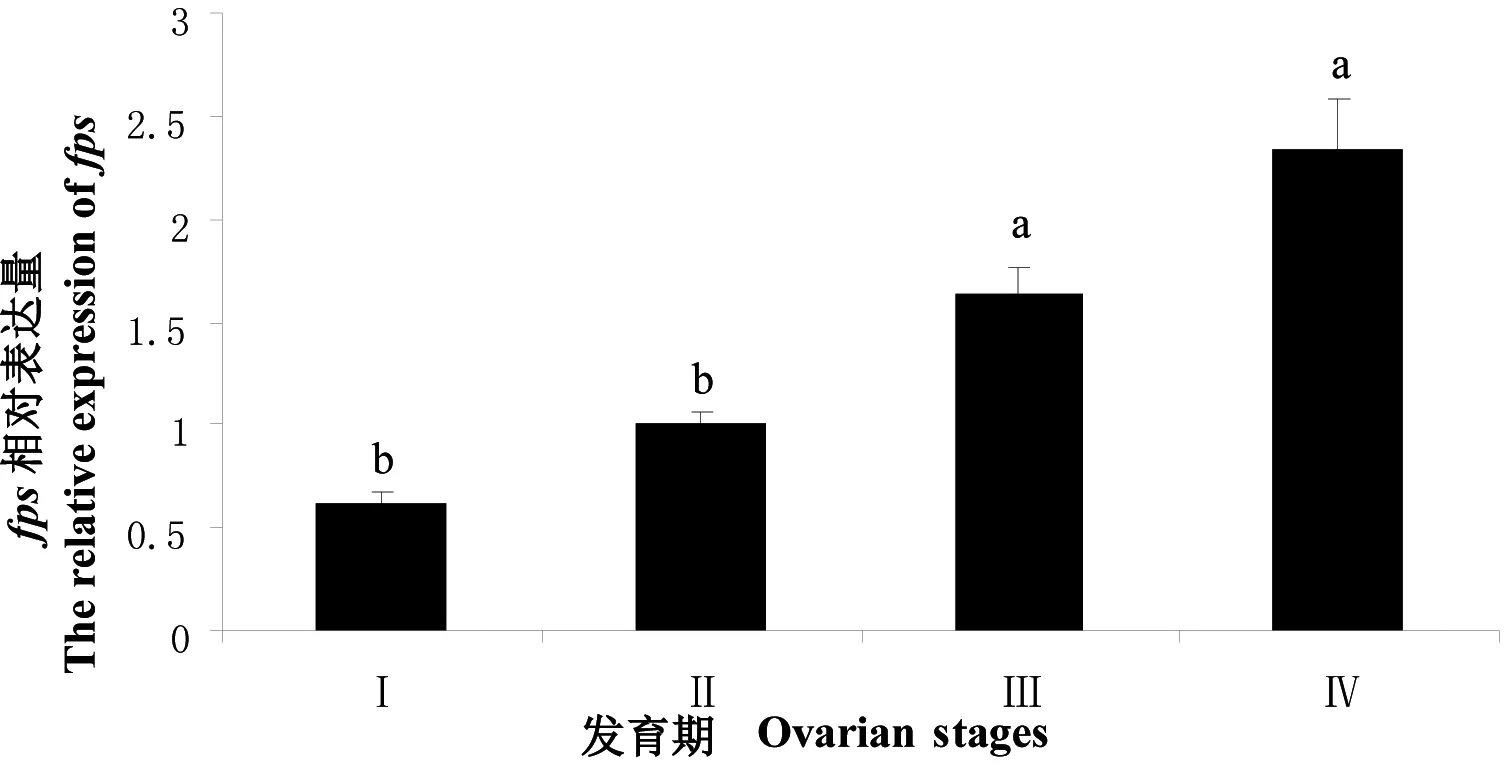
图6 三疣梭子蟹第2次卵巢发育中fps在大颚器中的相对表达量
不同小写字母表示有显著差异(P<0.05)
3 讨论
作为类异戊二烯生物合成途径中的重要催化酶,FPS在甲壳动物中尚未见研究报道。本实验克隆得到三疣梭子蟹fps的全长cDNA序列,与NCBI上已公布的昆虫FPS氨基酸序列具有较高的同源性。Gussion等[15]在对两种鳞翅目昆虫(家蚕B.mori和一星粘虫Pseudaletiaunipuncta)中编码FPS的cDNA分析发现FPS具有两种结构,分别为FPS I和FPS II。FPS I在鳞翅目昆虫的各组织中普遍表达,而FPS II则主要在咽侧体(CA)中表达,含量也高于FPS I近23倍左右,并依此认为咽侧体是分泌FPS II的主要部位[15, 16]。但是本次对三疣梭子蟹的实验中没有发现FPS的亚型,这可能与物种差异有关,也可能与鳞翅目昆虫能产生不同类型的保幼激素(JH)有关。
在与其他物种的 FPS 氨基酸序列进行比对的结果中发现, FPS基因家族具有7个异戊烯基转移酶特征结构域,分别为:结构域Ⅰ(GKXNRG)、结构域Ⅱ(WCXEXXXXXXLXXDDIXDXXXXRRG)、结构域Ⅲ(GXXAXND)、结构域Ⅳ(GQXLD)、结构域Ⅴ(KT)、结构域Ⅵ(LXEMGXFFQXQDDXLDCXGDXXVXGKXG)和结构域Ⅶ(FXXXXXXIXXR)[17],并且在结构域Ⅱ和结构域Ⅵ中均含有高度保守的富含天冬氨酸的序列(DDXXD)。许多对于该区域的研究都表明,这两个区域是丙烯基底物与异戊烯基焦磷酸(IPP)的结合位点[18]。系统进化树分析发现,三疣梭子蟹FPS与昆虫FPS聚为一支,脊椎动物单独聚为一支,这说明三疣梭子蟹fps与昆虫fps具有较高同源性,符合生物的自然进化关系。组织表达结果显示,fps在MO中表达量最高,而其他组织中的表达量均极低,具有极显著差异。这一研究结果支持了MO是MF唯一合成和分泌场所的观点[4]。
作为重要的养殖品种,对三疣梭子蟹卵巢发育调控机制的研究就极为重要。甲壳动物的卵巢发育主要是通过卵黄发生合成卵黄蛋白原(Vg),进而在卵母细胞中积累卵黄体和各类营养物质(蛋白质、脂类、碳水化合物等)的过程[19]。其中,卵黄体主要是由卵黄磷蛋白(vitellin,Vn)组成的,而卵黄蛋白原(Vg)又是Vn的前体物质[20]。据现有报道,MF能够促进卵黄发生:赵维信等[21]利用放射化学法对克氏原螯虾MO中的MF合成速率进行测定,发现MF与促进卵黄发生密切相关 ;郭敏[22]实验发现,与MF共同培养后的中华绒螯蟹(Eriocheirsinensis)卵母细胞中vg表达上升。谢熙等[23]的实验已证明三疣梭子蟹卵巢中vg的表达水平与卵巢发育呈正相关,同时结果显示在三疣梭子蟹第一次卵巢发育时,卵巢中vg的表达水平在Ⅳ期达到最高,Ⅳ期为三疣梭子蟹卵巢的卵黄合成旺盛期[12]。本实验中,fps的表达量在第一次卵巢发育的Ⅰ期、Ⅱ期和Ⅲ期均较低,Ⅳ期显著上升至最大值,Ⅴ期略有下降,与vg的表达趋势相符。在三疣梭子蟹第二次卵巢发育时,fps的表达量随着卵巢的成熟而逐渐升高,Ⅲ期有显著上升。这与第2次卵巢发育中vg的表达水平变化趋势[24]和GSI指数的变化曲线[13]均相吻合,说明三疣梭子蟹卵巢发育过程中vg的表达与fps有明显的相关性。由此推测,fps在第一次卵巢发育Ⅳ期和第二次卵巢发育的Ⅲ期、Ⅳ期高效表达,可能与卵巢中卵黄的旺盛合成有关,并能促进三疣梭子蟹卵巢的排卵过程。但在刘智俊等[25]对三疣梭子蟹第一次卵巢发育时MO中MF合成速率进行检测的实验中,发现MF的合成速率在Ⅲ期达到最高。这种差异可能与fps在三疣梭子蟹大颚器中还参与合成其它能促进次级卵黄发生的类固醇激素有关。早在1987年,Couch[26]发现无论美洲龙螯虾(H.americanus)卵巢是否发育,孕酮含量均较高且稳定,而雌二醇仅在卵黄发生期可以检测到,并由此认为大颚器除合成MF外,还合成分泌孕酮和雌二醇,促进卵黄发生。至于fps具体参与合成哪些促进三疣梭子蟹次级卵黄发生的类固醇激素,有待进一步研究证实。
参考文献:
[1]嵇保中, 刘曙雯, 田 铃, 等. 保幼激素生物合成研究进展 [J]. 生命科学, 2007, 19(1): 90-96.
[3]张丽丽, 郭兴荣, 冯启理, 等. 昆虫固醇转运蛋白的结构与功能 [J]. 昆虫学报, 2011, 54(4): 457-466.
[4]李 胜, 赵维信. 甲壳动物的大颚器和甲基法尼酯 [J]. 上海水产大学学报, 2000, 9(3): 240-246.
[5]DAVEY K G. The modes of action of juvenile hormones: some questions we ought to ask [J]. Insect Biochemistry & Molecular Biology, 2000, 30(8): 663-669.
[6]CASTILLO-GRACIA M, COUILLAUD F. Molecular cloning and tissue expression of an insect farnesyl diphosphate synthase [J]. European Journal of Biochemistry, 1999, 262(2): 365-370.
[7]刘 艳, 胜振涛, 蒋容静, 等. 保幼激素合成的研究进展 [J]. 昆虫学报, 2007, 50(12): 1285-1292.
[8]陆剑锋, 常国亮, 吴旭干, 等. 甲壳动物大颚器及其合成甲基法尼酯的放射化学测定法 [J]. 水产科学, 2009, 28(2): 113-116.
[9]王晓伟, 张子平, 王艺磊, 等. 虾蟹类卵巢发育调节机制研究进展 [J]. 生物技术通报, 2013(7): 29-35.
[10]ABDU U, YEHEZKEL G, WEIL S, et al. Is the unique negatively charged polypeptide of crayfish yolk HDL a component of crustacean vitellin? [J]. The Journal of Experimental Zoology, 2001, 290(3): 218-226.
[11]MEDESANI D A, FERRL E, GRODZIELSKI M, et al. In vitro effect of methyl farnesoate on the vitellogenin content of ovary and hepatopancreas, in the crayfishCheraxquadricarinatus[J]. Invertebrate Reproduction & Development, 2011, 56(2): 138-143.
[12]吴旭干, 姚桂桂, 杨筱珍, 等. 东海三疣梭子蟹第一次卵巢发育规律的研究 [J]. 海洋学报(中文版), 2007, 29(4): 120-127.
[13]姚桂桂, 吴旭干, 杨筱珍, 等. 三疣梭子蟹的第二次卵巢发育规律 [J]. 动物学研究, 2007, 28(4): 423-429.
[14]邱锡尔, 朱冬发, 崔晓雨, 等. 三疣梭子蟹HMGR基因的克隆及其在蜕皮中的表达分析 [J]. 海洋与湖沼, 2014, 45(6): 1192-1196.
[15]CUSSON M, BÉLIVEAU C, SEN S E, et al. Characterization and tissue-specific expression of two lepidopteran farnesyl diphosphate synthase homologs: implications for the biosynthesis of ethyl-substituted juvenile hormones [J]. Proteins, 2006, 65(3): 742-758.
[16]KINJOH T, KANEKO Y, ITOYAMA K, et al. Control of juvenile hormone biosynthesis inBombyxmori: cloning of the enzymes in the mevalonate pathway and assessment of their developmental expression in the corpora allata [J]. Insect Biochemistry and Molecular Biology, 2007, 37(8): 808-818.
[17]KOYAMA T, OBATA S, OSABE M, et al. Thermostable farnesyl diphosphate synthase ofBacillusstearothermophilus: molecular cloning, sequence determination, overproduction, and purification [J]. Journal of Biochemistry, 1993, 113(3): 355-363.
[18]OHNUMA S, HIROOKA K, HEMMI H, et al. Conversion of product specificity of archaebacterial geranylgeranyl-diphosphate synthase [J]. The Journal of Biological Chemistry, 1996, 271(31): 18831-18837.
[19]水 燕, 周 鑫, 徐增洪, 等. 虾蟹类卵黄蛋白原的研究进展 [J]. 安徽农业大学学报, 2012, 39(2): 177-183.
[20]SHI X, ZHANG S, PANG Q. Vitellogenin is a novel player in defense reactions [J]. Fish & Shellfish Immunology, 2006, 20(5): 769-772.
[21]赵维信, 白 桦. 克氏原螯虾大颚器合成甲基法尼酯的研究 [J]. 水产学报, 2001, 25(3): 193-196.
[22]郭 敏. 中华绒螯蟹(Eriocheirsinensis)大颚器的生理功能及其对卵巢发育的内分泌调控[D]. 上海:上海海洋大学, 2012.
[23]谢 熙. 三疣梭子蟹卵巢发育过程中FAMeT和MIH基因表达变化[D]. 浙江:宁波大学, 2013.
[24]汪春建. 三疣梭子蟹蜕皮周期与第二次卵巢发育中MIH表达研究[D]. 浙江:宁波大学, 2012.
[25]刘智俊. 三疣梭子蟹卵巢发育期间主要内分泌器官组织学变化[D]. 上海:上海海洋大学, 2010.
[26]COUCH E F, HAGINO N, LEE J W. Changes in estradiol and progesterone immunoreactivity in tissues of the lobster,Homarusamericanus, with developing and immature ovaries [J]. Comparative Biochemistry and Physiology Part A: Physiology, 1987, 87(3): 765-770.
Cloning of farnesyl diphosphate synthase (fps) from Portunus trituberculatus and its expression during the ovarian development
ZHU Tao, ZHU Dong-fa, QIU Xi-er, ZHOU Yan-qi, LIU Zhi-ye, XIE xi
( School of Marine Sciences, Ningbo University, Ningbo 315211, China)
AbstractFarnesyl diphosphate synthase (FPS) is a key enzyme in isoprenoid biosynthesis, participates in the synthesis of methyl farnesoate (MF) in the crustaceans. To study the regulatory role of FPS during ovarian development of the crustaceans, a full-length of fps (Ptfps, GeneBank accession number: KM013803) was cloned from Portunus trituberculatus by RT-PCR and rapid amplification of cDNA ends (RACE). The full-length of Ptfps was 2 360 bp and it contained an open reading frame (ORF) of 1 290 bp encoding a protein of 429 amino acid residues. Bioinformatics analysis found that PtFPS has seven prenyltransferase conserved regions, and exhibits the highest identity (58%) with FPS of Zootermopsis nevadensis. Quantitative real-time PCR analysis results showed that fps was mainly expressed in mandibular organ (MO), and the expression level was much higher than that in other tissues (P < 0.01). During the first ovarian development, the expression of fps significantly increased to the highest levels at stage Ⅳ (P < 0.05), and then slightly declined; During the second ovarian development, the expression of fps significantly increased to the highest level at stage Ⅲ (P < 0.05), and reached to the maximum at stage Ⅳ. The above results indicated that fps may closely related to the regulation of ovarian development in P. trituberculatus.
Key wordsPortunus trituberculatus; farnesyl diphosphate synthase (FPS); gene cloning; ovarian development; expression
收稿日期:2015-09-09;修回日期:2015-10-27
基金项目:国家自然科学基金项目(41376152);浙江省自然科学基金项目( LY13C190006)资助
作者简介:朱 韬,专业方向为甲壳动物发育生物学; 通信作者:朱冬发,教授,研究方向为甲壳动物发育生物学,E-mail: zhudongfa@nbu.edu.cn。
中图分类号Q78
文献标识码A
文章编号2095-1736(2016)03-0010-05
doi∶10.3969/j.issn.2095-1736.2016.03.010
