长孢藻(Dolichospermum)丝体长度与丰度的变化关系及其水华指示作用
2016-06-28刘金福胡韧段雪珂肖利娟
刘金福,胡韧, 2,段雪珂,肖利娟, 2*
1. 暨南大学水生生物研究中心,广东 广州 510632;2. 广东省水库蓝藻水华防治中心,广东 广州 510632
长孢藻(Dolichospermum)丝体长度与丰度的变化关系及其水华指示作用
刘金福1,胡韧1, 2,段雪珂1,肖利娟1, 2*
1. 暨南大学水生生物研究中心,广东 广州 510632;2. 广东省水库蓝藻水华防治中心,广东 广州 510632
摘要:长孢藻属(Dolichospermum)是南亚热带水体中常见水华蓝藻之一,常以丝状群体形式存在,其丝体长度变化具有高度可塑性。为探讨长孢藻丝体长度变化与哪些环境因子有关、丝体长度与丰度之间的关系以及丝体长度能否指示长孢藻水华发生的趋势及状况,选择了一座以长孢藻为主要优势种的南亚热带水库为研究对象,于2010年1月至2013年12月对该水库进行逐月采样,研究了长孢藻丰度、丝体长度和环境因子的季节变化,分析了影响长孢藻丝体长度的关键因子及其与丰度的关系。结果表明:在调查期间,长孢藻丝体长度介于15~2 400 µm之间,丝体长度和丰度具有极显著的正相关关系,两者的回归方程为logL=1.32+0.26logN(Radj2=0.30,P=0.000)。营养盐(TN、TP、NO3--N)和光照条件(SD、Zeu/Zm)是影响长孢藻丰度和丝体长度变化的主要环境因子,其中营养盐对丰度影响更大,两者呈极显著正相关关系;光照条件则对丝体长度影响更显著,两者呈极显著负相关关系。长孢藻丝体长度的变化可以作为自身水华预测的指示参数,其种群整体丝体变长是对营养盐升高、光限制增强的响应,长丝体预示着长孢藻丰度升高,漂浮能力增强,水华暴发风险增加。
关键词:长孢藻;丝体长度;丰度;环境因子
引用格式:刘金福, 胡韧, 段雪珂, 肖利娟. 长孢藻(Dolichospermum)丝体长度与丰度的变化关系及其水华指示作用[J]. 生态环境学报, 2016, 25(3): 496-502.
LIU Jinfu, HU Ren, DUAN Xueke, XIAO Lijuan. The Relationship between Abundance and Filament Length of Dolichospermum and Its Indicativefunction of Bloom [J]. Ecology and Environmental Sciences, 2016, 25(3): 496-502.
Wacklin等人依据现代分子评价手段将具气囊、能漂浮的鱼腥藻形态类型与经典的底栖垫状种分离开并形成了一个新属——长孢藻属(Dolichospermum),其种名和植物命名法规一致(Wacklin et al.,2009;胡鸿钧,2011)。长孢藻属是常见的水华蓝藻之一,自上世纪80年代在欧洲发生水华以来,一直受到广泛关注(Edler et al.,1985;Berg et al.,1985;Willén et al.,1997)。近年来,我国南亚热带地区水库时有长孢藻水华的发生(肖利娟等,2007;Yamamoto et al.,2009)。长孢藻水华发生后,水体会出现一系列水质问题,如水体异味、藻毒素升高、水体溶解氧下降等(Carmichael et al.,1979;Hilborn et al.,2015;Jüttner et al.,2007),因此对长孢藻水华的预测和预警是蓝藻水华防治工作的重要内容之一。目前,常规的蓝藻水华监测方法主要是在显微镜下计数蓝藻细胞数量,通过公式计算蓝藻丰度。长孢藻为丝状藻,由若干球形或桶形细胞紧密相连形成直的或弯曲的藻丝,在测定水体中长孢藻丰度时,要求计数工作人员能准确分辨细胞间隔并准确计数,因此长孢藻丰度的检测工作对显微镜质量和工作人员的技术要求较高。而目前多数基层水库水质监测工作人员技术以及实验室的条件有限,不能达到该条件的要求。鉴于长孢藻水华的危害,迫切需要发展更为简单易行且准确有效的长孢藻水华预测方法。
Brookes et al.(1999)通过原位实验表明,长孢藻丝体长度变化是对水下光照条件的响应,丝体长度增加导致群体浮力增强,增加暴露在有光层的机会,而高光照会增加细胞内溶物的浓度,降低丝体上浮的速度。Paerl et al.(1982)通过野外和室内实验相结合的研究表明,长孢藻丝体长度的变化与水体中CO2浓度有关,丝体长度变长有利于长孢藻漂浮到水-气交换界面竞争CO2,同时有利于进行固氮活动,遮蔽其他非蓝藻浮游植物。巫娟等(2012)的室内实验表明,长孢藻丝体长度随生长速率的增加呈现先升高后降低的过程。已有研究表明,长孢藻丝体长度主要受环境条件和生长阶段调节。那么,在我国南亚热带水体中影响长孢藻丰度和丝体长度的环境因子是什么?长孢藻丝体长度能否反应丰度的变化以及水华发展的趋势?能否将长孢藻丝体长度作为长孢藻水华预测的指标?基于以上问题,选择已发生过长孢藻水华的大沙河水库为研究对象(肖利娟等,2007),调查了该水库2010─2013年长孢藻丰度和丝体长度的变化,并分析了长孢藻丝体长度、丰度和水体环境的季节特征以及三者之间的关系,以期为探索简单快速预测南亚热带水库长孢藻水华的方法研究提供理论依据。
1 材料与方法
1.1 水库概况
大沙河水库(22°32′N,112°30′E)位于广东省珠三角地区西北部,属于大(二)型水库,是广东省重要的供水水库之一,也是开平市重要的饮用水水源地。水库最大蓄水量为2.58×108m3,正常库容为1.57×108m3,集水面积217 km2,水面面积16.3 km2,湖泊区平均水深10.8 m。
1.2 采样点和采样时间
本次调查的采样点设在水库坝前200 m处湖泊区(图1)。采样时间为2010年1月到2013年12月,采样频率为每月1次。

图1 大沙河水库采样点设置Fig. 1 Location of Dashahe Reservoir and sampling site
1.3 样品分析
现场用便携式多参数水质仪(YSI 185)测定表层水温(Temp),用塞氏盘测定透明度(SD)。于水下0.5 m处采集1 L水样于棕色瓶中带回实验室,测定总氮(TN)、总磷(TP)、硝态氮(NO-N)、铵态氮(NH-N)、可溶性磷(SRP)浓度。氮磷测定参照《水和废水监测分析方法(第四版)》测定方法(国家环境总局,2007)。于水面以下0.5 m处采集1 L水样于聚乙烯瓶中,现场用5%的鲁哥试剂固定,沉淀浓缩后,在光学显微镜(OLYMPUS-BX51)下观察、计算长孢藻丰度和测量丝体长度。
长孢藻丰度(N)计算公式:

式中,N为长孢藻丰度(cells·L-1);A为计数框面积(mm2);Ac为计数面积(mm2);Vs为1 L原水样沉淀浓缩后的体积(mL);Va为计数框的容量(0.1 mL);n为计数所得的浮游植物数目(cells)。
长孢藻丝体长度(L)计算公式:

式中,L为长孢藻丝体长度(μm);n为长孢藻丝体细胞数;D为长孢藻细胞直径(μm)。
降雨量(Prec)、出库流量和库容数据由大沙河水库管理局提供。
水力滞留时间(WRT)计算公式:

真光层与混合层之比(Zeu/Zm)计算公式:

式中,Zeu为真光层深度(m);Mix为混合层深度(m)。
1.4 数据处理与分析
利用R语言平台(MASS、vegan和stats)对数据进行计算和多元统计分析,利用Origin 8.0软件进行绘图。长孢藻丰度、丝体长度和环境因子关系采用双向逐步回归与方差分解的分析方法,在方差分解中,X1代表营养盐变量,包括:总氮(TN)、总磷(TP)和硝态氮(NO-N);X2代表光照变量,包括:真光层和混合层之比(Zeu/Zm)和透明度(SD)。本文对丰度、丝体长度、降雨量和水力滞留时间数据均进行对数转换。
2 结果与分析
2.1 水文水动力及理化特征
调查期间,大沙河水库年平均降雨量为2394 mm。4─9月为丰水期,月平均降雨量为304 mm;1─3月和10─12月为枯水期,月平均降雨量为81 mm。水力滞留时间在67~974 d之间,为中长滞留型水体,水力滞留时间与降雨量显著负相关(r=-0.378,n=48,P=0.001)。表层水温在14~32 ℃范围内波动,平均表层水温为24.1 ℃,7─9月份水温较高,在30 ℃以上,12月和1月份水温较低在20 ℃以下。水体明显分层出现在4─9月份,1 ─3月份和10─12月份水体分层不明显。混合层深度与表层水温呈极显著负相关(r=-0.577,n=48,P=0.000)。
总磷浓度介于0.027~0.046 mg·L-1之间,平均浓度为0.035 mg·L-1;总氮浓度介于0.9~1.3 mg·L-1,平均浓度为1.04 mg·L-1。总磷、总氮浓度和降雨量呈极显著负相关(r=-0.506,n=48,P=0.000;r=-0.400,n=48,P=0.001),与混合层深度呈显著正相关(r=0.405,n=48,P=0.000;r=0.306,n=48,P=0.000),与水力滞留时间呈显著正相关(r=0.412,n=48,P=0.001;r=0.407,n=48,P=0.000)。铵态氮平均浓度为0.27 mg·L-1,硝态氮平均浓度为0.28 mg·L-1,季节差异不显著(图2)。

图2 大沙河水库2010─2013年水文及理化特征季节变化(n=48),Dry:枯水期;Wet:丰水期Fig. 2 Seasonal variations of hydrodynamic and physicochemical traits of Dashahe Reservoir from 2010─2013 (n=48), Dry represent dry season; Wet represent wet season
2.2 长孢藻丝体长和丰度季节性变化
调查期间,大沙河水库长孢藻丝体长度介于15~2400 μm之间,平均长度为235 μm,丝体长度主要集中在67~293 μm(图3)。在季节动态上,枯水期(1─3月和10─12月)丝体长度显著高于丰水期丝体长度(F=4.12,n=48,P=0.048)。丰水期(4─9月)丝体相对较短,月平均长度集中在130~237 μm之间,其中7、8月份丝体长度最短;枯水期丝体长度相对较长,月平均长度主要集中在192~360 μm之间,其中11、12月份时丝体长度更长(图4)。
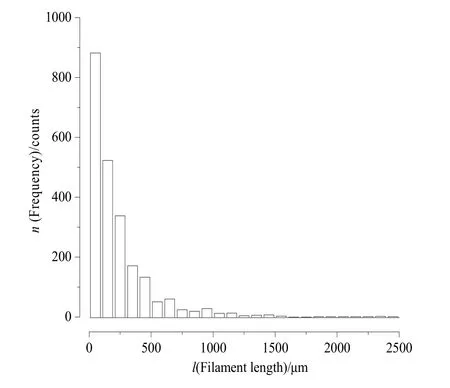
图3 长孢藻丝体长度及出现频率Fig. 3 The filament length of Dolichospermum and appearance frequency
调查期间长孢藻丰度介于3.78×104~7.56×107cells·L-1之间,平均丰度为7.4×106cells·L-1,4年间没有显著差异(F=2.75,n=48,P=0.054)。枯水期平均丰度为1.22×107cells·L-1,其中11、12月份时丰度最高;而丰水期平均丰度为2.58×106cells·L-1,其中7、8月份时丰度最低,枯水期和丰水期具有显著差异(F=5.83,n=48,P=0.02)。
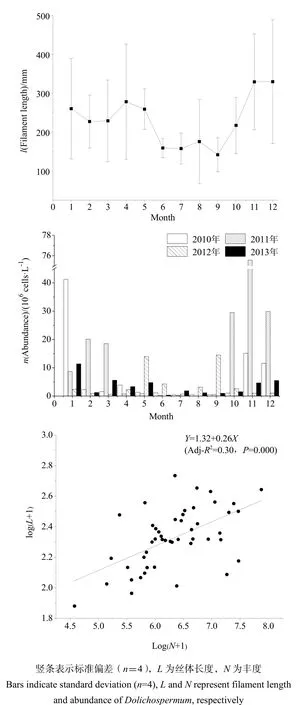
图4 长孢藻丝体长度、丰度季节动态及两者的关系Fig. 4 Seasonal dynamics of abundance and filament length of Dolichospermum, and their relationship
回归分析表明,长孢藻丰度对数与丝体长度有极显著相关性(P=0.000,r=0.058,n=48),丰度越大,丝体越长,丰度(N,cells·L-1)和丝体长度(L,µm)取对数的回归方程为:logL=1.32+0.26logN (R=0.30,P=0.000)。当丰度小于106cells·L-1时,其月平均丝体长度变化范围在75~360 μm之间;当丰度介于106~107cells·L-1时,其月平均丝体长度变化范围在102~450 μm之间;当丰度大于107cells·L-1时,其月平均丝体长度变化范围在120~480 μm之间(图4)。
2.3 长孢藻丰度、丝体长度与环境因子关系
分别对长孢藻丰度与丝体长度和环境因子(TP、SRP、TN、NO-N、NH-N、SD、Zeu/Zm、Temp、Prec、WRT和Mix)进行逐步回归分析。结果表明:长孢藻丰度与TN呈极显著相关,与TP、NO-N、SD和Zeu/Zm呈显著相关,回归方程的总解释度为39%;丝体长度与TP、NO-N和SD呈显著相关,与Zeu/Zm呈极显著负相关,回归方程的总解释度为45%(表1)。逐步回归说明营养盐条件(TN、TP、NO-N)和光照条件(SD、Zeu/Zm)是影响大沙河水库长孢藻丰度和丝体长度的主要环境因子。
根据逐步回归结果,进一步应用方差分解方法分析营养盐变量(X1:TN、TP、NO-N)和光照变量(X2:SD、Zeu/Zm)对长孢藻丰度变化和丝体长度变化的解释量(图5)。结果表明两组变量对丰度变化的解释量为36.5%,且营养盐变量是其主要解释因子(图5a);对丝体长度变化的解释为39.9%,光照变量是其主要解释因子(图5b)。此外,方差分解还表明营养盐变量和光照变量有很强的交互作用(图5)。

图5 长孢藻丰度(a)和丝体长度(b)的方差分解Fig. 5 Variation partition of abundance (a) and filament length (b) of Dolichospermum
3 讨论与结论
3.1 环境因子对长孢藻丰度的影响
光照、温度和营养盐是影响浮游植物生长和群落结构变化的关键因素(李季东等,2011;朱旭宇等,2013;郭蔚华等,2015)。在温带富营养化水体,光照和温度往往是这类水体浮游植物生长的限制因子,光的可获得性成为决定浮游植物群落演替的关键因子,在这类水体中蓝藻易成为优势种(韩博平等,2003;Sherman et al.,1998)。华南地区地处南亚热带气候区,常年水温较高,大沙河水库全年水温在14 ℃以上,年平均水温为24 ℃。因此,温度不是限制大沙河水库浮游植物生长的关键因子,当水体中的营养盐和光照条件适宜,浮游植物全年均能快速生长。由于受南亚热带季风气候的影响,在枯水期大沙河水库会出现水体混合,而在丰水期会出现稳定分层现象。枯水期,水体混合引起表层水体与下层水体发生交换,促使沉积物和滞水层中的营养盐扩散到表层水体中,能够为浮游植物生长提供所需的营养盐,此时长孢藻丰度较高,优势度明显;而在丰水期,水体出现稳定分层,上下层水体交换出现阻断,下层水体的营养盐无法进入上层水体,营养盐浓度相对较低,长孢藻优势度不明显,丰度下降。此外,长孢藻具有浮力调节机制,能够调节细胞在水体中的位置进而增强对营养盐和光的竞争能力,因此在枯水期由于水体中光可获得性低(Zeu/Zm<1),具有伪空泡的长孢藻竞争优势明显,而在丰水期水体中光可获得性高(Zeu/Zm>1),长孢藻在该条件下丧失其竞争优势。韩博平等(2006)研究发现,在高营养盐条件下,蓝藻往往易成为优势类群,且随着营养盐浓度升高,优势度越明显。因此,当长孢藻能够通过自身的浮力调节能力获得足够的光照时,其丰度会随着营养盐浓度升高快速上升。本文研究结果表明丰水期长孢藻丰度较低,在106cells·L-1以下;而枯水期,由于氮磷营养盐浓度升高,透明度下降,此时光可获得性较差(Zeu/Zm<1),长孢藻竞争优势明显,丰度也较高。因此枯水期高营养盐及弱光可获得性为长孢藻的快速生长并成为优势类群提供了重要的环境条件,此时正是大沙河水库长孢藻水华高风险时期。

表1 长孢藻丰度和丝体长度与环境因子逐步回归(n=48)Table 1 Step regression between the environmental factors and abundance or filament length of Dolichospermum (n=48)
3.2 环境因子对长孢藻丝体长度的影响
长孢藻丝体长度是其竞争适应性的重要表征,丝体长度的变化是其成为优势种的重要竞争策略(Booker et al.,1979)。在富营养化水体中,光照和碳源的可获得性是影响浮游植物生长的关键因素(Naselli-Flores,2000;孟顺龙等,2015)。Paerl et al. (1982)研究发现CO2是蓝藻的最佳碳源,当水体中CO2浓度下降时,长孢藻会通过增加丝体长度并聚集在水体表面以获得足够的CO2。Brookes et al. (1999)研究发现,当光照强度小于6 mol·m-2·d-1时,长孢藻会通过短丝体聚集形成长丝体的方式来增加自身的悬浮能力,以保证其能够悬浮在水体表面获取更多的光照。因此,通过调节自身的悬浮能力以增加暴露在充足的CO2和光照辐射的机会是长孢藻丝体长度变化的重要原因之一。蓝藻在水体中的悬浮机制服从Stokes方程(Brookes et al.,1999),其表达式为:v=2gr2(ρ-ρ′)A/9φη(g为重力加速度,r为克隆直径,ρ和ρ′分别为细胞密度和水的密度,A是细胞体积和群体体积之比,φ为体型阻力,η为流体黏度)。根据该表达式,对于链状长孢藻而言,丝体的大小直接决定了自身的悬浮能力,丝体越长,悬浮能力越大,在光限制条件下的竞争优势越明显。本研究结果也表明在低Zeu/Zm值的枯水期,由于光照不足,长孢藻需要通过改变丝体长度方式来增加暴露在有光层的机会,因此长丝体长孢藻的比例显著增加。而在高Zeu/Zm值的丰水期,由于光照条件相对充足,长孢藻不再需要通过增加自身悬浮能力来获取更多的关照,因此该时期长孢藻丝体相对较短。
Kruskopf et al.(2006)研究发现,在高氮、磷浓度条件下颤藻(Oscillatoria simplicissima)的丝体较长,而在低氮、磷浓度条件下丝体往往较短。一般而言,浮游植物个体越小,比表面积越大,越有利于营养盐的吸收(Lewis,1976;Friebele al.,1978)。因此,在营养盐浓度相对较低的条件下,营养盐成为藻类生长的重要限制因子,藻类之间竞争主要围绕营养盐的吸收,而短丝体具有较大的比表面积,营养盐吸收效率更高,因此在该条件下短丝体长孢藻更有利于生长繁殖;而在营养盐浓度较高的条件下,营养盐不再是限制藻类生长的关键因子,水体中的所有的浮游植物均能快速生长,此时水体透明度开始下降,光可获得性成为藻类生长的限制因子。由于长丝体有利于长孢藻上浮到上层水体中获得更多的光照和CO2,有利于长孢藻发挥竞争优势成为优势类群,因此在营养盐浓度高、光可获得性差的条件下长孢藻丝体往往较长。Smith et al.(1995)还发现,不管是否存在氮限制条件,长孢藻都会在丝体中间或两端形成异形胞,由于营养细胞与异形胞之间的连接通常没有营养细胞与营养细胞之间的连接稳定,因此在异形胞处往往容易断裂形成两个短丝体,而这种情况在氮限制水体中表现得尤为突出。这可能就是短丝体长孢藻在各个时期都占有较高比例的重要原因之一,同时也进一步验证了在营养盐浓度高的枯水期长孢藻丝体长度显著大于营养盐浓度较低的丰水期。
3.3 长孢藻丰度与丝体长度的关系
孔繁翔等(2009)认为,蓝藻水华的形成是已经存在的藻细胞群体在适宜条件下聚集在水体表面形成肉眼可见的过程。Hutchinson et al.(1994)研究表明,水体表面藻类聚集理论上符合等式:Ct=C0exp(-Ft/H),式中C0为表层水体藻类初始浓度,Ct为t时刻表层水体藻类浓度,F为悬浮速率,H为平均深度,t为悬浮时间。根据该表达式,当蓝藻细胞的悬浮速率为0.2 m·h-1,水柱深度为3 m时,只需54 h就可以使表层藻细胞浓度从初始为160 cells·mL-1上升到5940 cells·mL-1。因此,对于蓝藻而言,悬浮能力的大小是决定其能否在富营养化水体中快速形成水华的关键因素之一。对于大部分的蓝藻,群体越大,悬浮能力越强,特别是具有伪空泡的蓝藻,其悬浮能力主要取决于伪空泡的数量,群体越大,伪空泡数量越多,悬浮能力越强(Kromkamp et al.,1990)。长孢藻的悬浮速率介于-0.2~0.4 m·h-1之间,其悬浮速度主要取决于丝体的长短,丝体越长,悬浮速度越大,越容易在水体表面形成水华(Reynolds et al.,1987)。Smith et al. (1995)在美国Star湖的研究发现,长孢藻丝体长度在水华形成初期不断增长,而在水华结束时断裂变短。我们的研究也表明,长孢藻丰度和丝体长度有极显著的相关关系(P=0.000,r=0.058,n=48),当长孢藻丰度小于106cells·L-1时,其丝体长度介于75~255 µm之间,且50%的样品丝体长度在135 µm以下;当长孢藻丰度大于106cells·L-1时,其丝体长度介于102~478 µm之间,且76%的样品丝体长度在200 µm以上。巫娟等(2012)的室内研究实验也证实了这种关系,他们还认为长孢藻丝体长度和细胞比重的变化会引起藻细胞沉降损失,丝体长度越短,细胞比重越大,藻类细胞的沉降损失越严重,甚至可能导致蓝藻水华的消亡。因此,丝体长度作为长孢藻形态变化的重要特征参数能够有效地指示丰度变化,可以通过观察长孢藻丝体长度变化判断长孢藻丰度变化,预测长孢藻水华的发生。
3.4 结论
(1)大沙河水库长孢藻丰度和丝体长度具有显著的季节性变化。
(2)长孢藻丰度和丝体长度的变化主要取决于光照和营养盐条件,丰度和丝体长度的变化均是对环境条件的响应。
(3)长孢藻丰度和丝体长度有极显著相关性,丰度越高,丝体越长。
(4)长孢藻丝体长度的变化可以指示丰度的变化,丝体越长,指示环境营养条件越好,光可获得性越弱,长孢藻丰度有增加的趋势,暴发水华的风险增加。
参考文献:
BERG K, SKULBERG OM, SKULBERG R, et al. 1985. Observations of toxic blue-green algae (Cyanobacteria) in some Scandinavian lakes [J]. ActaVeterinariaScandinavica, 27(3): 440-452.
BOOKER M J, WALSBY A E. 1979. The relative form resistance of straight and helical blue-green algal filaments [J]. British phycological journal,14(2): 141-150.
BROOKES J D, GANF G G, GREEN D, et al. 1999. The influence of light and nutrients on buoyancy, filament aggregation and flotation of Anabaena circinalis [J]. Journal of Plankton Research, 21(2): 327-341.
CARMICHAEL W W, BIGGS D F, PETERSON M A. 1979. Pharmacology of anatoxin-a, produced by the freshwater cyanophyte Anabaena flos-aquae NRC-44-1 [J]. Toxicon, 17(3): 229-236.
EDLER L, FERNÖ S, LIND M G, et al. 1985. Mortality of dogs associated with a bloom of the cyanobacterium Nodularia spumigena in the Baltic Sea [J]. Ophelia, 24(2): 103-109.
FRIEBELE E S, CORRELL D L, FAUST M A. 1978. Relationship between phytoplankton cells size and the rate of orthophosphate uptake: in situ observations of an estuarine population [J]. Marine Biology, 45(1): 39-52.
HILBORN E D, WARD R A. 2016. The Risk of Cyanobacterial Toxins in Dialysate: What Do We Know?[C]//Seminars in dialysis, 29(1): 15-18.
HUTCHINSON P A, WEBSTER I T. 1994. On the distribution of blue-green algae in lakes: Wind-tunnel tank experiments [J]. Limnology and oceanography, 39(2): 374-382.
JÜTTNER F, WATSON S B. 2007. Biochemical and ecological control of geosmin and 2-methylisoborneol in source waters [J]. Applied and Environmental Microbiology, 73(14): 4395-4406.
KROMKAMP J, WALSBY A E. 1990. A computer model of buoyancy and vertical migration in cyanobacteria [J]. Journal of Plankton Research,12(1): 161-183.
KRUSKOPF M, DU PLESSIS S. 2006. Growth and filament length of the bloom forming Oscillatoria simplicissima(oscillatoriales, cyanophyta)in varying N and P concentrations [J]. Hydrobiologia, 556(1): 357-362.
LEWIS W M. 1976. Surface/volume ratio: implications for phytoplankton morphology [J]. Science, 192(4242): 885-887.
NASELLI-FLORES L. 2000. Phytoplankton assemblages in twenty-one Sicilian reservoirs: relationship between species composition andenvironmental factors [J]. Hydrobiologia, 424(1): 1-11.
PAERL HW, USTACH JF. 1982. Blue-green algal scums: An explanation for their occurrence during freshwater blooms [J]. Limnology and oceanography, 27(2): 212-217.
REYNOLDS C S, OLIVER R L, WALSBY A E. 1987. Cyanobacterial dominance: the role of buoyancy regulation in dynamic lake environments [J]. New Zealand journal of marine and freshwater research, 21(3): 379-390.
SHERMAN B S, WEBSTER I T, JONES G J, et al. 1998. Transitions between Auhcoseira and Anabaena dominance in a turbid river weir pool [J]. Limnology and Oceanography, 43(8): 1902-1915.
SMITH A D, GILBERT J J. 1995. Spatial and temporal variability in filament length of a toxic cyanobacterium (Anabaena affinis) [J]. Freshwater Biology, 33(1): 1-11.
WACKLIN P, HOFFMANN L, KOMÁREK J. 2009. Nomenclatural validation of the genetically revised cyanobacterial genus Dolichospermum (Ralfs ex Bornet et Flahault) comb. Nova [J]. Fottea,9(1): 59-64.
WILLÉN T, MATTSSON R. 1997. Water-blooming and toxin-producing cyanobacteria in Swedish fresh and bracish waters, 1981-1995 [J]. Hydrobiologia, 353(1-3): 181-192.
YAMAMOTO Y, NAKAHARA H. 2009. Seasonal variations in the morphology of bloom-forming cyanobacteria in a eutrophic pond [J]. Limnology, 10(3): 185-193.
郭蔚华,余敏,刘青香, 等. 2015. 滇池铜绿微囊藻春化过程与诱导低温间的关系[J]. 生态环境学报, 24(12): 2022-2026.
国家环境总局. 2007. 水和废水监测分析方法[M]. 第四版. 北京: 中国标准出版社: 200-284.
韩博平, 韩志国, 付翔. 2003. 藻类光合作用机理与模型[M]. 北京: 科学出版社: 165-174.
韩博平, 林桂花, 钟秀英. 2006. 水库蓝藻和蓝藻毒素分布与检测: 广东省典型供水水库研究[M]. 北京: 中国环境科学出版社: 222-243,39-53.
胡鸿钧. 2011. 水花蓝藻生物学[M]. 北京: 科学出版社: 66-75.
孔繁翔, 马荣华, 高俊峰, 等. 2009. 太湖蓝藻水华的预防、预测和预警的理论与实践[J]. 湖泊科学, 21(3): 314-328.
李季东, 肖利娟, 韩博平. 2011. 一座南亚热带中富营养水库夏季浮游植物群落的稳态平衡分析[J]. 应用与环境生物学报, 17(6): 833-838.
孟顺龙, 裘丽萍, 王菁, 等. 2015 光照对普通小球藻和鱼腥藻生长竞争的影响[J]. 生态环境学报, 24(10): 1654-1659.
巫娟, 陈雪初, 孔海南, 等. 2012. 光照度对水华鱼腥藻细胞比重与藻丝长度的影响研究[J]. 中国环境科学, 32(5): 875-879.
肖利娟, 韩博平, 林秋奇, 等. 2007. HA1絮凝剂在供水水库水华应急处理中的应用研究[J]. 环境科学, 28(10): 2192-2197.
朱旭宇, 黄伟, 曾江宁, 等. 2013. 氮磷比对冬季浮游植物群落结构的影响[J]. 应用与环境生物学报, 19(2): 293-299.
The Relationship between Abundance and Filament Length of Dolichospermum and Its Indicativefunction of Bloom
LIU Jinfu1, HU Ren1, 2, DUAN Xueke1, XIAO Lijuan1, 2*
1. Institute of Hydrobiology, Jinan University, Guangzhou 510632, China;2. Guangdong Center for Control and Prevention of Reservoir Cyanobacterial Blooms, Guangzhou 510632, China
Abstract:Dolichospermum, one of the most common cyanobacterial species in South China, usually occurs as filaments, the length of which highly varies. In order to fully understand the influence of environmental factors on the filament length of Dolichospermum,and to examine whether the filament length could indicate the timing and extent of bloom development, field investigations were performed monthly from January, 2010 to December, 2013 in Dashahe Reservoir which was dominated by Dolichospermum in bloom season. The Dolichospermum filament length, abundance and environment variables were monitored. Statistical analysis showed that the filament length of Dolichospermum ranged from 15 to 2 400 μm, and was significantly correlated with abundance (logL=1.32+0.26logN, Radj2=0.30, P=0.000). Nutrients (TN, TP, NO3--N) and light availability (SD, Zeu/Zm) were the key factors influencing the filaments length and abundance. Nutrients, compared with light availability, showed relatively higher explanation power for abundance which was significantly and positively correlated with nutrients. Light availability showed relatively higher explanation power for filament length, which was significantly and negatively correlated with light availability. The filament length could be regarded as the indicative parameter of the Dolichospermum bloom. The filament elongating of Dolichospermum, resulting from the nutrients increasing and light limitation, may indicate the relative abundance, buoyancy and bloom risk of Dolichospermum.
Key words:Dolichospermum; filament length; abundance; environment factors
DOI:10.16258/j.cnki.1674-5906.2016.03.019
中图分类号:X17
文献标志码:A
文章编号:1674-5906(2016)03-0496-07
基金项目:广东省科技计划项目(2013B091300015);广东省水利科技创新项目(201102)
作者简介:刘金福,(1987年生),男,硕士,研究方向为水体富营养化过程。E-mail: 510024347@qq.com*通信作者:肖利娟,助理研究员,主要从事藻类生态学研究。E-mail: tljxiao@jnu.edu.cn
收稿日期:2016-03-08
