非吸烟女性肺腺癌组织中miRNAs的表达与表皮生长因子受体关系的研究
2016-06-28王富民张寰许芳秀曲金力孔金玉钱碧云
王富民,张寰,许芳秀,曲金力,孔金玉,钱碧云,3,4
非吸烟女性肺腺癌组织中miRNAs的表达与表皮生长因子受体关系的研究
王富民1,2,张寰1,许芳秀1,曲金力1,孔金玉1,钱碧云1,3,4
摘要:目的探讨非吸烟女性肺腺癌(ADC)组织中miR-155、miR-16、miR-25及miR-133a的表达与表皮生长因子受体(EGFR)的关系及其临床意义。方法112例非吸烟女性ADC患者按EGFR类型分为EGFR野生型组(n= 51)和EGFR突变型组(n=61)。用实时荧光定量PCR定量检测2组ADC组织中4种miRNAs的表达量,比较2组4种miRNAs表达水平的差异。4种miRNAs表达量以平均数分层为高表达组和低表达组,比较2亚组患者间的生存差异。按年龄( 60岁,>60岁)、EGFR类型和miRNAs的表达量分层,进行Kaplan-Meier生存分析和Cox比例风险回归模型检验。结果EGFR突变型组miR-25的表达水平高于EGFR野生型组(P<0.05)。不同年龄分层、不同EGFR类型组、miR-155、miR-16及miR-133a表达量患者的生存率差异无统计学意义,miR-25低表达者的生存率较高表达者更高(P<0.05)。在EGFR突变型组中4种miRNAs的表达量与ADC预后无关(P>0.05);在EGFR野生型组中miR-16、miR-25、miR-133a低表达者较高表达者生存率更高(P<0.05)。Cox比例风险回归分析显示,miR-25高表达是非吸烟女性ADC患者预后死亡的独立危险因素(P<0.05)。结论miR-25是非吸烟女性ADC的独立预后指标。miR-25在非吸烟女性ADC,特别是在EGFR野生型的患者中表达升高,可能提示患者预后不佳。
关键词:受体,表皮生长因子;吸烟;性别因素;基因表达;肺腺癌;miR-155;miR-16;miR-25;miR-133a
作者单位:1天津医科大学肿瘤医院,肿瘤研究所肿瘤分子流行病与生物统计研究室,国家肿瘤临床研究中心,天津市肿瘤防治重点实验室(邮编300060);2天津医科大学研究生院;3上海交通大学公共卫生学院;4上海交通大学医学院虹桥国际医学研究院
肺癌是一种最常见的恶性肿瘤,已位居全部恶性肿瘤发病率和死亡率的首位[1]。虽然吸烟已被明确认为是肺癌的危险因素,但是肺癌在非吸烟人群中发病率也呈增加趋势[2]。亚洲人群中非吸烟所致的肺癌在整个肺癌患者占很大的比例。研究证实,表皮生长因子受体(EGFR)细胞突变对表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)药物的反应性更好,对此药物敏感的患者主要为亚洲非吸烟女性肺腺癌(ADC)者[3]。因此,ADC发生发展中进行分子标志物的研究对ADC的预防和治疗有重要意义。微小核糖核酸(miRNAs)是一类长约22个单位的内源性非编码的单链小分子RNA,通过特异性地与靶基因信使RNA(mRNA)的3′端非翻译区互补结合,可抑制或者降解mRNA的翻译,进而调控靶基因。越来越多的研究表明,特定的miRNAs失调可导致各种疾病,尤其是癌症的发生和发展过程,包括肺癌[4- 5]。目前,有关在非吸烟女性ADC患者中
miRNAs和EGFR关系的研究报道较少。本研究旨在探讨4种miRNAs——miR-155、miR-16、miR-25
及miR-133a在非吸烟女性ADC患者组织中的表达情况,并分析它们与EGFR突变和预后的关系。
1 资料与方法
1.1一般资料选取2007年7月—2011年8月于天津医科大学肿瘤医院行肺癌切除术的患者组织样本112例,均经肺癌病理确诊组织学类型为ADC。所有患者均为非吸烟女性,年龄34~80岁,平均(57.95±9.81)岁。本研究经天津医科大学伦理委员会认可。主要仪器和试剂:总RNA提取试剂Trizol、miRNA特异性逆转录引物、逆转录试剂盒、miRNAs特异性TaqManMGB探针引物及TaqMan PCR Master Mix(No UDG)均购自美国应用生物系统公司。相关引物由TaKaRa公司合成,有关探针序列,见表1。
1.2 miR-155、miR-16、miR-25及miR-133a表达检测(1)提取组织总RNA。取冷存的ADC组织样本50 mg在液氮中研磨至粉末状,加1 mL Trizol并按说明书提取总RNA,Nano⁃Drop 2000c(Thermo公司)微量紫外分光光度计检测RNA浓度和纯度,1%琼脂凝胶电泳鉴定RNA完整性,稀释到50mg/L,-80℃保存。(2)cDNA合成。根据试剂盒说明书,采用miRNA茎环结构特异性逆转录引物和miRNA逆转录试剂盒进行,总反应体系为15 μL。逆转录反应条件:16℃30 min,42℃30 min,85℃5 min。cDNA样本在-20℃保存。(3)实时荧光定量PCR。每个PCR反应体系为15 μL,每个样本设3个复孔,用ABI Prism7900HT荧光定量PCR仪进行TaqMan荧光定量检测。反应条件:95℃变性10 min;95℃15 s,60℃60 s;50个循环。以RUN6B作为内参照,以lg2- Ct表示miRNA的相对表达量,Ct值为循环阈值,以内参值RUN6B循环阈值来标准化, Ct=(CtmiRNA-CtRUN6B), Ct= Ct- Ctmean。
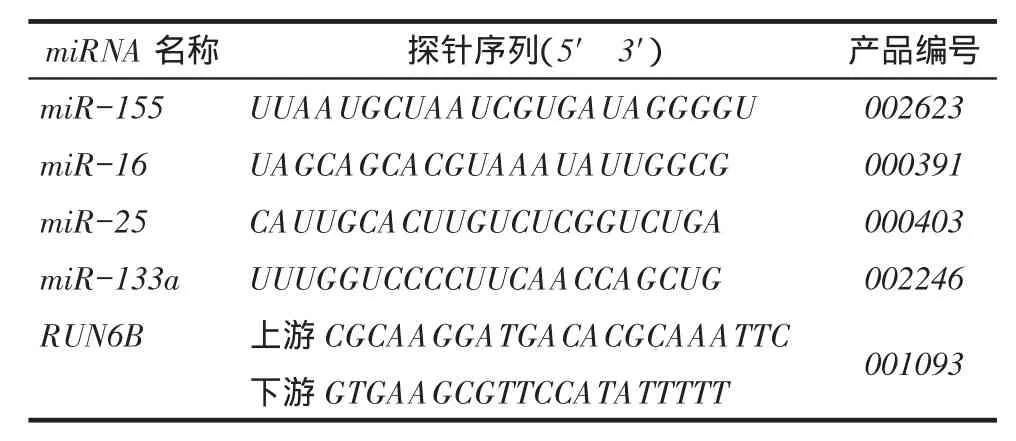
Tab.1 The sequence and assay ID of four miRNAs and RNU6B表1 4种miRNAs及其内参照的探针序列
1.3观察指标将112例非吸烟女性ADC患者按EGFR的类型分为EGFR野生型组51例和突变型组61例,比较2组4种miRNAs的表达差异。对112例ADC患者进行定期随访,截止日期为2012年12月,随访时间5~25个月,中位时间16个月,其中10例失访,随访率为91.07%。以miRNAs表达的平均数将ADC患者分为miRNAs高表达组和低表达组,比较高、低表达患者间的生存差异。临床资料中以年龄和EGFR类型进行分类纳入生存分析。另外,按EGFR类型进行分层,由各层的miRNAs表达的平均数将ADC患者分为miRNAs高表达组和低表达组,比较2组患者间的生存差异。总体生存期(OS)定义为从确诊患者为ADC到死亡或随访截止日期的时间。
1.4统计学方法采用SAS 9.2统计软件进行分析。符合正态分布的计量资料用x ±s表示,2组间均数比较行t检验;计数资料以例(%)表示,组间比较行χ2检验。生存分析采用Kaplan-Meier法,用Log-rank法检验生存率差异。Cox比例风险回归模型进行影响因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 4种miRNAs在EGFR野生型组和突变型组中表达情况比较EGFR突变型组miR-25的表达高于EGFR野生型组(P<0.05);但2组miR-155、miR-16和miR-133a表达差异无统计学意义,见表2。
Tab. 2 Relationship of four miRNAs in ADC tissue and EGFR表2 4种miRNAs在EGFR野生型组和突变型组的表达情况 (±s)
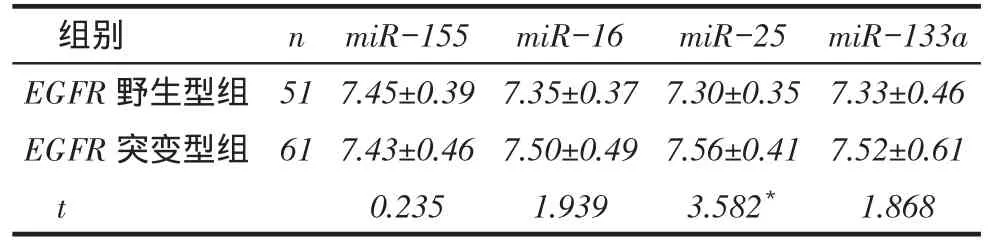
Tab. 2 Relationship of four miRNAs in ADC tissue and EGFR表2 4种miRNAs在EGFR野生型组和突变型组的表达情况 (±s)
*P<0.05
n组别EGFR野生型组EGFR突变型组t 51 61 miR-155 7.45±0.39 7.43±0.46 0.235 miR-16 7.35±0.37 7.50±0.49 1.939 miR-25 7.30±0.35 7.56±0.41 3.582*miR-133a 7.33±0.46 7.52±0.61 1.868
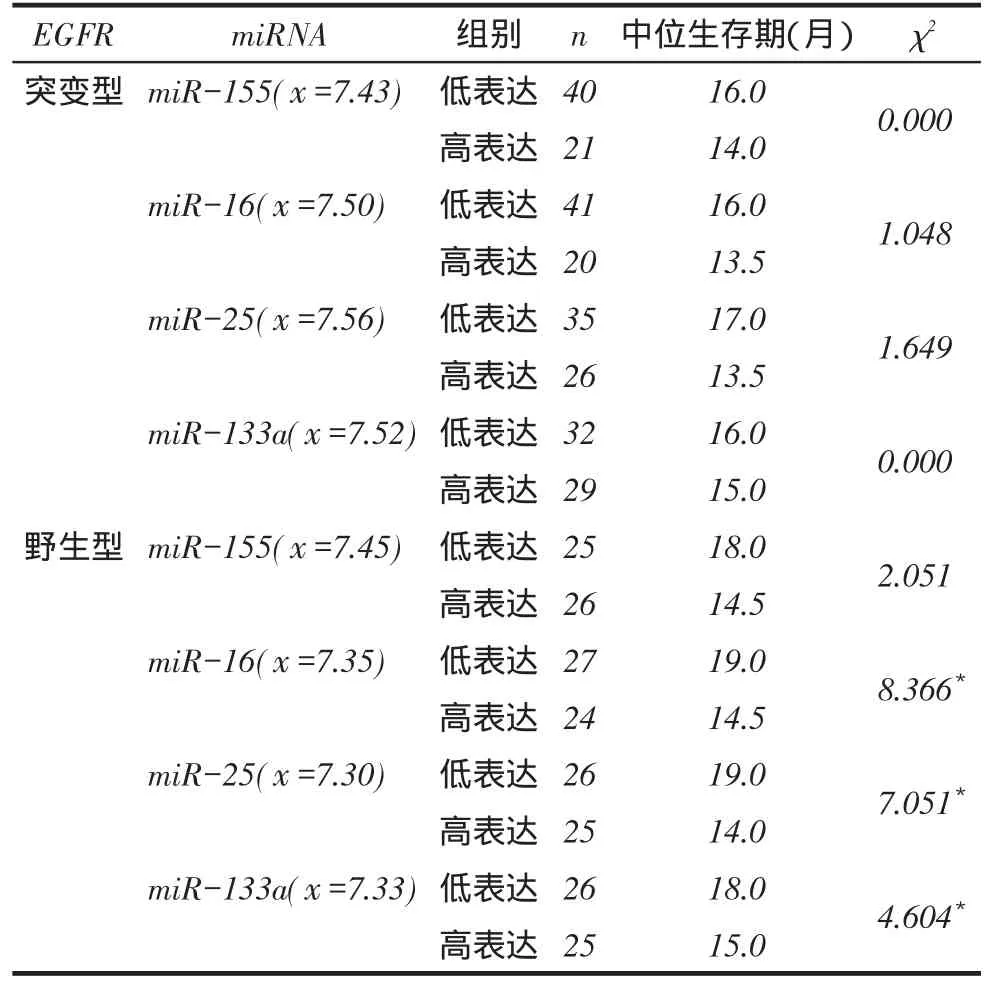
2.2年龄分层及4种miRNAs高低表达的生存分析结果不同年龄分层、不同EGFR类型组、miR-155、miR-16及miR-133a表达量患者的生存率差异均无统计学意义,miR-25低表达者生存率较高表达者更高(P<0.05),见表3、图1。
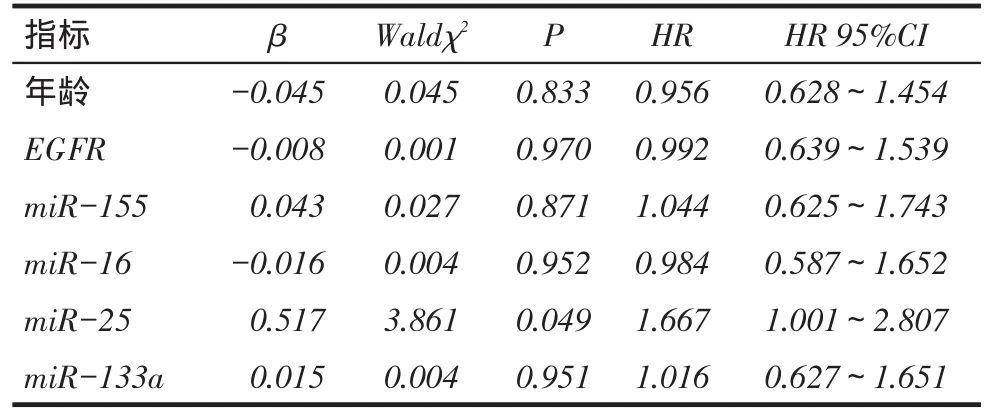
2.3不同EGFR类型分层中4种miRNAs高低表达的生存分析结果在EGFR突变型组中4种miRNAs的表达量与ADC预后无关(P>0.05),见图2、表4;在EGFR野生型组中miR-16、miR-25、miR-133a低表达者较高表达者生存率更高(P<0.05),见图3、表4。2.4非吸烟女性ADC患者影响因素分析以年龄(岁, 60=0,>60=1),EGFR突变类型(野生型=0,突变型=1),4种miRNAs(低表达=0,高表达=1)为自变量,患者生存时间及结局(生存=0,死亡=1)为因变量,Cox比例风险回归分析显示,miR-25高表达是非吸烟女性ADC患者预后死亡的独立危险因素,见表5。
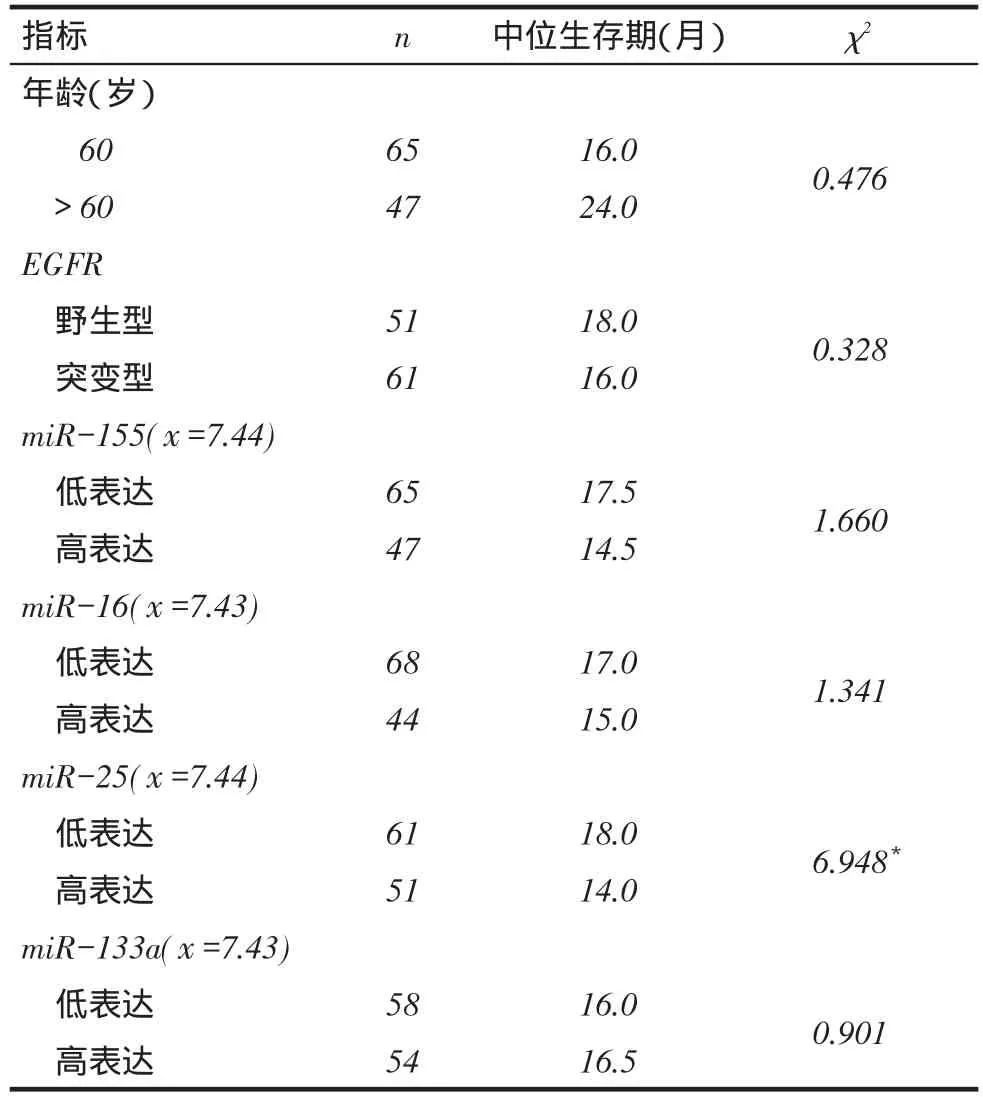
Tab. 3 Survival analysis results of 112 non-smoking female patients with ADC表3 112例非吸烟女性ADC患者的生存分析结果
3 讨论
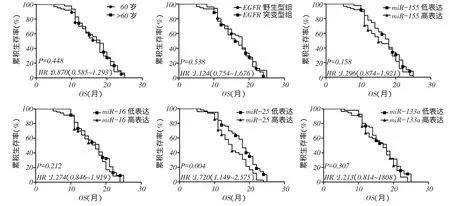
Fig.1 Comparison of survival rates between different ages, EGFR types and four miRNAs expression levels (Kaplan-Meier method)图1不同年龄、EGFR类型及4种miRNAs表达水平生存率比较(Kaplan-Meier法)
根据世界卫生组织(WHO)的统计,约25%的肺癌发生在非吸烟人群中[6]。欧洲癌症登记处的数据显示肺癌位居世界上非吸烟者死因中的前10位,女性癌症死亡的第9位[7]。EGFR是一种跨膜受体型酪氨酸激酶,在非小细胞肺癌中存在过表达和突变现象。EGFR-TKIs靶向治疗的一个必要前提是肺癌患者EGFR酪氨酸激酶编码区发生突变[8]。本研究结果显示,非吸烟女性ADC患者中EGFR的突变率(54.5%),明显高于西方人群[3],再次证实亚洲非吸烟女性ADC患者是EGFR-TKIs靶向治疗的优先人群。
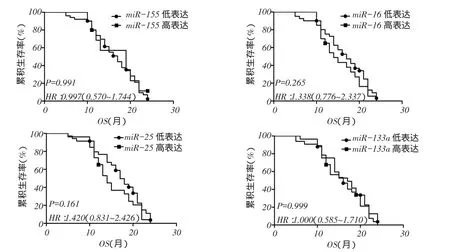
Fig. 2 Comparison of survival rates between four miRNAs expression levels in EGFR wild type group(Kaplan-Meier method)图2 EGFR突变型组中4种miRNAs表达水平生存率比较(Kaplan-Meier法)
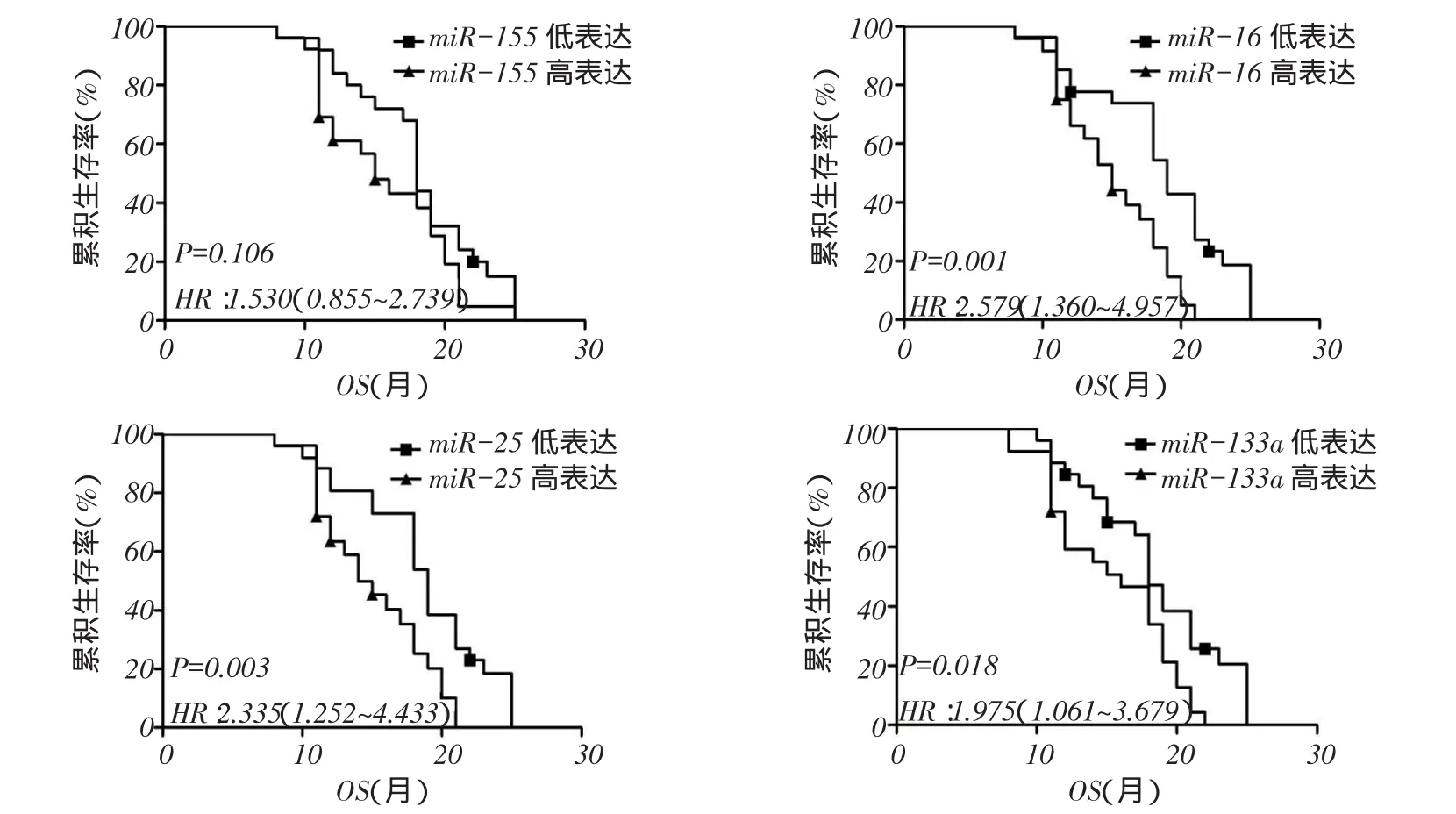
Fig. 3 Comparison of survival rates between four miRNAs expression levels in EGFR wild type group (Kaplan-Meier method)图3 EGFR野生型组中4种miRNAs表达水平生存率比较(Kaplan-Meier法)
miR-25是miR-106b-25-93家族的一员,它位于染色体7q22.1上MCM7基因的13内含子上。本研究结果显示,EGFR突变型组miR-25的表达高于EGFR野生型组,而且miR-25低表达者生存率较高表达者更高,表明miR-25高表达患者的预后不佳,因而,笔者推论miR-25可能是一种致癌基因。但是在已报道的研究中显示,miR-25对肿瘤的影响是复杂的,在骨肉瘤和胃癌的研究中均发现miR-25能够增强细胞的增殖、迁移和侵袭[9-10]。但在有关结肠癌的研究中发现,miR-25抑制了细胞的增殖和迁移[11]。因此,这进一步证实了miRNAs的表达存在组织特异性和功能多样性。
miR-133a为一种肿瘤抑制基因。Cui等[12]研究发现,miR-133a可以通过靶向EGFR来调节乳腺癌细胞增殖周期。Song等[13]研究显示,miR-133a通过EGFR靶点抑制宫颈癌的体外和体内生长,是宫颈癌治疗的一个潜在靶点。另有研究认为,miR-133a通过靶向IGF-1R抑制胃癌细胞的生长[14]。miR-16的研究目前较少。Wu等[15]研究显示,miR-16的高表达抑制肝癌细胞的增殖、侵袭和转移。本研究显示,在EGFR野生型组中miR-133a和miR-16低表达者较高表达者生存率更高,而在EGFR突变型组中4种miRNAs的表达量与ADC预后无关,表明在非吸烟女性ADC患者中,特别是EGFR野生型的患者,miR-133a和miR-16具有更好的提示预后价值。
Tab. 4 Survival analysis results of four miRNAs in EGFR mutation status表4按EGFR突变类型分层后4种miRNAs的生存分析结果
Tab. 5 Cox influence factor analysis results of 112 nonsmoking female patients with ADC表5 112例非吸烟女性ADC患者的Cox影响因素分析结果
miR-155是一种致癌基因,通过靶向FOXO3a在胶质瘤的进展中发挥作用[16]。miR-155通过QKI的表达来调控结肠癌细胞侵袭能力和细胞周期[17]。另有研究显示,miR-155的高表达是直肠癌的一个预后指标[18]。本研究未显示miR-155与非吸烟女性ADC患者的预后有关。考虑原因为:一方面可能因为本研究选取的患者的范围较窄,仅局限于非吸烟女性,并没有包含男性或者吸烟患者;另一方面可能因为不同病理类型的肺癌对miRNA的反应不同所致,本研究选取的只是ADC患者,并没有包含肺鳞癌等。
综上所述,miR-25是非吸烟女性ADC的独立预后指标。miR-25在非吸烟女性ADC特别是在EGFR野生型的患者中表达升高,可能提示患者预后不佳。
参考文献
[1] Saika K, Sobue T. Cancer statistics in the world [J]. Gan To Kagaku Ryoho, 2013, 40(13): 2475-2480.
[2] Wakelee HA, Chang ET, Gomez SL, et al. Lung cancer incidence in never smokers [J]. J Clin Oncol, 2007, 25(5): 472-478. doi:10.1200/ JCO.2006.07.2983.
[3] Yoshida T, Ishii G, Goto K, et al. Solid predominant histology pre⁃dicts EGFR tyrosine kinase inhibitor response in patients with EG⁃FR mutation-positive lung adenocarcinoma[J]. J Cancer Res Clin Oncol, 2013, 139(10): 1691- 1700. doi: 10.1007/s00432- 013-1495-0.
[4] Gao W, Shen H, Liu L, et al. MiR-21 overexpression in human pri⁃mary squamous cell lung carcinoma is associated with poor patient prognosis [J]. J Cancer Res Clin Oncol, 2011, 137(4): 557-566. doi: 10.1007/s00432-010-0918-4.
[5] Shen J, Todd NW, Zhang H, et al. Plasma microRNAs as potential biomarkers for non-small-cell lung cancer [J]. Lab Invest, 2011, 91 (4): 579-587. doi: 10.1038/labinvest.2010.194.
[6] Lee YJ, Cho BC, Jee SH, et al. Impact of environmental tobacco smoke on the incidence of mutations in epidermal growth factor receptor gene in never-smoker patients with non-small-cell lung cancer [J]. J Clin Oncol, 2010, 28(3): 487-492. doi: 10.1200/JCO.2009.24.5480.
[7] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002 [J]. CA Cancer JClin, 2005, 55(2): 74-108.
[8] Li X, Yang H, Zhao J, et al. Advanced lung adenocarcinoma with spinal cord metastasis successfully treated with second EGFR-TKI treatment: a case report and literature review [J]. Onco Targets Ther, 2015, 29(8):2739-2743. doi: 10.2147/OTT.S90213.
[9] Wang XH, Cai P, Wang MH, et al. microRNA25 promotes osteosar⁃coma cell proliferation by targeting the cellcycle inhibitor p2 [J]. Mol Med Rep, 2014, 10(2): 855-859. doi: 10.3892/mmr.2014.2260. [10] Zhao H, Wang Y, Yang L, et al. MiR-25 promotes gastric cancer cells growth and motility by targeting RECK [J]. Mol Cell Biochem, 2014, 385(1-2):207-213. doi: 10.1007/s11010-013-1829-x.
[11] Li Q, Zou C, Zou C, et al. MicroRNA-25 functions as a potential tu⁃mor suppressor in colon cancer by targeting Smad7 [J]. Cancer Lett, 2013, 335(1):168-174. doi: 10.1016/j.canlet.2013.02.029.
[12] Cui W, Zhang S, Shan C, et al. microRNA-133a regulates the cell cycle and proliferation of breast cancer cells by targeting epidermal growth factor receptor through the EGFR/Akt signaling pathway [J]. FEBS J, 2013, 280(16):3962-3974. doi: 10.1111/febs.12398.
[13] Song X, Shi B, Huang K, et al. miR-133a inhibits cervical cancergrowth by targeting EGFR [J]. Oncol Rep, 2015, 34(3): 1573-1580. doi: 10.3892/or.2015.4101.
[14] Gong Y, Ren J, Liu K,et al. Tumor suppressor role of miR-133a in gastric cancer by repressing IGF1R [J]. World J Gastroenterol, 2015, 21(10):2949-2958. doi: 10.3748/wjg.v21.i10.2949.
[15] Wu WL, Wang WY, Yao WQ, et al. Suppressive effects of microR⁃NA-16 on the proliferation, invasion and metastasis of hepatocellu⁃lar carcinoma cells [J]. Int J Mol Med, 2015,36(6):1713-1719. doi: 10.3892/ijmm.2015.2379.
[16] Ling N, Gu J, Lei Z, et al. microRNA-155 regulates cell prolifera⁃tion and invasion by targeting FOXO3a in glioma [J]. Oncol Rep, 2013, 30(5): 2111-2118. doi: 10.3892/or.2013.2685.
[17] He B, Gao SQ, Huang LD, et al. MicroRNA-155 promotes the pro⁃liferation and invasion abilities of colon cancer cells by targeting quaking [J]. Mol Med Rep, 2015, 11(3):2355-1359. doi: 10.3892/ mmr.2014.2994.
[18] Yang Y, Peng W, Tang T, et al. MicroRNAs as promising biomark⁃ers for tumor-staging: evaluation of MiR21 MiR155 MiR29a and MiR92a in predicting tumor stage of rectal cancer [J]. Asian Pac J Cancer Prev, 2014, 15(13): 5175-5180.
(2015-11-19收稿2015-12-05修回)
(本文编辑陆荣展)
Study on the relationship between expression of miRNAs and receptors of epidermal growth factor in lung adenocarcinoma of non-smoking female
WANG Fumin1, 2, ZHANG Huan1, XU Fangxiu1, QU Jinli1, KONG Jinyu1, QIAN Biyun1, 3, 4
1 Department of Epidemiology and Biostatistics, Key Laboratory of Breast Cancer Prevention and Therapy, Ministry of Education, Key Laboratory of Cancer Prevention and Therapy, National Clinical Research Center of Cancer, Tianjin Medical University Cancer Institute and Hospital, Tianjin 300060, China; 2 Graduate School of Tianjin Medical University;3 Public Health, Shanghai Jiao Tong University School; 4 Hongqiao International Institute of Medicine, Shanghai Jiao Tong University School of Medicine Corresponding Author E-mail: qianbiyun@126.com
Abstract:Objective To determine association between the expression of miR-155, miR-16, miR-25 and miR-133 and epidermal growth factor receptor (EGFR) in lung adenocarcinoma (ADC) samples of non-smoking female, and their clini⁃cal significance thereof. Methods According to EGFR types, 112 non-smoking female ADC patients were divided into two groups: EGFR wild (n=51) and EGFR mutant (n=61) groups. Expression levels of four miRNAs were detected by real time quantitative PCR. T-test was used to compare differences of four miRNAs expression in two groups. ADC patients were divid⁃ed into high miRNA expression group and low expression group according to the mean value of miRNAs expression. Logrank test was used to compare the survival difference between the two subgroups. Cox proportional hazards regression analy⁃sis was performed to determine the association between different ages ( 60,>60), EGFR types, miRNAs expression and over⁃all survival. Results The expression of miR-25 was significantly higher in EGFR mutant group than that in EGFR wild group (P<0.05). There were no significant differences in the survival rates of patients with different ages, EGFR types, and the expressions of miR-155, miR-16 and miR-133a. Patients with the lower expression of miR-25 had the higher survivaltime than patients with the higher expression of miR-25 (P<0.05). In EGFR mutation group, there was no relationship be⁃tween four miRNAs and the prognosis of ADC (P>0.05). In EGFR wild group, the lower expression of miR-16, miR-25 or miR-133a was associated with longer survival in ADC (P<0.05). Cox proportional hazards regression analysis revealed that the high expression of miR-25 was an independent risk factor for non-smoking female patients with ADC (P<0.05). Con⁃clusion miR-25 is an independent prognostic indicator for non-smoking female patients with ADC. High expression of miR-25 is found in non-smoking female patients with ADC, particularly in patients with EGFR wild-type, which may sug⁃gest apoor prognosis.
Key words:receptor, epidermal growth factor;moking;sex factors;gene expression;lung adenocarcinoma;miR-155;miR-16;miR-25;miR-133a
中图分类号:R734.2,R730.261.1
文献标志码:A
DOI:10.11958/20150331
基金项目:国家自然科学基金资助项目(81573231);天津市自然科学基金资助项目(13JCYBJC23100)
作者简介:王富民(1988),男,硕士在读,主要从事肿瘤分子流行病学研究
通讯作者E-mail: qianbiyun@126.com
