丹柴合剂对树突状细胞的诱导分化作用
2016-06-28李颖曦陈丹王小东景亚青李克秋李光
李颖曦,陈丹,王小东,景亚青,李克秋,李光
丹柴合剂对树突状细胞的诱导分化作用
李颖曦1,陈丹2,王小东2,景亚青1,李克秋1,李光1
摘要:目的研究中药复方制剂丹柴合剂对树突状细胞(DCs)的诱导分化作用,并探讨其机制。方法制备丹柴合剂的大鼠含药血清。分离人外周血单个核细胞,经磁珠筛选出CD14+单核细胞,培养5~7 d获得未成熟树突状细胞(imDCs),分为空白血清组与含药血清组,空白血清组分别加入含或不含脂多糖(LPS)的大鼠空白血清,含药血清组分别加入含或不含LPS的大鼠含药血清。用流式细胞术检测DCs表面分子CD86、CD11b和人白细胞抗原(HLA)-DR的表达;用酶联免疫吸附试验(ELISA)法检测DCs分泌白细胞介素(IL)-10的水平;用流式细胞术检测DCs对T细胞增殖能力的影响;用实时定量PCR检测吲哚胺2,3双加氧酶(IDO)基因的表达。结果经丹柴合剂作用后,DCs高表达CD11b,低表达CD86与HLA-DR,IL-10分泌增加。且该制剂通过促进DCs表达IDO进而抑制DCs介导的T细胞增殖能力。结论丹柴合剂可诱导DCs分化为调节性树突状细胞(DCregs)并发挥免疫调节作用。
关键词:树突细胞;免疫耐受;吲哚胺-吡咯2,3-双加氧酶;调节性树突状细胞;免疫调节
作者单位:1天津医科大学基础医学院生物学教研室(邮编300070),2药理学教研室
一直以来,免疫排斥反应是治疗器官移植和自身免疫性疾病的瓶颈。诱导机体产生针对移植物抗原和自身抗原的免疫耐受是治疗器官移植后免疫排斥反应和自身免疫性疾病的关键。树突状细胞(dendritic cells,DCs)是体内作用最强的抗原提呈细胞,它具有双向调控免疫作用的功能,既可提呈抗原,激活T细胞,刺激免疫应答,又可抑制T细胞增殖,诱导免疫耐受[1]。近年来,调节性树突状细胞(regulatory dendritic cells,DCregs)诱导的免疫耐受作用备受关注,在器官移植后免疫排斥反应、变态反应和自身免疫性疾病的治疗中具有潜在前景[2]。DCregs是一类具有负向免疫调节功能的DCs亚群,其高表达CD11b/c分子、低表达共刺激分子CD80、CD86和人白细胞抗原(HLA)-DR,其可增强细胞因子白细胞介素(IL)-10、转化生长因子(TGF)-β的分泌,还可抑制T细胞增殖并促进调节性T细胞扩增,从而诱导免疫耐受[3]。目前,DCregs已成为治疗包括移植物抗宿主病在内的免疫相关疾病的一种新策略[4]。中药复方制剂丹柴合剂是天津医科大学肿瘤医院吴雄志教授在长期临床工作中总结出的具有诱导免疫耐受作用的验方,本文旨在研究丹柴合剂对DCs的诱导分化作用和对免疫功能的调节,并探讨其机制。
1 材料与方法
1.1材料
1.1.1实验动物健康SPF级成年SD大鼠,体质量180~200 g,雌雄各半,购自北京军事医学科学院实验动物中心。
1.1.2材料与试剂CD14+磁珠购自德国Miltenyi Biotec;RPMI 1640培养基购自美国Hyclone Thermo Scientific;胎牛血清购自以色列Biological Industries;粒细胞巨噬细胞集落刺激因子(GM-CSF)与IL-4购自美国R&D Systems;LPS购自美国Sigma-Aldrich;anti-CD86抗体、anti-CD11b抗体、an⁃ti-HLA-DR抗体、同型抗体、anti-CD4+FITC抗体和7-AAD抗体均购自美国BioLegend。人IL-10酶联免疫试剂盒购自北京达科为。Trizol购自美国Life Technologies;逆转录试剂盒购自美国Invitrogen;实时定量PCR(Real-time PCR)试剂盒购自美国Applied Biosystems。引物合成于上海生工生物工程公司。
1.2实验方法
1.2.1丹柴合剂及含药血清的制备采用经常规炮制的生药,按份数称取柴胡6 g、牡丹皮6 g、白芍6 g、郁金6 g、甘草6 g,分别粉碎为粗末,混合,放入100℃沸水中浸泡30 min,再加入8倍的水,在100℃条件下浸提1 h,共浸提2次,最后将所得水提液合并使用;水提液经滤纸充分过滤后3 500 r/min离心15 min;旋转蒸发浓缩,冻干,得到冻干粉,药物得率为11.5%(W/W)。取该中药复方制剂冻干粉,用PBS稀释成适宜浓度,以6 g/kg剂量给予大鼠灌胃,每日2次,连续给药3 d,作为含药血清组;将等体积的PBS给予大鼠灌胃,作为空白血清组。末次给药后1 h经腹主动脉取血,室温静置3 h后无菌分离血清,再经56℃灭活30 min,即可得到含药/空白血清,冻存于-20℃备用。
1.2.2细胞培养从健康志愿者的外周静脉血中梯度离心获得外周血单个核细胞(PBMC),再经CD14+磁珠筛选出纯度可达90%的CD14+单核细胞。淋巴细胞取自第0天已贴壁的PBMC上清液。将CD14+单核细胞用含20%胎牛血清(FBS)的RPMI 1640培养基重悬并以1×106个/mL密度接种,加入60 μg/L GM-CSF和30 μg/L IL-4,培养5~7 d获得未成熟树突状细胞(immature dendritic cells,imDCs)。收集imDC,
分为空白血清对照组与含丹柴合剂的含药血清组。空白血清对照组分别加入含或者不含LPS(100 μg/L)的10%体积的大鼠空白血清,而含药血清组分别加入含或者不含LPS(100 μg/L)的10%体积的含药血清。
1.2.3 DCs表型分子鉴定收集imDC,实验方法与分组同1.2.2。48 h后收集细胞,用100 μL PBS缓冲液重悬,加入异硫氰酸荧光素(FITC)或枣红蛋白(PE)标记的抗体(anti-CD86、anti-CD11b、anti-HLA-DR),于4℃避光孵育20~30 min,PBS洗2遍,用流式细胞仪检测标记细胞的阳性率或平均荧光强度,未标记的DCs作为流式检测设门对照,最后用FlowJo软件分析。
1.2.4酶联免疫吸附试验(ELISA)收集imDC,实验方法与分组同1.2.2。48 h后,收集培养细胞的上清,用酶联免疫试剂盒检测IL-10的含量。
1.2.5混合淋巴细胞反应收集imDC,实验方法与分组同1.2.2。48 h后,将DCs作为刺激细胞(1×104个/mL),淋巴细胞(1×105个/mL)作为应答细胞,两者以1∶10的比例接种于24孔板中共培养5 d,再用100 μL PBS重悬,用anti-CD4+FITC和7-AAD的抗体标记淋巴细胞,最终用流式细胞仪检测CD4+7-AAD-的细胞数量。
1.2.6 Real-time PCR用Trizol法提取经10%含药血清与10%空白血清作用48 h的DCs总RNA,再将2 μg总RNA经逆转录试剂盒合成为cDNA,用Real-time PCR检测各组吲哚胺2,3双加氧酶(IDO)的相对表达量,并用相对于管家基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate de⁃hydrogenase,GAPDH)的倍数表示,每个样品设3次重复。引物序列如下:IDO(84 bp),上游为5′-GCCCTTCAAGTGTTTC ACCAA-3′,下游为5′-CCTTTCCAGCCAGACAAATATATG-3′;GAPDH(89 bp),上游为5′-TGCACCACCAACTGCTTAG C-3′;下游为5′-GGCATGGACTGTGGTCATGAG-3′。
1.3统计学方法采用SPSS 16.0分析数据,计量资料用均数±标准差(x ±s)表示,组间比较采用单因素方差分析,多重比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1丹柴合剂对DCs表型的影响imDC空白血清组、imDC含药血清组、imDC+LPS空白血清和imDC+ LPS含药血清组CD86阳性细胞百分率分别为(39.50±6.20)%、(16.95±2.05)%、(75.15±1.75)%、(56.00±3.10)%(F=132.52,P<0.05),见图1。经丹柴合剂作用后,imDC组和经LPS刺激的imDC组CD86阳性细胞百分率均显著降低,分别低于其对照组57.09%(P<0.05)和25.48%(P<0.05)。4组CD11b阳性细胞百分率分别为(5.13±0.99)%、(10.16±0.95)%、(4.91±0.46)%、(6.64±0.44)%(F= 31.02,P<0.05),见图1。imDC组与经LPS刺激的imDC组CD11b阳性细胞百分率分别高于其对照组49.51%和35.23%(P<0.05)。
此外,4组的HLA-DR平均荧光强度分别为1 252.00±211.00、901.00±41.00、1 784.50±113.50、1 436.00±92.00(F=24.11,P<0.05),见图1。经该制剂作用后,imDC组与经LPS刺激的imDC组HLADR平均荧光强度均显著降低,分别低于其对照组28.04%和19.53%(P<0.05)。综上,丹柴合剂可使共刺激分子CD86和抗原提呈分子HLA-DR表达降低,使DCregs的特征性表面分子CD11b表达增强。
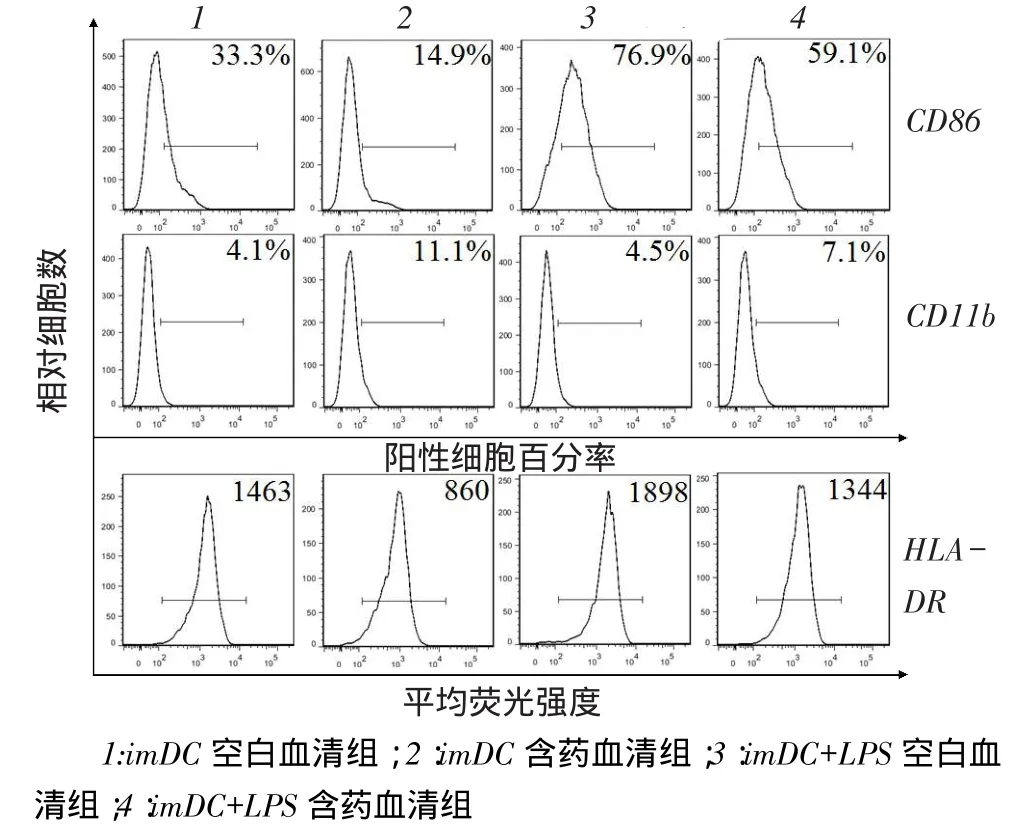
Fig. 1 The phenotypic characteristics of DCs treated with Danchaiheji图1丹柴合剂对DCs表型的影响
2.2丹柴合剂对DCs分泌细胞因子的影响imDC空白血清组、imDC含药血清组、imDC+LPS空白血清组与imDC+LPS含药血清组分泌的IL-10浓度分别为(108.50±5.20)、(127.17±4.55)、(168.50±4.90)、(209.30±8.50)ng/L(F=168.25,P<0.05),见图2。实验发现,与imDC和imDC+LPS空白血清组比较,丹柴合剂均能促进DCs分泌DCregs的特异性标志物IL-10(P<0.05)。
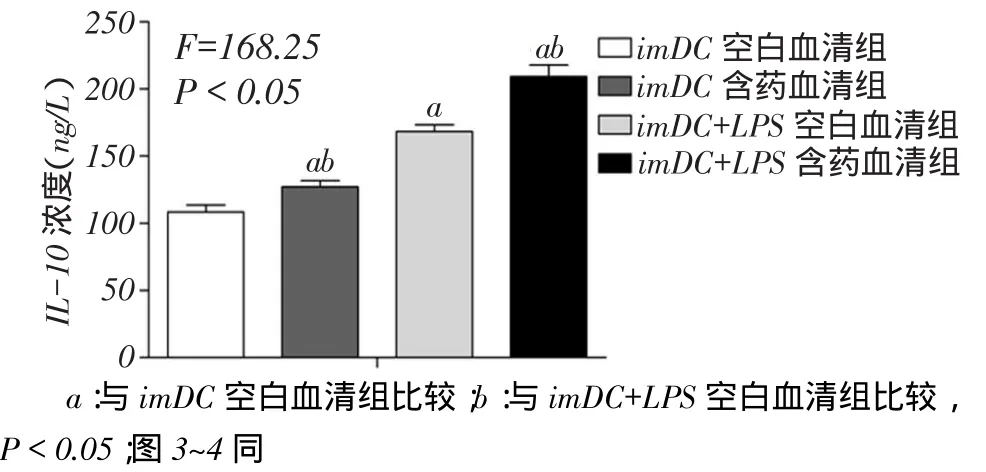
Fig. 2 The cytokine production of DCs treated with Danchaiheji图2丹柴合剂对DCs分泌细胞因子的影响
2.3丹柴合剂对T细胞增殖能力的影响imDC空白血清组、imDC+LPS空白血清组与imDC+LPS含药血清组T细胞的平均荧光强度分别为1 062.50± 22.50、1 641.00±138.00、1 024.00±83.00(F=40.67,P<0.05),见图3。研究发现,随着imDC分化成熟,其刺激同种异体T细胞增殖的能力也随之增强(P< 0.05),而丹柴合剂可显著降低经LPS刺激的DCs诱导的T细胞增殖能力(P<0.05),提示丹柴合剂能显著抑制DCs介导的淋巴细胞增殖作用。
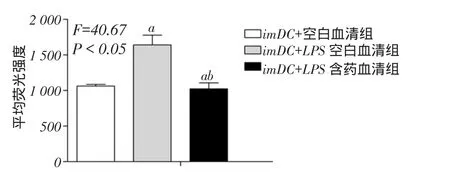
Fig. 3 The effects of Danchaiheji on the proliferation of T cells图3丹柴合剂对T细胞增殖能力的影响
2.4丹柴合剂在mRNA水平对IDO表达的影响经丹柴合剂作用后的imDC+LPS组IDO的相对表达量高于空白血清组近1.5倍(6.65±0.40 vs 4.73±0.23,F=471.22,P<0.05),见图4,提示该制剂可促进DCs高表达IDO。

Fig. 4 The relative transcription levels of IDO by real-time PCR图4 Real-time PCR检测IDO基因的相对表达量
3 讨论
3.1治疗免疫排斥反应的现状一直以来,免疫排斥反应是治疗器官移植和自身免疫性疾病的难点与重点。目前在免疫排斥反应的治疗中,疗效最为确切的是免疫抑制剂。理想的免疫抑制剂具有高效、低毒、方便和经济的特点,然而目前在临床上投入使用的免疫抑制剂大多存在广泛而强烈的毒副作用,长期服用可使患者的免疫功能下降,抗感染能力降低,甚至引起强烈的肝肾毒性[5]。例如肝移植常用的免疫抑制剂环孢素A、他克莫司等药物的神经毒作用已屡见报道,两者可出现头痛、癫痫、震颤、失明、局灶性脑白质病等神经系统病变[6]。因此,诱导患者产生针对移植物抗原和自身抗原的免疫耐受是治疗器官移植后免疫排斥反应和自身免疫性疾病的关键。
3.2 DCregs的免疫调节性能DCs根据其分化成熟的不同状态可分为imDCs和成熟树突状细胞(mature dendritic cells,mDCs)。imDCs低表达共刺激分子并产生大量抗炎细胞因子,抑制免疫应答,而mDCs与imDCs恰恰相反,其高表达共刺激分子并产生大量炎性细胞因子,诱导适应性免疫应答[7-8]。近年来,DCregs诱导的免疫耐受作用备受关注,在器官移植免疫排斥反应、变态反应和自身免疫性疾病的治疗中具有潜在的前景[2]。诱导产生DCregs的方法很多,如免疫抑制剂[9]、基质细胞[10]、生物制剂[11]。但由于大多数免疫抑制剂可降低机体的免疫功能,甚至具有肝肾毒性和神经毒作用,给患者带来严重的不良反应。因此,寻找一种经济、安全而又能高效获得DCreg的方法具有良好的临床应用价值。
3.3丹柴合剂的免疫调节性能本研究旨在克服上述不足之处,根据多年的临床实践,反复临床验证拆方组方,提供一种安全、经济、有效诱导免疫耐受的中药复方制剂——丹柴合剂。其配伍原理为少阳肝胆,病机为正邪相争,调理肝胆,使邪证两孤立,则可诱导机体免疫系统对病邪的免疫耐受。此方以柴胡为君,疏肝解表,白芍、郁金为臣,疏肝活血,肝藏血,佐以牡丹皮凉血,甘草调和诸药为使。肝体阴而用阳,白芍养肝之体,柴胡助肝之用;肝主气而藏血,柴胡理气,郁金活血;气有余便是火,更加牡丹皮凉血清热。纵观全方,攻补皆施,气血同调,实为调理肝胆以诱导免疫耐受之良方。本文通过大量实验证实,DCs经丹柴合剂作用后可诱导分化为一种高表达CD11b,低表达CD86与HLA-DR的DCs亚型,该DCs亚型可促进细胞因子IL-10的分泌。此外,将LPS刺激后的DCs与CD4+T细胞共培养后,该制剂可显著抑制DCs介导的T细胞增殖能力。IDO是一种调控色氨酸的代谢酶,其通过犬尿氨酸通路调控色氨酸的代谢,IDO还可抑制T细胞活化和增殖参与诱导免疫耐受[12]。大量研究报道,IDO在诱导免疫耐受中发挥重要的作用,可用于治疗器官移植后排斥反应、自身免疫性关节炎等免疫性疾病[13-14]。本研究发现丹柴合剂可诱导DCs使IDO基因表达上调。
3.4前景展望综上,丹柴合剂通过上调IDO表达将DCs诱导分化为具有负向免疫调节功能的DCregs,从而诱导免疫耐受。这些发现在器官移植免疫排斥反应、变态反应和自身免疫性疾病的治疗中具有潜在的前景,为DCregs的靶向治疗和细胞治疗提供了进一步的支持。
参考文献
[1] Li YX, Chen D, Li KQ, et al. Strategies for generating regulatory dendritic cells and the clinical application of immune tolerance[J]. Tianjin Med J, 2014, 42(7): 725-727. [李颖曦,陈丹,李克秋,等.调节性树突状细胞的获取途径及其诱导免疫耐受的临床应用[J].天津医药, 2014, 42(7): 725- 727]. doi:10.3969/j.issn.0253- 9896. 2014.07.030.
[2] Raich-Regue D, Glancy M, Thomson AW. Regulatory dendritic cell therapy: from rodents to clinical application[J]. Immunol Lett, 2014, 161(2): 216-221. doi: 10.1016/j.imlet.2013.11.016.
[3] Huang H, Dawicki W, Lu M, et al. Regulatory dendritic cell expres⁃sion of MHCII and IL-10 are jointly requisite for induction of toler⁃ance in a murine model of OVA-asthma[J]. Allergy, 2013, 68(9): 1126-1135.doi: 10.1111/all.12203.
[4] Han Y, Chen Z, Yang Y, et al. Human CD14+ CTLA-4+ regulatory dendritic cells suppress T-cell response by cytotoxic T-lymphocyte antigen-4-dependent IL-10 and indoleamine-2, 3-dioxygenase production in hepatocellular carcinoma[J]. Hepatology, 2014, 59(2): 567-579. doi: 10.1002/hep.26694.
[5] Rosborough BR, Raich-Regue D, Turnquist HR, et al. Regulatory myeloid cells in transplantation[J]. Transplantation, 2014, 97(4): 367-379. doi: 10.1097/TP.0b013e3182a860de.
[6] Wang LX, Chen W, Yang P, et al. Monitoring blood concentration of cyclosoprine A in renal transplant recipients[J]. Chongqing Med J, 2008, 37(3): 243-246. [王丽馨,陈伟,杨沛,等.肾移植术后患者环孢素A血药浓度的监测[J].重庆医学, 2008, 37(3): 243-246]. doi:10.3969/j.issn.1671-8348.2008.03.009.
[7] Steinman RM, Hawiger D, Nussenzweig MC. Tolerogenic dendritic cells[J]. Annu Rev Immunol, 2003, 21:685-711. doi: 10.1146/an⁃nurev.immunol.21.120601.141040.
[8] Ueno H, Klechevsky E, Morita R, et al. Dendritic cell subsets in health and disease[J]. Immunol Rev, 2007, 219:118- 142. doi: 10.1111/j.1600-065X.2007.00551.x.
[9] Hackstein H, Thomson AW. Dendritic cells: emerging pharmacolog⁃ical targets of immunosuppressive drugs[J]. Nat Rev Immunol, 2004, 4(1): 24-34. doi: 10.1038/nri1256.
[10] Zhang Y, Cai W, Huang Q, et al. Mesenchymal stem cells alleviate bacteria-induced liver injury in mice by inducing regulatory dendritic cells[J]. Hepatology, 2014, 59(2): 671-682. doi: 10.1002/hep.26670. [11] Cai Z, Zhang W, Li M, et al. TGF-beta1 gene-modified, immature dendritic cells delay the development of inflammatory bowel dis⁃ease by inducing CD4(+)Foxp3(+) regulatory T cells[J]. Cell Mol Im⁃munol, 2010, 7(1): 35-43. doi: 10.1038/cmi.2009.107.
[12] Bock F, Rossner S, Onderka J, et al. Topical application of soluble CD83 induces IDO-mediated immune modulation, increases Foxp3+ T cells, and prolongs allogeneic corneal graft survival[J]. J Immunol, 2013, 191(4): 1965-1975. doi: 10.4049/jimmunol.1201531.
[13] Cook CH, Bickerstaff AA, Wang JJ, et al. Spontaneous renal al⁃lograft acceptance associated with "regulatory" dendritic cells and IDO[J]. JImmunol, 2008, 180(5): 3103-3112.
[14] Yang J, Yang Y, Fan H, et al. Tolerogenic splenic IDO (+) dendritic cells from the mice treated with induced-Treg cells suppress colla⁃gen-induced arthritis[J]. J Immunol Res, 2014, 2014: 831054. doi: 10.1155/2014/831054.
(2015-10-23收稿2015-10-30修回)
(本文编辑李鹏)
The differential effects of traditional Chinese medicine Danchaiheji on dendritic cells
LI Yingxi1, CHEN Dan2, WANG Xiaodong2, JING Yaqing1, LI Keqiu1, LI Guang1
1 Department of Biology, Basic Medical College, Tianjin Medical University, Tianjin 300070, China;
2 Department of Pharmacology, Basic Medical College Corresponding Author E-mail:lig@tmu.edu.cn
Abstract:Objective To explore the effects of traditional Chinese formula Danchaiheji on the differentiation of regula⁃tory dendritic cells (DCs) and the underlying mechanism. Methods The rat blood serums with or without the formula Dan⁃chaiheji were prepared. The peripheral blood mononuclear cells were separated from the peripheral venous blood of healthy donors. CD14+monocytes were isolated using CD14+magnetic beads and cultured for 5-7 days to obtain immature dendritic cells (imDCs). Then the cells was divided into control group and Danchaiheji containing rat serum group. Control group was divided into two subgroups (containing LPS and without LPS). Danchaiheji containing rat serum group was also divided into two subgroups (containing LPS and without LPS). The surface markers CD86, CD11b and HLA-DR of DCs were detected by flow cytometry. The level of IL-10 was determined by enzyme-linked immunosorbent assays (ELISA). The proliferation of al⁃logeneic T-cells was detected by flow cytometry and the expression level of indoleamine 2,3-dioxygenase (IDO) was deter⁃mined using quantitative real-time PCR. Results DCs treated with the formula Danchaiheji exhibited high CD11b and low CD86 and HLA-DR expression levels as well as promoted the secretion of IL-10. In addition, the drug could inhibit the pro⁃motion of DCs on the proliferation of T cells, which was associated with the up-regulation of IDO expression. Conclusion The traditional Chinese formula Danchaiheji can induce the differentiation of DCs into regulatory DCs and play a role in in⁃hibitory effect on immune function.
Key words:dendritic cells;immune tolerance;indoleamine-pyrrole 2,3,-dioxygenase; regulatory dendritic cells;immu⁃nomodulation
中图分类号:R392.4
文献标志码:A
DOI:10.11958/20150255
基金项目:国家高技术研究发展计划(863计划)资助项目(2012AA021003);国家自然科学基金资助项目(21177091)
作者简介:李颖曦(1990),女,硕士在读,主要从事免疫耐受方面研究
通讯作者E-mail:lig@tmu.edu.cn
