氯化钴低氧对黑色素瘤细胞系迁移能力及FSTL1表达分泌的影响
2016-06-28任方元李莲姜芳馨冯靖陈宝元曹洁
任方元,李莲,姜芳馨,冯靖,陈宝元,曹洁
氯化钴低氧对黑色素瘤细胞系迁移能力及FSTL1表达分泌的影响
任方元1,李莲1,姜芳馨2,冯靖1,陈宝元1,曹洁1
摘要:目的探讨氯化钴(CoCl2)化学模拟低氧对黑色素瘤细胞系B16F10迁移的影响,以及Follistatin-like 1 (FSTL1)蛋白在此过程中的转录、表达和分泌情况。方法CoCl2模拟低氧作用于小鼠B16F10细胞,实验分为3组:0 μmol/L CoCl2对照组、50 μmol/L和100 μmol/L CoCl2处理组。用MTT法测定细胞活力;用Transwell法测定细胞迁移能力;qRT-PCR检测Fstl1 mRNA表达;Western blot检测细胞内外FSTL1蛋白表达。结果CoCl2模拟低氧可以导致B16F10细胞存活率显著下降,并呈浓度和时间依赖性;50 μmol/L CoCl2处理组(0.158±0.006)、100 μmol/L CoCl2处理组(0.203±0.002)B16F10细胞迁移能力均明显高于对照组(0.107±0.001,均P<0.05);50 μmol/L CoCl2处理组(1.573±0.114)、100 μmol/L CoCl2处理组(2.219±0.085)Fstl1 mRNA表达均显著高于对照组(0.962±0.054,均P<0.05),而胞内FSTL1蛋白表达与Fstl1 mRNA表达趋势一致。同时也发现,CoCl2处理组细胞外FSTL1蛋白表达均低于对照组,且100 μmol/L CoCl2处理组几乎检测不到FSTL1表达。结论CoCl2模拟低氧促进黑色素瘤细胞迁移,可能与FSTL1的表达和分泌有关,但其功能和作用机制还需进一步探讨。
关键词:黑色素瘤;细胞运动;细胞低氧;氯化钴;迁移;FSTL1
作者单位:1天津医科大学总医院呼吸科(邮编300052);2南开大学生命科学院
FSTL1的转录、表达和分泌情况,为研究低氧与肿瘤的关系及其分子机制提供新的目标和思路。
1 材料与方法
1.1材料黑色素瘤细胞可传代细胞株B16F10由天津南开大学生命科学院肺发育和疾病实验室馈赠。DMEM培养基、胎牛血清(FBS)和胰蛋白酶(美国Gibco公司),TRIzol(美国Invitrogen公司),M-MLV逆转录酶(美国Promega Leiden公司),SYBR®Select Master Mix(美国AMBION公司),Fstl1和内参β-actin的实时荧光定量PCR(qRT-PCR)引物(上海生工生物工程技术服务有限公司),Fibronectin胶、Fstl1抗体(美国Santa Cruz公司),β-actin抗体(美国Cell Signaling Technology公司)。
1.2方法
1.2.1细胞培养B16F10细胞用含10% FBS的DMEM培养液于37℃、5%CO2、饱和湿度条件下培养。待细胞长至70%~80%融合时,用0.25%胰蛋白酶消化并以1∶4传代,取生长良好的第3~5代细胞用于实验。
1.2.2 MTT法测定细胞活力取处于对数生长期的黑色素瘤细胞,以5×103个/孔的密度接种于96孔板内,培养4 h后弃掉原培养基,分别加入不同浓度的CoCl2(0、50、100、200和400 μmol/L),每个浓度组设4个复孔,在不含血清的DMEM中分别培养24 h、48 h。吸去旧培养基,每孔加入MTT溶液10 μL和含10%FBS的DMEM培养基100 μL,继续培养4 h后,吸去原溶液,每孔加入150 μL二甲基亚砜(DMSO)溶液终止反应。37℃培养10 min,于492 nm波长处测定各孔光密度(OD)值,计算细胞存活率。细胞存活率=实验组OD值/对照组OD值×100%。
1.2.3 Transwell法测定细胞迁移能力在Transwell小室下部加入一定量Fibronectin胶,于37℃培养箱孵育2 h。取对数生长期的细胞,消化成单细胞悬液后计数,调整浓度为5.0×104/mL。将细胞加入Transwell的上室,每孔加入100 μL细胞悬液。在Transwell小室底部加入不同浓度CoCl2(50、100 μmol/L),由10%FBS的培养基配制。37℃、5% CO2培养箱中培养24 h,每组细胞做2个复孔。24 h后用镊子小心取出Transwell小室,吸干上室液体,10%甲醛室温固定,结晶紫染色。用棉签擦去上室未穿膜的细胞。体式显微镜1.6及10倍光镜拍照。将小室滤膜取出,甲醇溶解,充分溶解后在酶标仪570 nm下测各孔吸光度(A)值,以衡量细胞的迁移能力。
1.2.4 qRT-PCR利用TRIzol提取细胞RNA,利用M-MLV逆转录酶将总RNA反转录为cDNA,然后用SYBR®Select Master Mix进行qRT-PCR。PCR引物设计见表1。PCR反应条件:95℃预变性3 min,94℃变性40 s,60℃复性30 s,72℃延伸30 s,循环40次后,72℃延伸7 min。以β-actin为内参来校正目的基因的表达量。Fstl1引物:上游5′-TTAT⁃GATGGGCACTGCAAAGAA-3′,下游5′-ACTGCCTTTAGAG AACCAAGCC-3′,产物151 bp。β-actin引物:上游5′-AGG CCAACCGTGAAAAGATG-3′,下游5′-AGAGCATAGCCCTC⁃GTAGATGG-3′,产物265 bp。
1.2.5 Western blot分析B16F10细胞分别用不同浓度的CoCl2(50、100 μmol/L)在不含血清的DMEM中处理24 h后,收集各组细胞及上清。收集的细胞超声破碎后,于4℃、12 000 r/min离心10 min,取上清即为蛋白提取溶液。用BCA试剂盒测定蛋白浓度后,加入5×Sample buffer,100℃煮沸5 min,根据蛋白浓度取一定量蛋白上样进行SDS-PAGE电泳分离。收集的细胞上清用饱和三氯乙酸(TCA)沉淀,加入100μL 1×Sample buffer,100℃煮沸5 min,每组各取30 μL总蛋白进行SDS-PAGE胶电泳分离。湿转法将凝胶上的蛋白转至PVDF膜上,5%脱脂奶粉室温封闭1 h后,再分别加入羊抗鼠FSTL1多克隆抗体(1∶200),兔抗鼠β-actin多克隆抗体(1∶5 000)4℃孵育过夜。TBST洗膜5次,每次7 min。加入辣根过氧化物酶标记的二抗,室温孵育1 h,洗膜,ECL显影。1.3统计学方法采用SPSS 16.0统计软件处理,数据用均数±标准差(x ±s)表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1不同浓度CoCl2对B16F10细胞活力的影响随着CoCl2浓度和培养时间的增加,B16F10细胞活力逐渐降低。CoCl2终浓度为200、400 μmol/L处理B16F10细胞24 h和48 h时以及CoCl2终浓度为50、100 μmol/L处理B16F10细胞48 h时,细胞活力均显著下降(P<0.05)。而50、100 μmol/L处理B16F10细胞24 h,细胞活力未受到显著影响(P>0.05),见表1。故后续研究中选择50 μmol/L和100 μmol/L 2个剂量处理细胞24 h作为CoCl2的实验浓度和时间,观察黑色素瘤细胞的生物学变化。

Tab. 1 Effects of hypoxia induced by different concentrations of CoCl2on cell viability of B16F10表1不同浓度CoCl2诱导低氧对B16F10细胞存活率的影响(n=4,%, x ±s)
2.2 CoCl2低氧对B16F10细胞迁移能力的影响50 μmol/L和100 μmol/L CoCl2处理组B16F10细胞迁移能力(0.158±0.006,0.203±0.002)均高于对照组(0.107±0.001,均P<0.05),见图1。
2.3 CoCl2低氧对B16F10细胞FSTL1转录、表达和分泌的影响50 μmol/L和100 μmol/L CoCl2处理组Fstl1 mRNA转录水平(1.573±0.114,2.219±0.085)均高于对照组(0.962±0.054,均P<0.01),见图2A。而胞内FSTL1蛋白表达与Fstl1 mRNA表达趋势一致,见图2B。同时也发现,不同浓度CoCl2处理B16F10细胞后,胞外FSTL1蛋白表达均低于对照组,且100 μmol/L CoCl2处理组几乎检测不到。
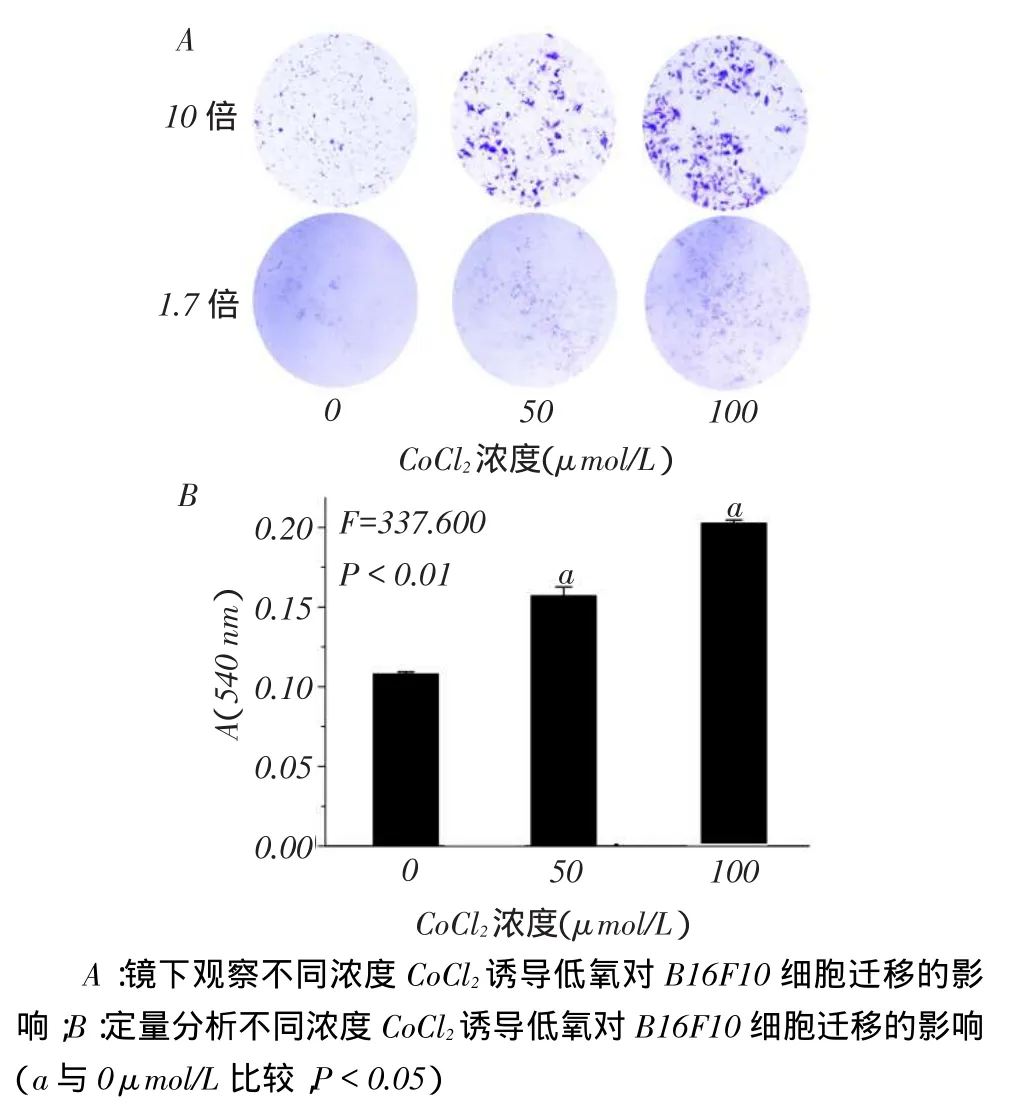
Fig. 1 Effects of hypoxiainduced by different concentrations of CoCl2on migration of B16F10图1 CoCl2低氧对B16F10细胞迁移能力的影响
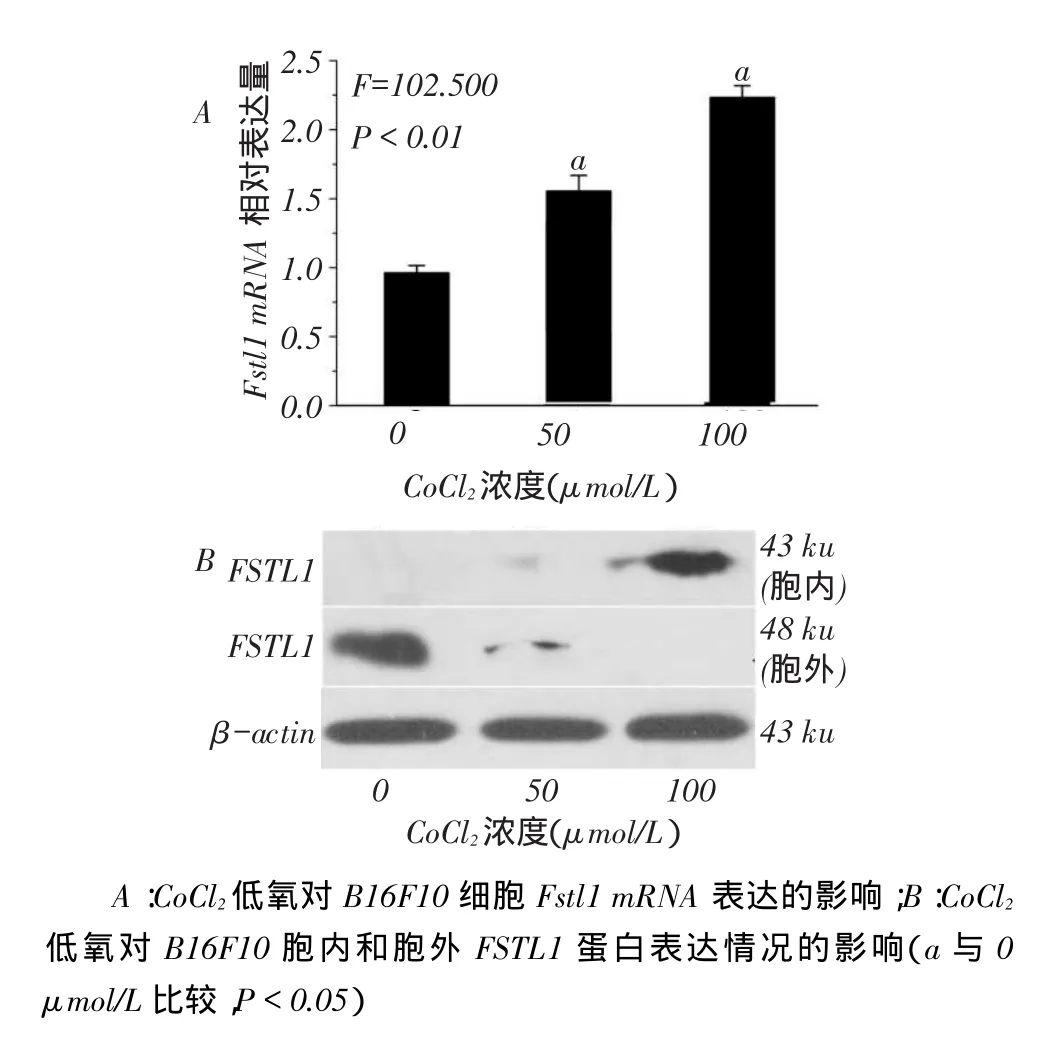
Fig. 2 Effects of CoCl2induced hypoxiaon expression of Fstl1 mRNA and FSTL1 protein in B16F10图2 CoCl2低氧对Fstl1 mRNA和FSTL1蛋白表达的影响
3 讨论
3.1研究背景恶性黑色素瘤因具有很高的增殖、局部浸润和远处转移的潜能,使其在皮肤肿瘤中具有恶性程度高、预后差的特点。迁移不仅是细胞进行很多重要生理活动的基础,同时也是肿瘤发生和炎症反应等病理过程中的重要环节[5]。如何控制癌细胞的运动是治疗肿瘤的关键问题之一。导致肿瘤细胞的迁移运动有着多种不同的机制,肿瘤发生发展过程存在的氧供应不足是其重要的原因之一。
3.2低氧模型建立细胞的低氧模型主要分为2种:环境低氧和细胞内低氧。环境低氧模型通过改变氧分压使细胞处于低氧状态,其与体内细胞缺氧的生理状况更接近,但需要特殊的细胞培养设备且费用高昂,而CoCl2模拟的细胞内缺氧模型操作相对简单,低氧更易于控制,因此更常用于各种实验性缺氧研究[6]。Co2+是铁螯合酶的底物,它可以通过与Fe2+竞争性结合血红蛋白,阻断氧感受器与氧结合,使细胞“感觉”缺氧,上调低氧诱导因子1α(HIF-1α)的表达而增强细胞的抗缺氧能力[7]。本研究采用CoCl2成功模拟了小鼠黑色素瘤细胞的缺氧环境,发现低氧环境可以导致B16F10细胞存活率显著下降,并呈浓度和时间依赖性。同时发现CoCl2低氧可以促进B16F10细胞的迁移能力以及Fstl1 mRNA和胞内蛋白表达显著升高,而抑制FSTL1蛋白向胞外的分泌。
3.3 FSTL1与肿瘤的关系FSTL1作为一个胞外分泌的小分子蛋白,具有生物学功能的多样性。现有研究表明FSTL1在胚胎发育[8-9]、类风湿性关节炎[10]、心血管疾病以及肺纤维[11-12]等过程中都扮演着重要角色。FSTL1的表达和人类多种肿瘤细胞也密切相关,但关于FSTL1在肿瘤免疫中的研究存在分歧。一方面,有研究发现在多种肿瘤细胞系中FSTL1均是低表达,研究发现connexin43蛋白通过调控FSTL1的分泌[13],从而抑制癌细胞增殖以及迁移[14];另一方面,也有研究发现FSTL1可以促进前列腺癌细胞的转移[15],这说明FSTL1对于肿瘤具有双向调节的作用。本研究显示,CoCl2模拟低氧虽然促进了FSTL1的转录和胞内蛋白水平表达,但却抑制了FSTL1向细胞外的分泌。FSTL1可通过改变细胞微环境,在细胞外水平调节细胞的各种活动。因此,笔者推测CoCl2低氧促进黑色素瘤细胞迁移可能主要与FSTL1蛋白向胞外的分泌有关。
3.4展望本课题组在后续的研究中将对FSTL1进行knockdown或加入其抑制剂,降低或阻断FSTL1的表达,观察其对迁移是否有减低或逆转作用,进一步明确CoCl2低氧促进黑色素瘤细胞迁移与FSTL1蛋白的关系及其分子机制。
参考文献
[1] Meijer TW, Kaanders JH, Span PN, et al.Targeting hypoxia, HIF-1, and tumor glucose metabolism to improve radiotherapy efficacy [J]. Clin Cancer Res, 2012, 18(20):5585- 5594. doi: 10.1158/1078-0432.CCR-12-0858.
[2] Shibanuma M, Mashimo J, Mita A, et al. Cloning from a mouse os⁃teoblastic cell line of a set of transforming-growth-factor-beta 1-regulated genes, one of which seems to encode a follistatin-related polypeptide [J]. Eur JBiochem, 1993, 217(1):13-19.
[3] Sumitomo K, Kurisaki A, Yamakawa N, et al.Expression of a TGF-beta1 inducible gene, TSC-36, causes growth inhibition in human lungcancer cell lines[J]. Cancer Lett, 2000, 155(1):37-46.
[4] Liu W, Zhang CC, Wang J, et al. Antiangiogenic drugs enhance the ability of invasion and metastasis of breast cancer cells under serum starvation and hypoxia [J]. Chinese Journal of Oncology, 2015, 37 (4):244-250. [刘薇,张翠翠,王晶,等.抗血管生成药物增加血清饥饿环境中MDA-MB-231乳腺癌细胞的侵袭和迁移能力[J].中华肿瘤杂志, 2015, 37(4): 244-250].
[5] Kundra V, Escobedo JA, Kazlauskas A, et al.Regulation of chemo⁃taxis by the platelet-derived growth factor receptor-beta[J]. Nature, 1994, 367(6462):474-476.doi: 10.1038/367474a0.
[6] Ryan HE, Poloni M, McNulty W, et al.Hypoxia-inducible factor-1alpha is a positive factor in solid tumor growth[J]. Cancer Res, 2000, 60(15):4010-4015.
[7] Kim KS, Rajagopal V, Gonsalves C, et al.A novel role of hypoxia-in⁃ducible factor in cobalt chloride- and hypoxia-mediated expression of IL-8 chemokine in human endothelial cells[J]. J Immunol, 2006, 177(10):7211-7224.
[8] Esterberg R, Delalande JM, Fritz A. Tailbud-derived Bmp4 drives proliferation and inhibits maturation of zebrafish chordamesoderm [J]. Development, 2008, 135(23):3891-3901. doi: 10.1242/dev.0292 64.
[9] Geng Y, Dong Y, Yu M, et al. Follistatin-like 1 (Fstl1) is a bone morphogenetic protein (BMP) 4 signaling antagonist in controlling mouse lung development [J]. Proc Natl Acad Sci USA, 2011, 108 (17):7058-7063.doi:10.1073/pnas.1007293108.
[10] Li D, Wang Y, Xu N, et al. Follistatin-like protein 1 is elevated in systemic autoimmune diseases and correlated with disease activity in patients with rheumatoid arthritis [J]. Arthritis Res Ther, 2011, 13 (1):R17. doi: 10.1186/ar3241.
[11] Oshima Y, Ouchi N, Sato K, et al. Follistatin-like 1 is an Akt-regu⁃lated cardioprotective factor that is secreted by the heart [J]. Circu⁃lation, 2008, 117(24):3099-3108. doi: 10.1161/CIRCULATIONAH A.108.767673.
[12] Shimano M, Ouchi N, Nakamura K, et al.Cardiac myocyte fol⁃listatin-like 1 functions to attenuate hypertrophy following pressure overload [J]. Proc Natl Acad Sci USA, 2011, 108(43):E899-906. doi: 10.1073/pnas.1108559108.
[13] Zhao W, Han HB, Zhang ZQ, et al. Suppression of lung cancer cell invasion and metastasis by connexin43 involves the secretion of fol⁃listatin-like 1 mediated via histone acetylation[J]. Int J Biochem Cell Biol, 2011, 43(10):1459-1468.doi: 10.1016/j.biocel.2011.06.009.
[14] Chan QK, Ngan HY, Ip PP, et al. Tumor suppressor effect of fol⁃listatin-like 1 in ovarian and endometrial carcinogenesis: a differen⁃tial expression and functional analysis [J]. Carcinogenesis, 2009, 30 (1):114-121.doi: 10.1093/carcin/bgn215.
[15] Trojan L, Schaaf A, Steidler A, et al.Identification of metastasis-as⁃sociated genes in prostate cancer by genetic profilingof human pros⁃tate cancer cell lines[J]. Anticancer Res, 2005, 25(1A):183-191.
(2015-09-02收稿2015-11-12修回)
(本文编辑李鹏)
Effects of cobalt chloride-induced hypoxia on cell migration and expression and secretion of FSTL1 in melanoma cell line
REN Fangyuan1,LI Lian1,JIANG Fangxin2,FENG Jing1,CHEN Baoyuan1, CAO Jie1
1 Respiratory Department of Tianjin Medical University General Hospital,Tianjin 300052, China;
2 College of Life Sciences, Nankai University
Corresponding Author E-mail:tjcaojie@sina.com
Abstract:Objective To explore the effects of cobalt chloride (CoCl2)-induced hypoxia on migration of melanoma cells, and to detect the transcription, expression and secretion of Follistatin-like 1(FSTL1)in this process. Methods B16F10 melanoma cell line was treated with CoCl2in order to mimic hypoxia. Experimental cells were divided into three groups: 0 μmol/L, 50 μmol/L and 100 μmol/L CoCl2treatment groups. MTT assay was used to assure cell viability, and to determinethe treatment concentration of CoCl2. Transwell assay was used to determine the migration ability of B16F10 melanoma cell line. Real-time PCR was used to measure the mRNA expression of Fstl1. Western blot assay was used to detect the intracel⁃lular and extracellular protein expression of FSTL1. Results The cell viability of B16F10 melanoma cell line was signifi⁃cantly reduced by CoCl2treatment, with a time and concentration-dependent manner. The migration ability of B16F10 cell line was significantly increased in CoCl2treated group compared with that of control group (P<0.05). The mRNA level of Fstl1 was obviously higher in CoCl2treated group than that of control group (P<0.05). The intracellular expression of FSTL1 protein was consistent with the expression trend of Fstl1 mRNA. Simultaneously, the extracellular protein level of FSTL1 was significantly decreased compared with that of control group. There was no expression of FSTL1 in 100 μmol/L CoCl2treat⁃ment group. Conclusion The migration ability of melanoma cell line is enhanced by CoCl2treatment, which may be associ⁃ated with expression and secretion of FSTL1, however, the relevant mechanism still needs further investigation.
Key words:melanoma;cell movement;cell hypoxia;cobalt chloride;migration;follistatin-like 1黑色素瘤是一类来源于神经嵴黑色素细胞的高度恶性肿瘤,具有很高的发病率和死亡率,一旦远处转移,预后极差。低氧是肿瘤发生发展过程中存在的一种普遍的病生理现象,同时也是诱发肿瘤细胞迁移的始动因素之一[1]。氯化钴(cobalt chloride,CoCl2)是一种常用的化学性低氧模拟剂,经常应用于研究低氧与肿瘤的关系及其分子机制。Follistatin-like protein 1(FSTL1)是一种可分泌的小分子糖蛋白(38 ku),属于Fst-SPARC蛋白家族[2]。研究表明它可以调控肿瘤细胞的增殖和分化,是一个与肿瘤相关的蛋白因子[3]。研究表明低氧对肿瘤迁移和进展具有重要作用[4],而在此过程中FSTL1的表达分泌及其调控的分子机制尚不清楚。本研究通过CoCl2模拟细胞缺氧检测低氧对黑色素瘤细胞系B16F10迁移能力的影响,并进一步观察在此过程中肿瘤相关蛋白
中图分类号:R739.5
文献标志码:A
DOI:10.11958/20150144
基金项目:国家十二五科技支撑计划(2012BAI05B02)
作者简介:任方元(1990),女,硕士在读,主要从事睡眠低氧性疾病和肿瘤相关研究
通讯作者E-mail:tjcaojie@sina.com
