GFAP单克隆抗体制备及ELISA检测方法研究
2016-06-27张守涛郭亚楠
王 珂, 张守涛, 郭亚楠
(郑州大学 生命科学学院 河南 郑州 450001)
GFAP单克隆抗体制备及ELISA检测方法研究
王 珂, 张守涛, 郭亚楠
(郑州大学 生命科学学院 河南 郑州 450001)
制备抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP) 单克隆抗体,并尝试建立双抗夹心ELISA 检测方法,为出血性脑卒中早期诊断提供基础材料.用重组人GFAP作为抗原免疫BALB/C小鼠,通过杂交瘤技术制备抗GFAP单克隆抗体;用HRP标记单克隆抗体,ELISA 和Western blot检测抗体的亚类、表位和特异性;采用ELISA 技术制备GFAP检测试剂盒.获得了7株抗GFAP单克隆抗体,抗体亚类为IgG2或IgG1,抗体特异性好.抗体配对成功,ELISA检测重组人GFAP灵敏且稳定.
GFAP; 出血性脑卒中; 抗体; 酶联免疫吸附检测
0 引言
胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是分子量为55 kDa的胞浆蛋白,最初从慢性多发性硬化症患者的白质斑块中发现[1].进一步研究发现,GFAP蛋白至少含有以下3个功能域:氨基端“头部”、羧基端“尾部”和中部螺旋杆状区,属于III型中间丝蛋白家族[2].大鼠、小鼠和人的GFAP基因已被克隆并测序,序列比对显示,大鼠、小鼠和人的GFAP高度同源.其中,人的GFAP基因定位于染色体17q21区域[3].GFAP基因含有9个外显子和8个内含子,还有4个可选择的外显子和2个可选择的内含子[4].截至目前,共计发现人类6种不同的GFAP转录本,其中第一个被发现、表达量最高的是GFAPα.大部分描述GFAP表达及其调控的论文包括本研究实际上指的是GFAPα[1,3].
星形胶质细胞(astrocyte,AS)广泛分布于中枢神经系统各个部位,约占正常成年人脑细胞总数的40%[5].GFAP则是星形胶质细胞特有的中间丝蛋白.研究发现星形胶质细胞在发育成熟后GFAP表达明显增加并贯穿一生[6].GFAP(-/-)小鼠中,星形胶质细胞的中间丝显著减少甚至完全没有[7].因此GFAP不仅被认为是星形胶质细胞的成熟标志,也成为正常及病理情况下应用最广泛的星形胶质细胞标记物[6].正常情况下,在细胞胞质内的GFAP循环降解,血液中GFAP水平较稳定;然而病理条件下,如病人的中枢神经系统受到损伤,其星形胶质细胞遭受破伤或坏死时,GFAP从胶质细胞中流出,穿过血脑屏障进入血液中,使GFAP浓度上调[6,8].
脑卒中是指由于急性脑血液循环障碍所致的局部或全脑性功能缺损综合征,包括缺血性和出血性脑卒中.脑卒中具有发病率高、致残率高、死亡率高和复发率高的特点.在脑卒中发病早期,快速准确地诊断,对患者的治疗和预后皆有显著的帮助和提高[9].作为脑部损伤的新型标志物GFAP已经被广泛研究.有研究表明,出血性脑卒中患者发病6小时内血液GFAP水平明显升高;而缺血性脑卒中患者6小时内血液中GFAP水平与正常对照组无明显差异.因此GFAP在发病早期对出血性及缺血性脑卒中患者也具有早期鉴别诊断意义[10].还有研究表明,急性脑出血患者血清中的GFAP含量与脑出血体积之间有一定的正相关关系.因此检测血清GFAP含量在出血后早期判断脑损伤的程度及患者的预后也具有重要的临床意义[4,9].检测血清GFAP最理想的方法是ELISA,但前提是必须制备针对GFAP的特异性抗体.本研究制备的多株单克隆抗体与GFAP有较好的结合能力,并可组装成抗体通过ELISA检测GFAP,为临床诊断提供了基础材料,有助于临床医生诊断和评估脑卒中进展情况,改善病人的预后.
1 材料和方法
1.1 材料
1.1.1 质粒、细菌菌株和细胞株 原核表达质粒pET-28a(+)和真核表达质粒pCDNA3.1(+)由本实验室保存;大肠杆菌(Escherichiacoli)感受态细胞DH5α和BL21(DE3)购自康为生物;Sp2/0小鼠骨髓瘤细胞株为本室液氮保存.
1.1.2 试剂 高保真Pfu酶、内切酶BamHⅠ、XhoⅠ和T4 DNA连接酶购自NEB;琼脂糖凝胶DNA回收试剂盒和柱式质粒抽提试剂盒购自上海生工生物;DNA marker、蛋白marker,异丙基-β-d-硫代半乳糖苷(IPTG)等分子生物学常用试剂购自康为生物;HRP标记的兔抗鼠IgG抗体购自优宁维生物;ECL化学发光检测试剂盒,PEG4000、HT、HAT、弗氏完全和不完全佐剂购自Sigma;血清及培养基购自生工生物(上海)公司;引物或基因由金维智生物(北京)公司合成.亲和层析柱料购自GE Healthcare(美国).
1.1.3 实验动物 SPF 级BALB/C小鼠4只,4~6周龄由北京维通利华实验动物有限公司提供.
1.2 方法
1.2.1 表达载体pET-28a(+)-GFAP和pCDNA3.1(+)-GFAP的构建及鉴定 从NCBI数据库中查到人GFAP基因序列(登陆号:J04569.1)委托金维智生物(北京)公司合成GFAP基因部分序列(编码氨基酸292-432).以合成基因为模板,序列28F:ATATGGATCCTTGACCTGCGACCTGGAG、28R:ATATCTCGAGCATCACATCCTTGTG为引物,通过PCR扩增目的片断;然后用内切酶BamHⅠ和XhoⅠ对PCR 产物和载体pET-28a(+)分别进行双酶切,用T4 DNA连接酶连接酶切产物;转化至大肠杆菌DH5α菌株,涂平板、筛选阳性克隆;随后提质粒、BamHⅠ和XhoⅠ双酶切验证,阳性质粒测序,保存测序正确的pET-28a(+)-GFAP质粒和菌种.质粒pCDNA3.1(+)-GFAP构建方法同上,所用引物为28F和3.1R:ATATCTCGAGGTGGTGGTGGTGGTGGTGCATCACATCCTTGTG,保存测序正确的质粒和菌种.上述所有引物中下划线序列皆为酶切位点.
1.2.2 表达GFAP融合蛋白 将pET-28a(+)-GFAP阳性质粒转化至大肠杆菌BL21(DE3)感受态细胞中,并涂布到LB 固体(Amp 50 μg/mL)平板上,37 ℃过夜培养.第二天挑取单菌落接种于LB液体培养基(Amp 50 μg/mL)中培养16小时.随后,按1∶100的体积比接种到LB液体培养基(Amp 50 μg/mL)中培养至OD600达到0.6~0.8 时,加入IPTG(终浓度为0.5 mmol/mL)诱导GFAP融合蛋白的表达.
用含10%FBS、DMEM和双抗的培养基,在5%CO2的37 ℃温箱中培养293T细胞.待细胞铺满培养皿约60%~70%的时候,将阳性pCDNA3.1(+)-GFAP质粒通过磷酸钙法转染293T细胞.
1.2.3 GFAP融合蛋白的纯化 通过大肠肝菌大量诱导表达GFAP融合蛋白用作抗原免疫小鼠.IPTG诱导结束后,离心收集菌体沉淀,用磷酸盐缓冲液重悬沉淀,在冰浴中进行超声波破碎.细胞破碎后离心收集上清,0.22 μm滤膜过滤后,使用Ni Sepharose 6亲和纯化柱通过亲和层析纯化目标蛋白(详细步骤按生产商说明书进行),纯化结束后通过SDS-PAGE分析检测蛋白纯化结果.
通过293T少量表达GFAP融合蛋白用作抗体检测.磷酸钙转染24小时后,每隔一天收集培养基一次共计收集6次.然后离心收集上清,0.22 μm滤膜过滤后,使用Ni Sepharose 6亲和纯化柱通过亲和层析作用纯化目标蛋白(纯化详细步骤生产商按说明书进行),纯化结束后通过SDS-PAGE分析检测蛋白纯化结果.
1.2.4 单克隆抗体的制备 免疫BALB/C小鼠使用细菌表达GFAP融合蛋白,BALB/C小鼠初次免疫取100 μg GFAP融合蛋白与等体积完全弗氏佐剂相混合,乳化后通过腹腔注射免疫小鼠(每只小鼠注射体积不超过200 μL).2周后取50 μg GFAP融合蛋白与等体积不完全弗氏佐剂相混合,乳化后通过腹腔注射对小鼠加强免疫.每次加强免疫使用剂量相同,间隔时间为两周.第4次加强免疫两周后,从小鼠尾静脉少量取血,通过间接ELISA检测血清效价.效价检测合格后,取100 μg GFAP融合蛋白再次加强免疫,加强免疫3天后分离阳性小鼠脾细胞按5∶1比例与SP2/0混合,通过PEG4000融合细胞.然后通过HAT选择培养基筛选阳性杂交瘤细胞系,进一步通过间接ELISA筛选出所需要的阳性杂交瘤细胞系.随后通过有限释洗法得到GFAP的单克隆抗体细胞株.进一步采用小鼠腹腔接种法大量制备GFAP单克隆抗体:选用BALB/C小鼠,先腹腔注射降植烷,一周后将GFAP单克隆抗体细胞株接种到小鼠腹腔中去,收集腹水纯化抗体.
1.2.5 间接ELSIA 检测血清或抗体时使用293T细胞表达的GFAP融合蛋白,用PBS稀释蛋白到2 μg/mL,96 孔ELISA板中每孔加入100 μL,4 ℃放置过夜.然后每孔加入200 μL 3%BSA,37 ℃放置1 h封闭.洗涤3次后,每孔加100 μL待测血清或抗体,37 ℃温育1 h.洗涤3次后,每孔加入100 μL HRP 标记兔抗鼠抗体(1∶5 000,酶稀释液稀释),室温孵育30 min.洗涤液洗涤6次后,每孔100 μL加新鲜配制的底物溶液,避光放置5~30 min显色.最后用酶标仪测定450 nm 处各孔的吸光值.
1.2.6 抗体纯化 用10倍柱体积的PBS洗涤平衡层析柱.将含抗体的腹水高速离心后,将上清与等体积2×PBS缓冲液混合,调整pH以及离子浓度后,缓慢加入层析柱.用10倍柱体积以上的PBS洗涤,至流出液无蛋白检出.加入0.1 mol/L柠檬酸(pH 2.7)洗脱.洗脱后的抗体加入2/5体积的1 mol/L的Tris-HCl(pH 8.0)中和,使用Millipore 超滤管切换到所需缓冲液、所需体积,经过SDS-PAGE 检测纯度,-20 ℃保存.
1.2.7 Western blot检测 各组样品加入适量蛋白裂解液充分裂解后离心收集上清,BCA法测量蛋白浓度.取适量蛋白进行SDS-PAGE电泳分离.转膜后置于5%的脱脂奶粉溶液中室温封闭0.5 h;加入一抗4 ℃孵育过夜;TBST充分洗5次,用HRP标记的二抗室温孵育1 h后充分洗膜,然后ECL发光成像.
2 结果与分析
2.1 表达载体pET-28a(+)-GFAP和pCDNA3.1(+)-GFAP的构建及鉴定
文献报道、序列比对及同源建模等揭示GFAP蛋白的羧基端“尾部”氨基酸水溶性较好.另一方面,虽然GFAP主要表达于星形胶质细胞,但已在人类中共计发现6种不同的GFAP转录本,这些转录本的羧基端氨基酸序列并不相同.综合考虑,选择GFAP羧基端292~432序列作为抗原免疫动物,以提高所制备单克隆抗体的特异性.免疫小鼠需要的蛋白量相对较大,采用原核细胞表达.筛选血清或抗体需要的蛋白量较少,同时也为提高筛选制备抗体的特异性,采用真核细胞表达.从NCBI数据库中查到人GFAP基因序列,然后委托公司合成GFAP基因(编码氨基酸292~432).进一步通过PCR扩增GFAP基因,产物1.5%琼脂糖电泳,电泳结果显示目的片段大小为430 bp,与预期值相符(见图1).回收的PCR产物与表达载体pET-28a(+)和pCDNA3.1(+)经双酶切、连接酶连接后构建pET-28a(+)-GFAP和pCDNA3.1(+)-GFAP重组质粒,重组质粒转化感受态细胞,培养后挑取阳性单克隆质粒进行酶切,酶切产物1.5%琼脂糖凝胶电泳,结果显示电泳条带与预期值相符.选取阳性克隆进行测序鉴定,测序结果与NCBI数据库中的序列一致,确定重组表达载体pET-28a(+)-GFAP和pCDNA3.1(+)-GFAP构建正确.
2.2 融合蛋白的表达及鉴定
测序正确的原核表达载体pET-28a(+)-GFAP经转化、培养、诱导等处理后,离心收集菌体沉淀,重悬沉淀、菌体经超声破碎后离心,收集上清,0.22 μm滤膜过滤后,使用Ni柱亲和纯化目的融合蛋白,通过SDS-PAGE分析检测蛋白纯化结果,结果显示电泳条带与预期值相符(见图2).
测序正确的真核表达载体pCDNA3.1(+)-GFAP转染293T细胞后,离心收集培养基,过滤后使用Ni柱亲和纯化目的蛋白,SDS-PAGE检测蛋白纯化结果,结果显示电泳条带与预期值相符.
2.3 免疫及抗GFAP血清效价检测
将GFAP纯化蛋白经腹腔注射的方式免疫4只雌性BALB/C小鼠,第4次免疫后采集小鼠尾静脉血,通过间接ELISA检测抗GFAP血清效价,结果见图3.进一步通过Western blot检测抗GFAP血清特异性,结果见图4.间接ELISA和Western blot结果皆说明小鼠免疫成功.

M:DNA marker;1:PCR扩增GFAP基因.

注:这里仅给出原核表达GFAP重组蛋白纯化分析结果,其分子量约为20 kD. M:蛋白 marker;1:GFAP重组蛋白.M:protein marker;1:recombinant GFAP protein.
图2 SDS-PAGE检测纯化的GFAP蛋白
Fig.2 SDS-PAGE analysis of recombinant GFAP protein

注:CTL注射PBS小鼠血清; MS(R1):右耳打孔一次免疫小鼠血清; MS(L1):左耳打孔一次免疫小鼠血清; MS(R2):右耳打孔二次免疫小鼠血清; MS(L2):左耳打孔二次免疫小鼠血清.
图3 间接ELISA检测免疫小鼠抗GFAP血清效价
Fig.3 The titer detection of the anti-GFAP mice serum by indirect ELISA

注:抗原为转染质粒pCDNA3.1(+)-GFAP的293T细胞裂解液,血清稀释比为1∶2 000. 1: 阳性抗体对照;2: 小鼠R2血清; 3: 对照小鼠血清; 4: 小鼠L1血清; 5: 小鼠R1血清
图4 Western Blot检测免疫小鼠抗GFAP血清特异性
Fig.4 The specificity of anti-GFAP serum detected by Western blot
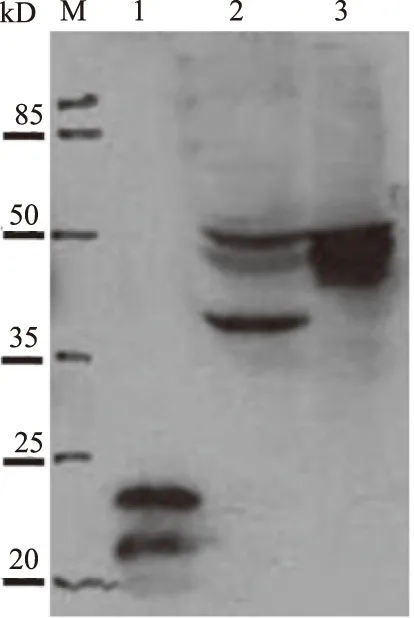
注:这里仅给出1D7稀释比为1∶4 000单克隆抗体检测结果.M: 蛋白marker; 1: 细菌表达GFAP重组蛋白(上样蛋白30 ng); 2: 为U251细胞裂解液(30 ng); 3: 小鼠脑组织裂解液.图5 Western blot检测GFAP单克隆抗体Fig.5 The specificity of anti-GFAP monoclonal antibody detected by Western blot
2.4 杂交瘤细胞株的建立及抗体纯化
免疫小鼠血清效价及Western blot检测免疫成功后,再次加强免疫后分离阳性小鼠脾细胞与SP2/0细胞融合.HAT选择培养基筛选杂交瘤细胞系,间接ELISA筛选出所需要的阳性杂交瘤细胞系.随后通过有限释洗法得到单克隆细胞株.共筛选7株GFAP的单克隆抗体细胞株,分别命名为1D2、3C9、1D7、1E2、1G5、3A4和1H5.进一步采用小鼠腹腔接种法大量制备GFAP单克隆抗体:选用BALB/C小鼠,先腹腔注射降植烷,一周后将GFAP单克隆抗体细胞株接种到小鼠腹腔中去,收集腹水纯化抗体.
2.5 Western blot分析抗体特性
对在小鼠脑组织、U251细胞中表达的内源GFAP蛋白和在大肠杆菌中表达的重组GFAP蛋白,使用Western blot分析GFAP单克隆抗体的特性.结果显示所制备的7 株单克隆抗体细胞株,其中6 株在Western blot中能很好地识别组织及细胞裂解液中的内源蛋白,另外1株3A4只能识别重组GFAP蛋白.Western blot结果见图5.
2.6 抗体亚型鉴定及初步表位分析
通过BD小鼠抗体亚型鉴定试剂盒鉴定7株单克隆抗体重链的亚型.然后通过竞争法分析单克隆抗体的表位.结果表明7株单抗共识别抗原6个不同的表位,其中3C9和1D7识别相同表位,概括如表1.
2.7 抗体配对及夹心ELISA检测方法的建立和评价
表位分析揭示7株单克隆抗体共识别5种抗原表位.抗体配对结果显示,1E2和1H5两种抗体可以配对.配对抗体中,4 μg/mL的1E2作为包被抗体、HRP标记的1H5(1∶2 000稀释)作为检测抗体,双抗夹心检测重组GFAP蛋白的标曲很好且非常稳定(见图6,表2).结果显示双抗夹心ELISA检测重组GFAP标准曲线很好,ELISA检测显示重组GFAP标准曲线很好.从医院收集人急性脑出血阳性血清样本2份,用来初步分析试剂盒的临床应用,但是,本研究组装的夹心ELISA试剂盒测样无阳性值.

表1 抗体初步表位分析及重链亚型鉴定
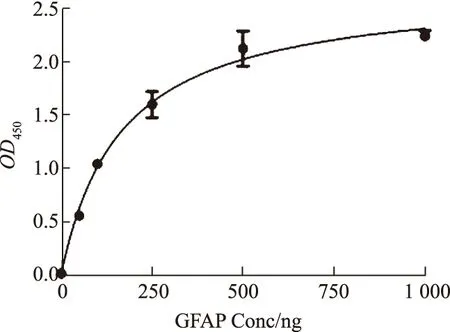
图6 双抗夹心ELISA检测重组GFAP蛋白的标准曲线
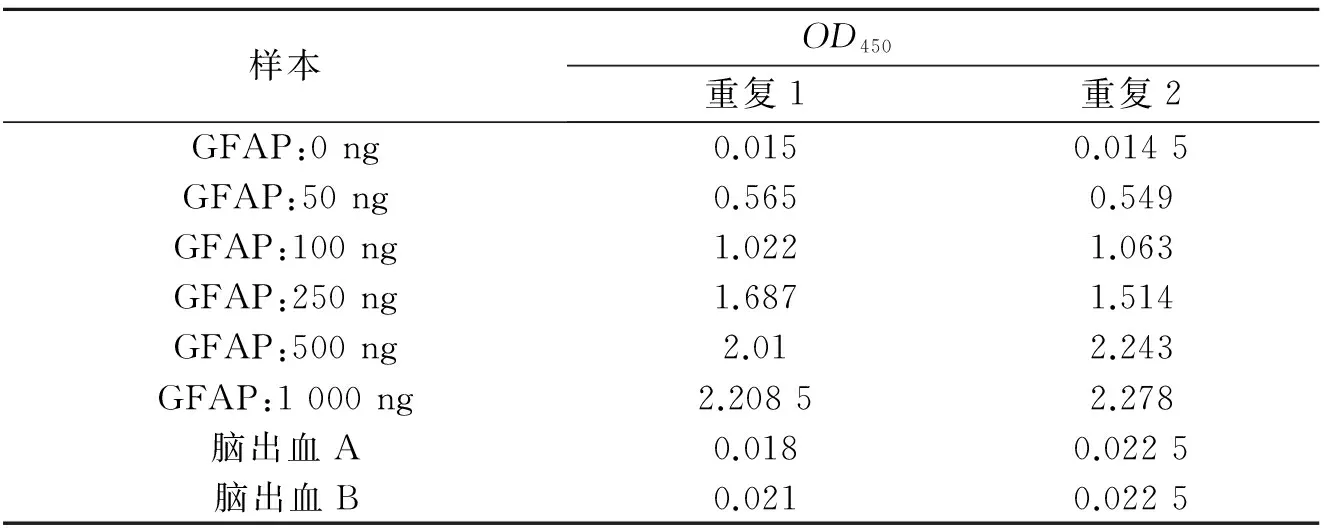
表2 双抗夹心ELISA检测重组GFAP蛋白及急性脑出血阳性血清样本原始数据
3 讨论
据统计我国新发脑卒中患者每年超过150万;死于脑卒中的病人每年在120万以上;脑卒中存活患者已达500~600万,其中3/4以上患者带有不同程度的后遗症.脑卒中不但给患者生活带来严重的不便和痛苦,也给患者家庭、国家和社会带来沉重的经济负担、巨大的经济损失[11].脑卒中可简单分为以下两类:一类为出血性脑血管病,另一类是缺血性脑血管病,脑卒中的准确和快速诊断,对患者治疗和预后皆有显著的帮助和提高[1,3,8].
目前,诊断脑卒中主要依靠影像学检查,如核磁共振和CT.最近,关于脑卒中血清学标志物的研究显示,检测血清标志物可提高脑卒中患者诊断的及时性和准确度[12].GFAP作为一个新的出血性脑卒中的标志物,可反映神经胶质细胞的损害程度,为判断出血性脑卒中患者的梗死面积及神经系统受损信息提供辅助数据,GFAP检测也可用于预后估计.
本研究成功制备了多株GFAP特异性单克隆抗体,经过检测所制抗体与GFAP有较好的结合能力,并可组装成抗体对通过双抗夹心ELISA检测GFAP.实测两例人急性脑出血阳性血清样本,新组装的ELISA试剂盒没有检测出阳性值.分析不能检出的原因如下:1) 不排除选取的样本为阴性;2) 抗体配对识别的表位在天然样本中被阻断;3) 抗体只识别内源蛋白的线性表位,不识别构象表位.多次检测证实配对抗体对通过双抗夹心ELISA检测重组GFAP的标准曲线很好,且非常稳定.进一步工作通过增加测样数量,排除阴性样本的可能;同时制备识别天然样本的多抗,增加识别的靶位点,再和单抗配对测样组装ELISA试剂盒.无论如何本研究成功制备了多株GFAP特异性单克隆抗体,为临床诊断提供了基础材料,有助于临床医生诊断和评估脑卒中进展情况,改善病人的预后.
[1] MIDDELDORP J, HOL E M. GFAP in health and disease[J]. Progress in neurobiology, 2011, 93(3):421-443.
[2] SZEVERENYI I, CASSIDY A J,CHUNG C W, et al.The human intermediate filament database: comprehensive information on a gene family involved in many human diseases[J]. Hum Mutat, 2008, 29(3):351-360.
[3] 张辉,饶志仁,黄文晋.胶质原纤维酸性蛋白的研究进展[J].生理科学进展,2001,32(4):353-355.
[4] BRENNER M. Structure and transcriptional regulation of the GFAP gene[J]. Brain Pathol, 1994, 4(3):245-257.
[5] TEMPLE S. The development of neural stem cells[J]. Nature, 2001, 414(6859): 112-117.
[6] GOMES F C, PAULIN D, MOURA N V,et al. Glial fibrillary acidic protein(GFAP): modulation by growth factors and its implication in astrocyte differentiation[J]. Braz J Med Biol Res, 1999, 32(5):619-631.
[7] GIMENEZ Y, RIBOTTA M, MENETV, et al. Comparative anatomy of the cerebellar cortex in mice lacking vimentin, GFAP, and both vimentin and GFAP[J]. Glia, 2000, 31(1):69-83.
[8] CHRISTIAN F, MARION N, BACK T, et al. Diagnostic accuracy of plasma glial fibrillary acidic protein for differentiating intracerebral hemorrhage and cerebral ischemia in patients with symptoms of acute stroke[J]. Clin Chemi, 2012, 58(1):237-245.
[9] 赵冬.我国人群脑卒中发病率、死亡率的流行病学研究[J].中华流行病学杂志,2003,23(3):236-239.
[10] 贾楠,张国军,康熙雄.GFAP对急性脑卒中早期鉴别诊断意义的初步探讨[J].中国免疫学杂志,2011,27(4):368-370.
[11] 崔桂萍,刘萍.脑卒中患者血清胶质纤维酸性蛋白含量的动态变化及临床意义[J].中华老年心脑血管病杂志,2011,13(3):238-241.
[12] FLORIAN D, ISABEL H, SITZER M, et al. Characterisation of the diagnostic window of serum glial fibrillary acidic protein for the differentiation of intracerebral haemorrhage and ischaemic stroke[J]. Cerebrovasc Dis, 2009, 27(1):37-41.
(责任编辑:王浩毅)
Preparation of Anti-GFAP Monoclonal Antibodies and Development of Double Antibody Sandwich ELISA for GFAP
WANG Ke, ZHANG Shoutao, GUO Ya’nan
(SchoolofLifeScience,ZhengzhouUniversity,Zhengzhou450001,China)
Preparing monoclonal antibodies against GFAP and an ELISA kit for GFAP could provide reliable tools for early diagnosis of hemorrhagic stroke. Hybridomacells were obtained by fusing myeloma cells (SP2/0) with spleen cells from BALB/C mice immunized with GFAP from human. After screened and subcloned, the seven hybridoma cell lines against human GFAP were obtained. The mcAbs from mice injected with hybridomacells were purified and conjugated to HRP. The subtype, epitopes and specificity of monoclonal antibodies were determined by ELISA and Western blot. All hybridoma cells obtained were high specifically bound to GFAP,which were belonged to IgG1or IgG2. Based on epitopes of GFAP mcAbs, the sandwich ELISA kit for GFAP was developed. All the results indicated that the high specific mcAbs against GFAP had been prepared, and a rapid, sensitive and specific ELISA for recombinant GFAP detection was established successfully.
GFAP; hemorrhagic stroke; antibody; ELISA
2016-12-06
国家自然科学基金青年科学基金资助项目(31501094);河南省基础与前沿技术研究项目(152300410032).
王珂(1990—),男,北京人,硕士研究生,主要从事分子免疫学及免疫诊断检测技术研究,E-mail: 334160330@qq.com;通讯作者:郭亚楠(1983—),男,河南沈丘人,讲师,博士,主要从事分子免疫学、抗体制备及免疫诊断检测技术研究,E-mail: guoyn@zzu.edu.cn.
王珂,张守涛,郭亚楠.GFAP单克隆抗体制备及ELISA检测方法研究[J].郑州大学学报(理学版),2016,48(2):95-100.
Q813.2;R392.12
A
1671-6841(2016)02-0095-06
10.13705/j.issn.1671-6841.2016297
