Gab2通过GSK-3β/Snail信号通路促进乳腺癌的上皮-间质转化
2016-06-25田红艳孙志亮李洪利刘雨清尹崇高潍坊医学院病理学教研室山东潍坊605潍坊医学院生物科学与技术学院山东潍坊605潍坊医学院医学研究实验中心山东潍坊605潍坊医学院护理学院山东潍坊605
田红艳,李 笑,孙志亮,李洪利,刘雨清,尹崇高.潍坊医学院病理学教研室,山东 潍坊 605;.潍坊医学院生物科学与技术学院,山东 潍坊 605;.潍坊医学院医学研究实验中心,山东 潍坊 605;.潍坊医学院护理学院,山东 潍坊 605
Gab2通过GSK-3β/Snail信号通路促进乳腺癌的上皮-间质转化
田红艳1,李 笑2,孙志亮2,李洪利3,刘雨清1,尹崇高4
1.潍坊医学院病理学教研室,山东 潍坊 261053;
2.潍坊医学院生物科学与技术学院,山东 潍坊 261053;
3.潍坊医学院医学研究实验中心,山东 潍坊 261053;
4.潍坊医学院护理学院,山东 潍坊 261053
[摘要]背景与目的:越来越多的证据显示,Grb2协同结合蛋白2(Grb2 binding protein-2,Gab2)与肿瘤的侵袭转移相关,但Gab2与乳腺癌上皮-间质转化(epithelial-mesenchymal transition,EMT)的关系尚不清楚。本研究旨在探讨Gab2对乳腺癌EMT标志物的影响,明确Gab2在乳腺癌侵袭和转移中的作用机制。方法:采用免疫组织化学染色法检测80例乳腺癌组织中Gab2及EMT标记物上皮性钙黏着蛋白(E-cadherin)、波形蛋白(vimentin)的表达情况并分析其相关性,用蛋白[质]印迹法(Western blot)检测乳腺组织Gab2的表达情况,采用小干扰RNA(siRNA)技术降低乳腺癌细胞系MDA-MB-231中Gab2的表达,采用划痕实验检测表皮生长因子(epithelial growth factor,EGF)刺激后转染细胞的侵袭能力变化,用Western blot检测敲低Gab2后MDAMB-231细胞中E-cadherin及vimentin的表达情况,同时检测p-GSK-3β的表达情况、转录因子Snail转核情况。结果:Gab2在乳腺癌组织中的表达与E-cadherin的表达呈负相关,而与vimentin的表达呈正相关(P<0.05);乳腺癌组织中Gab2的表达量明显高于正常乳腺组织;siRNA质粒转染后,SiGab2/MDA-MB-231细胞组中Gab2蛋白的表达量明显降低,结果显示转染成功,划痕实验显示细胞的侵袭能力减弱,表明Gab2影响乳腺癌细胞系的侵袭能力;敲低Gab2后,MDA-MB-231细胞中的E-cadherin的表达明显升高,而vimentin的表达明显降低;GSK-3β的磷酸化受到抑制,而Snail在敲低Gab2的细胞核中的表达明显下调。结论:Gab2可以通过GSK-3β/Snail信号通路促进乳腺癌的EMT,从而促进乳腺癌的侵袭和转移。
[关键词]乳腺癌;侵袭;Grb2协同结合蛋白2;上皮-间质转化;信号通路
山东省高等学校科技计划(J12LK03,J13LK03);国家级大学生创新训练计划项目(201410438003);潍坊医学院大学生科技创新基金(KX2014033)。
Correspondence to: YIN Chonggao E-mail: lihongli1213@sina.com
上皮-间质转化(epithelial-mesenchymal transition,EMT)是上皮细胞通过骨架重排,降低细胞间黏附力,向侵袭、迁移能力增强的间质细胞转化的过程[1]。细胞极性消失,上皮细胞表型改变,如上皮性钙黏着蛋白(E-cadherin)向神经性钙黏着蛋白(N-cadherin)转化、波形蛋白(vimentin)增多是EMT过程中的重要变化[2]。肿瘤细胞借助EMT方式使其运动迁移能力增强,EMT是肿瘤发生浸润及远处转移的基础。
Grb2协同结合蛋白2(Grb2 binding protein-2,Gab2)是Gabs家族的重要成员,被酪氨酸磷酸化激活后接受细胞外多种因子刺激,介导细胞内多条信号通路,在细胞增殖、分化中起重要作用[3-4]。越来越多的研究表明,Gab2与多种肿瘤的侵袭转移相关[5],但Gab2与乳腺癌EMT的研究尚未见报道。本实验通过探讨Gab2对乳腺癌EMT标志物的影响,明确Gab2在乳腺癌侵袭和转移中的作用机制。
1 材料和方法
1.1 材料
1.1.1 临床资料
收集2013年11月—2014年11月潍坊医学院附属医院手术切除的80例乳腺浸润性导管癌组织,并另取对应的癌旁(大于5 cm)正常乳腺组织作为对照,其中部分存于-80 ℃冰箱保存留用,剩余做石蜡切片。所有患者的临床资料完整,术前均未做过化疗及放疗,并经病理确诊。患者年龄在27~74岁之间,平均51岁。
1.1.2 主要试剂
兔抗人Gab2、Snail购自美国Santa Cruz公司,p-GSK3β抗体购自美国Cell Signaling Technology公司,鼠抗人vimentin、鼠抗人E-cadherin、PV-9000通用型二步法检测试剂购自北京中杉金桥生物技术有限公司,BCA蛋白浓度试剂盒、核蛋白抽提试剂盒购自北京碧云天生物技术有限公司,转染试剂LipofectamineTM2000购自美国Invitrogen公司,RPMI 1640培养液和胎牛血清购自美国Hyclone公司。MDA-MB-231细胞由潍坊医学院医学研究实验中心提供。
1.2 方法
1.2.1 免疫组织化学染色
连续组织切片3张,分别滴加Gab2(1︰100)、vimentin(工作液)和E-cadherin(1︰400)抗体,并做阴性对照,其余按试剂盒说明操作。结果判定参照参考文献[6]。
1.2.2 细胞培养与转染
G a b 2干扰质粒由上海吉凯基因化学技术有限公司合成。MDA-MB-231细胞常规培养,选取三代以后对数生长期的细胞进行转染,转染后细胞命名:Si Gab2/ MDA-MB-231细胞组插入Gab2目标片段5’-GTGAGAACGATGAGAAATA-3’;Scr/MDAMB-231细胞组插入无效序列的小RNA片段。转染步骤按LipofectamineTM2000说明书操作。
1.2.3 蛋白[质]印迹法(Western blot)
提取组织及转染前后细胞总蛋白,用BCA法测定蛋白浓度,根据蛋白浓度调整每孔蛋白上样量,电泳,转膜,脱脂奶粉封闭,滴加Gab2(1︰500)、E-cadherin(1︰1 000)、vimentin(1︰1 000)、p-GSK-3β(1︰1 000)、Snail(1︰500)和β-actin(1︰1 000)抗体,4 ℃过夜,二抗温育1 h,滴加化学发光剂,曝光。结果使用Image J软件进行灰度分析。实验重复3次。
1.2.4 划痕实验
MDA-MB-231细胞接种6孔板,生长到90%左右时转染,4 h换液并用10 µL枪头划痕,培养于含有0.1%血清的1640培养基中,并用10 ng/mL的表皮生长因子(epithelial growth factor,EGF)刺激,取不同时间点,置于显微镜下拍照,应用Image J软件测量划痕距离,取3次实验平均值。
1.2.5 核质分离
MDA-MB-231细胞接种6孔板,实验组转染干扰质粒,对照组转染空载质粒,置于37 ℃培养箱培养24 h后,按核质分离试剂盒说明书操作。抽提得到的细胞核蛋白,通过Western blot检测各组细胞核内Snail蛋白表达。实验重复3次。
1.3 统计学处理
实验数据采用SPSS 17.0软件处理。计数资料比较采用χ2检验,计量资料比较采用t检验及两变量的相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 乳腺癌组织中Gab2表达与E-cadherin、vimentin表达的相关性
Gab2阳性显色位于细胞质,E-cadherin阳性显色位于细胞膜,vimentin阳性显色位于组织、细胞间质(图1)。乳腺癌组织中Gab2表达与E-cadherin表达呈负相关,与vimentin表达呈正相关(P<0.05,表1)。
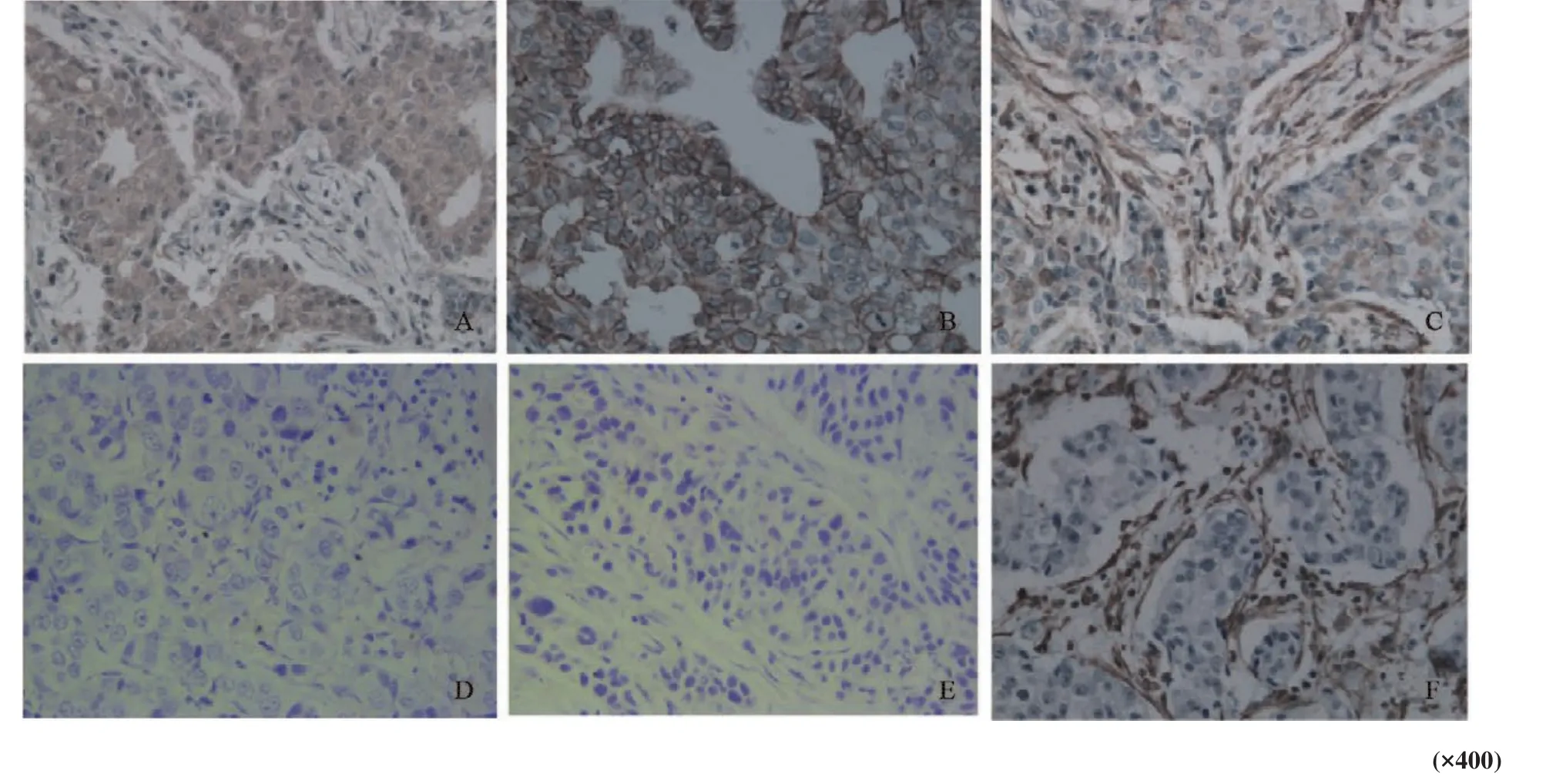
图1 Gab2、E-cadherin和vimentin在乳腺癌组织中的表达Fig.1 Expressions of Gab2, E-cadherin and vimentin in breast invasive ductal carcinoma tissues by immunohistochemical staining
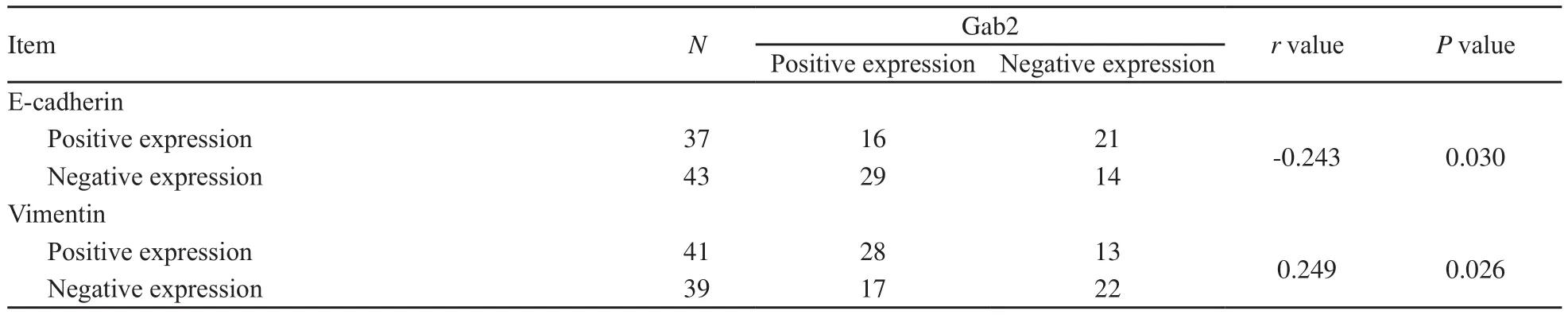
表1 乳腺癌组织中Gab2表达与E-cadherin、vimentin表达的相关性Tab.1 Correlations of Gab2 with E-cadherin and vimentin in breast invasive ductal carcinoma tissues (n)
2.2 Gab2在正常乳腺组织及乳腺癌组织中的表达
Western blot检测显示,乳腺浸润性导管癌组织中Gab2的表达量高于癌旁正常组织(图2)。
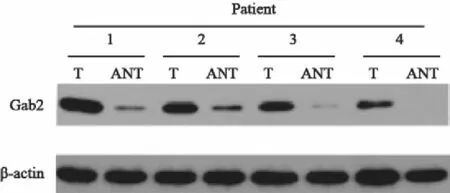
图2 Gab2在正常乳腺组织和乳腺癌组织中的表达Fig.2 The expressions of Gab2 in normal breast tissues and breast invasive ductal carcinoma tissues
2.3 SiGab2/MDA-MB-231细胞中Gab2、E-cadherin及vimentin表达
Western blot检测显示,Gab2在SiGab2/ MDA-MB-231细胞中表达比在Scr/MDA-MB-231细胞中低,提示转染成功。Gab2表达降低后,SiGab2/MDA-MB-231细胞较Scr/MDA-MB-231细胞,E-cadherin表达量升高,而vimentin表达量降低(图3)。
2.4 Gab2对MDA-MB-231细胞侵袭性的影响
EGF刺激后SiGab2/MDA-MB-231细胞组相对迁移距离明显比Scr/MDA-MB-231细胞组迁移距离小,差异有统计学意义(P<0.05),结果提示Gab2降低后MDA-MB-231细胞的定向迁移能力降低(图4)。
2.5 Gab2对p-GSK-3β、Snail的影响
为了研究Gab2促进乳腺癌EMT发生可能的分子机制,用10 ng/mL EGF无血清培养基刺激各组转染细胞。Western blot检测显示,EGF刺激后SiGab2/MDA-MB-231细胞中GSK-3β的磷酸化降低,锌指转录因子Snail在细胞核中的表达减少。结果表明Gab2表达减少后,GSK-3β失活减少且Snail转核减少(图5、6)。

图3 Gab2、E-cadherin和vimentin在SiGab2/MDA-MB-231细胞和Scr/MDA-MB-231细胞中的表达Fig.3 The expressions of Gab2, E-cadherin and vimentin in SiGab2/MDA-MB-231 and ScrGab2/MDA-MB-231 cells
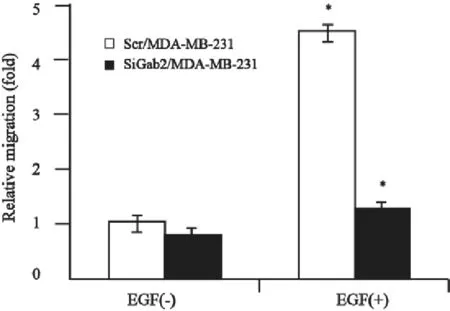
图4 Gab2对EGF刺激后MDA-MB-231细胞侵袭性的影响Fig.4 Influence of Gab2 on invasion of MDA-MB-231 cells induced by EGF
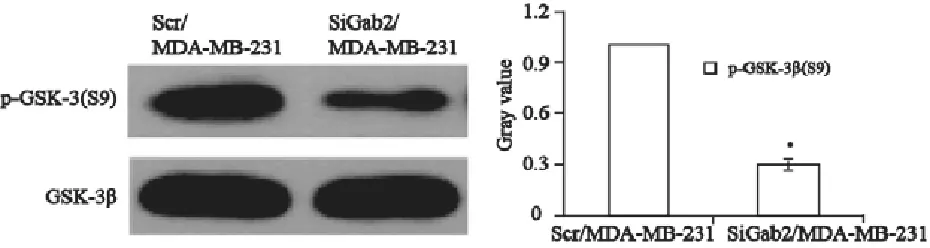
图5 GSK-3β在SiGab2/MDA-MB-231细胞和ScrGab2/ MDAMB-231细胞中的磷酸化情况Fig.5 The phosphorylation of GSK-3β in SiGab2/MDA-MB-231 and ScrGab2/ MDA-MB-231cells

图6 Snail在SiGab2/MDA-MB-231细胞和ScrGab2/ MDAMB-231细胞核中的表达Fig.6 The expression of Snail in SiGab2/MDA-MB-231 and ScrGab2/ MDA-MB-231 cell nuclei
3 讨 论
近年来乳腺癌的发病率升高,并且发病年龄年轻化。随着诊断水平的提高,乳腺癌的检出率提高,但是许多患者确诊时已发展为浸润癌或已有淋巴结及远处转移。乳腺癌的浸润与转移是患者复发、死亡的主要原因。
多项研究证明,Gab2是潜在的癌基因,在卵巢癌中存在扩增。Gavin P老鼠在体研究发现,Gab2是卵巢癌的一个癌基因[7-8]。Gab2与胶质瘤WHO分级相关,Gab2表达增多,患者生存期明显缩短,Gab2表达降低后通过调节细胞骨架重排及基质金属蛋白酶的表达降低胶质瘤细胞侵袭[5-9]。Matsumura等[10]发现,Gab2在结肠癌组织中表达增多,并与淋巴结、静脉转移及肝转移相关。沉默Gab2基因后,乳腺癌细胞周期增殖明显降低,凋亡增加,细胞的侵袭性减弱[11]。本实验免疫组化及Western blot检测结果显示,乳腺浸润性导管癌癌组织中Gab2表达高于癌旁正常组织,结果表明Gab2的表达与乳腺癌的侵袭相关。
EMT可发生在胚胎发育及组织损伤修复过程中,但其在肿瘤形成及促进肿瘤细胞侵袭转移中起重要作用[12]。发生EMT改变的肿瘤细胞极性消失,细胞上皮表型改变,上皮表型分子E-cadherin表达降低,间质分子vimentin表达增多,是EMT的特征性改变[13-14]。EMT改变使肿瘤侵袭、转移能力增强。Wang等[3]证明,Gab2通过PI3K途径促进卵巢癌细胞侵袭转移,并且抑制E-cadherin表达促进EMT发生。本实验结果显示,在乳腺浸润性导管癌组织中Gab2表达与E-cadherin表达呈负相关,与vimentin表达呈正相关。降低MDA-MB-231细胞中Gab2表达后,E-cadherin表达量升高,vimentin表达量降低,并且MDA-MB-231细胞侵袭性降低。此结果说明,Gab2阳性表达的乳腺浸润性导管癌组织中存在EMT的发生,同时也说明降低Gab2的表达可以减少或逆转乳腺癌MDA-MB-231细胞中EMT的发生,进而减弱细胞的侵袭能力。
GSK-3β是一种丝氨酸/苏氨酸蛋白激酶,在细胞中以活性状态存在,在细胞增殖、迁移中发挥重要作用。研究发现,p-GSK-3β在乳腺癌中表达增多,GSK-3β失活可诱导乳腺癌EMT发生[15]。肿瘤微环境、转录因子等都可以诱导EMT的发生。锌指转录因子Snail是E-cadherin的转录抑制因子[16]。Liu等[17]发现,EGF通过抑制GSK-3β的活性,使Snail转录增加,促进肺癌A549细胞EMT的发生。本实验结果显示,Gab2表达减少,使GSK-3β磷酸化降低,GSK-3β抑制了Snail转核,并促进E-cadherin表达,减少vimentin表达,从而逆转EMT发生。
综上所述,本实验证明了Gab2可以通过GSK-3β/Snail信号通路促进乳腺癌EMT发生,进而促进乳腺癌细胞的侵袭、转移,这将为研究控制乳腺癌的侵袭转移提供新靶点。
[参 考 文 献]
[1]BOYER B, VALLÉS A M, EDME N.Induction and regulation of epithelial-mesenchymal transitions[J].Biochem Pharmacol, 2000, 60(8): 1091-1099.
[2]包俊杰, 吴诚义.E-cadherin、N-cadherin与CD44~+/ CD24~(-/low)表型在乳腺癌中表达的相关性及其意义[J].中国癌症杂志, 2010, 20(8): 596-601.
[3]WANG Y, SHENG Q, SPILLMAN M A, et al.Gab2 regulates the migratory behaviors and E-cadherin expression via activation of the PI3K pathway in ovarian cancer cells[J].Oncogene, 2012, 31(20): 2512-2520.
[4]BOCANEGRA M, BERGAMASCHI A, KIM Y H, et al.Increased proliferation and altered growth factor dependence of human mammary epithelial cells overexpressing the Gab2 docking protein[J].Biol Chem, 2006, 281(1): 626-637.
[5]SHI L, SUN X, ZHANG J, et al.Gab2 expression in glioma and its implications for tumor invasion[J].Acta Oncol,2013, 52(8): 1739-1750.
[6]ZHANG B, YIN C, LI H, et al.Nir1 promotes invasion of breast cancer cells by binding to chemokine (C-C motif) ligand 18 through the PI3K/Akt/GSK3beta/Snail signalling pathway [J].Eur J Cancer, 2013, 49(18): 3900-3913
[7]BROWN L A, KALLOGER S E, MILLER M A, et al.Amplification of 11q13 in ovarian carcinoma[J].Genes Chromosomes Cancer, 2008, 47(6): 481-489.
[8]DUNN G P, CHEUNG H W, AGARWALLA P K, et al.In vivo multiplexed interrogation of amplified genes identifies GAB2 as an ovarian cancer oncogene[J].Proc Natl Acad Sci U S A,2014, 111(3): 1102-1107.
[9]LIU H, LI G, ZENG W, et al.Combined detection of Gab1 and Gab2 expression predicts clinical outcome of patients with glioma[J].Med Oncol, 2014, 31(8): 77.
[10]MATSUMURA T, SUGIMACHI K, TAKAHASHI Y, et al.Clinical significance of GAB2, a scaffolding/docking protein acting downstream of EGFR in human colorectal cancer[J].Ann Surg Oncol, 2014, 21 Suppl 4: S743-S749.
[11]BOCANEGRA M, BERGAMASCHI A, KIM Y H, et al.Focal amplification and oncogene dependency of GAB2 in breast cancer[J].Oncogene, 2010, 29(5): 774-779.
[12]GARG M.Epithelial-mesenchymal transition-activating transcription factors-multifunctional regulators in cancer [J].World J Stem Cells, 2013, 5(4): 188-195.
[13]CHAKABARTI R, HWANG J, ANDRES BLANCO M, et al.Elf5 inhibits the epithelial-mesenchymal transition in mammary gland development and breast cancer metastasis by transcriptionally repressing Snail2[J].Nat Cell Biol, 2012,14(11): 1212-1222.
[14]PARK J, SCHWARZBAUER J E.Mammary epithelial cell interactions with fibronectin stimulate epithelial-mesenchymal transition[J].Oncogene, 2014, 33(13): 1649-1657.
[15]ARMANIOUS H, DESCHENES J, GELEBART P, et al.Clinical and biological significance of GSK-3 beta inactivation in breast cancer-an immunohistochemical study[J].Hum Pathol, 2010, 41(12): 1657-1663.
[16]LEE M Y, SHEN M R.Epithelial-mesenchymal transition in cervical carcinoma[J].Am J Transl Res, 2012, 4(1): 1-13.
[17]LIU Z C, CHEN X H, SONG H X, et al.Snail regulated by PKC/GSK-3 beta pathway is crucial for EGF-induced epithelial-mesenchymal transition (EMT) of cancer cells[J].Cell Tissue Res, 2014, 358(2): 491-502.
Gab2 promotes epithelial-mesenchymal transition in breast cancer through GSK-3β/Snail signaling pathway
TIAN Hongyan1, LI Xiao2, SUN Zhiliang2, LI Hongli3, LIU Yuqing1, YIN Chonggao4(1.Department of Pathology, Weifang Medical University, Weifang 261053, Shandong Province, China;2.College of Biological Science and Technology, Weifang Medical University, Weifang 261053, Shandong Province, China; 3.Medicine Research Center, Weifang Medical University, Weifang 261053, Shandong Province, China; 4.College of Nursing, Weifang Medical University, Weifang 261053, Shandong Province,China)
[Key words]Breast cancer; Invasion; Grb2 binding protein-2; Epithelial-mesenchymal transition; Signaling pathway
[Abstract]Background and purpose: More and more evidence has showed that Grb2 binding protein-2 (Gab2) is associated with tumor invasion and metastasis.However, the relationship between Gab2 and epithelialmesenchymal transition (EMT) in breast cancer is not clear.The aim of this study is to investigate the effect of Gab2 on EMT markers and the mechanism of Gab2 on breast cancer invasion and metastasis.Methods: Immunohistochemicalmethods were used to detect the expressions of Gab2, E-cadherin and vimentin in 80 cases of breast cancer tissues, and the correlations between them were analyzed.Western blot was used to detect the expression of Gab2 in breast tissues.After MDA-MB-231 cells were transfected with siRNA plasmid, wound healing assay was used to detect the invasive ability of transfected cells induced by epithelial growth factor (EGF) in vitro.Then Western blot was used to analyze the protein expressions of E-cadherin, vimentin, phosphorylated GSK-3β (p-GSK-3β) and nuclear Snail.Results: Gab2 was negatively correlated with the expression of E-cadherin and positively correlated with the expression of vimentin in breast cancer tissues (P<0.05).The expression of Gab2 in breast cancer tissues was higher than that in normal breast tissues adjacent to breast cancer.In vitro, Gab2 expression was significantly knocked down in MDA-MB-231 cells transfected with Gab2 siRNA plasmid (SiGab2/MDA-MB-231cells).Meanwhile, the invasive ability of SiGab2/MDAMB-231cells was decreased with EGF stimulation.The expression of E-cadherin was increased in SiGab2/MDA-MB-231cells.However, the expressions of vimentin, p-GSK-3β and nuclear Snail were decreased in SiGab2/MDA-MB-231cells.Conclusion: Gab2 can promote the invasion and metastasis of breast cancer by EMT through GSK-3β/Snail signaling pathway.
DOI:10.3969/j.issn.1007-3969.2016.02.003
中图分类号:R737.9
文献标志码:A
文章编号:1007-3639(2016)2-0134-06
基金项目:国家自然科学基金青年基金项目(81402389);山东省自然科学基金(ZR2014HL077);
通信作者:尹崇高 E-mail:lihongli1213@sina.com
收稿日期:(2015-04-29 修回日期:2015-06-08)
