大肠癌表观遗传修饰在东西方人口中的异同研究
2016-06-25房静远上海交通大学医学院附属仁济医院消化科上海市消化疾病研究所上海200001
胡 强,熊 华,房静远上海交通大学医学院附属仁济医院消化科,上海市消化疾病研究所,上海 200001
大肠癌表观遗传修饰在东西方人口中的异同研究
胡 强,熊 华,房静远
上海交通大学医学院附属仁济医院消化科,上海市消化疾病研究所,上海 200001
[摘要]大肠癌对全世界人口的危害仍尤为重大,在其研究领域,大肠癌表观遗传学的研究越来越受到研究者重视。从大肠癌表观遗传学中的DNA甲基化和组蛋白修饰两个主要方面,对比分析了东西方人口中大肠癌患者之间存在的异同。接着,初步介绍了东西方大肠癌患者用作生物标识和治疗靶点的表观遗传修饰基因的异同点。分析表明,虽然大肠癌在世界范围内有一些共同的特征,但其在不同人种中确实存在某些明显的表观遗传的不同,例如特异性基因甲基化以及组蛋白修饰位点和甲基化,乙酰化的程度不同在各国的研究中都已得到证实,这就为不同人种中大肠癌特异性的诊断、治疗及预后提供了依据。在进一步的规范研究方法和增加样本量的情况下,相信更多的大肠癌组织特异性的分子靶点将会被发现,继而针对单个患者的个体化治疗将有望实现。
[关键词]结直肠肿瘤;后成说;遗传学;DNA甲基化
Correspondence to: XIONG hua E-mail: huaxong88@126.com
在全球范围内,大肠癌是威胁人类健康的主要疾病之一。现在一般认为,大肠癌的发生是遗传学改变(包括基因突变和基因缺失)与表观遗传学改变两者逐渐累积,共同作用的结果[1]。自Feinberg和Vogelstein发现表观遗传修饰在大肠癌发生、发展中可能发挥重要作用以来,表观遗传修饰在大肠癌中的地位越来越受到研究者重视。表观遗传学的改变具有可逆性和可调控性,可以作为大肠癌预防、诊断、治疗及预后的靶点,因而这一领域已经取得了长足的发展。令人遗憾的是,决定大肠癌进展和临床过程因素的确切可用知识主要由西方国家构建。与西方国家相比,东方和中东国家的大肠癌可能出现新的临床和分子分型,即不同的发病率、隐含的家族聚集性和发病年轻化等[2]。本文就东西方大肠癌患病人群中表观遗传修饰的异同研究作一综述。
表观遗传学是指在基因核酸不发生改变的情况下发生基因表达可遗传的变化,它包含的现象很多。我们将重点从DNA甲基化和组蛋白修饰两个方面来进行本课题的探讨,并就相关的分子标志及治疗作简明阐述。
1 DNA甲基化
DNA甲基化是研究得最为深入的表观遗传学现象,它指在DNA甲基转移酶的催化下,DNA的CG核苷酸上的胞嘧啶添加甲基而形成5-甲基胞嘧啶。正常哺乳动物基因组中60%~90% 的CpG都被甲基化,未甲基化的CpG成簇组成CpG岛,主要位于基因启动子的核心序列和转录起始点。大肠癌最重要的表观遗传学特征就是全基因组的低甲基化和局部区域的高甲基化,两者共同促进肿瘤的形成。一般认为,全基因组低甲基化激活原癌基因;而超甲基化主要发生在抑癌基因,导致抑癌基因失活。在大肠癌基因型中,成百上千的基因可以出现异常甲基化,但是,只有其中部分对大肠癌的发病机制具有重要作用,它们可能在大肠癌中表现为超甲基化或沉默(表1)[3]。
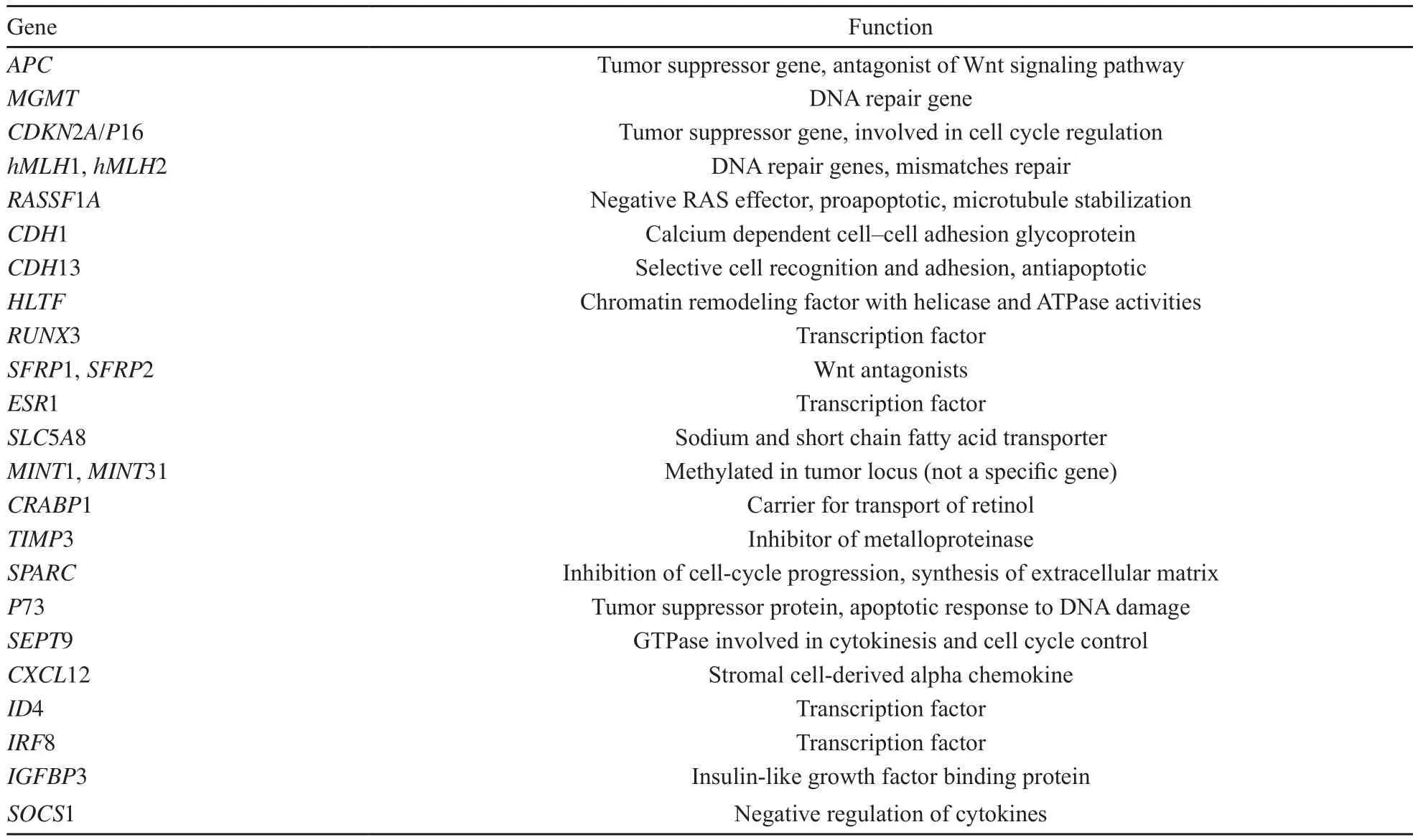
表1 大肠癌中常见有代表性的超甲基化和沉默基因Tab.1 Some examples of genes frequently methylated and silenced in colorectal cancer
大肠癌作为一种人类疾病,在各人种中具有某些共同的特征。例如,组织因子通路抑制剂2是一种潜在的肿瘤抑制基因,它被发现在超过97%的大肠腺瘤和大肠癌中甲基化。在对一些独立族群的研究中,它在所有的大肠癌中均异常甲基化[4-6]。同样,在一项对数个独立族群大肠癌的研究中,TWIST1基因启动子甲基化被确认为新近发现的基因沉默[7]。尽管如此,越来越多的研究证实,大肠癌中DNA甲基化在不同人种中存在差异。一项研究表明,非裔美国人有着比伊朗人更高的GPNMB、ICAM5和CHD5基因启动子甲基化水平。西班牙人和其他族群有着比非裔美国人和高加索人更高水平的广泛甲基化(表2)。在大肠癌中观察到的种族分离,可能部分解释其在不同种群中发病率和进展性的不同[8]。
2 组蛋白修饰
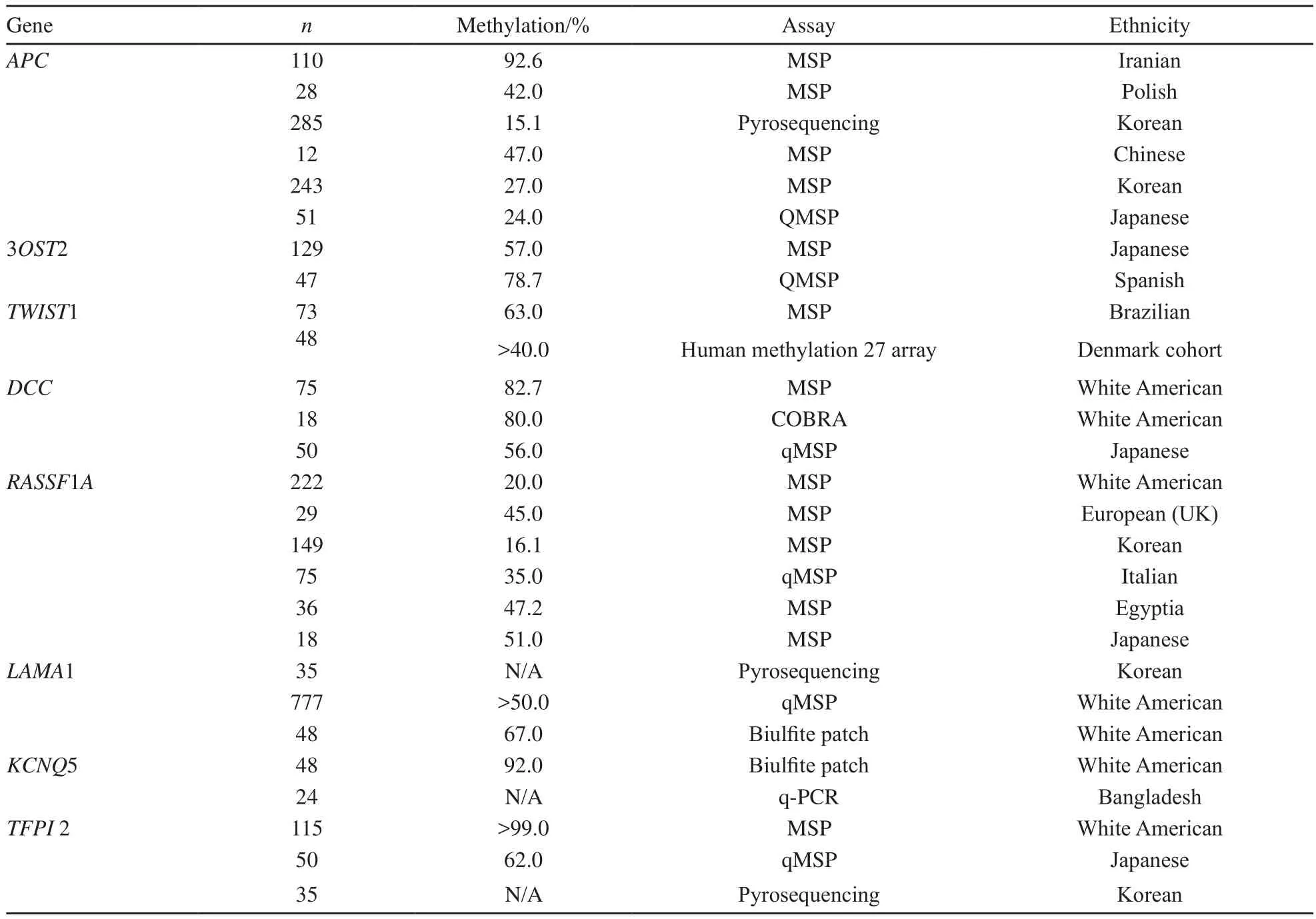
表2 不同基因甲基化在不同人种大肠癌中的比较Tab.2 Summary of literature review for nonCIMP-panes genes
组蛋白作为核小体的重要组成部分,其N-末端氨基酸(主要为精氨酸和赖氨酸)残基可发生甲基化、乙酰化、磷酸化、泛素化和多聚ADP糖基化等多种共价修饰作用。组蛋白修饰是激活或抑制基因表达的关键可逆性表观遗传学事件[9],它对目的基因表达的影响由组蛋白修饰的类型和参与的特定氨基酸的种类两个因素决定。目前,组蛋白甲基化和乙酰化是大肠癌中研究得最为广泛的组蛋白谱异常。常见的组蛋白甲基化修饰有组蛋白H3第4位赖氨酸的二甲基化或三甲基化,H3第9和第27位赖氨酸的三甲基化。前两者与基因的转录激活有关,后两者则抑制甚至沉默基因的表达。大肠癌产生过程中最重要的组蛋白修饰有:H3K9的去乙酰化和甲基化,H4K16单乙酰化和H4K20的三甲基化。Kondo等[10]对结肠癌细胞株的研究表明,H3K9的低乙酰化、H3K4的低甲基化和H3K9的过度甲基化与P16、hMLH1和MGMT这3个基因启动子过度甲基化引起的基因表达沉默相关,提示大肠癌DNA甲基化和组蛋白的修饰密切相关,共同作用于基因的调控进程。东西方人群中大肠癌的组蛋白修饰有较大的区别,具体结果见表3。
3 东西方人群中用作生物标志的甲基化基因的异同
众所周知,大肠癌的早期诊断对患者的预后至关重要,传统上用于大肠癌的早期筛查有多种方法,如电子直肠检查、大便隐血试验、乙状结肠镜检查和结肠镜检查。然而,这些方法具有侵入性,也缺乏必要的灵敏度,临床上迫切需要更敏感和更温和的手段来检测大肠癌。新颖的生物标志可以起到补充作用[17]。在大肠癌的形成过程中,我们相信肿瘤抑制基因的遗传学和表观遗传学改变起到了重要作用。因为其启动子区域CPG岛的超甲基化而引起基因沉默,这在大肠癌发展的早期阶段发生率较高。这样的异常现象可以被用来作为早期大肠癌的诊断和风险评估的分子标志(表4)。
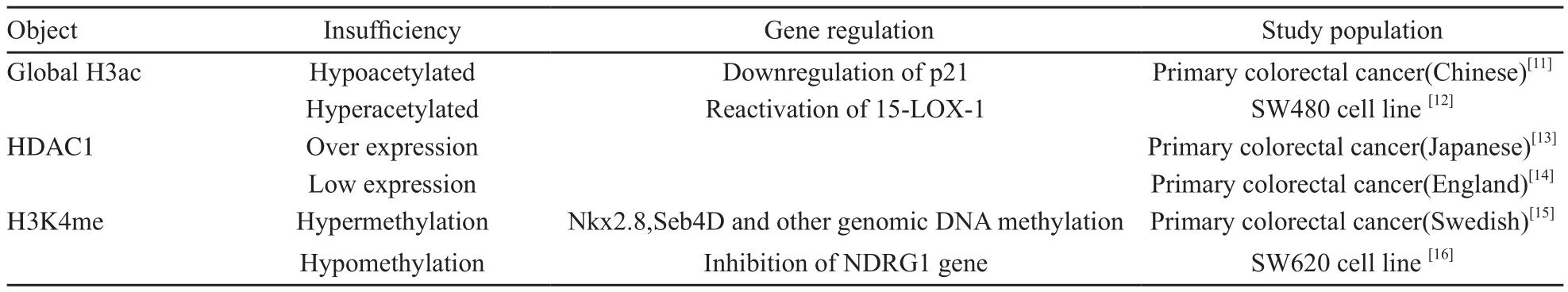
表3 大肠癌中组蛋白修饰的比较Tab.3 Comparison of histone modifications in colorectal cancer
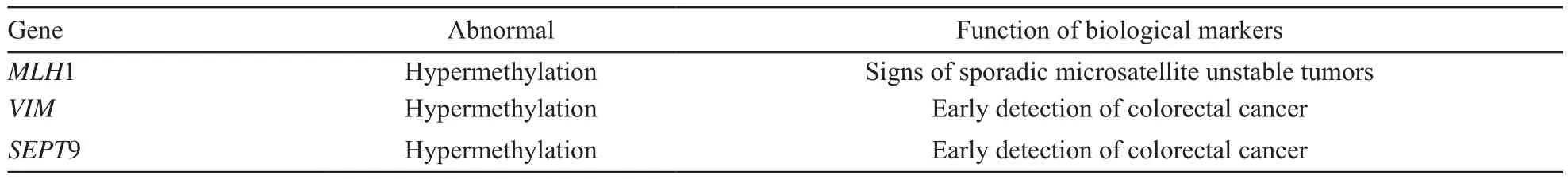
表4 在大肠癌中常见的有潜力的甲基化基因生物标志Fig.4 Common potential biomarks from methylation of genes in colorectal cancer
最近,新的甲基化生物标志芯片通过了临床试验,正逐步走向商业化。Colovantage是一项血标志测试,用于检测甲基化sepT9的存在[18]。
候选生物标志在实验室及临床经过了大量的测试,而且取得了令人鼓舞的效果。更多的生物标志检测见表5。

表5 不同国家新近发现可作为生物标志的基因甲基化Fig.5 Newly discovered gene methylation can be used as biomarkers in different countries
4 东西方人群中用作治疗靶点的表观遗传修饰基因的异同
由于表观遗传修饰的改变具有可逆性,为大肠癌的治疗提供了一个新的趋势。相比于组蛋白甲基化,组蛋白乙酰转移酶、染色质重塑和miRNA的干预剂的应用仍处于早期阶段,DNMTi(DNA甲基转移酶抑制剂)和HDACi(组蛋白去乙酰化酶)的使用已日趋成熟[18]。DNA甲基化抑制剂分为核苷类似物、非核苷类似物和反义寡核苷酸。其主要作用机制为:与DNA混合后,同DNMTS形成共价结合,阻碍酶的活性。其中,5-阿扎胞苷和5-脱氧胞苷已被美国食品和药物管理局(Food and Drug Administration,FDA)批准用于治疗骨髓异常增生综合征,这提供了表观遗传学治疗的证据原则[25]。由于HDACi多方面参与肿瘤的产生,吸引研究者用于肿瘤治疗。然而,两者在临床的应用极其有限,究其原因是不能作为选择性的抑制剂,在治疗的同时干预了正常的生理。是否能根据甲基化或乙酰化的不同来选择特异性的抑制剂,现在很多实验室正进行探索(表6)。
表观遗传学的发展很快,对大肠癌的研究显得越来越重要。目前来看,欧美国家大肠癌患者在3OST2、LAMA1、KCNQ5、TFPI2、EYA4和ADHEF1D等基因的甲基化上明显高于亚洲人种,而RASSF1A等基因甲基化则在亚洲大肠癌患者中多发。一大批新的作为生物标志的甲基化基因的发现也说明大肠癌表观遗传学在东西方存在差异,例如,韩国发现的CDX2-/ CK20-、GABRA和LAMA2基因,中国发现的CDH13和FBLN3基因,挪威发现的DCLK1基因以及芬兰发现的PTPR家族基因等。随着更多的甲基化位点被各国研究者证实,我们需仔细分析其中隐藏的信息[29]。首先,重亚硫酸盐测序是如今肿瘤甲基化分析的金标准,但在一些研究中没有采用此方法。其次,很多研究存在样本容量不足的现象。因此,研究者应该改进实验方案和增加样本统计量[8]。而且,最重要的一点,新发现的甲基化位点是否是因为人种差异而产生的呢?具有普遍性的甲基化位点可以为疾病的诊断提供依据,而具有种族特异性的位点在各自种族中的用处则更加重要。
利用高通量的DNA甲基化芯片技术与信息学方法进行更加深入的研究可加速特异性大肠癌抑癌基因的发现,为寻找大肠癌的组织特异性的分子靶点提供快捷的途径。

表6 大肠癌中不同用作治疗靶点的表观遗传修饰基因的比较Fig.6 Comparison of different epigenetic modifications that can be used as gene therapy targets in colorectal cancer
[参 考 文 献]
[1]LAO V V, GRADY W M.Epigenetics and colorectal cancer [J].Nat Rev Gastroenterol Hepatol, 2011, 8(12): 686-700.
[2]NIEMINEN T T, SHOMAN S, EISSA S, et al.Distinct genetic and epigenetic signatures of colorectal cancers according to ethnic origin[J].Cancer Epidemiol Biomarkers Prev, 2012,21(1): 202-211.
[3]COPPEDÈ F.Epigenetic biomarkers of colorectal cancer:Focus on DNA methylation[J].Cancer Lett, 2014, 342(2):238-247.
[4]HIBI K, MIZUKAMI H, SHIRAHATA A, et al.Aberrant methylation of the netrin-1 receptor genes UNC5C and DCC detected in advanced colorectal cancer[J].World J Surg,2009, 33(5): 1053-1057.
[5]GLÖCKNER S C, DHIR M, YI J M, et al.Methylation of TFPI2 in stool DNA: a potential novel biomarker for the detection of colorectal cancer[J].Cancer Res, 2009, 69(11):4691-4699.
[6]SCHNEKENBURGER M, DIEDERICH M.Epigenetics offer new horizons for colorectal cancer prevention[J].Curr Colorectal Cancer Rep, 2012, 8(1): 66-81.
[7]ASHKTORAB H, RAHI H, WANSLEY D, et al.Toward a comprehensive and systematic methylome signature in colorectal cancers[J].Epigenetics, 2013, 8(8): 807-815.
[8]XIA Y Y, DING Y B, LIU X Q, et al.Racial/ethnic disparities in human DNA methylation[J].Biochim Biophys Acta,2014, 1846(1): 258-262.
[9]ZORATTO F, ROSSI L, VERRICO M, et al.Focus on genetic and epigenetic events of colorectal cancer pathogenesis:implications for molecular diagnosis[J].Tumour Biol, 2014,35(7): 6195-6206.
[10]KONDO Y, SHEN L, ISSA J P.Critical role of histone methylation in tumor suppressor gene silencing in colorectal cancer[J].Mol Cell Biol, 2003, 23(1): 206-215.
[11]GARGALIONIS A N, PIPERI C, ADAMOPOULOS C, et al.Histone modifications as a pathogenic mechanism of colorectal tumorigenesis[J].Int J Biochem Cell Biol, 2012, 44(8):1276-1289.
[12]ZUO X, MORRIS J S, SHUREIQI I.Chromatin modification requirements for 15-lipoxygenase-1 transcriptional reactivation in colon cancer cells[J].J Biol Chem, 2008,283(46): 31341-31347.
[13]HIGASHIJIMA J, KURITA N, MIYATANI T, et al.Expression of histone deacetylase 1 and metastasis-associated protein 1 as prognostic factors in colon cancer[J].Oncol Rep, 2011,26(2): 343-348.
[14]OZDAĞ H, TESCHENDORFF A E, AHMED A A, et al.Differential expression of selected histone modifier genes in human solid cancers[J].BMC Genomics, 2006, 7(2): 90-104.
[15]ENROTH S, RADA-IGLESISAS A, ANDERSSON R, et al.Cancer associated epigenetic transitions identified by genome-wide histone methylation binding profiles in human colorectal cancer samples and paired normal mucosa[J].BMC Cancer, 2011, 11(5): 450-462.
[16]LI Q, CHEN H.Transcriptional silencing of N-Myc downstream-regulated gene 1 (NDRG1) in metastatic colon cancer cell line SW620[J].Clin Exp Metastasis, 2011,28(2): 127-135.
[17]LEE S, OH T, CHUNG H, et al.Identification of GABRA1 and LAMA2 as new DNA methylation markers in colorectal cancer [J].Int J Oncol, 2012, 40(3): 889-898.
[18]VAIOPOULOS A G, ATHANASOULA K, PAPAVASSILIOU A G.Epigenetic modifications in colorectal cancer: molecularinsights and therapeutic challenges[J].Biochim Biophys Acta, 2014, 1842(7): 971-980.
[19]KIM J H, RHEE Y Y, BAE J M, et al.Loss of CDX2/CK20 expression is associated with poorly differentiated carcinoma,the CpG island methylator phenotype, and adverse prognosis in microsatellite-unstable colorectal cancer[J].Am J Surg Pathol, 2013, 37(10): 1532-1541.
[20]WANG Z, YUAN X, JIAO N, et al.CDH13 and FLBN3 gene methylation are associated with poor prognosis in colorectal cancer[J].Pathol Oncol Res, 2012, 18(2): 263-270.
[21]KIM Y H, LEE H C, KIM S Y, et al.Epigenomic analysis of aberrantly methylated genes in colorectal cancer identifies genes commonly affected by epigenetic alterations[J].Ann Surg Oncol, 2011, 18(8): 2338-2347.
[22]NAUMOV V A, GENEROZOV E V, ZAHARJEVSKAYA N B,et al.Genome-scale analysis of DNA methylation in colorectal cancer using infinium human methylation 450 bead chips [J].Epigenetics, 2013, 8(9): 921-934.
[23]VEDELD H M, SKOTHEIM R I, LOTHE R A, et al.The recently suggested intestinal cancer stem cell marker DCLK1 is an epigenetic biomarker for colorectal cancer[J].Epigenetics, 2014, 9(3): 346-350.
[24]LACZMANSKA I, KARPINSKI P, BEBENEK M, et al.Protein tyrosine phosphatase receptor-like genes are frequently hypermethylated in sporadic colorectal cancer[J].J Hum Genet, 2013, 58(1): 11-15
[25]PATAI A V, MOLNÁR B, KALMAR A, et al.Role of DNA methylation in colorectal carcinogenesis[J].Dig Dis, 2012,30(3): 310-315.
[26]CREA F, NOBILI S, PAOLICCHI E, et al.Epigenetics and chemoresistance in colorectal cancer: an opportunity for treatment tailoring and novel therapeutic strategies[J].Drug Resist Update, 2011, 14(6): 280-296.
[27]XIONG H, DU W, ZHANG Y J, et al.Trichostatin A, a histone deacetylase inhibitor, suppresses JAK2/STAT3 signaling via inducing the promoter-associated histone acetylation of SOCS1 and SOCS3 in human colorectal cancer cells[J].Mol Carcinog, 2012, 51(2): 174-184.
[28]BELANGER A S, TOJCIC J, HARVEY M, et al.Regulation of UGT1A1 and HNF1 transcription factor gene expression by DNA methylation in colon cancer cells[J].BMC Mol Biol,2010, 11(3): 9-20.
[29]RAJENDRAN P, KIDANE A I, YU T W, et al.HDAC turnover, CtIP acetylation and dysregulated DNA damage signaling in colon cancer cells treated with sulforaphane and related dietary isothiocyanates[J].Epigenetics, 2013, 8(6):612-623.
Research on similarities and differences of colorectal cancer epigenetic modifications in the Eastern and Western population
HU Qiang, XIONG Hua, FANG Jingyuan (Department of Gastroenterology,Renji Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai Institute of Digestive Diseases, Shanghai 200001, China)
[Key words]Colorectal neoplasms; Epigenesis; Genetics; DNA methylation
[Abstract]Colorectal cancer remains a major threat to people’s health around the world.Researchers have paid more and more attention to colorectal cancer epigenetics.From two main aspects of colorectal cancer epigenetics: DNA methylation and histone modification, this article analyzes the similarities and differences between patients with colorectal cancer in Eastern and Western countries.This review briefly introduces epigenetic modification of genes that were used to be biomarkers and therapeutic targets.Although there are some common features of colorectal cancer in the world, analysis has showed that some obvious epigenetic differences do exist in different races.For example, it had been confirmed in the studies that there are differences in specific gene methylation, histone modification sites and the degree of methylation and acetylation among countries, which provide the basis for specific diagnosis, treatment and prognosis of colorectal cancer in different ethnic groups.With improved research methods and increased sample size,more and more special molecular targets of colorectal cancer tissues will be found, and then personalized therapy for colorectal cancer can be achieved.
DOI:10.3969/j.issn.1007-3969.2016.02.011
中图分类号:R735.3+4
文献标志码:A
文章编号:1007-3639(2016)02-0182-06
通信作者:熊华 E-mail:huaxong88@126.com
收稿日期:(2015-02-03 修回日期:2016-01-11)
