美洲拟鲽抗菌肽Pleurocidin在大肠杆菌中的高效分泌表达及优化
2016-06-24徐雪姣查向东车媛媛马利娟吴思群杨培龙黄火清姚斌安徽大学生命科学学院安徽合肥3060中国农业科学院饲料研究所北京0008
徐雪姣,查向东,车媛媛,马利娟,吴思群,杨培龙,黄火清,姚斌 安徽大学 生命科学学院,安徽 合肥 3060 中国农业科学院 饲料研究所,北京 0008
美洲拟鲽抗菌肽Pleurocidin在大肠杆菌中的高效分泌表达及优化
徐雪姣1,查向东1,车媛媛1,马利娟1,吴思群1,杨培龙2,黄火清2,姚斌2
1 安徽大学生命科学学院,安徽合肥230601
2 中国农业科学院饲料研究所,北京100081
徐雪姣, 查向东, 车媛媛, 等. 美洲拟鲽抗菌肽Pleurocidin在大肠杆菌中的高效分泌表达及优化. 生物工程学报, 2016, 32(3): 365–374.
Xu XJ, Zha XD, Che YY, et al. Expression of Pleurocidin from winter flounder in Escherichia coli and optimization of culture conditions. Chin J Biotech, 2016, 32(3): 365–374.
摘 要:为在大肠杆菌中分泌表达Pleurocidin,并提高融合蛋白的分泌效率,将Pleurocidin基因和Cherry DNA序列通过平末端连接融合,再将融合基因整合到pET22b (+) 载体中,转化大肠杆菌BL21 (DE3);乳糖诱导表达。成功构建含pET22b (+)-CP重组质粒的基因工程菌,用乳糖诱导获得高效表达。在诱导16 h时加入甘氨酸可以显著提高融合蛋白Cherry-Pleurocidin的分泌效率。用稀盐酸水解融合蛋白的酸敏感位点,再进一步分离纯化即得到r-Pleurocidin,其对大肠杆菌DH5α和枯草芽孢杆菌BS168具有明显的抑菌活性。结果表明成功构建了高效表达Pleurocidin的大肠杆菌基因工程菌,获得有活性的r-Pleurocidin。
关键词:Pleurocidin,分泌表达,Asp-Pro酸敏感位点,抑菌活性
Received: June 19, 2015; Accepted: October 16, 2015
Supported by: Anhui Provincial Natural Science Foundation (No. 1408085MC50).
安徽省自然科学基金 (No. 1408085MC50) 资助。
网络出版时间:2015-12-22 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20151222.1415.001.html
阳离子抗菌肽是由植物和动物产生的阳离子型的两亲性分子,一般由12–50个氨基酸残基组成,相对分子质量小,水溶性好,等电点在8.9–10.7之间,具有两亲α-螺旋和 (或) 两亲β-折叠结构[1]。
海洋生物抗菌肽存在独特的翻译后修饰,例如半胱氨酸结、卤化作用、组氨酸和丙氨酸桥,这些修饰可以使海洋生物抵抗严酷的生活环境[2]。Pleurocidin是从美洲拟鲽Pseudopleuronectes americanu的皮肤粘液中分离出的含25个氨基酸残基的线性α-螺旋多肽,具有广谱的抗菌活性,能够抑杀多种细菌和真菌,如肺炎克雷伯菌、金黄色葡萄球菌、绿脓杆菌和白色念珠菌[3-4]。Pleurocidin的等电点为10.05,可以形成两亲的α-螺旋,通过在细菌细胞膜上形成离子通道,不可逆地破坏细胞膜,从而杀死细菌[5]。 Pleurocidin热稳定性好、耐盐,对多种食品微生物有抑杀作用,可用于食品保鲜[6]。在体外毒性研究中,Pleurocidin表现出较低的溶血性,具有潜在的治疗价值[7]。
Pleurocidin天然来源有限,化学合成价格昂贵,利用基因工程方法合成Pleurocidin是一条高效低成本的生产途径。大肠杆菌表达系统目前应用最为广泛。但是用大肠杆菌表达抗菌肽却有一些困难,主要在于抗菌肽对大肠杆菌有毒性。本实验室曾尝试在大肠杆菌内非融合表达Pleurocidin未获成功。
本文利用来源于大鼠肝脏细胞色素b5的亲水结构域Cherry[8],它与信号肽pelB共同作用,一方面抑制Pleurocidin对宿主细胞的毒性,另一方面促进融合蛋白分泌至胞外;对分泌的重组融合蛋白用酸水解特异性切割Asp-Pro位点,获得有活性的r-Pleurocidin。
1 材料与方法
1.1菌株和质粒
质粒pET22b (+) 购自Novagen公司(Darmstadt, Germany);大肠杆菌DH5α,BL21 (DE3)和枯草芽孢杆菌BS168均为本实验室保存。
1.2工具酶和试剂
NcoⅠ和EcoRⅠ限制性内切酶购自MBI Fermentas (北京,中国);T4 PNK和T4 DNA连接酶购自日本TaKaRa公司;DNA琼脂糖凝胶回收试剂盒和质粒小量快速提取试剂盒购自爱思进公司;改良型Lowry法蛋白定量试剂盒、胰蛋白胨、酵母提取物、IPTG、DNA Marker、Pfu DNA聚合酶等购自生工生物工程 (上海)股份有限公司。其他试剂为国产分析纯。
1.3重组质粒pET22b(+)-CP的构建
1.3.1Pleurocidin基因的扩增
根据Pleurocidin基因的氨基酸序列GWGSFFKKAAHVGKHVGKAALTHYL,依据大肠杆菌密码子的偏爱性,设计并合成Pleurocidin基因的编码序列5′-GGTTGGGGT AGCTTTTTCAAGAAAGCAGCACATGTTGGT AAACATGTTGGTAAAGCAGCACTGACCCAT TATCTG-3′。以Pleurocidin基因为模板,设计上、下游引物ple1和ple2 (表1)。PCR反应条件:94 ℃5 min ;94 ℃ 30 s,62 ℃ 30 s,72 ℃30 s,循环30次;72 ℃10 min 。实验中PCR产物和质粒均经1.4%琼脂糖电泳检测,试剂盒纯化回收。
1.3.2Cherry DNA序列的扩增
参考挪威大鼠细胞色素b5DNA序列(GenBank登录号:BC086945),设计上、下游引物C1和C2 (表1)。反应条件同Pleurocidin基因的扩增,但退火温度为60 ℃。引物与基因的合成及质粒测序均由生工生物工程 (上海)股份有限公司完成。
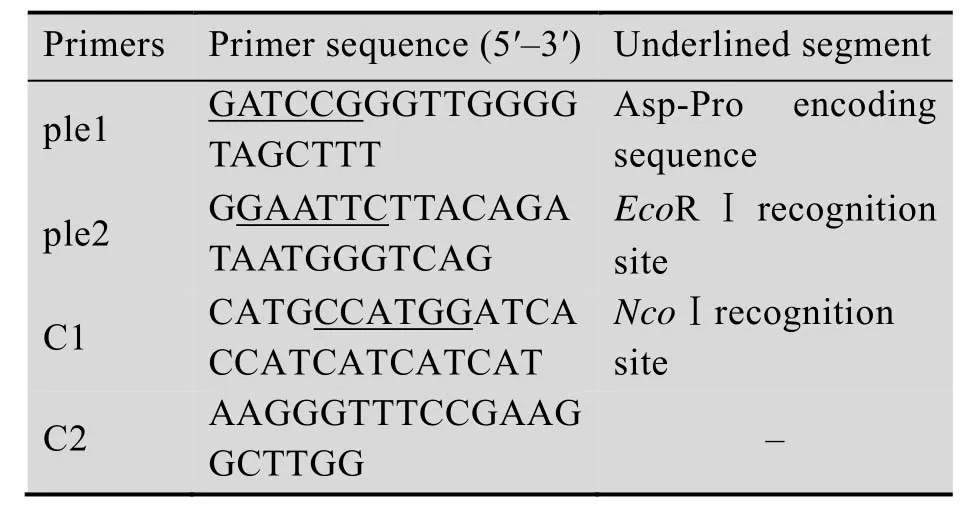
表1 PCR反应引物Table 1 PCR primers
1.3.3Cherry DNA序列和Pleurocidin基因平末端连接
将Pleurocidin基因和Cherry DNA的PCR扩增产物混合,用T4多核苷酸激酶37 ℃磷酸化30 min,再加入T4 DNA连接酶37 ℃连接1 h。
1.3.4融合基因Cherry-pleurocidin (CP) 的扩增
上述连接产物用无菌水稀释20倍后作为模板,以C1和ple2为上、下游引物,PCR扩增得到融合基因CP。PCR反应条件同Pleurocidin基因的扩增。
1.3.5融合基因与质粒pET22b (+) 连接及转化
融合基因CP和质粒pET22b (+) 经NcoⅠ和EcoRⅠ限制性内切酶酶切,胶回收后用T4 DNA连接酶连接。将连接产物转化大肠杆菌BL21 (DE3) 感受态细胞,37 ℃过夜培养,菌液PCR鉴定阳性克隆。对重组质粒pET22b(+)-CP (Cherry-Pleurocidin) 进行测序。
1.4诱导表达
挑测序正确的阳性克隆接种至含有50 μg/mL氨苄青霉素钠的LB培养基中,37 ℃、200 r/min过夜振荡培养,按1%量接入新鲜的LB抗性培养基扩大培养,37 ℃振荡培养至OD600≈0.6时,加入终浓度4 g/L的乳糖,37 ℃、30 ℃和25 ℃分别诱导20 h,9 000×g离心1 min,收集上清液和菌体。诱导期间,每隔4 h取样,Lowry 法[9]测定培养上清中的总蛋白浓度。用Bandscan软件扫描分析SDS-PAGE图谱,估算融合蛋白CP在总蛋白中所占的比例。
1.5不同浓度甘氨酸对融合蛋白CP分泌效率的影响
诱导16 h时加入不同浓度的甘氨酸,使终浓度分别为1、2、3、4、5 g/L,诱导20 h时离心收集上清液。对乳糖诱导组和乳糖+甘氨酸诱导组培养上清中融合蛋白CP浓度进行比较分析。诱导期间,每隔4 h取样,Lowry法[9]测定培养上清中的总蛋白浓度。
1.6融合蛋白CP的酸特异性切割
向培养上清中滴加1 mol/L盐酸,至终浓度为100 mmol/L,65 ℃恒温水浴72 h;每隔24 h 取1 mL水解液,4 ℃、12 000×g离心10 min。在上清液中,加5倍体积的丙酮,–20 ℃下静置30 min,4 ℃、12 000×g离心10 min,弃去上清丙酮,自然风干后加100 μL还原性SDS-PAGE上样缓冲液,Tricine-SDS-PAGE凝胶电泳检测水解效果。
1.7Pleurocidin纯化及质谱鉴定
1.7.1离子交换层析
利用Sephadex CM-FF 5 mL阳离子交换柱在AKTA Explorer100进行分离纯化。条件为:波长214 nm和280 nm,流速1 mL/min,平衡缓冲液为20 mmol/L PB (pH 7.0),洗脱缓冲液为20 mmol/L PB、1 mol/L NaCl、pH 8.0。0.2 mol/L NaCl洗脱,收集洗脱峰样品,用Tricine-SDSPAGE电泳分析。
1.7.2电洗脱
1) 凝胶切割:将SDS-PAGE胺凝胶用蒸馏水彻底冲洗,切下目的条带,捣碎,放入透析袋内,注入Tris-甘氨酸缓冲液 (pH 8.3),置4 ℃冰箱;2) 洗脱:将透析袋放入盛有预冷Tris-甘氨酸缓冲液 (pH 8.3) 的核酸电泳槽 (冰浴)中,100 V电泳1 h左右;待考马斯亮蓝完全从凝胶条带上跑出时,将透析袋放入预冷的0.01 mol/L的PBS溶液中透析;3) 沉淀:取出透析袋内的液体用丙酮过夜沉淀,透析液与丙酮体积比为1∶5;最后用SDS-PAGE凝胶电泳检测电洗脱纯化效果。纯化后样品经透析脱盐后冻干,再用二维液相色谱多级质谱联用仪(2DIC-MS) 进行质谱分析。
1.8Pleurocidin的抑菌活性检测
利用琼脂糖扩散法进行抑菌实验,取10 mg纯化后的Pleurocidin溶于4 mL PB缓冲液(pH 7.0) 中,过滤灭菌,备用。将过夜活化的大肠杆菌DH5α和枯草芽胞杆菌BS168,均匀涂布于LB固体培养基上,取制备好的Pleurocidin进行抑菌实验,以融合蛋白CP和无菌水作阴性对照,氨苄青霉素钠作阳性对照,37 ℃恒温培养,20 h后观察抑菌效果,并测量抑菌圈直径。
最小抑菌浓度的测定[10-11]:将处于对数期的大肠杆菌DH5α和枯草芽孢杆菌BS168稀释到104–105CFU/mL,取1 mL菌液和10 μL不同浓度的r-Pleurocidin加入到EP管中,以PB缓冲液作阴性对照,37 ℃、200 r/min振荡培养3 h,测菌液的OD600,以吸光度值无变化处所对应的r-Pleurocidin浓度为最小抑菌浓度 (MIC)。
2 结果与分析
2.1重组质粒的构建
CP融合基因片段的大小为413 bp,其PCR产物经电泳检测,条带大小与预期一致 (图1)。构建的重组质粒pET22b (+)-CP转化大肠杆菌BL21 (DE3),获得了阳性克隆,测序证明碱基序列正确,pelB编码序列、Cherry DNA和Pleureucidin基因依次正确连接。
2.2融合蛋白CP的诱导表达
SDS-PAGE分析表明,30 ℃恒温诱导条件下,诱导组培养上清和菌体中均出现融合蛋白CP,信号肽完全切割,而未诱导组在相同位置未发现相应条带 (图2)。诱导组诱导20 h时上清中总蛋白浓度达到520 μg/mL;融合蛋白CP占总蛋白67.2%,融合蛋白CP浓度为349 μg/mL;菌体内也存在融合蛋白CP,根据Bandscan中的灰度值乘以总体积,估算出胞外融合蛋白CP占总融合蛋白CP的73.2%。诱导温度为37 ℃时没有表达条带,30 ℃表达效果优于25 ℃。

图1 融合基因Cherry-Pleurocidin的PCR扩增结果Fig. 1 PCR product of Cherry-Pleurocidin fusion gene. M: DNA marker; 1: PCR products of fusion gene.

图2 pET22b (+)-CP工程菌诱导表达分析Fig. 2 SDS-PAGE analysis of the induced expression in the engineering bacteria harboring pET22b (+)-CP. 1: cell pellet of the control group; 2: cell pellet of the lactose induction group; 3: culture supernatant of lactose induction group; 4: culture supernatant of the control group; M: protein marker (from bottom to top: 14.4, 20, 31, 45, 66.2 and 98 kDa).
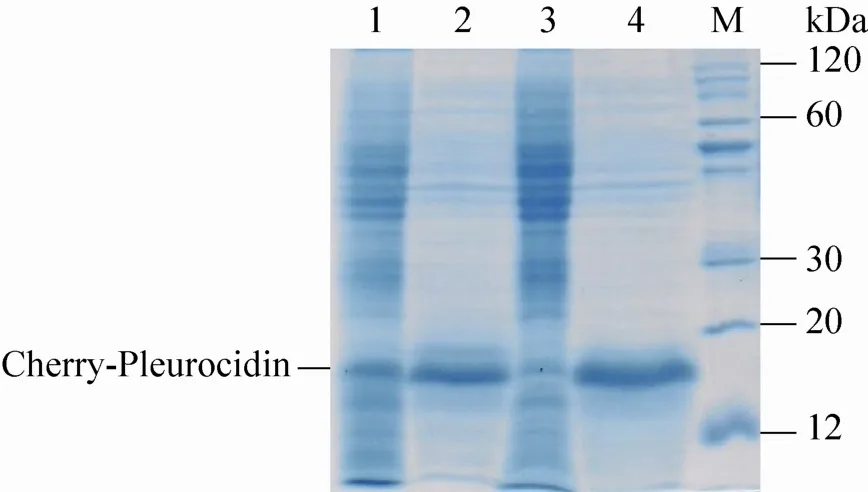
图3 乳糖诱导组和乳糖+甘氨酸诱导组SDS-PAGE比较图Fig. 3 Comparison between the lactose induction group and the lactose+glycine group by SDS-PAGE. 1: cell pellet of the lactose induction group; 2: culture supernatant of the lactose induction group; 3: cell pellet of the lactose + glycine group; 4: culture supernatant of the lactose + glycine group; M: protein marker (from bottom to top: 12, 20, 30, 40, 50, 60, 80, 100 and 120 kDa).
2.3不同浓度甘氨酸对融合蛋白CP分泌效率的影响
在诱导16 h时加入甘氨酸,当甘氨酸终浓度增加为4 g/L,融合蛋白CP接近完全分泌 (图3);终浓度为5 g/L时,分泌效果与4 g/L无明显差异。诱导20 h后上清中总蛋白浓度达到608 μg/mL;融合蛋白CP占总蛋白浓度的84.5%,融合蛋白CP浓度为513 μg/mL。配对数据t检验分析表明:乳糖+甘氨酸诱导组 (甘氨酸终浓度4 g/L) 胞外融合蛋白CP产量极显著高于乳糖诱导组。
不同时间点诱导培养上清中的总蛋白浓度变化曲线如图4所示。乳糖+甘氨酸诱导组加入甘氨酸后,培养上清中总蛋白浓度显著增加,随后也一直高于乳糖诱导组。
2.4融合蛋白CP的酸特异性切割
盐酸浓度为100 mmol/L,水解温度65 ℃,水解时间24 h、48 h、72 h,均有目的条带出现;48 h和72 h目的条带含量没有明显差异 (图5)。
2.5Pleurocidin纯化、SDS-PAGE电泳检测和质谱检测
盐酸水解后的培养上清用Sephadex CM-FF层析柱吸附,用0.2 mol/L NaCl洗脱,洗脱液经电泳检测出现多个条带,对r-Pleurocidin条带利用电洗脱进一步纯化,经SDS-PAGE检测可以达到电泳纯 (图6)。样品进行2DIC-MS质谱分析,样品的离子模式为[M+H]2+,对应的分子量为2 809.26 Da;与理论分子量2 808.2 Da相符,误差在仪器测量允许范围内 (图7)。样品的实际二级碎片离子与MS2理论碎片离子一致,证实样品为r-Pleurocidin (图8、9)。

图4 培养基中总蛋白浓度随诱导时间变化曲线图Fig. 4 Time course of the total protein concentration in culture supernatant.

图5 融合蛋白Cheery-Pleurocidin酸切割的Tricine-SDS-PAGE分析Fig. 5 Tricine-SDS-PAGE analysis of Cheery-Pleurocidin Asp-Pro cleavage. 1: control sample incubated at the same condition without any acid added for 72 hours; 2–4: the supernatant of the hydrolysis solution at the time point of 24 h, 48 h and 72 h; M: low range protein marker (from bottom to top: 4.1, 6.5, 9.5, 14.4, 20, 27, 35, 45, and 66 kDa).
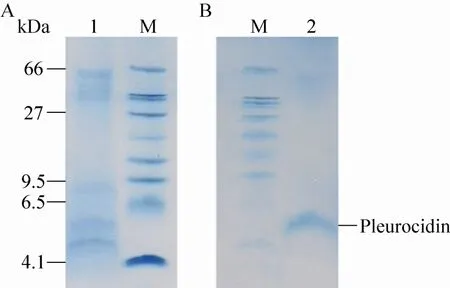
图6 r-Pleurocidin的纯化图Fig. 6 Tricine-SDS-PAGE analysis of purified r-Pleurocidin. (A) Purification of r-Pleurocidin by cation exchange chromatography. (B) Purification of r-Pleurocidin by electroelution. 1: fractions from the Sephadex CM-FF 5 mL column; 2: purified r-Pleurocidin; M: low range protein marker (from bottom to top: 4.1, 6.5, 9.5, 14.4, 20, 27, 35, 45, and 66 kDa).

图7 r-Pleurocidin的一级质谱图Fig. 7 Primary mass spectrometry (DIC-MS) of r-Pleurocidin.

图8 r-Pleurocidin的二级质谱图Fig. 8 The second grade mass spectrometry(DIC-MS) of r-Pleurocidin.

图9 r-Pleurocidin的MS2理论碎片离子Fig. 9 MS2 theoretical fragment ions of r-Pleurocidin.
2.6r-Pleurocidin的抑菌活性检测
琼脂糖扩散法抑菌实验表明,r-Pleurocidin对大肠杆菌DH5α (500 μg r-Pleurocidin) 和枯草芽胞杆菌BS168 (250 μg r-Pleurocidin) 均有明显的抑菌活性 (图10)。通过液体抑制测定法确定了r-Pleurocidin对大肠杆菌DH5α和枯草芽孢杆菌BS168的最小抑菌浓度分别为300、150 μg/mL。
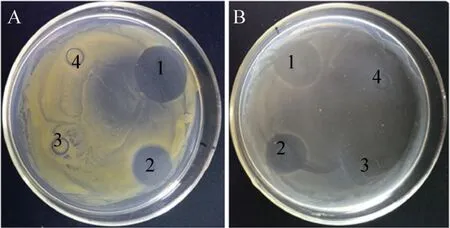
图10 r-Pleurocidin的抑菌活性检测Fig. 10 Antibacterial activity assay of r-Pleurocidin. (A) Bacillus subtilis BS168. (B) E. coli DH5α. 1: ampicillin sodium salt; 2: r-Pleurocidin; 3: the fusion protein CP; 4: sterile ddH2O.
3 讨论
目前关于Pleurocidin的重组表达研究涉及原核和真核表达系统。Bryksa等用pET21a质粒为载体在大肠杆菌中融合表达Pleurocidin基因,融合蛋白在细胞内形成包涵体,溶解后用羟胺切除融合头而获得完整的重组Pleurocidin[12];该方法的纯化过程较为复杂,而且所用羟胺是致癌剂。Burrowes等将Pleurocidin cDNA基因片段插入到pPICZα质粒中,转化毕赤酵母,用甲醇诱导表达,转录水平正常,但并未获得翻译产物,可能是Pleurocidin被蛋白水解酶降解或表达产量过低[13]。Brocal等用鱼类细胞系表达Pleurocidin,Western blotting结果显示转染EPC细胞系的培养上清和细胞内均有Pleurocidin,但表达产量低,表达时间长,成本较高,不适用于大规模生产[14]。
大肠杆菌异源表达是生产重组蛋白的有力工具,而分泌表达更具有避免胞内降解、可连续生产、便于分离纯化等优势。但大肠杆菌中外源蛋白的分泌表达面临一些困难,例如1) 大肠杆菌双层细胞膜不利于分泌,蛋白质有分泌到胞外和周质两种可能性;2) 与胞内表达比较,胞外分泌所对应的高密度发酵技术尚不够成熟[15]。随着对大肠杆菌蛋白分泌系统了解的深入,分泌表达技术也更为有效[16],主要从以下几个方面提高分泌效率:1) 宿主菌本身的遗传改造;例如Wacker Biotech公司开发ESETEC®系统,其宿主菌若干外膜蛋白被突变[17];2) 选择或改造信号肽序列[18];3) 目的蛋白的修饰或结构改变[19];4) 优化培养条件,如添加甘氨酸、Triton X-100,改变培养温度等[20-21]。
Ⅱ型分泌系统是最常用的分泌系统,它先通过SecB、SRP或TAT通路,将含信号肽的蛋白质前体转运至周质,再通过MTB机制由12–16个蛋白质组成的secreton分泌到胞外[15]。本实验成功构建了PelB-Cherry-Pleurocidin融合基因,表达过程中信号肽PelB切割完全,融合蛋白CP分泌到培养上清中。PelB信号肽属于Ⅱ型分泌系统的SecB途径,配合使用Cherry作为前导序列[21],一方面抑制抗菌肽pleurocidin对宿主细胞的毒性,另一方面促进融合蛋白CP直接分泌到胞外。另外,甘氨酸干扰大肠杆菌细胞壁肽聚糖层的合成,破坏细胞外膜的完整性[22],添加适量的甘氨酸促进了胞内蛋白质的释放,有效提高了产量和分泌效率。本实验中融合蛋白CP几乎全部分泌到胞外,在培养上清中的产量达 516 mg/L,在同类研究中 (20–500 mg/L) 处于较高水平[23-26]。酸水解切割融合蛋白,成本低,安全性好,操作方便。本实验中融合蛋白盐酸水解效果优于甲酸和乙酸,但水解过程中出现了部分蛋白质沉淀的问题,需要进一步摸索条件加以改进。
本实验成功构建了含重组质粒pET22b (+)-CP的大肠杆菌工程菌,首次实现了Pleurocidin在大肠杆菌中高效分泌表达,结合下游高密度发酵,可以获得更高的产量,具有重要的应用价值。
REFERENCES
[1] Deng C, Wang LJ. Research advances in cationic antimicrobial peptides. China Biotechnol, 2008, 28(6): 100–107 (in Chinese).
邓超, 王联结. 阳离子抗菌肽的研究进展. 中国生物工程杂志, 2008, 28(6): 100–107.
[2] Ponnappan N, Budagavi DP, Yadav BK, et al. Membrane-active peptides from marine organisms-antimicrobials, cell-penetrating peptides and peptide toxins: applications and prospects. Probiotics Antimicrob Proteins, 2015, 7(1): 75–89.
[3] Cole AM, Weis P, Diamond G. Isolation and characterization of pleurocidin, an antimicrobial peptide in the skin secretions of winter flounder. J Biol Chem, 1997, 272(18): 12008–12013.
[4] Burrowes OJ, Hadjicharalambous C, Diamond G, et al. Evaluation of antimicrobial spectrum and cytotoxic activity of pleurocidin for food applications. J Food Sci, 2004, 69(3): FM66–FM71.
[5] Lee J, Lee DG. Structure-antimicrobial activity relationship between pleurocidin and its enantiomer. Exp Mol Med, 2008, 40(4): 370–376.
[6] Cole AM, Darouiche RO, Legarda D, et al. Characterization of a fish antimicrobial peptide: gene expression, subcellular localization, and spectrum of activity. Antimicrob Agents Chemother, 2000, 44(8): 2039–2045.
[7] Lee J, Lee DG. Influence of the hydrophobic amino acids in the N-and C-terminal regions of pleurocidin on antifungal activity. J Microbiol Biotechnol, 2010, 20(8): 1192–1195.
[8] Falzone CJ, Wang YM, Vu BC, et al. Structural and dynamic perturbations induced by heme binding in cytochrome b5. Biochemistry, 2001, 40(15): 4879–4891.
[9] Fu YM, Xu JZ, Liao Q, et al. Research of Lowry determination of oligopeptides. Chin J Pharm Anal, 2011, 31(4): 739–741 (in Chinese).
付玉梅, 许锦珍, 廖群, 等. Lowry法测定寡肽的研究. 药物分析杂志, 2011, 31(4): 739–741.
[10] Li BC, Chen YQ, Liu P, et al. Expression of the antibacterial peptide CM4-like gene of Chinesesilkworm bombyx mori in Escherichia coli and its antibacterial activity analysis. J Mol Cell Biol, 2007, 40(2): 98–102.
[11] Liu XQ, Zha XD, Xiao YZ, et al. Efficient fusion expression of G13 domain derived from granulysin in Escherichia coli. Chin J Biotech, 2009, 25(2): 235–242 (in Chinese).
刘小强, 查向东, 肖亚中, 等. 颗粒裂解肽G13结构域在大肠杆菌中的高效融合表达. 生物工程学报, 2009, 25(2): 235–242.
[12] Bryksa BC, MacDonald LD, Patrzykat A, et al. A C-terminal glycine suppresses production of pleurocidin as a fusion peptide in Escherichia coli. Protein Expr Purif, 2006, 45(1): 88–98.
[13] Burrowes OJ, Diamond G, Lee TC. Recombinant expression of pleurocidin cDNA using the Pichia pastoris expression system. J Biomed Biotechnol, 2005, 2005(4): 374–384.
[14] Brocal I, Falco A, Mas V, et al. Stable expression of bioactive recombinant pleurocidin in a fish cell line. Appl Microbiol Biotechnol, 2006, 72(6): 1217–1228.
[15] Mergulhao FJM, Summers DK, Monteiro GA. Recombinant protein secretion in Escherichia coli. Biotechnol Adv, 2005, 23(3): 177−202.
[16] Low KO, Mahadi NM, Illias RM. Optimisation of signal peptide for recombinant protein secretion in bacterial hosts. Appl Microbiol Biotechnol, 2013, 97(9): 3811–3826.
[17] Ostendorp R, Popp A, Fischer M. Expression of full length igg and secretion into the culture medium of prokaryotic cells: Germany, EP2176291 A1. 2009-02-19.
[18] Zamani M, Nezafat N, Negahdaripour M, et al. In silico evaluation of different signal peptides for the secretory production of human growth hormone in E. coli. Int J Pept Res Ther, 2015, 21(3): 261–268.
[19] Chen N, Hong FL, Wang HH, et al. Modified recombinant proteins can be exported via the Sec pathway in Escherichia coli. PLoS ONE, 2012, 7(8): e42519.
[20] Liu ZM, Tian L, Chen YL, et al. Efficient extracellular production of κ-carrageenase in Escherichia coli: effects of wild-type signal sequence and process conditions on extracellular secretion. J Biotechnol, 2014, 185: 8–14.
[21] Wu D, Lu YH, Huang HQ, et al. High-level secretory expression of metchnikowin in Escherichia coli. Protein Expr Purif, 2013, 91(1): 49–53.
[22] Kaderbhai N, Karim A, Hankey W, et al. Glycine-induced extracellular secretion of a recombinant cytochrome expressed in Escherichia coli. Biotechnol Appl Biochem, 1997, 25(1): 53–61.
[23] Khushoo A, Pal Y, Mukherjee KJ. Optimization of extracellular production of recombinant asparaginase in Escherichia coli in shake-flask and bioreactor. Appl Microbiol Biotechnol, 2005, 68(2): 189–197.
[24] Wen CW, Wang ZR, Du P, et al. Secretion expression of recombinant glucagon in Escherichia coli. Sci China C: Life Sci, 2001, 44(3): 233–240.
闻崇炜, 王佐仁, 杜鹏, 等. 胰高血糖素在大肠杆菌中的分泌表达. 中国科学(C辑), 2001, 31(1): 22–27.
[25] Han ZH, Zhao QZ, Wang HL, et al. Characteristics of the secretory expression of pectate lyase A from Aspergillus nidulans in Escherichia coli. Afr J Microbiol Res, 2011, 5(15): 2155–2159.
[26] Songsiriritthigul C, Buranabanyat B, Haltrich D, et al. Efficient recombinant expression and secretion of a thermostable GH26 mannan endo-1, 4-β-mannosidase from Bacillus licheniformis in Escherichia coli. Microb Cell Fact, 2010, 9: 20.
(本文责编郝丽芳)
农业生物技术
Expression of Pleurocidin from winter flounder in Escherichia coli and optimization of culture conditions
Xuejiao Xu1, Xiangdong Zha1, Yuanyuan Che1, Lijuan Ma1, Siqun Wu1, Peilong Yang2, Huoqing Huang2, and Bin Yao2
1 School of Life Sciences, Anhui University, Hefei 230601, Anhui, China
2 Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Abstract:To express Pleurocidin in Escherichia coli and to enhance the secretory efficiency of the fusion protein, the gene encoding Pleurocidin was ligated with Cherry DNA sequence via blunt-end ligation. Then this fusion gene was cloned into pET22b (+) vector and the recombinant plasmid was transformed into E. coli BL21 (DE3). Lactose was used to induce expression of fusion protein. The recombinant plasmid pET22b (+) -CP was successfully constructed and high-level expression of fusion protein was induced with lactose. Statistics showed that addition of glycine after 16 h of induction significantly enhanced the secretory efficiency of the fusion protein. After hydrolysis of the fusion protein by diluted hydrochloric acid and some further purification steps, r-Pleurocidin was obtained with antibacterial activity against E. coli DH5α and Bacillus subtilis BS168. In conclusion, the fusion protein was expressed in E. coli and biologically active r-Pleurocidin was obtained after hydrochloric acid cleavage and purification.
Keywords:Pleurocidin, secretory expression, Asp-Pro acid-sensitive sites, antibacterial activity
Corresponding authors: Xiangdong Zha. Tel: +86-551-63861281; E-mail: xdcha@163.com Peilong Yang. E-mail: yangpeilong@caas.cn
