ggpS基因过表达对集胞藻PCC 6803甘油葡萄糖苷和甘油合成的影响
2016-06-24马培珍谈晓明吕雪峰田继远青岛农业大学食品科学与工程学院山东青岛6609中国科学院青岛生物能源与过程研究所中国科学院生物燃料重点实验室山东青岛660
马培珍,谈晓明,吕雪峰,田继远 青岛农业大学 食品科学与工程学院,山东 青岛 6609 中国科学院青岛生物能源与过程研究所 中国科学院生物燃料重点实验室,山东 青岛 660
ggpS基因过表达对集胞藻PCC 6803甘油葡萄糖苷和甘油合成的影响
马培珍1,2,谈晓明2,吕雪峰2,田继远1
1 青岛农业大学食品科学与工程学院,山东青岛266109
2 中国科学院青岛生物能源与过程研究所中国科学院生物燃料重点实验室,山东青岛266101
马培珍, 谈晓明, 吕雪峰, 等. ggpS基因过表达对集胞藻PCC 6803甘油葡萄糖苷和甘油合成的影响. 生物工程学报, 2016, 32(3): 347–354.
Ma PZ, Tan XM, Lü XF, et al. Effects of ggpS over-expression on glycosylglycerol and glycerol biosynthesis of Synechocystis sp. PCC 6803. Chin J Biotech, 2016, 32(3): 347–354.
摘 要:为了研究甘油葡萄糖苷磷酸合成酶 (GgpS) 在集胞藻PCC 803甘油葡萄糖苷和甘油合成中的作用,本研究在前期获得高产甘油葡萄糖苷藻株的基础上分别过量表达来自于集胞藻PCC 6803自身和聚球藻PCC 7002的甘油葡萄糖苷磷酸合成酶基因ggpS,并测定了在不同浓度NaCl胁迫时突变藻株的甘油葡萄糖苷和甘油积累量。结果发现获得的突变株甘油葡萄糖苷合成没有提高,但是甘油合成显著增强。此外,当培养基NaCl浓度从600 mmol/L提高到900 mmol/L时,集胞藻PCC 6803自身ggpS过表达藻株的甘油合成进一步提高75%。这些结果显示了GgpS在将碳代谢流导入集胞藻甘油合成途径中的作用。研究成果也为进一步通过基因工程改造提高集胞藻甘油葡萄糖苷和甘油合成效率奠定了基础。
关键词:甘油葡萄糖苷,甘油,集胞藻PCC6803,ggpS基因,基因工程
Received: July 5, 2015; Accepted: August 31, 2015
Supported by: The Shandong Province Science and Technology Development Project (No. 2014GSF121033), the State Oceanic Administration (SOA) Global Change and Air-Sea Interaction Program (No. GASI-03-01-02-05).
山东省科技发展计划 (No. 2014GSF121033),国家海洋局“全球变化与海气相互作用”专项 (No. GASI-03-01-02-05) 资助。
网络出版时间:2015-10-21 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20151021.1034.003.html
集胞藻Synechocystis PCC 6803是一种单细胞淡水蓝藻,具有与高等植物类似的光合系统,一直被作为光合作用研究的模式生物[1]。由于其遗传改造方便、生长速度较快,近年来集胞藻PCC 6803又被用作光合细胞工厂[2],用于合成氢气[3]、乙醇[4]、乙烯[5]、异戊二烯[6]、乳酸[7-8]、蔗糖[9]、脂肪酸[10]、脂肪醇[11]和脂肪烃[12]等多种生物燃料和化学品。虽然这些研究引起了学术界和工业界的广泛关注,但是由于大多数产品价值和产率低,因此目前仍处于研发阶段。在这种情况下,发展一种利用蓝藻生产高附加值产物的技术路线,将更具可行性和潜力,也将推动蓝藻光合生物合成技术路线的产业化应用。
甘油葡萄糖苷 (Glucosylglycerol) 是一类由甘油分子与葡萄糖分子以糖苷键结合的物质,由葡萄糖分子的构型、结合甘油分子的位置分为多种;其中作为天然渗透压抵抗分子的是2-O-(α-D-gluco-pyranosyl)-sn-glycerol (以下简称GG)。GG是一种大分子稳定剂,可用于蛋白质药物等的长期保存[13];还是一种良好的化妆品添加剂,具有保湿、抗氧化和抗衰老等功效,可以消除洁面后皮肤的紧绷感[14]。日本传统发酵食品 (如清酒) 中也被发现含有GG[15];研究发现GG还可能具有治疗过敏性呼吸系统疾病[16]、保护眼角结膜[17]和降低血糖[18]等多种人体保健功效。
除了化学[15]和酶催化[19]合成之外,GG也可以被一些异养微生物[20]或光合自养蓝藻[21]合成。以集胞藻PCC 6803为例,在细胞受到盐胁迫时,甘油-3-磷酸和ADP-葡萄糖会在甘油葡萄糖苷磷酸合成酶 (ggpS基因编码) 作用下生成甘油葡萄糖苷磷酸,随后甘油葡萄糖苷磷酸又被甘油葡萄糖苷磷酸磷酸酶 (ggpP基因编码)水解获得GG。ggtA、B、C和D基因编码一个ABC转运蛋白,负责将胞外的GG转运到细胞内;而GgpR是一个抑制ggpS基因转录的转录因子。本实验室前期工作敲除了集胞藻PCC 6803的ggtC和D基因,使得部分GG产物分泌到胞外;在此基础上敲除ggpR,又得到了GG产量进一步提高的藻株ΔggtCDΔggpR[22](以下简称ΔΔ)。虽然通过这些改造,该藻株GG产量提高到约为野生型的3倍,但是离产业化应用的要求仍有不小的距离。
通过前期合作研究,我们发现集胞藻PCC 6803在NaCl胁迫条件下,细胞除了积累GG外还会积累一定含量的甘油;而表达外源的磷酸甘油磷酸酶,可以实现甘油的大量合成[23]。虽然到目前为止集胞藻PCC 6803盐胁迫条件下甘油合成的生化途径还未被报道,不过考虑到GG是由甘油和葡萄糖分子通过糖苷键连接而组成的,甘油有可能就来源于GG的水解。
GgpS催化GG合成的第一步反应,其表达量增加是否会影响集胞藻GG和甘油的合成呢?为了研究GgpS对GG和甘油合成的影响,本研究在ΔΔ藻株的基础上分别过表达了来源于集胞藻PCC 6803或聚球藻PCC 7002的ggpS基因,分析了这些基因工程改造对ΔΔ藻株在不同NaCl浓度下GG和甘油合成方面的影响。
1 材料与方法
1.1试剂
集胞藻PCC 6803突变株ΔΔ由本实验室保存;甘油葡萄糖苷标准品 (50%,W/W) 购自德国Bitop公司;用于分子克隆的试剂盒购自Omega 公司 (美国);DNA 引物在Sangon公司(中国上海) 合成,限制性内切酶购自Fermentas公司 (美国)。
1.2仪器
离子色谱ICS-3000 (DIONEX)、T 6新锐可见光分光光度计 (北京普析通用)、DU800 NUCLEIC ACID/PROTEIN ANALYZER (BECKMAN COULTER)、GXZ-4300智能光照培养箱 (宁波江南仪器厂)。
1.3方法
1.3.1质粒和集胞藻突变株的构建
所有引物见表1。大肠杆菌E. coli DH5α被用作分子克隆的宿主菌。用KpnⅠ+NdeⅠ酶切pXX47[24],回收得到约600 bp的启动子片段PcpcB;将pWD38用相同的内切酶酶切,回收得到约8 kb的载体片段;将以上两个片段连接得到用于过表达集胞藻PCC 6803来源ggpS (以下用6803ggpS表示) 的重组质粒pPM2。
以聚球藻PCC 7002基因组为模板,以7002-ggpS-F/R (表1) 为引物对,PCR扩增得到约1.5 kb的ggpS基因片段,用NdeⅠ和XhoⅠ进行酶切以获得粘性末端;将pPM2质粒用NdeⅠ和XhoⅠ双酶切,以获得7 kb的载体片段;将上述片段连接得到用于过表达聚球藻PCC 7002来源ggpS (以下用7002ggpS表示) 的重组质粒pPM7。
将pPM2和pPM7转化集胞藻ΔΔ,以补加壮观霉素、卡那霉素和氯霉素的BG11固体平板筛选得到转化子。转化子经多轮划线分离、液体传代和PCR鉴定,分别获得分离完全的纯合突变株ΔΔ-PM2和ΔΔ-PM7。
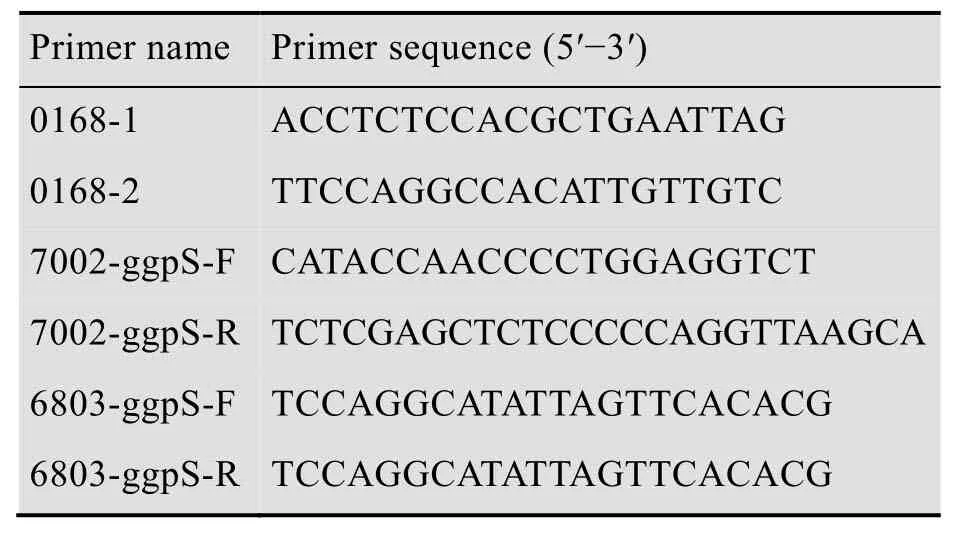
表1 本研究中所用的引物Table 1 Primers used in this study
1.3.2集胞藻藻株的常规培养方法
将集胞藻各突变藻株在BG11固体平板、30 ℃、30 μEm–2·s–1光照强度的条件下日常传代培养。在柱式反应器培养前,先从平板上刮取少量藻细胞至BG11液体培养基中,于30 ℃、30 μEm–2·s–1、140 r/min的条件下振荡培养至对数期;然后再将这些培养物按1∶10 (V/V) 的比例接种到新鲜BG11液体培养基中,在30 ℃、30−50 μEm–2·s–1、通入空气的条件下继续培养至OD730为1.5−2.0。当需要时,加入壮观霉素至20 mg/L、卡那霉素至30 mg/L,氯霉素至10 mg/L。
1.3.3集胞藻藻株的柱式反应器培养方法
将常规液体培养到对数期的培养物,倒入灭菌的柱式光反应器内,接种体积为200 mL,在30 ℃、100 μEm–2·s–1、通入5% CO2(V/V) 的条件下培养;待生长进入平台期 (OD730=8–9)后,加入BG11配制的5 mol/L NaCl溶液至NaCl终浓度为600 mmol/L,然后将藻细胞继续在上述条件下培养,每2天取样1 mL用于监测细胞生长 (新锐,可见光分光光度计T6)。在盐胁迫后的第6天取1 mL藻细胞样品,经12 000 r/min离心5 min,将得到的上清液用0.45 μm微孔滤膜过滤,并稀释后用于离子色谱检测。
1.3.4GG和甘油的测定方法
离子色谱ICS-3000 (DIONEX) 检测样品GG含量参考文献[22]中描述进行。检测器为配套的电化学检测器 (DIONEX) ,使用内径为4 mm × 250 mm 的carbPac®A1柱;淋洗液为800 mmol/L NaOH,流速为0.4 mL/min。
2 结果与分析
2.1过表达ggpS的重组质粒构建
PcpcB启动子是目前被鉴定在集胞藻中具有最强启动活性的启动子;使用该启动子,外源蛋白的表达量能达到集胞藻PCC 6803可溶性蛋白的15%[25]。本实验室使用该启动子驱动乙烯合成酶在集胞藻PCC 6803表达亦获得了优于其他启动子的效果[23]。因此,我们选择用PcpcB启动子驱动ggpS基因在ΔΔ藻株过量表达。

表2 本研究中所用的质粒Table 2 Plasmids used in this study
通过酶切将PcpcB启动子从pXX47载体[23]中切下,插入到实验室之前构建的pWD38载体,即获得了用于过表达集胞藻PCC 6803来源的ggpS基因的载体pPM2。该载体具有slr0168中性位点上下游片段,用于转化蓝藻后整合到基因组中;而slr0168同源片段中间带有氯霉素抗性基因片段,用于转化蓝藻后筛选蓝藻转化子;同时同源片段之间的片段,用于在整合到蓝藻基因组后驱动6803ggpS基因过表达。另外,通过PCR扩增获得了来源于聚球藻PCC 7002的7002ggpS基因,并以其替换pPM2载体上的6803ggpS基因获得了质粒pPM7。
2.2过表达6803ggpS或7002ggpS的藻株基因型鉴定
由于蓝藻基因组具有多倍性[27],通过转化获得转化子需要在抗生素选择压力下多轮传代分离才可获得纯合的突变体。在本研究中,我们选择同源整合位点两侧序列匹配的引物0168-1/2通过PCR确定转化子基因组slr0168位点是否有外源片段整合;同时选择ggpS基因特异引物 (6803-ggpS-F或7002-ggpS-F) PCR以确认外源ggpS基因导入并整合在slr0168位点。从图1的PCR结果 (泳道1−4) 可见,对照野生型藻株slr0168位点没有外源基因导入,其PCR条带长度为0.5 kb (泳道1);而ΔΔ-PM2藻株PCR条带约为3.8 kb,却没有对照ΔΔ藻株的0.5 kb条带 (泳道2)。这证明ΔΔ-PM2藻株slr0168位点有约3.3 kb外源片段的插入且基因组分离完全;以6803-ggpS-F/0168-2引物对PCR扩增得到约为1.5 kb条带,证明6803ggpS基因整合到了ΔΔ-PM2藻株的slr0168位点。图1 (泳道5–8) 的PCR结果也证明ΔΔ-PM7藻株slr0168位点已被成功导入来源于聚球藻PCC 7002的7002ggpS基因,而且藻株基因组分离完全,是纯合的突变株。
2.3ggpS基因过量表达对盐胁迫下集胞藻细胞GG合成的影响
ΔΔ在600 mmol/L NaCl胁迫第6天后GG分泌量约为110 mg/L,这与本实验室之前报道的实验结果[22]基本吻合;而在900 mmol/L NaCl胁迫下,ΔΔ藻株GG分泌量略有提高。但是与ΔΔ藻株相比,在600 mmol/L NaCl胁迫条件下ΔΔ-PM2和ΔΔ-PM7藻株GG合成甚至还略有降低 (分别减少8%和7%);在900 mmol/L NaCl胁迫条件下ΔΔ-PM2藻株GG合成量略有提高(10%),但是并不显著 (P>0.05),而ΔΔ-PM7藻株GG合成量约减少4% (图2A)。因此,在ΔΔ藻株中分别过表达来自于集胞藻PCC 6803和聚球藻PCC 7002的ggpS基因,并未进一步提高藻株的GG合成。
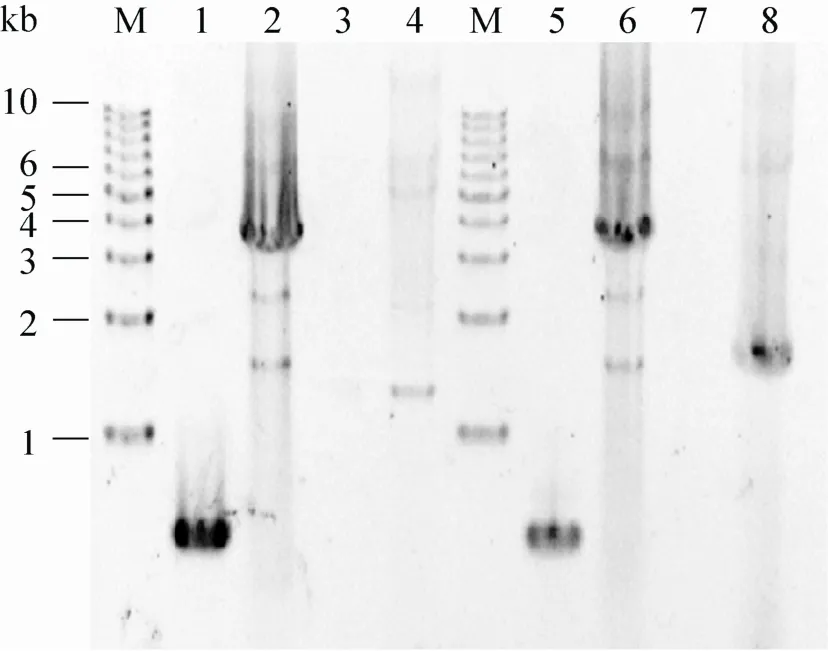
图1 PCR检测集胞藻突变藻株基因型Fig. 1 Genotype determination of Synechocystis mutants by PCR. 1, 3, 5 and 7: wild type genome DNA was used as template. 2 and 4: ΔΔ-PM2 genome DNA was used as template. 6 and 8: ΔΔ-PM7 genome DNA was used as template. Primers 0168-1 and 0168-2 were used in lane 1, 2, 5 and 6. Primers 0168-2 and 6803-ggpS-F were used in lane 3 and 4. Primers 0168-2 and 7002-ggpS-F were used in lane 7 and 8.
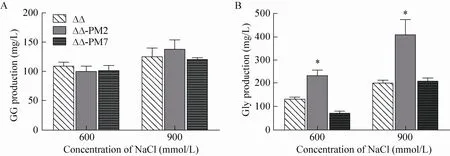
图2 盐胁迫第6天各突变株在不同盐浓度下GG (A) 和甘油合成量 (B)Fig. 2 GG (A) and glycerol (B) production in different mutant strains cultured under salt-stressed conditions for 6 days. The glycerol production that was significantly improved compared with the ΔΔ mutant was indicated as star.
如前所述,GG是集胞藻PCC 6803响应外界盐胁迫刺激而合成的一种渗透保护物质,其合成途径关键基因ggpS的转录受到转录调控因子GgpR[27]、Slr1588[28]以及染色体DNA超螺旋程度[28]等的多重调控。另外,Stirnberg等发现在集胞藻PCC 6803中过表达ggpS,虽然GgpS蛋白含量明显提高,但是在没有NaCl胁迫刺激的条件下细胞仍然不能大量合成GG;而如果敲除ftsH2基因,在盐胁迫条件下即使ggpS正常受诱导转录、GgpS蛋白含量甚至还高于野生型藻株,但是其GgpS酶活性和GG合成却显著低于野生型[30]。所以,集胞藻PCC 6803 GgpS蛋白还受到DNA-蛋白相互作用[29]、FtsH蛋白酶修饰[30]等翻译后修饰调控。集胞藻PCC 6803正是通过这些不同层次的调控手段保证了细胞只在需要的时候合成GG,并将GG含量保持在所需要的水平。因此,本研究利用强启动子驱动了ggpS表达,但是这并不能解除宿主细胞对GgpS蛋白在翻译后水平的调控;过量表达的蛋白并未被激活,可能是GG合成没有明显提高的主要原因。
2.4ggpS基因过量表达对盐胁迫下集胞藻细胞甘油合成的影响
与之前报道[23]采用200 mmol/L NaCl胁迫条件不同,本研究中采用600和900 mmol/L NaCl胁迫条件;而在这两种条件下,集胞藻ΔΔ藻株甘油合成量均高于文献报道,达到133和199 mg/L (图2B),这说明甘油的合成在一定范围内随着NaCl浓度增加而提高。过表达6803ggpS之后,甘油合成相对于ΔΔ藻株显著增加:在600 mmol/L NaCl胁迫条件下提高了79% (*P<0.05),而在900 mmol/L NaCl胁迫条件下提高了105% (*P<0.05)。而过表达7002ggpS之后,甘油合成相对于ΔΔ藻株没有显著提高。
当培养基中NaCl浓度从600提高到900 mmol/L后,6803ggpS过表达菌株ΔΔ-PM7的甘油积累量又进一步提高约75% (图2B)。甘油含量随NaCl浓度提高而增加的现象,提示我们甘油可能也在集胞藻PCC 6803盐胁迫适应中发挥着某种作用。如前所述,我们推测甘油合成来自于GG的水解。因此,过表达6803ggpS很可能已短暂提高了细胞内的GG含量,但是宿主细胞感应到GG水平的变化,于是启动GG水解酶表达以将细胞内GG含量维持在所需要的水平。这提示我们要想在ΔΔ藻株基础上通过过表达ggpS提高GG产量还需要先鉴定和敲除负责GG分解的关键酶;而如果希望得到的目标产物是甘油,那么过表达ggpS和GG分解酶也将是有效的手段。
3 结论
ggpS基因编码甘油葡萄糖苷磷酸合成酶,该酶催化集胞藻PCC6803 GG合成途径的关键步骤;敲除该基因,细胞不能合成GG,并对盐胁迫敏感。在本研究中,来源于集胞藻PCC 6803和聚球藻PCC 7002的ggpS基因分别在高产GG 的ΔΔ藻株中得到过表达,但是这一改造未能进一步提高GG的合成,但是显著提高了甘油的合成。另外,提高培养基盐浓度也被证实可以进一步促进甘油的积累。相关实验结果为将来进一步基因工程改造集胞藻以提高GG和甘油合成指明了方向。
REFERENCES
[1] Kaneko T, Tabata S. Complete genome structure of the unicellular cyanobacterium Synechocystis sp. PCC6803. Plant Cell Physiol, 1997, 38(11): 1171–1176.
[2] Yu Y, You L, Liu D, et al. Development of Synechocystis sp. PCC 6803 as a phototrophic cell factory. Mar Drugs, 2013, 11(8): 2894–2916.
[3] Bernát G, Waschewski N, Rögner M. Towards efficient hydrogen production: the impact of antenna size and external factors on electron transport dynamics in Synechocystis PCC 6803. Photosynth Res, 2009, 99(3): 205–216.
[4] Gao ZX, Zhao H, Li ZM, et al. Photosynthetic production of ethanol from carbon dioxide in genetically engineered cyanobacteria. Energy Environ Sci, 2012, 5(12): 9857–9865.
[5] Zhu T, Xie X, Li Z, et al. Enhancing photosynthetic production of ethylene in genetically engineered Synechocystis sp. PCC 6803. Green Chem, 2015, 17(1): 421–434.
[6] Lindberg P, Park S, Melis A. Engineering a platform for photosynthetic isoprene production in cyanobacteria, using Synechocystis as the model organism. Metab Eng, 2009, 12(1): 70–79.
[7] van der Woude AD, Angermayr SA, Puthan Veetil V, et al. Carbon sink removal: Increased photosynthetic production of lactic acid by Synechocystis sp. PCC6803 in a glycogen storage mutant. J Biotechnol, 2014, 184: 100–102.
[8] Zhou J, Zhang HF, Meng HK, et al. Production of optically pure D-lactate from CO2by blocking the PHB and acetate pathways and expressing D-lactate dehydrogenase in cyanobacterium Synechocystis sp. PCC 6803. Process Biochem, 2014, 49(12): 2071–2077.
[9] Du W, Liang F, Duan Y, et al. Exploring the photosynthetic production capacity of sucrose by cyanobacteria. Metab Eng, 2013, 19(10): 17–25.
[10] Liu X, Sheng J, Curtiss III R. Fatty acid production in genetically modified cyanobacteria. Proc Natl Acad Sci USA, 2011, 108(17): 6899–6904.
[11] Yao L, Qi F, Tan X, et al. Improved production of fatty alcohols in cyanobacteria by metabolic engineering. Biotechnol Biofuels, 2014, 7(1): 94–99.
[12] Wang W, Liu X, Lu X. Engineering cyanobacteria to improve photosynthetic production of alka(e)nes. Biotechnol Biofuels, 2013, 6(1): 69–74.
[13] Sawangwan T, Goedl C, Nidetzky B. Glucosylglycerol and glucosylglycerate as enzyme stabilizers. Biotechnol J, 2010, 5(2): 187–191.
[14] Klein J, Stumm G. Use of glucosylglycerol: US, 20110207681 A1. 2011-08-25.
[15] Takenaka F, Uchiyama H, Imamura T. Identification of α-D-glucosylglycerol in sake.Biosci Biotechnol Biochem, 2000, 64(2): 378–385.
[16] Krutmann J, Lentzen G, Schwarz T. Osmolytes for the treatment of allergic or viral respiratory diseases: US, 20110053896 A1. 2011-03-03.
[17] Aizawa Kyo ST, Yasuhiro K, Koushi I, et al. Keratoconjunctival protecting agent, or keratoconjunctival disorder inhibiting agent: WO/2013/077433. 2013-05-30.
[18] Okumura Hidenobu US. Blood glucose level suppressant and food inhibiting sharp increase in blood glucose level: JP, JP2004–331576. 2004-11-25.
[19] Goedl C, Sawangwan T, Mueller M, et al. A high-yielding biocatalytic process for the production of 2-O-(α-D-glucopyranosyl)-sn-glycerol, a natural osmolyte and useful moisturizing ingredient. Angew Chem Int Ed, 2008, 47(52): 10086–10089.
[20] Roder A, Hoffmann E, Hagemann M, et al. Synthesis of the compatible solutes glucosylglycerol and trehalose by salt-stressed cells of Stenotrophomonas strains. FEMS Microbiol Lett, 2005, 243(1): 219–226.
[21] Hagemann M. Molecular biology of cyanobacterial salt acclimation. FEMS Microbiol Rev, 2011, 35(1): 87–123.
[22] Tan XM, Du W, Lu XF. Photosynthetic and extracellular production of glucosylglycerol by genetically engineered and gel-encapsulated cyanobacteria. Appl Microbiol Biotechnol, 2015, 99(5): 2147–2154.
[23] Savakis P, Tan XM, Du W, et al. Photosynthetic production of glycerol by a recombinant cyanobacterium. J Biotechnol, 2015, 195: 46–51.
[24] Zhu T, Xie XM, Li ZM, et al. Enhancing photosynthetic production of ethylene in genetically engineered Synechocystis sp. PCC 6803. Green Chem, 2015, 17(1): 421–434.
[25] Zhou J, Zhang H, Meng H, et al. Discovery of a super-strong promoter enables efficient production of heterologous proteins in cyanobacteria. Sci Rep, 2014, 4(11): 4500–4507. [26] Griese M, Lange C, Soppa J. Ploidy in cyanobacteria. FEMS Microbiol Lett, 2011, 323(2): 124–131.
[27] Klähn S, Höhne A, Simon E, et al. The gene ssl3076 encodes a protein mediating the salt-induced expression of ggpS for the biosynthesis of the compatible solute glucosylglycerol in Synechocystis sp. strain PCC 6803. J Bacteriol, 2010, 192(17): 4403–4412.
[28] Chen L, Wu LN, Zhu Y, et al. An orphan two-component response regulator Slr1588 involves salt tolerance by directly regulating synthesis of compatible solutes in photosynthetic Synechocystis sp. PCC 6803. Mol BioSyst, 2014, 10(7): 1765–1774.
[29] Prakash JSS, Sinetova M, Zorina A, et al. DNA supercoiling regulates the stress-inducible expression of genes in the cyanobacterium Synechocystis. Mol BioSyst, 2009, 5(12): 1904–1912.
[30] Stirnberg M, Fulda S, Huckauf J, et al. A membrane-bound FtsH protease is involved in osmoregulation in Synechocystis sp. PCC 6803: the compatible solute synthesizing enzyme GgpS is one of the targets for proteolysis. Mol Microbiol, 2007, 63(1): 86–102.
(本文责编陈宏宇)
Effects of ggpS over-expression on glycosylglycerol and glycerol biosynthesis of Synechocystis sp. PCC 6803
Peizhen Ma1,2, Xiaoming Tan2, Xuefeng Lü2, and Jiyuan Tian1
1 College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, Shandong, China
2 Key Laboratory of Biofuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong, China
Abstract:To study the roles of glucosylglycerol phosphate synthase (Ggps) in glucosylglycerol (GG) and glycerol biosynthesis, we over-expressed Ggps from either Synechocystis sp. PCC 6803 or Synechococcus sp. PCC 7002 in a Synechocystis strain with a high GG titer, and determined the GG and glycerol accumulation in the resultant mutants grown under different NaCl-stress conditions. Ion chromatography results revealed that GG yield was not improved, but glycerol production was significantly enhanced by over-expression of Ggps from Synechocystis sp. PCC 6803 (6803ggpS). In addition, increasing the NaCl concentration of medium from 600 to 900 mmol/L led to a further 75% increase of glycerol accumulation in the mutant strain with 6803ggpS over-expression. These findings show the role of ggpS in driving the carbon flux to the glycerol biosynthesis pathway, and will be helpful for further improvement of GG and glycerol production in Synechocystis.
Keywords:glucosylglycerol, glycerol, Synechocystis sp. PCC 6803, ggpS, genetic engineering
Corresponding author:Jiyuan Tian. Tel: +86-532-80662715; E-mail: jytian_75@qau.edu.cn
