miRNA- 30c及其靶基因MTA- 1在子宫内膜癌裸鼠皮下移植瘤中的作用
2016-06-22孔祥怡周怀君
孔祥怡,周怀君
(南京大学医学院附属鼓楼医院 妇产科,江苏 南京 210008)
miRNA- 30c及其靶基因MTA- 1在子宫内膜癌裸鼠皮下移植瘤中的作用
孔祥怡,周怀君
(南京大学医学院附属鼓楼医院 妇产科,江苏 南京210008)
[摘要]目的:探讨过表达miRNA- 30c对子宫内膜癌裸鼠皮下移植瘤生长的影响。方法:应用子宫内膜癌Ishikawa细胞系建立子宫内膜癌裸鼠皮下移植瘤模型,予裸鼠皮下移植瘤内多点注射miRNA- 30c前体表达质粒,并以阴性质粒及PBS为对照。测量移植瘤体积,计算肿瘤生长抑制率;荧光定量PCR技术检测移植瘤组织miRNA- 30c表达水平;蛋白质印迹技术检测移植瘤组织MTA- 1蛋白表达水平;免疫组化技术检测移植瘤组织E- cadherin表达及微血管密度(MVD)。结果:成功建立子宫内膜癌裸鼠皮下移植瘤模型,miRNA- 30c质粒治疗明显抑制肿瘤生长,抑制率为(46.98±5.13)%(P<0.01);上调移植瘤组织中miRNA- 30c的表达(P<0.05),下调MTA- 1蛋白表达(P<0.05),下调移植瘤组织MVD(P<0.05),上调移植瘤组织E- cadherin表达(P<0.05)。结论:过表达miRNA- 30c可以通过下调MTA- 1表达明显抑制子宫内膜癌裸鼠皮下移植瘤的生长。
[关键词]miRNA- 30c; 子宫内膜癌; 裸鼠; 移植瘤
微小RNA(miRNA)是一类广泛存在于真核细胞中的由内源性基因编码的长度为18~25个核苷酸的非编码单链RNA,不仅参与胚胎早期发育、细胞增殖分化、细胞凋亡等正常生命活动[1],而且可以通过调控细胞的增殖、代谢、分化以及凋亡等行为影响肿瘤的发生发展及侵袭转移[2]。女性生殖道恶性肿瘤之一的子宫内膜癌近年来发病率在世界范围内呈持续上升趋势,在西方国家已经成为发病率最高的妇科肿瘤[3]。子宫内膜癌与miRNA的相关研究逐渐增多,目前有研究证实miR- 30c[4]以肿瘤转移相关基因1(MTA- 1)为靶基因,上调miR- 30c(miR- 30c)表达可以下调Ishikawa及HEC- 1B细胞系中靶基因mRNA及蛋白质的表达,抑制细胞增殖及迁移侵袭能力[4- 5]。本实验通过构建子宫内膜癌裸鼠皮下移植瘤模型探讨过表达miR- 30c在动物体内对于移植瘤生长的影响,进一步探究miR- 30c在子宫内膜癌中的作用。
1材料与方法
1.1材料
子宫内膜癌Ishikawa细胞株由北京大学医学院魏丽惠教授惠赠。BALB/c nunu雌性裸鼠18只,14~15周龄,购于南京大学动物模式中心[许可证号:SCXK(苏)2009- 0017],由鼓楼医院动物房饲养,SPF级。DMEM高糖培养基、胎牛血清(GIBCO公司),miR- 30c前体表达质粒(pRNAT- CMV3.2- Neo- miR- 30c)及阴性质粒(pRNAT- CMV3.2- neg)(GeneScript公司),质粒大提试剂盒(Tiangen公司),LipofectamineTM 2000(Invitrogen公司),MTA- 1一抗(ab50263)(Abcam公司),GAPDH一抗(Bioworld Technology公司),山羊抗小鼠HRP标记抗体(Bioworld Technology公司),兔抗山羊免疫组化抗体(武汉博士德公司),PrimeScript® RT reagent Kit、SYBR® RT reagent Kit(Takara公司)。
1.2方法
1.2.1Ishikawa细胞的培养及裸鼠皮下移植瘤模型的建立在37 ℃、体积分数为5%的 CO2、饱和湿度条件下,于含 10 % 胎牛血清的DMEM高糖培养基中培养Ishikawa细胞,将处于对数期生长的细胞常规胰酶消化,1 500 r·min-1离心5 min收集细胞。PBS重悬计数,调整细胞浓度为5×107个·ml-1。每只裸鼠右侧肩胛区皮下注射细胞悬液200 μl,注射后观察皮下出现局部包块,无出血、破溃。
1.2.2质粒的扩增及提取miR- 30c前体表达质粒(pRNAT- CMV3.2- Neo- miR- 30c)以及阴性质粒(pRNAT- CMV3.2- Neo)由GeneScript公司构建合成,并转化大肠杆菌。将1 ml含有质粒的大肠杆菌菌液加入4 ml LB培养基中于摇床上(37 ℃180 r·min-1)摇至浑浊,再在100 ml LB培养基中扩大培养,摇菌过夜至浑浊。应用质粒大提试剂盒(Tiangen公司)按照说明书提取质粒,并用紫外分光光度计测质粒DNA浓度。
1.2.3荷瘤裸鼠分组治疗及处理待肿瘤体积到60 mm3时随机分为miR- 30c治疗组、miR- N对照组及PBS对照组3组,每组6只。质粒与LipofectamineTM 2000按质量体积比1∶2混合,以Opti- MEM稀释至体积为150 μl,并以150 μl PBS为空白治疗,分别瘤内多点注射,每3 d 1次,共7次。期间每天观察裸鼠一般状况,记录各组裸鼠的进食、活动反应、皮肤毛发情况,每3 d称量体重1次并测量皮下移植瘤长、短径,计算体积[体积(mm3)=长径(mm)×短径2(mm)×1/2]。末次治疗后3 d脱颈处死裸鼠,剥离肿瘤,测量肿瘤体积、质量,计算肿瘤生长抑制率[抑瘤率(%)=(1-治疗组平均瘤体体积/空白对照组平均瘤体体积)×100%]。
1.2.4荧光定量PCR(Realtime- PCR)检测肿瘤组织miR- 30c表达水平用Trizol法提取移植瘤组织中的总RNA,紫外分光光度计测定 RNA 浓度,取2 μg总RNA逆转录成cDNA。再取2 μg cDNA进行实时荧光定量PCR反应,扩增条件:95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 34 s,40个循环。引物序列如下:microRNA- 30c(RT)5′- GTCGTATCCAGTGCAGGGTCCGAGGTATT CGCACTGGATACGACGCTGA- 3′,microRNA- 30c(FW)5′- GCCGCTGTAAACATCCTACACT- 3′,microRNA- 30c(RW)5′- GTGCAGGGTCCGAGGT- 3′,U6(FW)5′- CT CGCTTCGGCAGCACA- 3′,U6(RW)5′- AACGCTTCACG AATTTGCGT- 3′。相对表达量采用公式RQ=2- △△Ct,Ct是荧光达到荧光阈值的循环数,△△Ct=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。
1.2.5蛋白质印迹法检测移植瘤组织MTA- 1蛋白表达水平应用RIPA蛋白裂解液提取移植瘤组织中的总蛋白,BCA蛋白测定试剂盒测定总蛋白浓度,上样量50 μg。10%聚丙烯酰胺凝胶电泳后将蛋白转移至PVDF膜, 用10%脱脂奶粉封闭2 h。分别加入MTA- 1一抗(1∶500)和GAPDH一抗(1∶10 000)4 ℃过夜后室温孵育4 h。TBST漂洗6次(5、5、10、10、15、15 min)后加入二抗(1∶10 000)室温孵育2 h,TBST漂洗6次(5、5、10、10、15、15 min)。ECL试剂显色,暗室中进行 X 线胶片曝光,拍照光密度扫描条带,检测各组中MTA- 1和 GAPDH 所对应条带的A值,对AMTA- 1/AGAPDH的值进行统计学分析。
1.2.6免疫组化检测移植瘤组织相应蛋白的表达石蜡切片常规处理至抗原修复,5%BSA封闭20 min,vWF、E- cadherin一抗4 ℃过夜孵育,PBS冲洗3次后滴加生物素标记的二抗,37 ℃孵育30 min后DAB试剂显色,苏木素复染后封片。针对vWF抗体染色行微血管密度(MVD)计数,具体方法即先在40倍镜下观察整张切片的血管分布情况,选择切片中棕黄颗粒最密集的3个区域(即“热点”),在200倍镜下计数每个区域中vWF阳性细胞,求其平均值。针对E- cadherin抗体染色于400倍光镜下随机取5个视野对阳性染色进行观察,计算E- cadherin阳性染色细胞的百分率。
1.3统计学处理
2结果
2.1过表达miR- 30c抑制裸鼠移植瘤生长
成功建立裸鼠皮下移植瘤模型,种瘤后7~10 d皮下移植瘤逐渐形成,待14 d左右肿瘤体积约60 mm3后开始不同的干预治疗。治疗过程中3组裸鼠在负瘤初期一般状态逐渐变差,随着肿瘤增长及治疗次数增加治疗组裸鼠一般状态逐渐稳定,而两对照组裸鼠一般状态继续变差,出现消瘦、腹泻等不良反应,实验结束时全部裸鼠存活。治疗结束后3组裸鼠皮下移植瘤体积均较前有所增长,但在第3次治疗后治疗组裸鼠皮下移植瘤的增长速度明显受到抑制(图1),在第7次治疗后3 d处死裸鼠获得离体移植瘤标本,测量其体积及质量发现治疗组移植瘤体积及质量均明显小于两对照组(图2、表 1)。通过以上实验结果证实miR- 30c质粒可以有效抑制裸鼠皮下移植瘤增长。
2.2移植瘤组织中miR- 30c的表达
成功建立裸鼠皮下移植瘤模型后分组对其进行瘤内注射治疗,末次治疗后3 d脱颈处死裸鼠,剥离肿瘤,用Trizol法提取移植瘤组织中的总RNA,紫外分光光度计测定RNA浓度,取2 μg总RNA逆转录成cDNA进行Realtime- PCR实验。实验结果显示miR- 30c治疗组移植瘤组织中miR- 30c表达明显高于其他两组(图3),提示miR- 30c质粒瘤内注射治疗能够上调移植瘤组织中miR- 30c表达。

aP<0.05,bP<0.01
图13组裸鼠皮下移植瘤体积增长趋势
Fig 1The growth of xenograft in three groups

图2末次治疗后3组裸鼠皮下移植瘤离体状态
Fig 2The xenograft after treatment in three groups
表1 末次治疗后3组裸鼠皮下移植瘤体积、质量及抑瘤率
Tab 1The volume, weight of xenograft and inhibitory rate in three groups after the last treatment
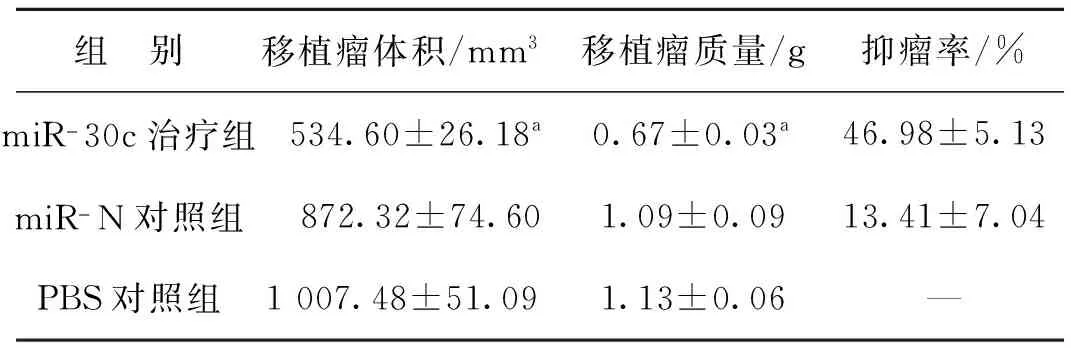
组 别移植瘤体积/mm3移植瘤质量/g抑瘤率/%miR-30c治疗组534.60±26.18a0.67±0.03a46.98±5.13miR-N对照组872.32±74.601.09±0.0913.41±7.04PBS对照组1007.48±51.091.13±0.06—
a 与对照组比,P<0.01
2.3移植瘤组织中MTA- 1蛋白的表达
成功建立裸鼠皮下移植瘤模型后分组对其进行瘤内注射治疗,末次治疗后3 d脱颈处死裸鼠,剥离肿瘤,应用RIPA蛋白裂解液提取移植瘤组织中的总蛋白,BCA蛋白测定试剂盒测定总蛋白浓度,上样量50 μg进行蛋白质印迹实验。实验结果显示,miR- 30c治疗组移植瘤组织中MTA- 1蛋白表达明显低于其他两组。移植瘤组织中miR- 30c表达后可以明显下调移植瘤组织中MTA- 1蛋白表达。见图4。

aP<0.05
图3各组移植瘤组织中miR- 30c表达水平
Fig 3The miR- 30c expression of xenograft in three groups
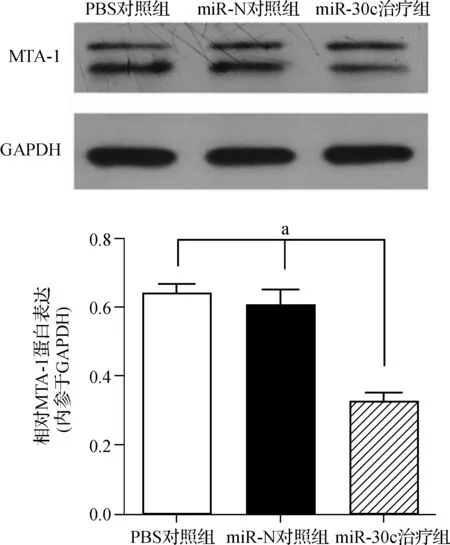
aP<0.05
图4各组裸鼠移植瘤组织MTA- 1蛋白相对表达
Fig 4The relative MTA- 1 expression of xenograft in three groups
2.4移植瘤组织中MVD及E- cadherin蛋白的表达
对各组裸鼠移植瘤组织进行免疫组化实验,针对vWF抗体染色行MVD计数,结果显示miR- 30c治疗组肿瘤组织中vWF表达较其他两组表达减弱,MVD减少,提示miR- 30c治疗可以下调移植瘤组织中vWF蛋白表达,抑制新生血管形成。针对E- cadherin抗体染色结果显示在miR- 30c治疗组中E- cadherin蛋白细胞表达阳性率明显高于其他两组(图5、表2)。综合以上实验结果提示,miR- 30c过表达可以抑制移植瘤血管形成及上皮-间质转化。
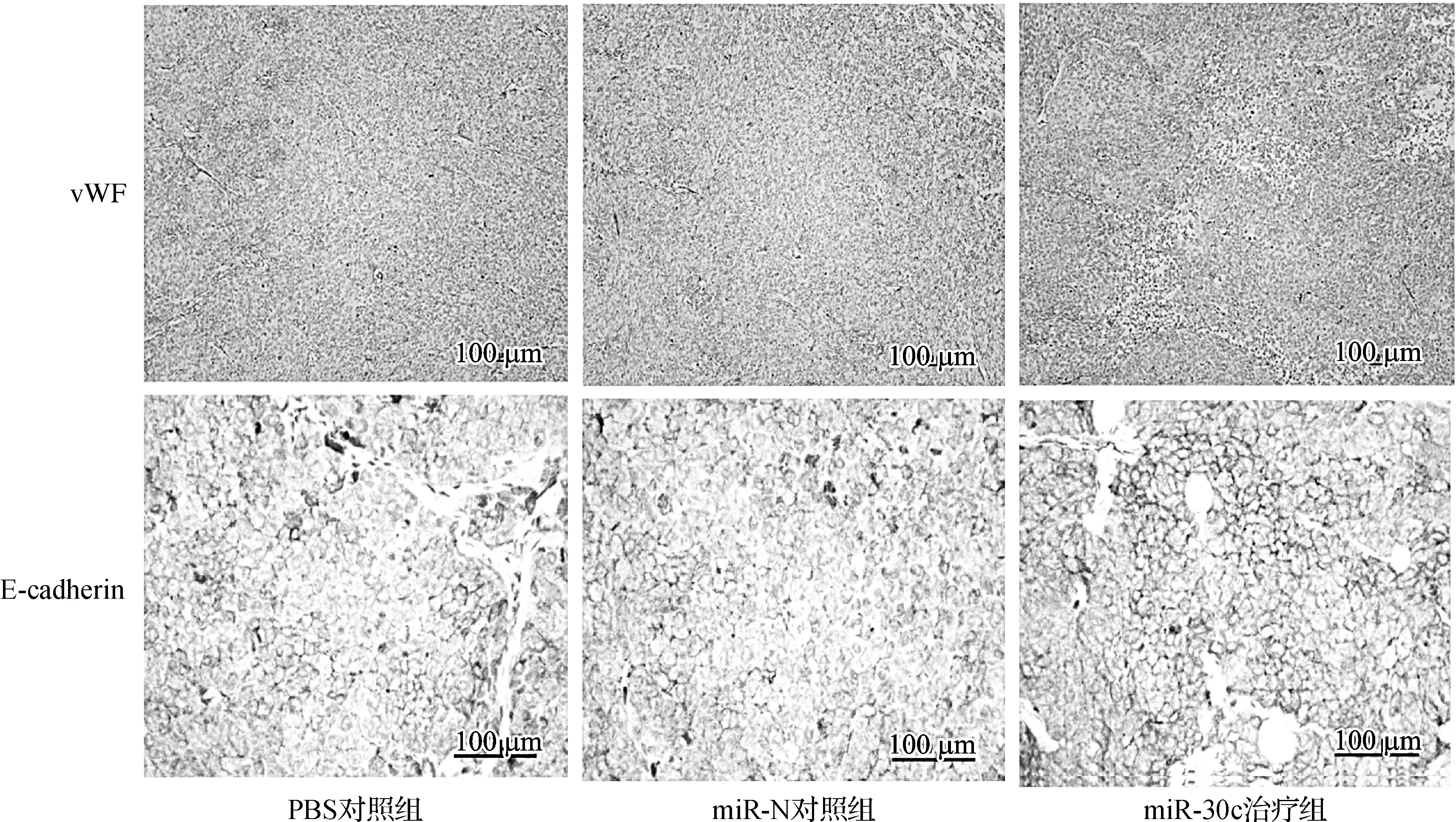
图5各组移植瘤组织中MVD及E- cadherin蛋白表达情况
Fig 5The MVD and E- cadherin expression of xenograft in three groups
表2各组移植瘤组织中MVD及E- cadherin蛋白表达情况
Tab 2The MVD and E- cadherin expression of xenograft in three groups
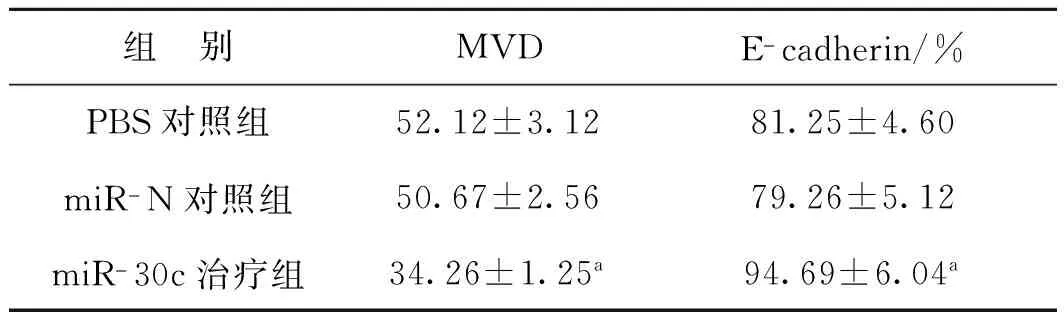
组 别MVDE-cadherin/%PBS对照组52.12±3.1281.25±4.60miR-N对照组50.67±2.5679.26±5.12miR-30c治疗组34.26±1.25a94.69±6.04a
a 与对照组比,P<0.05
3讨论
miR- 30c是miRNA- 30家族中的一员,研究发现miR- 30c在子宫内膜癌[6]、乳腺癌[7]、前列腺癌[8]、甲状腺癌[9]、结肠癌[10]及肝癌[11]等恶性肿瘤组织中均低表达于相应的正常组织,且在发生淋巴结转移的甲状腺癌肿瘤组织中低表达于早期甲状腺癌肿瘤组织[9],另外低表达miR- 30c与乳腺癌患者发生三苯氧胺耐药及较差的预后[12- 13]以及肾脏透明细胞癌患者较短的无进展存活率相关[14],提示miR- 30c的低表达与肿瘤的发生及进展存在密切关系。进一步的研究发现在卵巢癌中miR- 30c通过作用于转录活化因子3(ATF3)调节溶血磷脂酸通路调控肿瘤进展[15],在肝癌中以IER2为靶基因调控肿瘤细胞的迁移侵袭能力[16],在结肠癌中调节去整合素金属基质蛋白酶19(ADAM19)表达调控肿瘤的生长及转移[10],进一步揭示了miR- 30c的抑癌作用。然而另一些研究显示miR- 30c在间皮瘤细胞中高表达[17],在卵巢癌组织中高表达于良性卵巢肿瘤组织及交界性肿瘤组织[18],并且与恶性间皮瘤患者较差的预后[17]及肺癌患者的化疗抵抗相关[19],说明miR- 30c在肿瘤的发生发展中同样具有促进作用,这可能与肿瘤发生的组织特异性及发病原因不同有关,然而具体机制仍然需要进一步探究。
我们已经证实miR- 30c在子宫内膜癌组织中低表达于正常内膜组织,并通过荧光素酶报告实验证实了是miR- 30c直接作用于MTA- 1抑制其表达,从而抑制子宫内膜癌细胞株的增殖及侵袭能力[4- 5],提示miR- 30c- MTA- 1通路在子宫内膜癌细胞水平的调控中起着重要作用。为进一步探究miR- 30c- MTA- 1通路的作用本研究建立了裸鼠皮下移植瘤模型,并通过miR- 30c质粒的瘤内治疗发现miR- 30c质粒可以有效上调移植瘤组织中miR- 30c的表达,下调MTA- 1蛋白,并能够抑制裸鼠皮下移植瘤组织生长及新生血管的形成,提示在裸鼠模型中上调miR- 30c的表达可以有效抑制肿瘤的进展,与我们的细胞水平研究结果一致。
MTA- 1在子宫内膜癌组织中低表达[20],并作为致癌基因参与调控乳腺癌[21]、结肠癌[22]等肿瘤的进展,有研究显示MTA- 1通过下调E- cadherin的表达促进上皮-间质转化从而增加食管癌细胞的转移能力[23]。我们已经证实上调miR- 30c表达在下调MTA- 1表达同时可以抑制子宫内膜癌细胞株的迁移、侵袭能力。本研究对裸鼠移植瘤组织进行了免疫组化实验,结果表明miR- 30c下调MTA- 1表达的同时降低了肿瘤组织中MVD的形成,并增加了E- cadherin染色阳性率,而新生血管的形成及上皮-间质转化是肿瘤发生侵袭、转移的重要条件,并且上皮-间质转化的发生与子宫内膜癌的进展密切相关[24],这提示MTA- 1在子宫内膜癌中可能通过调节微血管的新生及上皮-间质转化影响肿瘤的转移,参与调解肿瘤的进展。
综上所述,miR- 30c及其靶基因MTA- 1在子宫内膜癌组织生长及侵袭、转移过程中起着重要的调节作用,为进一步研究其具体调节机制及进一步探寻以miR- 30c- MTA- 1通路为靶点的新型靶向治疗方法奠定了基础,为临床治疗提供了新的方向。
[参考文献]
[1] INUI M,MARTELLO G,PICCOLO S.MicroRNA control of signal transduction[J].Nat Rev Mol Cell Biol,2010,11(4):252- 263.
[2] LAM E W,SHAH K,BROSENS J J.The diversity of sex steroid action:the role of micro- RNAs and FOXO transcription factors in cycling endometrium and cancer[J].J Endocrinol,2012,212(1):13- 25.
[3] JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69- 90.
[4] ZHOU H J,XU X F,XUN Q Y,et al.microRNA- 30c negatively regulates endometrial cancer cells by targeting metastasis- associated gene- 1[J].Oncol Rep,2012,27(3):807- 812.
[5] KONG X Y,XU X F,YAN Y H,et al.Estrogen regulates the tumour suppressor MiRNA- 30c and its target gene,MTA- 1,in endometrial cancer[J].PLoS One,2014,9:90810.
[6] YANOKURA M,BANNO K,IIDA M,et al.MicroRNAS in endometrial cancer:recent advances and potential clinical applications[J].Excli J,2015,14:190- 198.
[7] LI S,YANG C,ZHAI L,et al.Deep sequencing reveals small RNA characterization of invasive micropapillary carcinomas of the breast[J].Breast Cancer Res Treat,2012,136(1):77- 87.
[8] HUANG Z,ZHANG L,YI X,et al.Diagnostic and prognostic values of tissue hsa- miR- 30c and hsa- miR- 203 in prostate carcinoma[J/OL].T Tumour Biol,2015,doi:10.1007/s13277-
015- 4262- 9.
[9] SAISELET M,GACQUER D,SPINETTE A,et al.New global analysis of the microRNA transcriptome of primary tumors and lymph node metastases of papillary thyroid cancer[J].BMC Genomics,2015,16:828.
[10] ZHANG Q,YU L,QIN D,et al.Role of microRNA- 30c targeting ADAM19 in colorectal cancer[J].PLoS One,2015,10(3):e0120698.
[11] LIU D,WU J,LIU M,et al.Downregulation of miRNA- 30c and miR- 203a is associated with hepatitis C virus core protein- induced epithelial- mesenchymal transition in normal hepatocytes and hepatocellular carcinoma cells[J].Biochem Biophys Res Commun,2015,464(4):1215- 1221.
[12] RODRIGUEZ- GONZALEZ F G,SIEUWERTS A M,SMID M,et al.MicroRNA- 30c expression level is an independent predictor of clinical benefit of endocrine therapy in advanced estrogen receptor positive breast cancer[J].Breast Cancer Res Treat,2011,127(1):43- 51.
[13] EGELAND N G,LUNDES S,JONSDOTTIR K,et al.The role of MicroRNAs as predictors of response to tamoxifen treatment in breast cancer patients[J].Int J Mol Sci,2015,16(10):24243- 24275.
[14] HEINZELMANN J,HENNING B,SANJMYATAV J,et al.Specific miRNA signatures are associated with metastasis and poor prognosis in clear cell renal cell carcinoma[J].World J Urol,2011,29(3):367- 373.
[15] NGUYEN H T,JIA W,BEEDLE A M,et al.Lysophosphatidic acid mediates activating transcription factor 3 expression which is a target for post- transcriptional silencing by miR- 30c- 2- 3p[J].PLoS One,2015,10(9):e0139489.
[16] WU W,ZHANG X,LIAO Y,et al.miR- 30c negatively regulates the migration and invasion by targeting the immediate early response protein 2 in SMMC- 7721 and HepG2 cells[J].Am J Cancer Res,2015,5(4):1435- 1446.
[17] BUSACCA S,GERMANO S,DEL,et al.MicroRNA signature of malignant mesothelioma with potential diagnostic and prognostic implications[J].Am J Respir Cell Mol Biol,2010,42(3):312- 319.
[18] LEE H,PARK C S,DEFTEREOS G,et al.MicroRNA expression in ovarian carcinoma and its correlation with clinicopathological features[J].World J Surg Oncol,2012,10:174.
[19] GAROFALE M,ROMANO G,DI G,et al.EGFR and MET receptor tyrosine kinase- altered microRNA expression induces tumorigenesis and gefitinib resistance in lung cancers[J].Nat Med,2012,18(1):74- 82.
[20] BALASENTHIL S,BROADDUS R R,KUMAR R.Expression of metastasis- associated protein 1 (MTA1) in benign endometrium and endometrial adenocarcinomas[J].Hum Pathol,2006,37(6):656- 661.
[21] NAGARAJ S R,SHILPA P,RACHAIAH K,et al.Crosstalk between VEGF and MTA1 signaling pathways contribute to aggressiveness of breast carcinoma[J].Mol Carcinogen,2015,54(5):333- 350.
[22] TUNCAY C S,CIMEN I,SAVAS B,et al.MTA- 1 expression is associated with metastasis and epithelial to mesenchymal transition in colorectal cancer cells[J].Tumour Biology,2013,34(2):1189- 1204.
[23] WENG W,YIN J,ZHANG Y,et al.Metastasis- associated protein 1 promotes tumor invasion by downregulation of E- cadherin[J].Int J Oncol,2014 ,44(3):812- 818.
[24] 池丽敏,肖鹏,陈定科,等.Vimentin 蛋白在子宫内膜样腺癌组织中的表达及其临床意义[J].现代医学,2015,43(10):1216- 1218.
The function of miRNA- 30c and MTA- 1 in xenograft of endometrial carcinoma in nude mice
KONG Xiang- yi,ZHOU Huai- jun
(DepartmentofGynecologyandObstetrics,NanjingDrumTowerHospitalAffiliatedto
NanjingUniversityMedicalSchool,Nanjing210008,China)
[Abstract]Objective:To investigate the inhibition effect on tumor growth by up- regulating the expression of miRNA- 30c in nude mice model. Methods:Subcutaneous xenografts of mude mice models with Ishikawa cells were established,the mice were treated with miRNA- 30c expression plasmid intratumorally,controled by negative control plasmid and PBS.Then, the xenograft volume was measured and inhibition ratio of tumor proliferation was calculated. Moreover,the expression of miRNA- 30c was analysed by Realtime- PCR and the expression of MTA- 1 protein was analysed by Western blot, the microvessel density and expression of E- cadherin were detected by immunohistochemistry. Results:The subcutaneous xenografts models of mude mice were established successfully.Treatment with miRNA- 30c expression plasmid inhibited the growth of xenograft and the inhibitory rate was(46.98±5.13)%(P<0.01).The expression of miRNA- 30c was up- regulated(P<0.05) and MTA- 1 protein expression was down- regulated (P<0.05)respectively. Immunohistochemistry showed that the microvessel density decreased(P<0.05),the expression of E- cadherin increased(P<0.05). Conclusion:Up- regulation of miRNA- 30c can inhibit the growth of xenograft in nude mice model of endometrial carcinoma by down- regulating MTA- 1.
[Key words]miRNA- 30c; endometrial carcinoma; nude mice; xenograft
[收稿日期]2015- 12- 24[修回日期] 2016- 01- 28
[基金项目]中央高校基本科研业务苗圃项目(021414340294)
[作者简介]孔祥怡(1987-),女,黑龙江牡丹江人,住院医师。E- mail:xiangyikong@126.com
[通信作者]周怀君E- mail:zhouhj2007@126.com
[中图分类号]R737.33; R- 33; R- 332
[文献标识码]A
[文章编号]1671- 6264(2016)03- 0364- 07
doi:10.3969/j.issn.1671- 6264.2016.03.016
[引文格式] 孔祥怡,周怀君.miRNA- 30c及其靶基因MTA- 1在子宫内膜癌裸鼠皮下移植瘤中的作用[J].东南大学学报:医学版,2016,35(3):364- 370.
·论著·
