LSD1和KDM5家族在卵巢癌细胞中的表达及LSD1对细胞增殖迁移的影响
2016-06-22贾超王洁邵根宝陆祖宏
贾超,王洁,邵根宝,陆祖宏
(1. 东南大学生物科学与医学工程学院 生物电子学国家重点实验室,江苏 南京 210096; 2. 南京农业大学
LSD1和KDM5家族在卵巢癌细胞中的表达及LSD1对细胞增殖迁移的影响
贾超1,2,王洁3,邵根宝3,陆祖宏1
(1. 东南大学生物科学与医学工程学院 生物电子学国家重点实验室,江苏 南京 210096; 2. 南京农业大学
动物科技学院,江苏 南京210095; 3.江苏大学 医学院,江苏 镇江212013)
[摘要]目的:研究赖氨酸特异去甲基化酶1(LSD1)和赖氨酸去甲基化酶5家族(KDM5家族成员)在人卵巢癌细胞中的表达,分析LSD1对细胞增殖迁移的影响。方法:在3种卵巢癌细胞株中,分别用RT- PCR检测LSD1、KDM5A、KDM5B、KDM5C、KDM5D的mRNA的表达,蛋白质印迹法检测前4种酶的表达;在人正常卵巢上皮细胞和癌细胞株中,采用蛋白质印迹法检测LSD1的表达;用MTT法检测LSD1对卵巢癌细胞株增殖的影响;应用划痕试验检测LSD1对卵巢癌细胞株迁移的影响。结果:在3种人卵巢癌细胞的上述5种酶中,LSD1表达水平最高(P<0.01),KDM5家族成员在不同细胞系中差异表达。LSD1抑制剂反苯环丙胺处理卵巢癌细胞后,用MTT法发现抑制LSD1能显著降低癌细胞增殖(P<0.05),刮痕实验发现该药物可显著抑制卵巢癌细胞的迁移(P<0.05)。结论:LSD1在卵巢癌中高表达,KDM5家族差异化表达;LSD1与卵巢癌细胞系的增殖和迁移能力密切相关。
[关键词]赖氨酸特异去甲基化酶; 卵巢癌; 细胞增殖; 细胞迁移
组蛋白甲基化修饰可以激活或抑制基因的表达,其修饰状态的异常变化与多种癌症密切相关[1- 3]。赖氨酸特异性去甲基化酶(lysine- specific demethylase,LSD1)特异性去除组蛋白p第4位赖氨酸(pK4)的单甲基(me1)和二甲基(me2)修饰[4],而赖氨酸去甲基化酶KDM5家族可以去除pK4的二甲基(me2)和三甲基修饰(me2)[5],从而调节基因的转录活性。研究表明LSD1在多种癌症中高表达,与癌细胞的增殖、迁移和侵袭密切相关[6- 8]。KDM5家族包含KDM5A、KDM5B、KDM5C、KDM5D共4个成员[1];其在乳腺癌[9]、前列腺癌[10]、胃癌[11]、肺癌[12- 13]、肝癌[14]、急性淋巴细胞白血病[15]等多种恶性肿瘤中高表达,成为目前癌症表观遗传学研究的新热点。而抑制LSD1与KDM5的活性可以影响相应肿瘤细胞的增殖、迁移和转化,作为肿瘤诊断标记或治疗药物的靶点,LSD1和KDM5受到越来越多的关注[1,7]。
我们在前期研究[6]中发现,表皮生长因子(EGF)可以在翻译水平上调LSD1蛋白的表达,而不依赖于mRNA水平的变化;并且在不同卵巢癌细胞系中,EGF1对pK4me2影响存在差异,意味着除LSD1外,其他赖氨酸去甲基化酶可能在发挥着调控作用。本研究对卵巢癌细胞以及正常卵巢上皮细胞系中的LSD1和KDM5,在mRNA和蛋白水平均进行表达分析;同时分析LSD1对卵巢癌细胞增殖迁移的影响。
1材料与方法
1.1材料
Transwell小室为美国Corning公司产品;DMEM培养液和胰蛋白酶为Gibco公司产品;逆转录试剂盒购自美国Promega公司;实时荧光定量PCR相关酶购自Bio- Rad公司;抗体LSD1、KDM5A、KDM5B、KDM5C、β- actin均购自美国CST公司;LSD1抑制剂反苯环丙胺(TCP)购自美国Sigma公司。人卵巢表层上皮细胞(HOSEpiC)购自美国ScienCell,人卵巢癌细胞株SKOV- 3购自美国ATCC,HO8910和3AO由江苏大学基础医学研究所保存,相关引物由上海生物工程公司合成(引物序列信息可与第一作者或通信作者联系)。
1.2实验方法
1.2.1细胞培养SKOV- 3、HO8910、3AO 细胞接种于含10%胎牛血清的高糖DMEM培养液中,置于37℃、体积分数为5%CO2饱和湿度培养箱中传代培养。
1.2.2MTT法检测细胞增殖活性用单个细胞悬液,以每孔2×103~3×103个细胞接种到96孔板。待贴壁后分别加入0、25、50、100、500μmol·L-1TCP并继续培养24 h;每孔加MTT溶液20μl继续孵育4 h后终止培养,每孔加150μl DMSO,选择490nm波长测定各孔光吸收值[16]。
1.2.3实时荧光定量检测取对数生长期细胞进行胰酶消化,离心后收集细胞。采用Trizol法提取细胞总RNA,用cDNA作为模板,RT- PCR检测mRNA表达水平。
1.2.4蛋白质印迹法检测取30~50μg蛋白样品,8% SDS变性聚丙烯酰胺凝胶(SDS- PAGE)电泳分离,转至PVDF膜,以5%脱脂牛奶封闭后加一抗4℃过夜,洗膜后加辣根过氧化物酶标记的二抗,室温孵育60min后ECL显色,设β- actin为内参。
1.2.5细胞划痕实验将对数生长期的细胞消化后接种于24孔培养板中,每孔接种细胞约5×104个,置37℃、体积分数为5% CO2培养箱中培养24 h。用100 μl移液器吸头沿孔板的中轴轻划出一道痕,用PBS洗去漂浮细胞。培养24 h后拍照,利用目镜刻度尺测量划痕的前(S0)、后(S1)宽度,计算迁移率(migration rate,MR)。MR(%)=[(S0-S1)/S0]×100%
1.3统计学处理
采用Quantity One 4.5软件进行半定量分析,计量资料用平均值±标准误表示,进行t检验,P<0.05表示差异有统计学意义。
2结果
2.1组蛋白去甲基化酶在卵巢癌细胞株中的表达
mRNA水平的表达分析发现,在SKOV- 3、HO8910、3AO 3种人卵巢癌细胞株中,LSD1表达量最高且差异有统计学意义(P<0.01),只有KDM5A和KDM5B在HO8910中低表达(图1a)。蛋白水平表达分析发现,LSD1在3种卵巢癌细胞中均高表达;KDM5A在SKOV- 3和HO89104中高表达,在3AO细胞中低表达,KDM5C在3AO中低表达(图1b)。KDM5D只在雄性特异表达[17]。
2.2LSD1在正常卵巢上皮细胞和癌细胞中的表达
我们进一步应用蛋白质印迹法检测了LSD1在正常卵巢上皮细胞中的表达,结果表明,与正常卵巢上皮细胞系(HOSEpiC)比较,LSD1在卵巢癌细胞中的表达异常增高(图1c)。
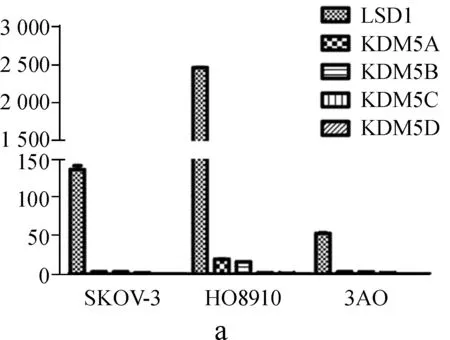
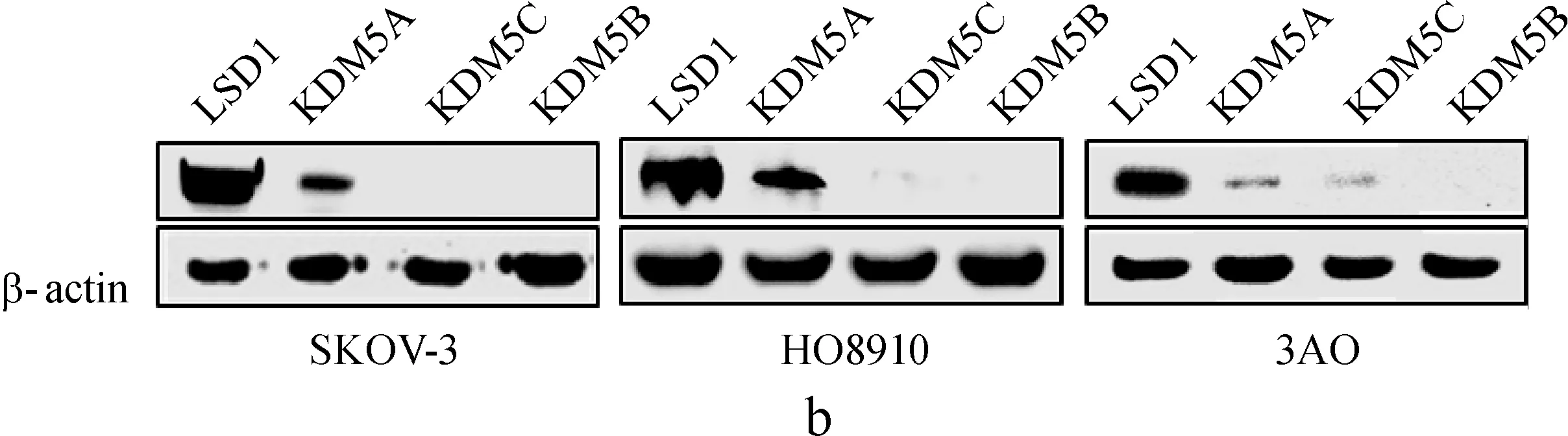
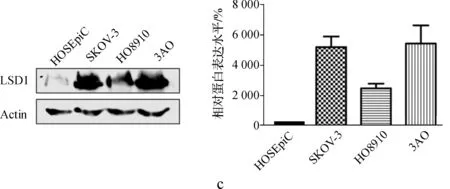
a.LSD1和KDM5家族在SKOV- 3、HO8910、3AO中的RT- PCR分析;b.LSD1和KDM5家族在3种卵巢癌细胞中的蛋白质印迹检测;c.LSD1在3种卵巢癌细胞和正常卵巢上皮细胞的蛋白质印迹对比检测
图1LSD1和KDM5家族在SKOV- 3、HO8910、3AO和HOSEpiC中的表达
a.mRNA expression of LSD1 and KDM5 members within SKOV- 3,HO8910,3AO by RT- PCR;b.Protein expression of LSD1 and KDM5 members within these 3 ovarian cancer cell lines by Western blot; c.Comparative protein expression of LSD1 between normal ovary epithelium cells and 3 ovarian cancer cell lines by Western blot
Fig 1Expression of LSD1 and KDM5 members within SKOV- 3,HO8910,3AO and HOSEpiC cell lines
2.3 LSD1对卵巢癌细胞增殖的影响
MTT法检测发现,LSD1的特异性抑制剂TCP(500μmol·L-1)处理卵巢癌细胞24 h后能显著抑制癌细胞的增殖(P<0.05)(图2),进一步验证了LSD1与卵巢癌的发生发展有密切关系。
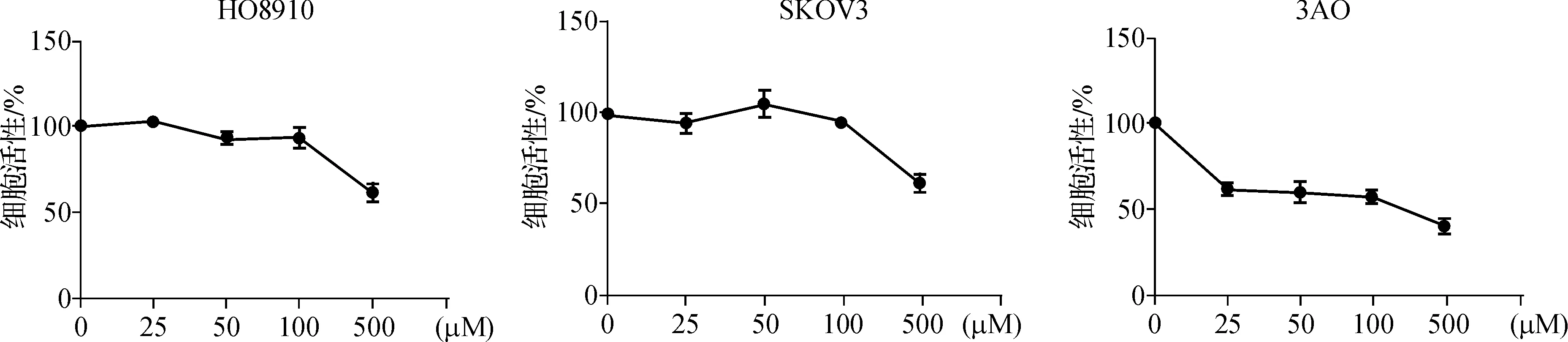
图2MTT检测不同浓度TCP处理24 h后SKOV- 3、HO8910和3AO细胞的增殖
Fig 2SKOV- 3,HO8910 and 3AO were treated with various concentration of TCP for 24 h,and cell viability was assessed by MTT assay
2.4LSD1对卵巢癌细胞迁移的影响
另一方面,通过划痕实验观察了TCP(500μmol·L-1)对卵巢癌细胞迁移的影响,发现与对照组相比,TCP处理组细胞迁移率显著小于正常组(P<0.05)(图3),提示LSD1促进了卵巢癌细胞的迁移。

图3TCP处理不同时间后SKOV- 3和HO8910细胞的迁移
注:柱状图表示TCP处理0、6、12、24 h后刮痕区的迁移率;数据由3次实验取平均数和标准差
Fig 3Microphotographs show the migration rate of wounded area(Data are presented as means±SD from 3 independent experiments)
3讨论
多个研究表明LSD1在卵巢癌细胞中高表达[6,18],我们的结果与其是一致的;我们先前研究[6]发现LSD1在翻译水平也存在着调控,表明分析LSD1在蛋白水平的表达也有着重要的研究价值。
有研究[19]发现,KDM5A可以显著(>100倍)影响肿瘤细胞对药物的敏感性。本实验结果表明,KDM5A在SKOV- 3、HO8910中均高表达,在3AO中表达较弱。Wang等[20]发现在上皮卵巢癌细胞中KDM5B表达显著增加,KDM5B表达水平与化疗抗药性和病人5年存活率之间存在着显著相关;而本实验中KDM5B在3种卵巢癌细胞系中均呈低表达,这可能是由于我们采用的3种卵巢囊腺瘤细胞系,KDM5B在不同类型的卵巢癌中表达不同,但仍需进一步证实。Wang等[9]研究表明,KDM5C(JARID1C)可以促进乳腺癌细胞的转移和侵袭;本实验中只有3AO细胞系存在着KDM5C的弱表达,该酶对不同卵巢癌的转移和侵袭能力也具有一定的研究价值。KDM5D(JARID1D)位于Y染色体,只在雄性特异表达[17];本研究也从mRNA表达水平证实卵巢癌细胞中不存在该基因的表达。
TCP是目前研究中普遍采用的LSD1特异性抑制剂,它可以抑制LSD1的pK4去甲基化活性[21]。TCP抑制LSD1活性后发现卵巢癌细胞的增殖受到明显抑制,这表明LSD1能明显促进人卵巢癌细胞增殖。同样处理后发现卵巢癌细胞的迁移也受到抑制,这表明LSD1可能参与了迁移过程。这些结果与其他利用不同卵巢样品或细胞系所做出的实验结论[18]是一致的。目前,已经有抑制KDM5A、KDM5B活性的化合物处于前期研究阶段[1],但相应的特异抑制剂以及KDM5C、KDM5D的抑制剂还未有报道,LSD1和KDM5家族特异抑制剂的研发、对抗癌药物筛选及其在卵巢癌中的作用机制研究都有着医学和科学价值。
综上所述,LSD1和KDM5家族成员与人卵巢癌的发生发展密切相关。LSD1不仅能促进人卵巢癌细胞增殖,同时能显著提高人卵巢癌细胞的迁移能力。LSD1和KDM5家族成员抑制剂有望成为筛选抗癌药物的新方向。
[参考文献]
[1] MCGRATH J,TROJER P.Targeting histone lysine methylation in cancer[J].Pharmacol Ther,2015,150:1- 22.
[2] VARIER R A,TIMMERS H T.Histone lysine methylation and demethylation pathways in cancer[J].Biochim Biophys Acta,2011,1815(1):75- 89.
[3] THINNES C C,ENGLAND K S,KAWAMURA A,et al.Targeting histone lysine demethylases- progress,challenges,and the future[J].Biochim Biophys Acta,2014,1839(12):1416- 1432.[4] LAN F,NOTTKE A C,SHI Y,Mechanisms involved in the regulation of histone lysine demethylases[J].Curr Opin Cell Biol,2008,20(3):316- 325.
[5] ROTILI D,MAI A.Targeting histone demethylases:a new avenue for the fight against cancer[J].Genes Cancer,2011,2(6):663- 679.
[6] SHAO G,WANG J,LI Y,et al.Lysine- specific demethylase 1 mediates epidermal growth factor signaling to promote cell migration in ovarian cancer cells[J].Sci Rep,2015,5:15344.
[7] ZHENG Y C,MA J,WANG Z,et al.A systematic review of histone lysine- specific demethylase 1 and its inhibitors[J].Med Res Rev,2015,35(5):1032- 1071.
[8] LYNCH J T,HARRIS W J,SOMERVAILLE T C.LSD1 inhibition:a therapeutic strategy in cancer?[J].Expert Opin Ther Targets,2012,16(12):1239- 1249.
[9] WANG Q,WEI J,SU P,et al.Histone demethylase JARID1C promotes breast cancer metastasis cells via down regulating BRMS1 expression[J].Biochem Biophys Res Commun,2015,464(2):659- 666.
[10] LI N,DHAR S S,CHEN T Y,et al.JARID1D is a suppressor and prognostic marker of prostate cancer invasion and metastasis[J].Cancer Res,2016,76(4):831- 843.
[11] XU L M,WU W,CHENG G L,et al.Enhancement of proliferation and invasion of gastric cancer cell by KDM5C via decrease in p53 expression[J].Technol Cancer Res Treat,2016,doi:10.1177/1533034616629261
[12] TORRES I O,KUCHENBECKER K M,NNADI C I,et al.Histone demethylase KDM5A is regulated by its reader domain through a positive- feedback mechanism[J].Nat Commun,2015,6:6204.
[13] SHEN X,ZHUANG Z,ZHANG Y,et al.JARID1B modulates lung cancer cell proliferation and invasion by regulating p53 expression[J].Tumour Biol,2015,36(9):7133- 7142.
[14] TANG B,QI G,TANG F,et al.JARID1B promotes metastasis and epithelial- mesenchymal transition via PTEN/AKT signaling in hepatocellular carcinoma cells[J].Oncotarget,2015,6(14):12723- 12739.
[15] WANG H,SONG C,DING Y,et al.Transcriptional regulation of JARID1B/KDM5B histone demethylase by ikaros,histone deacetylase 1(HDAC1),and casein kinase 2(CK2) in B- cell acute lymphoblastic leukemia[J].J Biol Chem,2016,291(8):4004- 4018.
[16] 卢凯,许斌,陈恕求,等.miR- 19a对于去势抵抗性前列腺癌细胞的增殖及凋亡的调控[J].现代医学,2013,41(9):613- 616.
[17] AKIMOTO C,KITAGAWA H,MATSUMOTO T,et al.Spermatogenesis- specific association of SMCY and MSH5[J].Genes Cells,2008,13(6):623- 633.
[18] KONOVALOV S,GARCIA- BASSETS I.Analysis of the levels of lysine- specific demethylase 1(LSD1) mRNA in human ovarian tumors and the effects of chemical LSD1 inhibitors in ovarian cancer cell lines[J].J Ovarian Res,2013,6(1):75.
[19] SHARMA S V,LEE D Y,LI B,et al.A chromatin- mediated reversible drug- tolerant state in cancer cell subpopulations[J].Cell,2010,141(1):69- 80.
[20] WANG L,MAO Y,DU G,et al.Overexpression of JARID1B is associated with poor prognosis and chemotherapy resistance in epithelial ovarian cancer[J].Tumour Biol,2015,36(4):2465- 2472.
[21] SCHMIDT D M,MCCAFFERTY D G.Trans- 2- Phenylcyclopropylamine is a mechanism- based inactivator of the histone demethylase LSD1[J].Biochemistry,2007,46(14):4408-
4416.
The expression of LSD1 and KDM5 and the effects of LSD1 on proliferation and migration in ovarian cancer cells
JIA Chao1,2,WANG Jie3,SHAO Gen- bao3,LU Zu- hong1
(1.StateKeyLaboratoryofBioelectronics,SchoolofBiologicalScienceandMedicalEngineering,SoutheastUniversity,Nanjing210096,China; 2.CollegeofAnimalScienceandTechnology,NanjingAgriculturalUniversity,Nanjing210095,China; 3.SchoolofBasicMedicineandMedicalTechnology,JiangsuUniversity,Zhenjiang212013,China)
[Abstract]Objective: To investigate the expression of lysine- specific demethylase 1(LSD1) and lysine demethylase 5 (KDM5),as well as the role of LSD1 on proliferation and migration within human ovarian cancer cells. Methods: Relative mRNA and protein levels of LSD1,KDM5A,KDM5B,KDM5C,KDM5D were detected respectively by real- time quantitative and Western blot in SKOV- 3,HO8910,3AO cells. The expressions of LSD1 were comparatively analyzed between a human ovarian epithelial cell line and three ovarian cancer cell lines by Western blot. In addition, the effects of LSD1 on proliferation and migration were determinted by MTT and wound- healing assay respectively. Results: The expression of LSD1 was highest(P<0.01),and the expression of KDM5 members was different in these ovarian cancer cells. Tranylcypromine, the inhibitor of LSD1, significantly decreased the proliferation and migration(P<0.05). Conclusion: LSD1 expresse at high level and the member of KDM5 family expresse at differentiated level within 3 ovarian cancer cell lines, and LSD1 is significantly correlated with the proliferation and migration within these 3 ovarian cancer cell lines.
[Key words]lysine- specific demethylase 1; ovarian cancer; cell proliferation; cell migration
[收稿日期]2016- 02- 27[修回日期] 2016- 03- 20
[基金项目]国家自然科学基金资助项目(61227803,81170573);南京农业大学青年基金资助项目(060J2063)
[作者简介]
贾超(1980-),男,安徽亳州人,讲师,在读博士研究生。E- mail:jiachao@njau.edu.cn

[通信作者]陆祖宏E- mail:zhlu@seu.edu.cn;邵根宝E- mail:gbshao07@ujs.edu.cn
[中图分类号]R737.31; R73- 3
[文献标识码]A
[文章编号]1671- 6264(2016)03- 0350- 05
doi:10.3969/j.issn.1671- 6264.2016.03.013
[引文格式] 贾超,王洁,邵根宝,等.LSD1和KDM5家族在卵巢癌细胞中的表达及LSD1对细胞增殖迁移的影响 [J].东南大学学报:医学版,2016,35(3):350- 354.
·论著·
