长链非编码RNA RP11- 191L9.4促进前列腺癌PC- 3细胞的迁移和侵袭
2016-06-22王京黄烨清许斌陈明
王京,黄烨清,许斌,陈明
(1.东南大学 医学院,江苏 南京 210009; 2.东南大学 附属中大医院,江苏 南京 210009)
长链非编码RNA RP11- 191L9.4促进前列腺癌PC- 3细胞的迁移和侵袭
王京1,黄烨清1,许斌2,陈明2
(1.东南大学 医学院,江苏 南京210009; 2.东南大学 附属中大医院,江苏 南京210009)
[摘要]目的:探讨长链非编码RNA RP11- 191L9.4对前列腺癌PC- 3细胞增殖、迁移及侵袭能力的影响。方法:荧光定量PCR检测RP11- 191L9.4 siRNA在PC- 3细胞中的敲除效率; 通过MTT实验和克隆形成实验观察在PC- 3细胞中低表达RP11- 191L9.4对其增殖的影响;通过transwell细胞迁移实验检测敲低RP11- 191L9.4的表达对PC- 3细胞的迁移能力影响;通过Matrigel侵袭实验检测敲低RP11- 191L9.4的表达对PC- 3细胞侵袭能力的影响。结果:向前列腺癌细胞系PC- 3中转染RP11- 191L9.4 siRNA 48 h后,qPCR检测PC- 3细胞中RP11- 191L9.4明显低表达;MTT及克隆形成实验结果显示,敲低RP11- 191L9.4的表达能显著抑制PC- 3细胞的增殖;transwell迁移实验结果显示,敲低RP11- 191L9.4的表达能减弱PC- 3细胞的迁移能力;Matrigel胶细胞侵袭实验结果显示,敲低RP11- 191L9.4的表达能减弱PC- 3细胞的侵袭能力。结论:转染RP11- 191L9.4 siRNA能显著抑制PC- 3细胞中RP11- 191L9.4的表达,而敲低RP11- 191L9.4的表达可显著抑制前列腺癌细胞PC- 3增殖、迁移及侵袭能力。
[关键词]lncRNA; RP11- 191L9.4; 前列腺癌; 细胞增殖; 细胞迁移; 肿瘤侵袭
前列腺癌是我国男性的常见恶性肿瘤之一,目前认为前列腺癌与年龄、雄激素、高动物脂肪摄入以及遗传等因素相关,但其确切发病机制仍不清楚[1]。长链非编码RNA(long non- coding RNA, lncRNA)是长度大于200个核苷酸的非编码RNA,约占RNA总量的98%,多数位于细胞核或细胞质内,在真核细胞中被普遍转录[2]。研究发现多种lncRNA在人的肿瘤组织和正常组织中存在显著的差异性表达,并且lncRNA很可能在肿瘤的发生发展过程中起着促癌或抑癌的作用[3]。目前研究表明,多种lncRNA与前列腺癌的发生、发展、转移等有着非常密切的关系。我们课题组在前期工作中从收集到的前列腺癌组织及相应癌旁组织中应用芯片筛选出表达水平有显著差异的一批lncRNA,其中RP11- 191L9.4在癌组织中的表达水平相比对应的癌旁组织有显著提升。而目前有关长链非编码RNA RP11- 191L9.4未见相关报道。本研究在前列腺癌细胞系PC- 3细胞中敲低RP11- 191L9.4的表达后发现,细胞的增殖、迁移和侵袭等能力均受到明显影响。
1材料和方法
1.1材料
人前列腺癌细胞PC- 3购自上海细胞库;RP11- 191L9.4 siRNA(干扰RNA)及negative siRNA由上海吉玛制药技术有限公司合成;逆转录试剂盒(Thermoscientific公司);实时荧光定量PCR检测所需SYBR Green染料(Roche公司);MTT试剂盒(碧云天公司);DMEM/F- 12培养基、opti- MEM和胎牛血清(Gibco公司);胰酶(Sigma公司);LipofectamineTM2000、TRIzol(Invitrogen公司);Matrigel(BD 公司);6/24/96孔细胞培养板、transwell小室购自Corning公司。
1.2细胞培养和转染
在37 ℃、体积分数5%CO2孵箱中用含1%双抗和10%胎牛血清(fetalbovineserum,FBS)的DMEM/F12培养基培养PC- 3细胞。第1天用不含双抗的培养基将PC- 3细胞接种于6孔板中,次日当细胞汇合度约为50%时,每孔加入400 μl 配制好的含有lipofectaminTM2000和siRNA的转染培养基opti- MEM,水平晃匀,在37 ℃、体积分数5%CO2培养箱中孵育4~6 h后吸去旧培养基,每孔加入2 ml完全培养基。RP11- 191L9.4 siRNA正向序列5′- UCAUUGAGAUCAUGGAUUUUU- 3′,反向序列5′- AAAUCCAUGAUCUCAAUGAUU- 3′; negative siRNA正向序列5′- UUCUCCGAACGUGUCACGU TT- 3′,反向序列5′- ACGUGACACGUUCGGAGAATT- 3′。
1.3实时荧光定量聚合酶链反应(PCR)检测转染后PC- 3细胞lncRNA RP11- 191L9.4的表达量
用TRIzol提取前列腺癌细胞PC- 3的总mRNA,逆转录为cDNA,逆转录反应条件:42 ℃ 30 min,85 ℃ 5 min,用实时荧光定量PCR试剂盒进行检测。RP11- 191L9.4上游引物5′- TGTGGCCTCAGCTGAAAGTGAG- 3′,下游引物5′- AGTGTGAATCTGCAGAGCTGGC- 3′;内参基因GAPDH上游引物5′- GAAATCCCATCACCACTT CCAGG- 3′,下游引物5′- GAGCCCCAGCCTTCTCCATG- 3′。实时荧光定量PCR反应条件:94 ℃ 5 min、94 ℃ 15 s、60 ℃ 1 min,40个循环。溶解曲线温度设定为60~95 ℃,每个样品设置3个复孔;应用2%琼脂糖凝胶电泳检测特异性。
1.4噻唑蓝(MTT)法检测siRNA对PC- 3细胞增殖的影响
实验组细胞转染siRNA,对照组细胞转染siNC,48 h后胰酶消化,收集细胞,加入完全培养基,调整细胞悬液浓度铺板到96孔板,实验组和对照组各设置4行,每行设置5个复孔,每孔细胞调密度至2 000 个·孔-1,体积分数5%CO2、37 ℃孵育,由次日开始加MTT,每天两组各加1行,连续加4 d。每孔加入20 μl MTT试剂,继续于培养箱中孵育4 h后逐一吸净孔内培养液,每孔加入150 μl二甲基亚砜(DMSO),将96孔板置摇床上低速振荡10 min后上机检测。在无细胞的孔中加入DMSO作为调零孔,在酶联免疫检测仪OD490 nm处测量各孔的吸光值。
1.5克隆形成实验检测细胞增殖活性
将转染48 h后的实验组和对照组细胞用胰酶消化,收集细胞,加入完全培养液重悬,计数细胞,以1 000 个·孔-1密度接种于6孔板(实验组和对照组各3孔),每孔加入2 ml完全培养液,水平方向晃动培养板使细胞均匀分布。培养7 d后吸去各孔培养基,磷酸盐缓冲液(PBS)漂洗2次,每孔加1 ml 4%多聚甲醛固定20 min,吸去多聚甲醛,PBS漂洗2次,每孔加入1 ml结晶紫染色液,20 min后吸去结晶紫染色液,将6孔板置于自来水下冲洗,晾干后计算集落数。
1.6transwell迁移实验检测细胞迁移
转染48 h后将实验组及对照组细胞胰酶消化,收集细胞,用无血清培养基重悬,细胞计数并调整细胞密度至1×106ml-1,取100 μl加入上室,下室所在24孔板加入600 μl完全培养基,37 ℃、体积分数5%CO2、95%饱和湿度培养箱中孵育8 h后用PBS清洗transwell小室后放入24孔板,小室所在24孔板每孔加入600 μl 95%甲醇室温固定15 min。吸出固定液,24孔板中每孔加入600 μl 0.2%结晶紫染液,室温作用20 min,PBS洗涤轻洗后显微镜下计数穿过滤膜的细胞,同时观察下层液体中是否有掉落细胞。小室的细胞计数以显微镜下5个视野的细胞平均数为准。
1.7Matrigel侵袭实验检测细胞侵袭能力
将Matrigel胶置于4 ℃融化后,于冰上与无血清培养基混匀稀释(稀释比例为:Matrigel胶∶培养基=1∶8);将Transwell小室放入24孔板中,在上室内加入200 μl稀释的Matrigel胶,37 °C、体积分数5%CO2和95%饱和湿度培养箱内孵育1 h,使小室表面形成Matrigel胶涂层;用0.25%的胰酶消化细胞,离心后加入无血清培养基制成单细胞悬液,调整细胞浓度为1×106ml-1;将100 μl细胞悬液加入Transwell小室的上室,小室所在的24孔板加入600 μl完全培养基;将24孔板置于37 ℃、体积分数5%CO2和95%饱和湿度培养箱内培养24 h,95%甲醇固定20 min;PBS洗涤后用0.2%结晶紫染色20 min;PBS洗涤轻洗后显微镜下计数穿过滤膜的细胞,同时观察下层液体中是否有掉落细胞。小室的细胞计数以显微镜下5个视野的细胞平均数为准。
1.8统计学处理
2结果
2.1转染RP11- 191L9.4 siRNA后 PC- 3细胞lncRNA RP11- 191L9.4 的表达
实验组和对照组分别转染RP11- 191L9.4 siRNA和negative siRNA,48 h后提取总RNA,逆转录为cDNA,qPCR检测两组细胞中RP11- 191L9.4的表达。结果显示,实验组细胞中RP11- 191L9.4表达水平明显降低(图1),说明RP11- 191L9.4 siRNA能够有效干涉RP11- 191L9.4的表达,使细胞中RP11- 191L9.4的表达明显减少。
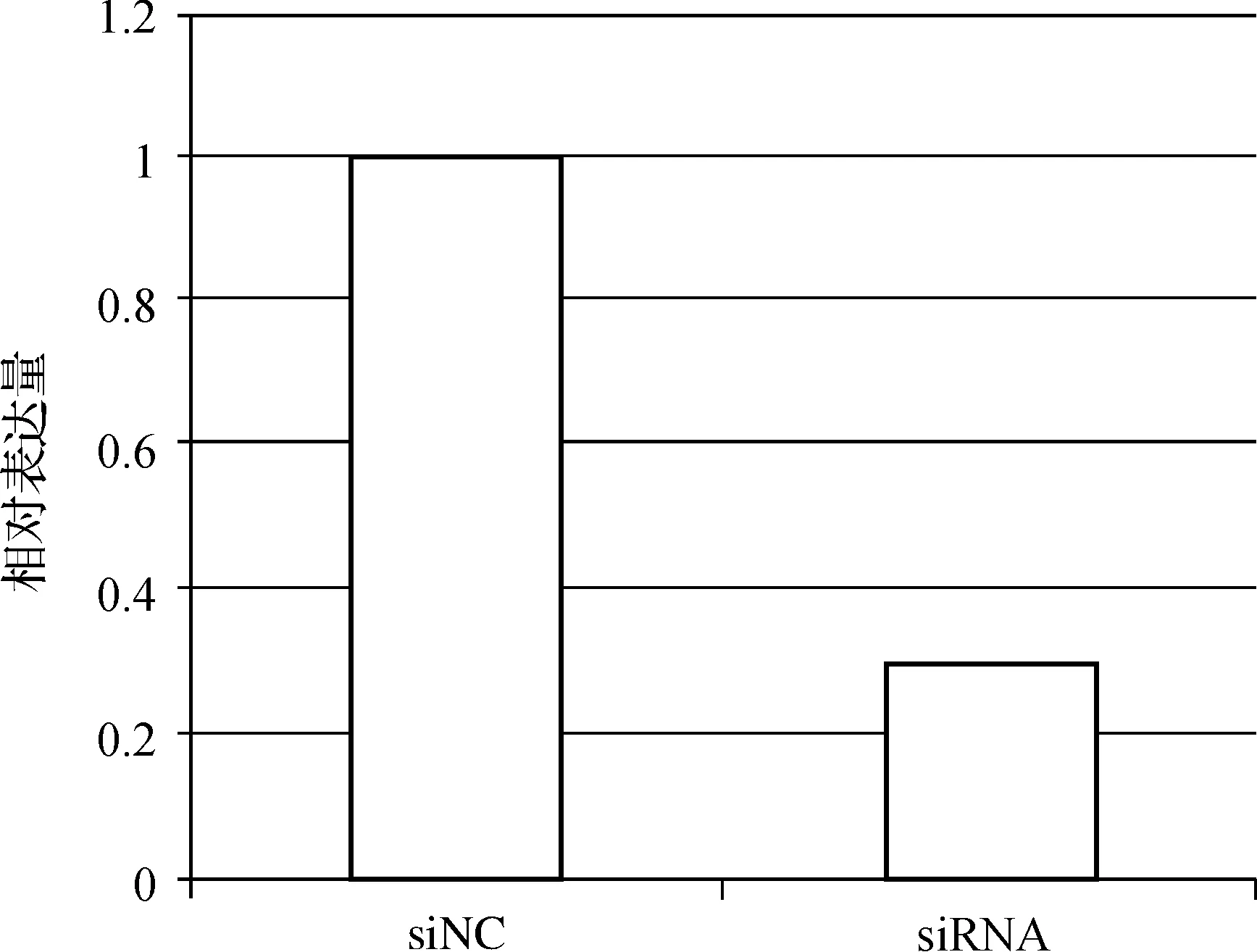
RP11- 191L9.4 siRNA转染48 h后进行qPCR检测,每组设3个复孔,siRNA为实验组,siNC为对照,2- ΔΔCt为纵坐标
图1qPCR 检测PC- 3前列腺癌细胞中RP11- 191L9.4 表达水平的敲低效果
qPCR was used after transfection of RP11- 191L9.4 siRNA,each group had 3 holes,siRNA as experimental group,siNC for comparison,2- ΔΔCtas the ordinate
Fig 1The effect of low expression of RP11- 191L9.4 after the siRNA transfection in PC- 3 cell
2.2转染RP11- 191L9.4 siRNA对PC- 3细胞增殖能力的影响
通过MTT实验连续4 d检测各组细胞的增殖活性,以时间为横轴、490 nm吸光值为纵轴绘制增殖曲线。与对照组相比,转染RP11- 191L9.4 siRNA的实验组PC- 3吸光值明显降低,说明细胞增殖活性明显下降,从检测第2天至第4天差异有统计学意义(t2 d=3.991,P<0.01;t3 d=2.455,P<0.05;t4 d=3.748,P<0.01)。见图2。

与对照组相比,RP11- 191L9.4被敲低后第 2、3、4天吸光值明显减少,差异具有统计学意义,P<0.05
图2RP11- 191L9.4敲低后与对照组PC- 3前列腺癌细胞增殖速度的定量分析
Compared with control group,the absorbance value decreased significantly at the 2,3,4 day in experimental group,the difference was statistically significant (P<0.05)
Fig 2Quantitative analysis of prostate cancer cell proliferation rate of experimental group and controll group
2.3转染RP11- 191L9.4 siRNA对前列腺癌细胞PC- 3克隆形成能力的影响
克隆形成实验结果显示,PC- 3细胞中RP11- 191L9.4表达被敲低后单个细胞形成细胞集落的能力显著减弱(图3),克隆形成实验和MTT实验的结果都表明敲低RP11- 191L9.4的表达能够抑制前列腺癌PC- 3细胞的增殖。
2.4转染RP11- 191L9.4 siRNA对前列腺癌细胞PC- 3迁移能力的影响
Transwell迁移实验结果显示,与对照组相比,转染RP11- 191L9.4 siRNA的实验组PC- 3细胞穿过膜的细胞数显著减少(图4),差异有统计学意义(P<0.05),表明RP11- 191L9.4能够促进PC- 3细胞的迁移。
2.5转染RP11- 191L9.4 siRNA对前列腺癌PC- 3细胞侵袭能力的影响
基质凝胶小室侵袭实验结果显示,转染RP11- 191L9.4 siRNA的实验组PC- 3细胞进入到小室下层的数量明显减少(图4),表明RP11- 191L9.4能够促进PC- 3细胞的侵袭。
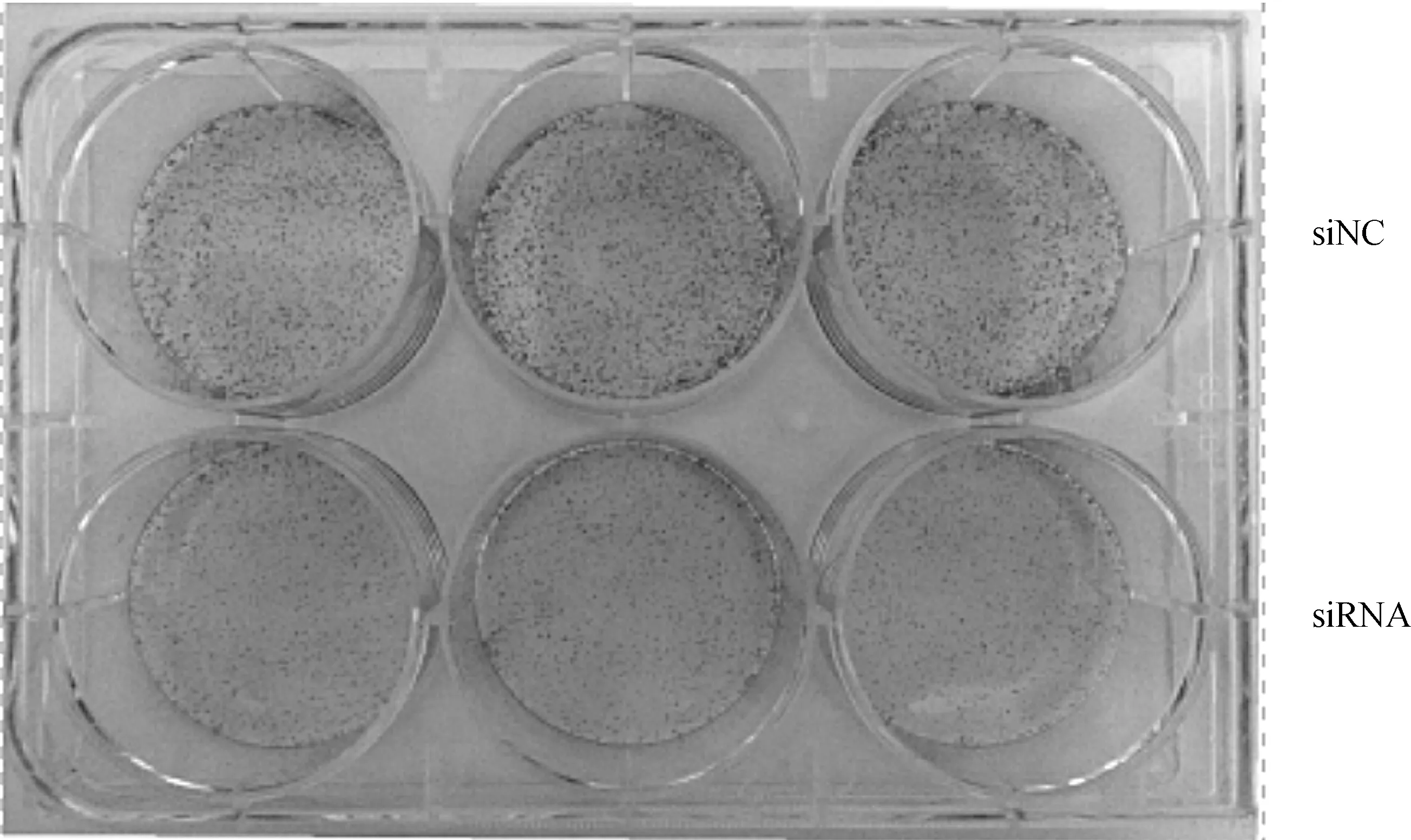

RP11- 191L9.4被敲低后克隆形成数量明显少于对照组,差异具有统计学意义,aP<0.01
图3RP11- 191L9.4 敲低与对照组PC- 3前列腺癌细胞平板克隆形成对比
The number of clone formation in experimental group was significantly less than that in the control group,the difference was statistically significant,aP<0.01
Fig 3The comparison of clone formation between experimental group and control group
3讨论
前列腺癌是威胁老年男性健康的常见肿瘤之一,其发病率呈逐年上升趋势,已成为泌尿系统的第2大肿瘤。lncRNA是长度大于200 nt无蛋白编码能力的长链非编码RNA,其稳定存在于血液、尿液等体液中,并具有组织特异性和疾病特异性。lncRNA可在细胞层次和分子水平调控基因表达,以往研究表明在细胞水平lncRNA与细胞增殖[4]、细胞凋亡[5]、细胞分化[6]、胚胎干细胞的自我更新修复[7]等方面有关;在分子层次,lncRNA和染色质重塑[8]、X染色体失活[9]等有关。在转录后水平,可以通过选择性剪接、加帽加尾等多种方式靶向调控(抑制或促进)目的基因表达[10]。近几年的研究成果表明,lncRNA与多种恶性肿瘤有着密切的关系[11- 13]。前列腺癌的发生发展过程中也有lncRNA的参与,例如,Prensner等通过比对前列腺癌组织和癌旁组织发现,lncRNA SChLAP1在癌组织中表达上调并可通过对抗SWI/SNF染色质修饰物复合体增加前列腺癌细胞的侵袭及转移能力[14];Zhu等研究发现lncRNA H19- miR- 675轴通过靶向调控目的基因TGFBI抑制前列腺癌的转移[15];Hung等研究认为lncRNA PCGEM1作为c- Myc和雄激素受体的共激活剂促进前列腺癌的发生发展[16];Luo等研究发现lncRNA MEG3在前列腺癌组织中低表达,并用体内外实验发现lncRNA MEG3可以抑制细胞的增殖、促进细胞凋亡而最终抑制前列腺癌的发生发展[17]。
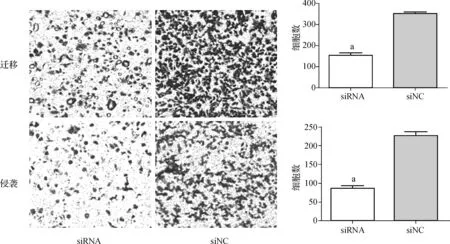
转染RP110191L9.4 被敲低后穿过traswell小室(上)及基质凝胶的细胞数明显少于对照组,差异具有统计学意义, aP<0.01
图4RP11- 191L9.4 敲低与对照组NC PC- 3前列腺癌细胞迁移及侵袭对比
The cell number of traversing the matrigel in experimental group was significantly less than that in the control group,the difference was statistically significant,aP<0.01
Fig 4The comparison of migration and invasion between experimental group and control group
RP11- 191L9.4基因位于人类染色体的22q13.31,目前有关长链非编码RNA RP11- 191L9.4在肿瘤中的作用未见报道。本课题组在前期工作研究中发现RP11- 191L9.4在前列腺癌组织中相对表达上调,提示RP11- 191L9.4可能在前列腺癌中发挥类癌基因的作用。本实验通过RNAi实验证明了RP11- 191L9.4降低表达能抑制前列腺癌细胞的增殖,说明RP11- 191L9.4可能通过促进增殖参与前列腺癌的形成。通过干涉RP11- 191L9.4的表达,其迁移和侵袭能力减弱,表明RP11- 191L9.4可能促进前列腺癌的转移,这对于进一步揭示前列腺癌的发生发展及转移机制具有重要意义。而在本实验的基础上进一步探索RP11- 191L9.4发挥作用的分子机制,明确其发挥作用的靶向基因和信号通路,将为前列腺癌的诊治提供新的分子标志物及治疗靶标。
[参考文献]
[1] 韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330- 334.
[2] 郭辉,傅强.长链非编码RNA与前列腺癌[J].上海医学,2012,35(5):371- 375.
[3] 唐珍,王含彦,易芳,等.长非编码RNA以及与疾病发生的研究进展[J].西南师范大学学报:自然科学版,2015(1):51- 55.
[4] POLISENO L,SALMENA L,ZHANG J,et al.A coding- independent function of gene and pseudogene mRNAs regulates tumour biology[J].Nature,2010,465(7301):1033- 1038.
[5] ISIN M,UYSALER E,OZGUR E,et al.Exosomal lncRNA- p21 levels may help to distinguish prostate cancer from benign disease[J].Front Genet,2015,6:168.
[6] CESANA M,CACCHIARELLI D,LEGNINI I,et al.A long noncoding RNA controls muscle differentiation by functioning as a competing endogenous RNA[J].Cell,2011,147(2):358- 369.
[7] WANG Y,XU Z,JIANG J,et al.Endogenous miRNA sponge lincRNA- RoR regulates Oct4,Nanog,and Sox2 in human embryonic stem cell self- renewal[J].Dev Cell,2013,25(1):69- 80.
[8] RINN J L,KERTESZ M,WANG J K,et al.Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs[J].Cell,2007,129(7):1311- 1323.
[9] AUTUORO J M,PIRNIE S P,CARMICHAEL G G,et al.Long noncoding RNAs in imprinting and X chromosome inactivation[J].Biomolecules,2014,4(1):76- 100.
[10] HAEMMERLE M,GUTSCHNER T.Long non- coding RNAs in cancer and development:where do we go from here?[J].Int J Mol Sci,2015,16(1):1395- 1405.
[11] DONG R,JIA D,XUE P,et al.Genome- wide analysis of long noncoding RNA (lncRNA) expression in hepatoblastoma tis-
sues[J].PLoS One,2014,9(1):e85599.
[12] XIA T,LIAO Q,JIANG X,et al.Long noncoding RNA associated- competing endogenous RNAs in gastric cancer[J].Sci Rep,2014,4:6088.
[13] LI L J,ZHU J L,BAO W S,et al.Long noncoding RNA GHET1 promotes the development of bladder cancer[J].Int J Clin Exp Pathol,2014,7(10):7196- 7205.
[14] PRENSNER J R,IYER M K,SAHU A,et al.The long noncoding RNA SChLAP1 promotes aggressive prostate cancer and antagonizes the SWI/SNF complex[J].Nat Genet,2013,45(11):1392- 1398.
[15] ZHU M,CHEN Q,LIU X,et al.lncRNA H19/miR- 675 axis represses prostate cancer metastasis by targeting TGFBI[J].FEBS J,2014,281(16):3766- 3775.
[16] HUNG C L,WANG L,YU Y L,et al.A long noncoding RNA connects c- Myc to tumor metabolism[J].Proc Nat Acad Sci USA,2014,111(52):18697- 18702.
[17] LUO G,WANG M,WU X,et al.Long non- coding RNA MEG3 inhibits cell proliferation and induces apoptosis in prostate cancer[J].Cell Physiol Biochem,2015,37(6):2209- 2220.
Effection of lncRNA RP11- 191L9.4 on the migration and invasion of prostate cancer cell PC- 3
WANG Jing1,HUANG Ye- qing1,XU Bin2,CHEN Ming2
(1.SchoolofMedicine,SoutheastUniversity,Nanjing210009,China; 2.ZhongdaHospital,SoutheastUniversity,Nanjing210009,China)
[Abstract]Objective:To explore the effect of lncRNA RP11- 191L9.4 on the proliferation,migration and invasion ability of prostate cancer PC- 3 cells.Methods:qPCR assay was used to confirm the low expression level of RP11- 191L9.4 after the transfection of RP11- 191L9.4 siRNA.MTT assay and colony- forming unit assay were performed to evaluate the effect of RP11- 191L9.4 knock- down on PC- 3 cell proliferation. Transwell migration assay was used to evaluate the effect of RP11- 191L9.4 knock- down on the migration ability of PC- 3 cells. Matrigel invasion assay was used to evaluate the effect of RP11- 191L9.4 knock- down on the invasion ability of PC- 3 cells. Results:The expression level of RP11- 191L9.4 was significantly knocked down by the transfection of siRNA.MTT assay and colony forming unit assay showed that reducing the expression of RP11- 191L9.4 can significantly weaken the proliferation ability of PC- 3 cells. The result of transwell migration assay indicated that reducing the expression of RP11- 191L9.4 in PC- 3 cells obviously suppressed its migration ability. The result of Matrigel invasion assay demonstrated that reducing the expression of RP11- 191L9.4 significantly suppressed the invasion ability of PC- 3 cells. Conclusion:RP11- 191L9.4 level in PC- 3 cells can be efficiently knocked down with the transfection of RP11- 191L9.4 siRNA, and knock down the expression level of RP11- 191L9.4 can significantly suppress the ability of proliferation,migration and invasion in PC- 3 cells.
[Key words]lncRNA; RP11- 191L9.4; prostate cancer; cell proliferation; cell migration; tumor invasion
[收稿日期]2015- 12- 30[修回日期] 2016- 01- 27
[基金项目]国家自然科学基金(81370849,81300472,81202034),临床医学科技专项——新型临床诊疗技术攻关基金(BL2013032),教育部博士点基金(20120092120071),江苏省自然科学基金(BK2012336),南京市科技发展项目基金(201201053),东南大学新教师基本科研项目基金(3290002402)资助项目
[作者简介]王京(1990-),男,蒙古族,河南南阳人,在读硕士研究生。E- mail:332319938@qq.com
[通信作者]陈明E- mail:mingchenseu@126.com
[中图分类号]R737.25; R- 33; R329.25
[文献标识码]A
[文章编号]1671- 6264(2016)03- 0305- 06
doi:10.3969/j.issn.1671- 6264.2016.03.003
[引文格式] 王京,黄烨清,许斌,等.长链非编码RNA RP11- 191L9.4促进前列腺癌PC- 3细胞的迁移和侵袭[J].东南大学学报:医学版,2016,35(3):305- 310.
·论著·
