鲍肠道益生菌芽孢杆菌A3440菌株培养基及发酵条件优化
2016-06-22凌宇恒吴淑妃柯才焕
凌宇恒,吴淑妃,柯才焕,赵 晶
(厦门大学海洋与地球学院,福建厦门 361102)
鲍肠道益生菌芽孢杆菌A3440菌株培养基及发酵条件优化
凌宇恒,吴淑妃,柯才焕,赵晶*
(厦门大学海洋与地球学院,福建厦门 361102)
摘要:对一株来自于杂色鲍(Haliotis diversicolor)肠道并经证实具有显著促进其生长及免疫活性的同温层芽孢杆菌 (Bacillus stratosphericus)A3440菌株进行培养基及发酵条件的优化研究,为该益生菌应用于鲍及其他水产动物的健康养殖奠定基础.以细菌芽孢率和蛋白酶活力为检测指标,采用单因素试验和正交设计试验优化发酵培养基组分及发酵条件.结果显示,该菌最佳发酵配方为:蛋白胨7 g/L,酵母膏7 g/L,NaCl 20 g/L,CaCl2 0.20 g/L;最佳发酵条件为:初始pH 9.0,培养温度30 ℃,种子液接种量8%,装液量30 mL(250 mL锥形瓶),培养时间24 h.优化后芽孢率为94.3%,较基础培养基提高8.77%;蛋白酶活力为294.44 U/mL,较基础培养基提高76.67%.
关键词:同温层芽孢杆菌;发酵培养基;发酵条件;蛋白酶活力;芽孢率
随着对动物蛋白需求的增大,水产养殖业作为世界发展最快的食品供给领域,受到越来越多的关注,具有广阔的前景[1].亚洲的水产养殖业近几十年迅猛发展,目前产量已占全球的90%[2].我国的鲍养殖研究开始于20世纪70年代,80年代开始大规模养殖,2013年全国鲍养殖总产量达11万t,其中福建省8.85万t[3],创造了巨大的经济价值与社会效益.然而,随着鲍养殖业的快速发展,养殖规模的不断扩大,集约化程度的提高以及沿海水质的恶化,鲍病害日益频繁,危害了鲍的生长发育以及鲍养殖业的健康发展[4-5].抗生素的应用在一定程度上能有效应对水产养殖病害的发生和蔓延,但长期使用将会导致一系列副作用,如抗生素残留水平升高、病原菌抗药性增强、破坏肠道有益菌群的微生态环境等,且抗生素在水生动物体内的富集也会对人类健康造成危害[6-7].因此,开展鲍健康养殖方式势在必行.
益生菌能够有效改善水环境,调节养殖动物体内微生态平衡,提高宿主免疫水平和消化酶活性,在促进水产养殖对象生长发育与预防病害中发挥重要作用,成为水产养殖业的研究应用焦点[8],益生菌取代抗生素也成为未来的发展趋势[9].1974年,Parker定义益生菌为有助于肠道菌群平衡的微生物和物质[10].1986年,Kozasa将益生菌应用于水产养殖中[11].此后,益生菌水产养殖研究迅速发展,在作为饲料微生态添加剂和水体微生态调节剂上都发挥巨大的作用.2001年,食品农业组织(FAO)和世界卫生组织(WHO)完善了它的定义,将益生菌定义为有活性的微生物,当其适量施用时,能够赋予宿主健康[12].目前已经发现了多种可以用于养殖的益生菌,包括革兰氏阴性菌和革兰氏阳性菌,其来源通常是宿主动物的消化道[13].芽孢杆菌是一种重要的益生菌,革兰氏阳性,大多好氧或兼性厌氧,具有极强的产孢能力;且其分解转化和适应能力强,可代谢产生蛋白酶、淀粉酶、酯酶等多种酶类,提高养殖对象对饲料的吸收与转化,并能够降解水体中的氨氮、亚硝酸盐,抑制病原菌的生长[14-15].在过去30年,芽孢杆菌属已扩展至超过100种,但可用作养殖益生菌的菌种并不多[16].目前,益生菌在水产养殖中的应用主要集中在鱼类、甲壳类和双壳类,关于鲍等腹足类的益生菌研究相对较少,许多在鲍养殖中使用与研究的益生菌多从其他水生动物或水体中提取,效果并不明显.
同温层芽孢杆菌(Bacillusstratosphericus)A3440菌株是从健康杂色鲍(Haliotisdiversicolor)肠道分离筛选获得的,研究发现其具有5种消化酶活性,包括蛋白酶、脂肪酶、淀粉酶、褐藻酸钠酶和纤维素酶,其中以蛋白酶活力最强;并通过初步检测其安全性发现不产生溶血素,且在菌株生物量为1×108cfu/g (cfu,colony-forming units,指单位体积中的细菌群落总数)时对鲍无明显的毒害作用,可以作为益生菌应用于鲍养殖[17].本研究以芽孢率和蛋白酶活力为指标,通过单因素试验和正交试验对同温层芽孢杆菌A3440菌株芽孢率和蛋白酶活力的发酵条件优化,为工业化生产提供理论依据与参考.
1材料与方法
1.1菌株
同温层芽孢杆菌A3440菌株由厦门大学海洋与地球学院分离保存.
1.2基础发酵培养基和种子培养
以2216E液体培养基作为基础发酵培养基:蛋白胨5 g/L,酵母膏1 g/L,磷酸高铁0.01 g/L,过滤陈海水1 L.将A3440菌株接种于100 mL培养基,200 r/min、30 ℃摇床培养20 h后作为种子培养液备用.
1.3实验方法
1.3.1生长曲线的测定
为选择合适生长时期的菌液作为种子液,进行A3440菌株生长曲线的测定.将1 mL种子液接种于100 mL基础培养基(即接种量为1%),200 r/min、30 ℃摇床培养.每隔2 h取样,以基础培养基为空白,测定发酵液在630 nm条件下的吸光度(OD630).以培养时间为横坐标,OD630为纵坐标,绘制A3440菌株的生长曲线,以选择对数生长期为最佳接种时间.
1.3.2芽孢率的测定
采用稀释平板计数法,选取3个梯度为106,107,108,每个梯度涂布3个平板,30 ℃培养48 h后进行计数.将菌液80 ℃水浴10 min后稀释平板计数,按以下方程式计算A3440菌株的芽孢率:

1.3.3蛋白酶活力的测定
The Position of Khan Kharangui in Mongolian Heroic Epics
用100 μg/mL的酪蛋白标准溶液配置标准系列溶液,酪蛋白终质量浓度分别为0,10,20,30,40,50 μg/mL,使用改良型Lowey法蛋白浓度测定试剂盒(上海生工生物工程股份有限公司)处理,以蒸馏水作为空白对照,在酶标仪上测定其OD630,绘制标准曲线(图1).

图1 酪蛋白标准曲线Fig.1Standard curve of casein
参照张映京等的方法[18]测定蛋白酶活力.取发酵菌液1 mL,8 000 r/min离心15 min,分别取0.2 mL加入2个1.5 mL离心管,标记为试验组与空白组.40 ℃水浴2 min,空白组加入0.4 mol/L三氯乙酸0.4 mL.各组加入1%(质量分数)酪蛋白0.8 mL,40 ℃保温20 min.试验组加入0.4 mol/L三氯乙酸0.4 mL,保温20 min.4 000 r/min离心10 min,取上清,稀释100倍.取20 μL于酶标板,以20 μL蒸馏水作为对照.使用改良型Lowey法蛋白浓度测定试剂盒处理,在酶标仪上测定其OD630.在上述反应条件下,每分钟水解酪蛋白产生1 μg 酪氨酸的酶量为1个酶活力单位.计算公式:酶活力(U/mL)=ΔOD×1×N/(k×20).其中ΔOD为试验组与空白组的OD630差值,N为酶液的稀释倍数,k为标准曲线斜率,1表示1 mL发酵菌液,20表示反应20 min.
1.3.4培养基组分的选择
在其他培养条件不变的情况下:1) 将基础培养基中的蛋白胨替换为等质量的淀粉、乳糖、葡萄糖、蔗糖、麦芽糖为菌株提供碳源,以不加碳源的培养基作为阴性对照;2) 将基础培养基中的酵母膏替换为等质量的牛肉膏、硫酸铵、硝酸铵、乙酸铵为菌株提供氮源,以不加氮源的培养基作为阴性对照;3) 将基础培养基中的陈海水替换为10 g/L NaCl、KCl、MgSO4、CaCl2为菌株提供无机盐,以不加无机盐的培养基作为阴性对照;4) 将基础培养基中的磷酸高铁(Fe3+)替换为等物质的量Mg2+、Ca2+、Zn2+、Cu2+为菌株提供金属离子,以不加金属离子的培养基作为阴性对照.上述实验均以基础培养基作为阳性对照,探究最优碳源、氮源、无机盐和金属离子.
1.3.5培养基组分的正交优化
根据以上实验结果,选择最优碳源、氮源、无机盐、金属离子设计4因素4水平正交试验,如表1所示.

表1 A3440菌株培养基组分的正交试验因子
1.3.6发酵条件的选择

图2 A3440菌株的生长曲线Fig.2Growth curve of A3440
根据正交试验结果配制发酵培养基,在其他培养条件不变的情况下:1) 分别在20,25,30,35,40 ℃培养,确定最优培养温度;2) 分别以1%,3%,5%,8%,10%接种量加入种子液,确定最优接种量;3) 在250 mL锥形瓶中分别加入20,30,40,50,60,70 mL培养基,确定最优装液量;将培养基初始pH分别调节至5.0,6.0,7.0,8.0,9.0,10.0,11.0,确定最优初始pH.
1.3.7数据处理
采用SPSS 17.0软件进行统计分析,通过Duncan氏多重比较分析组间差异显著性,显著性水平为0.05.
2结果与分析
2.1A3440菌株种子液培养时间的确定
对A3440菌株进行生长曲线的绘制(图2),结果表明:在0~10 h,菌体生长速度缓慢;在10~28 h,菌体生长速度加快;从28 h开始,菌体生长速度逐渐减小.因此,选择处于生命力旺盛的对数期菌体作为种子液,即选择24~26 h作为种龄.
2.2培养基组分对A3440菌株蛋白酶活力、生物量与芽孢率的影响

相同字母代表组间无显著差异(下同).图3 不同培养基组分对A3440菌株蛋白酶活力的影响Fig.3Effects of different culture medium components on protease activity of A3440

图4 不同培养基组分对A3440菌株生物量和芽孢率的影响Fig.4Effects of different culture medium components on viable count and yield spore production of A3440
碳源、氮源、无机盐和金属离子的优化结果如图3和4所示.碳源优化实验(图3(a)、图4(a))中,以蛋白胨、蔗糖、乳糖作为碳源,芽孢率较大,均在85%以上,但蛋白胨作为碳源,生物量和蛋白酶活力都显著高于其他组(p<0.05),因此选择蛋白胨作为最优碳源.氮源优化实验(图3(b)、图4(b))结果显示以酵母膏、乙酸铵、牛肉膏作为氮源,芽孢率较大,都在80%以上,但酵母膏作为氮源,生物量和蛋白酶活力都高于其他组,其中生物量对比其他组差异显著(p<0.05),因此选择酵母膏作为最优氮源.无机盐优化实验(图3(c)、图4(c))中各实验组芽孢率并无显著差异(p>0.05),以NaCl作为无机盐,生物量显著高于其他组(p<0.05),且NaCl作为无机盐时,发酵液的蛋白酶活力最强,因此选择NaCl作为最优无机盐.金属离子优化实验(图3(d)、图4(d))中,以Fe3+和Ca2+作为金属离子时,发酵液蛋白酶活力较高,但两者并无显著性差异(p>0.05),以Ca2+作为金属离子时,有最高的生物量和芽孢率,因此选择Ca2+作为最优金属离子.
2.3A3440菌株培养基组分的正交优化
正交试验极差分析结果(表2)表明,R蛋白胨>RNaCl>R酵母膏>RCaCl2,可知蛋白胨作为主要的影响因素,NaCl次之.由均值k得出:蛋白胨7 g/L,酵母膏7 g/L,NaCl 20 g/L,CaCl20.20 g/L为最佳培养基组合,以此进行发酵条件优化.

表2 A3440菌株培养基组分的正交试验结果
注:k1~k4表示各因素水平下蛋白酶活力的平均值;R表示极差.
2.4培养条件对A3440菌株蛋白酶活力、生物量与芽孢率的影响

图5 不同培养条件对A3440菌株蛋白酶活力的影响Fig.5Effects of different culture conditions on protease activity of A3440
培养条件优化结果如图5和6所示.在30和35 ℃时,发酵液的蛋白酶活力最高,但随着温度的升高,发酵液的芽孢率不断降低,35 ℃时的芽孢率显著低于30 ℃时(p<0.05) (图5(a)、图6(a)).接种量为3%~8%时,蛋白酶活力较高,但接种量为5%时生物量偏低,接种量为8%时生物量最高(图5(b)、图6(b)).装液量为20~40 mL时,各试验组的蛋白酶活力、生物量与芽孢率较高,但并无显著性差异(p>0.05),其中装液量为30 mL时具有最高的生物量和芽孢率(图5(c)、图6(c)).初始pH值为7.0~10.0时,发酵液具有最高的蛋白酶活力和生物量,显著高于其他试验组(p<0.05),其中当初始pH为9.0时,蛋白酶活力和芽孢率最高(图5(d)、图6(d)).综上所述,最优培养条件为:初始pH 9.0,培养温度30 ℃,种子液接种量8%,装液量30 mL(250 mL锥形瓶).
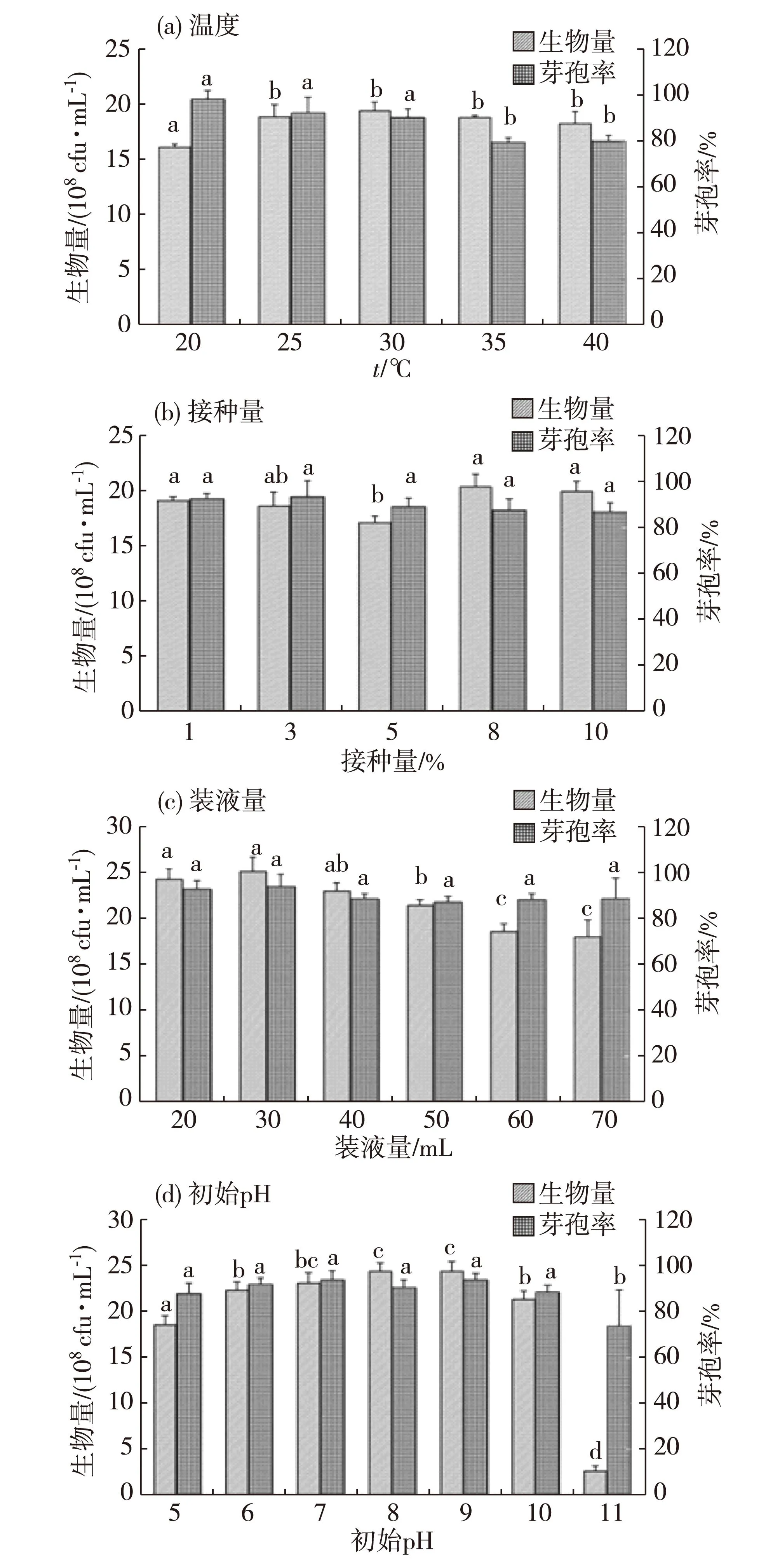
图6 不同培养条件对A3440菌株生物量和芽孢率的影响Fig.6Effects of different culture conditions on viable count and yield spore production of A3440
所有发酵培养基和培养条件优化后,芽孢率为94.3%,较基础培养基提高8.77%;蛋白酶活力为294.44 U/mL,较基础培养基提高76.67%.
3讨论
幼鲍饵料中含有大量的蛋白成分,芽孢杆菌进入肠道后产生较强活性的蛋白酶,有助于幼鲍对饵料的消化,进而提高饵料消化率,促进幼鲍的生长[19].相比于动物蛋白酶、植物蛋白酶和真菌蛋白酶,微生物蛋白酶更多地被运用于工业生产中.芽孢杆菌具有快速产酶能力,其生产的碱性蛋白酶具有很高的蛋白水解活性和在碱性条件下的稳定性[20-21],几乎包括了能够应用于生物技术的所有特征[22],因此本研究选择蛋白酶活力作为一项指标.
在益生菌投喂过程中,必须保证足够的活菌量.在不良运输与加工条件下,芽孢杆菌能形成芽孢,使其具有抗逆性强、耐高温高压、易贮存的特点[23],因此本研究选择芽孢率作为另一项指标.
在培养基优化实验中,发现以蛋白胨和酵母膏分别作为碳、氮源时,具有最高的蛋白酶活力与芽孢率.蛋白胨的主要成分为氨基酸、多肽,一般蛋白质含量会达到80%以上,糖类含量较低;酵母膏中含有多种氨基酸、肽类、水溶性纤维素.由此说明同温层芽孢杆菌A3440菌株在丰富氨基酸、多肽培养基条件下有更强的活性.
从培养条件优化结果可以看出,同温层芽孢杆菌A3440菌株的适合培养范围较广.装液量与蛋白酶活力和芽孢率都呈负相关性,装液量反映了菌株的通气量需求,表明同温层芽孢杆菌A3440菌株为好氧菌,在实际生产过程中应注意适当提高通气量.同温层芽孢杆菌A3440菌株的最适培养pH值为9.0,与郎双静等[24]、舒丹等[25]、胡承等[26]的实验结果相近,推测同温层芽孢杆菌A3440菌株为产碱性蛋白酶菌株.多个实验结果可以看出,同温层芽孢杆菌A3440菌株蛋白酶活力与芽孢率的最适条件接近,但并不一致,因此实际生产中的最适条件有待进一步研究.
本研究对同温层芽孢杆菌A3440菌株芽孢率和蛋白酶活力的发酵条件进行了优化,在优化条件下芽孢率为94.3%,较基础培养基提高8.77%;蛋白酶活力为294.44 U/mL,较基础培养基提高76.67%.研究结果为进一步放大优化以及工业化生产奠定了基础.
参考文献:
[1]MOHAPATRA S,CHAKRABORTY T,PRUSTY A K,et al.Use of different microbial probiotics in the diet of rohu,Labeo rohita fingerlings:effects on growth,nutrient digestibility and retention,digestive enzyme activities and intestinal microflora[J].Aquaculture Nutrition,2012,18(1):1-11.
[2]ALDAY-SANZ V,CORSIN F,IRDE E,et al.Survey on the use of veterinary medicines in aquaculture[M]∥BONDAD-REANTASO M G,ARTHUR J R,SUBASINGHE R P.Improving biosecurity through prudent and responsible use of veterinary medicine in aquatic food production.Roma:FAO,2012:29-45.
[3]柯才焕.我国鲍鱼养殖产业现状与展望[J].中国水产,2013(1):27-30.
[4]谢凤行,赵玉洁.几种微生态制剂在水产养殖中的研究进展和展望[J].天津农业科学,2007,12(4):18-21.
[5]杨火盛.福建省鲍的养殖生产及病害流行情况调查[J].福建水产,2009(4):43-47.
[6]王亚敏,王印庚.微生态制剂在水产养殖中的作用机理及应用研究进展[J].动物医学进展,2008,29(6):72-75.
[7]SAPKOTA A,SAPKOTA A R,KUCHARSKI M,et al.Aquaculture practices and potential human health risks:current knowledge and future priorities[J].Environment International,2008,34(8):1215-1226.
[8]高权新,施兆鸿,彭士明.益生菌在水产养殖中的研究进展[J].海洋渔业,2013,35(3):364-372.
[9]KUMAR R,MUKHERJEE S C,RANJAN R,et al.Enhanced innate immune parameters inLabeorohita(Ham.) following oral administration ofBacillussubtilis[J].Fish & Shellfish Immunology,2008,24(2):168-172.
[10]PARKER R B.Probiotics,the other half of the antibiotic story[J].Animal Nutrition and Health,1974,29(4):8.
[11]KOZASA M.Toyocerin (Bacillustoyoi) as growth promotor for animal feeding[J].Microbiol Aliment Nutr,1986,4(1):121-135.
[12]HOTEL A C P.Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria[M]∥GILLILAND S E,MORELLI L,REID G.Joint FAO/WHO expert consultation on evaluation of health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria.Roma:FAO,2001:1-33.
[13]NEWAJ-FYZUL A,AL-HARBI A H,AUSTIN B.Review:developments in the use of probiotics for disease control in aquaculture[J].Aquaculture,2014,431:1-11.
[14]LIU C H,CHIU C S,HO P L,et al.Improvement in the growth performance of white shrimp,Litopenaeusvannamei,by a protease-producing probiotic,BacillussubtilisE20,from natto[J].Journal of Applied Microbiology,2009,107(3):1031-1041.
[15]王志丽,管越强,王颖,等.养殖中华鳖肠道中芽孢杆菌的分离鉴定及其噬菌体的分离和性质分析[J].水产科学,2012,31(7):419-424.
[16]LEE J H,NAM S H,SEO W T,et al.The production of surfactin during the fermentation of cheonggukjang by potential probioticBacillussubtilisCSY191 and the resultant growth suppression of MCF-7 human breast cancer cells[J].Food Chemistry,2012,131(4):1347-1354.
[17]蒋庆茹,柯才焕,虞晋晋,等.杂色鲍肠道益生菌的分离和鉴定[J].厦门大学学报 (自然科学版),2012,51(4):782-788.
[18]张映京.南极中山站沉积物宏基因组文库的构建及碱性蛋白酶基因 ACPRO001 的克隆,表达和性质分析[D].厦门:厦门大学,2009:26.
[19]陈永青,林亮,杨莺莺,等.微生态制剂在水产养殖中的应用[J].生态科学,2005,24(1):80-83.
[20]LIANG T W,HSIEH J L,WANG S L.Production and purification of a protease,a chitosanase,and chitin oligosaccharides byBacilluscereusTKU022 fermentation[J].Carbohydrate Research,2012,362:38-46.
[21]JOSHI S,SATYANARAYANA T.Characteristics and applications of a recombinant alkaline serine protease from a novel bacteriumBacilluslehensis[J].Bioresource Technology,2013,131:76-85.
[22]PADMAPRIYA B,RAJESWARI T,NANDITA R,et al.Production and purification of alkaline serine protease from marineBacillusspecies and its application in detergent industry[J].European Journal of Applied Sciences,2012,4(1):21-26.
[23]鲍振国,张文举,胡猛,等.芽孢杆菌的研究进展及其在动物生产中的应用[J].饲料博览,2012(1):17-20.
[24]郎双静,张东杰.地衣芽孢杆菌碱性蛋白酶改性大豆分离蛋白工艺条件的优化[J].农产品加工(学刊),2012(7):59-62.
[25]舒丹,李宏,严建华,等.高温芽孢杆菌碱性蛋白酶发酵条件及酶性质研究[J].四川大学学报(自然科学版),2004(4):856-860.
[26]胡承,彭勇,王忠彦,等.地衣芽孢杆菌碱性蛋白酶的研究Ⅰ:碱性蛋白酶高产菌的筛选及产酶条件初探[J].工业微生物,1999(4):27-30.
Optimization of Culture Medium and Fermentation Conditions of Probiotics Bacillus stratosphericus A3440 from Farmed Abalone
LING Yuheng,WU Shufei,KE Caihuan,ZHAO Jing*
(College of Ocean & Earth Sciences,Xiamen University,Xiamen 361102,China)
Abstract:Bacillus stratosphericus A3440 isolated from farmed abalone Haliotis diversicolour has been verified as probiotic to improve the growth rate and the disease resistance of abalone.Based on high yield spore production and strong protease activity,the culture medium and fermentation conditions of B. stratosphericus A3440 were optimized using a single factor test and orthogonal experiments.The results showed that the optimized medium components of A3440 were peptone 7 g/L,yeast extract 7 g/L,NaCl 20 g/L,CaCl2 0.20 g/L and the optimized culture conditions were initial pH 9.0,temperature 37 ℃,inoculation amount 8%,liquid volume 30 mL (in 250 mL flask),and cultivation for 24 h.Under the optimized fermentation conditions,the spore yield was up to 94.3%, which increased by 8.77% compared with that from the initial medium,and the protease activity was 294.44 U/mL,which increased by 76.67% compared with that from the initial culture conditions.
Key words:Bacillus stratosphericus;culture medium;fermentation condition;protease activity;spore yield
doi:10.6043/j.issn.0438-0479.2016.03.006
收稿日期:2015-06-18录用日期:2015-08-18
基金项目:国家自然科学基金(31202014);福建省科技计划重点项目(2013N0034)
*通信作者:sunnyzhaoj@xmu.edu.cn
中图分类号:Q 939.9
文献标志码:A
文章编号:0438-0479(2016)03-0336-07
引文格式:凌宇恒,吴淑妃,柯才焕,等.鲍肠道益生菌芽孢杆菌A3440菌株培养基及发酵条件优化.厦门大学学报(自然科学版),2016,55(3):336-342.
Citation:LING Y H,WU S F,KE C H,et al.Optimization of culture medium and fermentation conditions of probioticsBacillusstratosphericusA3440 from farmed abalone.Journal of Xiamen University(Natural Science),2016,55(3):336-342.(in Chinese)
