醛基功能化喹啉螺旋折叠体的合成及手性识别研究
2016-06-22吴雯路刘宇宸林建斌江云宝
吴雯路,黎 朝,刘宇宸,林建斌,江云宝
(厦门大学 化学化工学院,谱学分析与仪器教育部重点实验室,福建厦门361005)
醛基功能化喹啉螺旋折叠体的合成及手性识别研究
吴雯路,黎朝,刘宇宸,林建斌,江云宝*
(厦门大学 化学化工学院,谱学分析与仪器教育部重点实验室,福建厦门361005)
摘要:设计合成了以8-氨基喹啉-4-甲酸为重复结构单元,氨基端修饰(1S,4R)-坎烷酰基,羧基端醛基功能化的螺旋折叠体分子1g~4g,进而应用这类折叠体分子探讨螺旋结构与手性选择性之间的关系.通过折叠体端基选择的外识别方式实现对手性萘乙胺对映异构体的选择性.实验表明,3g对手性萘乙胺的手性选择性最好(产物m(R3g)/m(S3g)=1.00/4.10),说明螺旋结构的形成有利于3g对手性萘乙胺的选择性识别.
关键词:螺旋折叠体;手性识别;外识别
手性即物和其镜像不能重合的现象.化合物分子仅是手性的差异便能在生物活性方面表现出明显的差异.DNA和多肽等天然螺旋结构在对手性分子高效选择性识别过程中,其自身螺旋构象起着至关重要的作用.因此,通过人工折叠体模拟天然螺旋结构来研究生命体内结构与功能之间的关系,对认识生命过程有着深远的意义.
折叠体是建立在超分子化学、物理有机化学、化学生物学等多学科基础上发展的新兴学科[1-4].其概念为一类人工合成的,受非共价作用驱动而形成的具有稳定有序构象的寡聚物或聚合物[5].折叠体可分为以多肽为骨架结构的脂肪类和以氮杂环化合物为骨架结构的芳香类两大类.目前,折叠体在手性诱导[6]、手性传递[7]、手性识别[8]与手性检测[9]等方面已有相关研究.但在折叠体识别手性分子的研究中,大多基于折叠体形成的内部空腔包裹手性小分子的方式进行识别(即内识别方式),该方式要求折叠体具有足够的链长以保证所形成的内腔尺寸,因而对折叠体的合成提出了极高的要求.而基于端基选择的外识别方式的研究却鲜见报道,这种方式对链长要求较低同时识别过程还可实现螺旋链的增长[10].Jiang等报道了具有多个喹啉酰胺结构单元的螺旋折叠体分子[11],当具有2个及2个以上喹啉酰胺结构时,结构单元间受分子内氢键作用驱动形成螺旋结构,而当喹啉结构单元数为2.5时,即可形成较完整的螺旋环状结构.
本文在螺旋结构氨基端修饰(1S,4R)-坎烷酰基诱导形成单一右手螺旋折叠体[12],羧基端醛基功能化并合成具有不同结构单元数目的分子1g~4g(图1).通过醛基端基选择的外识别方式与手性萘乙胺(NEA)作用模拟天然螺旋结构的手性选择,考察螺旋结构的形成对手性选择性识别的影响.研究结果表明,具有一个完整螺旋环结构的3g对手性NEA具有突出的选择性.
1实验部分
1.1仪器与试剂
Bruker AV400和AV500核磁共振(NMR)仪,Bruker En Apex ultra 7.0T傅里叶变换质谱(FT-MS)仪.
邻硝基苯胺(98%,质量分数,下同),二氧化硒(99%),巴豆醛(98%),钯碳(10%)购买自阿拉丁试剂公司,(1S,4R)-坎烷酰氯(98%)购买自百灵威公司,R-/S-NEA(99%)购买自安耐吉公司.氘代试剂购自Sigma-Aldrich公司.其余均为国药集团药业股份有限公司试剂.
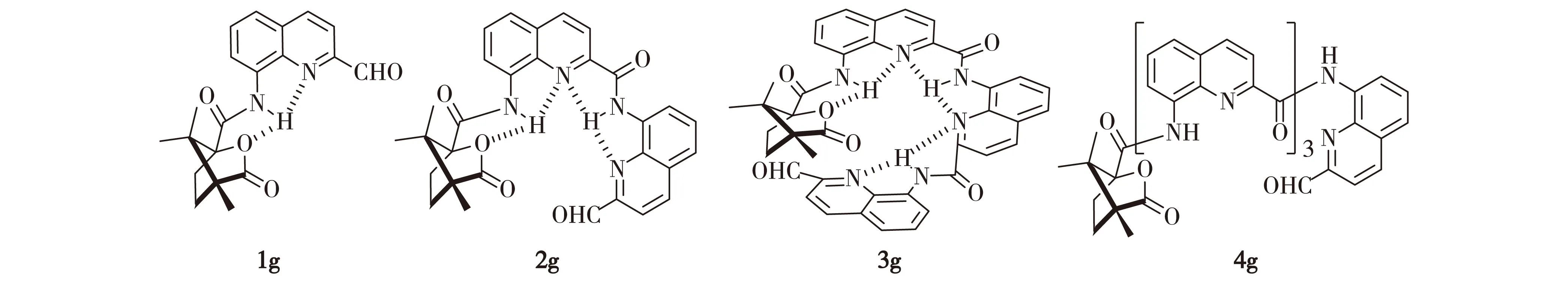
图1 1g~4g分子结构Fig.1Chemical structures of 1g-4g
1.21g~4g分子的合成与鉴定
如图2所示,1a(2.19 g,9.4 mmol)溶解于50 mL甲醇,加入铁粉(1.58 g,28.2 mmol),9.4 mL乙酸,回流搅拌反应4 h.过滤除去铁粉得到滤液,用二氯甲烷(30 mL×3,即每次30 mL,洗涤3次,下同)洗涤滤渣,合并滤液并旋转蒸发除去有机溶剂.所得固体溶解于100 mL乙酸乙酯中,依次用饱和碳酸氢钠溶液(100 mL×3)和饱和氯化钠水溶液(100 mL×3)洗涤,无水硫酸钠干燥,旋转蒸发除去有机溶剂,得到棕色油状1b(1.71 g,8.5 mmol),产率90.0%.

反应条件:(1) Fe,AcOH,MeOH,NaOH,回流;(2) (1S,4R)-坎烷酰氯,二氯甲烷,三乙胺,0~25 ℃;(3) NaBH4,0~25 ℃;(4) SeO2,1,4-二氧六环,90 ℃;(5) 二氯亚砜,二氧甲烷,三乙胺,0~25 ℃.图2 1g~4g的合成Fig.2Synthesis of 1g-4g
1b(1.01 g,5.0 mmol)溶解于50 mL干燥的二氯甲烷中,加入三乙胺(2.1 mL,15.0 mmol),氮气保护并保持冰浴条件.(1S,4R)-坎烷酰氯(1.29 g,6.0 mmol)溶解于10 mL二氯甲烷并滴加入反应体系.恢复室温搅拌反应24 h,旋转蒸发除去有机溶剂.所得固体溶于80 mL乙酸乙酯中,依次用饱和碳酸氢钠溶液(80 mL×3)和饱和氯化钠水溶液(80 mL×3)洗涤,无水硫酸钠干燥.旋转蒸发除去有机溶剂,硅胶色谱柱纯化,洗脱剂为二氯甲烷,得到浅黄色固体1c(1.75 g,4.6 mmol),产率92.0%.
1c(0.76 g,2.0 mmol)溶解于30 mL四氢呋喃中,硼氢化钠(0.76 g,20.0 mmol)溶解于30 mL乙醇,乙醇溶液滴加入四氢呋喃溶液中并保持冰浴条件.滴加完毕后,恢复室温反应16 h,加入8 mL碳酸氢钠和8 mL水终止反应.旋转蒸发除去有机溶剂,二氯甲烷(30 mL×2)萃取水层,饱和氯化钠水溶液(50 mL×2)洗涤有机相,无水硫酸钠干燥,旋转蒸发除去有机溶剂.硅胶色谱柱纯化,洗脱剂为V(二氯甲烷)∶V(甲醇)=100∶0.4,得到产物为浅黄色固体1d(0.40 g,1.1 mmol),产率55.0%.
1d(0.40 g,1.1 mmol)溶解于20 mL 1,4-二氧六环,加入二氧化硒(0.24 g,2.2 mmol),90 ℃下反应2 h.冷却至室温,砂芯漏斗过滤得到滤液,30 mL二氯甲烷洗涤固体,旋转蒸发除去有机溶剂.硅胶色谱柱纯化,洗脱剂为二氯甲烷.得到产物为浅黄色固体1g(0.31 g,0.9 mmol),产率80.0%.
b(2.18 g,10.0 mmol)于25 mL圆底烧瓶,加入10 mL二氯亚砜,保持40 ℃搅拌反应4 h,旋转蒸发除去有机溶剂,备用.1b(2.02 g,10.0 mmol)用50 mL干燥的二氯甲烷溶解于滴液漏斗中,加入三乙胺(4.2 mL,30 mmol),缓慢滴加入上述备用化合物中,反应12 h.反应完毕后,旋转蒸发除去有机溶剂,依次用乙醇与乙醚洗涤得到部分纯产物.旋转蒸发除去洗液,硅胶色谱柱纯化,洗脱剂为二氯甲烷.合并两次产物,得到黄色固体2a(3.78 g,9.4 mmol),产率94.0%.3a和4a 的合成与2a类似.
2g~4g合成步骤按图2中的条件(1)~(4)进行,不再赘述.2g为淡黄色固体,总产率17.3%;3g为黄色固体,总产率4.8%;4g为黄色固体,总产率2.2%.
产物1g~4g的NMR鉴定及FT-MS鉴定结果依次如下:
1)1H-NMR (400 MHz,CDCl3):δ10.74 (s,1H),10.29 (d,J=0.8 Hz,1H),8.89 (dd,J=7.6,1.4 Hz,1H),8.35 (dd,J=8.5,0.6 Hz,1H),8.11 (d,J=8.4 Hz,1H),7.74~7.69 (m,1H),7.66 (dd,J=8.3,1.4 Hz,1H),2.70 (ddd,J=13.3,10.6,4.3 Hz,1H),2.14 (ddd,J=13.4,9.2,4.6 Hz,1H),2.09~2.01 (m,1H),1.85~1.79 (m,1H),1.24 (s,3H),1.20 (s,3H),1.07 (s,3H).13C-NMR (125 MHz,CDCl3):δ193.01,177.66,165.98,150.70,138.31,137.69,134.40,130.10,129.94,122.36,117.91,117.83,92.64,55.51,54.40,30.64,29.21,16.80,16.71,9.80.MS(m/z):理论相对分子质量[M+H]+为353.150 1,测定值为353.149 4.
2)1H-NMR (500 MHz,CDCl3):δ11.98 (s,1H),10.63 (s,1H),10.33 (s,1H),9.12~9.00 (m,2H),8.54 (d,J=8.4 Hz,1H),8.47 (d,J=8.5 Hz,1H),8.39 (d,J=8.4 Hz,1H),8.11 (d,J=8.4 Hz,1H),7.79 (t,J=7.9 Hz,1H),7.72 (dd,J=11.9,6.5 Hz,3H),2.73 (ddd,J=14.8,10.9,4.3 Hz,1H),2.19 (ddd,J=13.8,9.3,4.5 Hz,1H),1.98 (ddd,J=15.3,10.9,4.5 Hz,1H),1.66 (ddd,J=13.4,9.3,4.3 Hz,1H),1.18 (s,3H),0.97 (s,3H),0.91 (s,3H).13C-NMR (125 MHz,CDCl3):δ193.68,176.72,166.25,162.85,150.79,149.62,138.97,138.36,137.47,137.31,135.14,134.01,130.06,129.91,129.47,128.98,122.73,122.39,120.17,118.34,118.15,117.75,92.42,55.20,54.46,30.65,28.99,16.77,16.55,9.59.MS(m/z):理论相对分子质量[M+H]+为523.198 1,测定值为523.198 3.
3)1H-NMR (500 MHz,CDCl3):δ12.28 (s,1H),12.25 (s,1H),10.16 (s,1H),9.17 (d,J=7.7 Hz,1H),9.08 (d,J=7.3 Hz,1H),8.53 (dd,J=23.0,8.5 Hz,3H),8.46 (dd,J=8.4,5.0 Hz,2H),8.05 (d,J=8.3 Hz,1H),7.94 (dd,J=7.6,1.1 Hz,1H),7.80~7.73 (m,3H),7.65~7.59 (m,1H),7.57 (dd,J=8.3,1.0 Hz,1H),7.35 (t,J=8.0 Hz,1H),7.24 (d,J=8.4 Hz,1H),2.28 (ddd,J=13.4,10.8,4.3 Hz,1H),1.96 (ddd,J=13.5,9.3,4.5 Hz,1H),1.82 (ddd,J=13.0,10.8,4.5 Hz,1H),1.68~1.62 (m,1H),0.87 (d,J=7.6 Hz,6H),0.57 (s,3H).13C-NMR (101 MHz,CDCl3):δ190.71,176.61,165.02,163.62,162.38,149.20,149.08,139.18,138.16,138.11,137.83,137.12,136.42,135.13,134.49,132.79,130.11,129.77,129.51,129.34,128.99,128.75,122.51,122.17,122.02,119.83,117.62,117.06,116.81,116.70,91.98,54.93,54.25,29.32,28.82,16.38,16.35,9.65.MS (m/z):理论相对分子质量[M+H]+为715.228 1,测定值为715.228 5.
4)1H-NMR (500 MHz,CDCl3):δ12.42 (s,1H),11.90 (s,1H),11.63 (s,1H),9.98 (s,1H),9.20 (d,J=7.4 Hz,1H),8.68 (d,J=7.5 Hz,1H),8.47 (dd,J=14.8,7.5 Hz,4H),8.09 (t,J=7.8 Hz,2H),7.99 (d,J=8.3 Hz,1H),7.95 (d,J=7.5 Hz,1H),7.90 (d,J=7.5 Hz,1H),7.80 (d,J=7.9 Hz,1H),7.76 (t,J=7.9 Hz,1H),7.71 (d,J=7.8 Hz,1H),7.66 (d,J=8.2 Hz,2H),7.57 (t,J=7.8 Hz,2H),7.37 (dd,J=16.3,8.2 Hz,2H),7.21 (d,J=8.3 Hz,1H),2.32 (t,J=9.7 Hz,1H),2.15 (d,J=9.5 Hz,1H),1.84~1.74 (m,1H),0.81 (s,3H),0.77 (s,3H),0.40 (s,3H).13C-NMR (125 MHz,CDCl3):δ190.52,176.51,164.88,163.58,160.76,160.63,149.14,149.06,148.77,147.28,138.79,138.74,138.18,137.72,137.10,137.05,136.18,134.67,134.03,133.49,132.52,129.82,129.76,129.57,129.28,129.24,129.10,128.59,128.47,122.54,122.37,122.08,121.93,119.80,119.53,118.65,117.90,116.95,116.64,116.54,116.07,92.04,54.83,54.25,29.68,29.17,28.80,16.25,9.56.MS (m/z):理论相对分子质量[M+H]+为885.276 1,测定值为885.275 5.

图3 3g分别与R-NEA和S-NEA作用的化学结构示意图Fig.3Chemical structures of 3g with R-NEA and S-NEA separately
1.3实验方法
1.3.1样品配制
1g~4g溶液(A)配制:称取相应量醛基化合物溶于1.00 mL氘代三氯甲烷,配成浓度为0.015 mol/L母液.
R-/S-NEA溶液配制:称取2.6 μgR-/S-NEA溶于1.00 mL氘代二甲亚砜,配成浓度为0.015 mol/L的母液.
1g~4g分别与R-/S-NEA作用的反应速率测定实验溶液配制:0.20 mL A+0.20 mLR-NEA(或S-NEA)+0.20 mL氘代二甲亚砜.
1g~4g手性选择性竞争实验溶液配制:0.20 mL A+0.20 mLR-NEA+0.20 mLS-NEA.
1.3.2动力学拟合
反应遵循一级动力学[8],反应速度方程式为:
r=-dc/dt=kc.
其中c为t时化合物浓度,dc为时间dt时浓度,t为反应时间,k为一级动力学反应速率常数.
经过推导可得
-ln(c/c0)=kt,
其中c0为起始浓度.
2结果与讨论
2.11g~4g分别与R-/S-NEA作用的反应速率分析
实验检测过程以3g分别与R-/S-NEA作用为例进行说明.3g与R-NEA和S-NEA作用生成2种产物(图3),运用NMR技术进行实时监测(图4),对NMR吸收峰面积积分并计算相应手性产物的含量.类似地,对1g、2g和4g分别与R-/S-NEA作用情况进行分析.通过一级动力学方程拟合(图5),得到相应反应速率数据(表1).
由表1可见,1g~3g随着喹啉酰胺单体数目的增多,反应速率逐渐减小.由于从1g到3g螺旋结构逐渐形成,使得在与手性NEA作用时作用位点处空间位阻不断增大,从而导致其与R-/S-NEA作用的反应速率逐渐减低.有趣的是,4g的反应速率较3g的反应速率大,这可能是由于3g恰好形成一个完整的螺旋环结构,(1S,4R)-坎烷酰基对醛基具有较大的空间位阻效应,降低了醛基与NEA的作用.而4g是在形成螺旋环后又增加一个喹啉单体结构,导致螺旋结构继续延伸,这样便使(1S,4R)-坎烷酰基远离醛基,空间位阻降低.因此在刚好形成一个完整的螺旋环结构(3g)时反应速率是最低的.
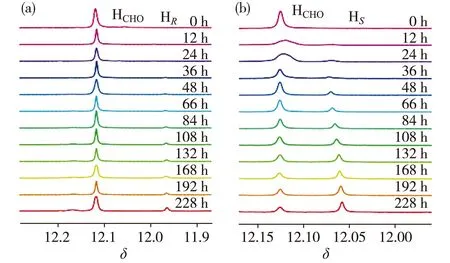
实验条件:在室温25 ℃、V(氘代三氯甲烷)∶V(氘代二甲亚砜)=1∶2的混合溶剂中,3g、R-NEA和S-NEA的浓度均为5 mmol/L.图中HCHO为3g的吸收峰,HR和HS分别为3g与R-NEA和S-NEA作用产生的吸收峰.图4 3g分别与R-NEA(a)和S-NEA(b)作用随时间变化的1H-NMR谱图Fig.4Time dependent 1H-NMR spectra showing reaction of 3g with R-NEA (a) and S-NEA (b) separately

实验条件:在室温25 ℃、V(氘代三氯甲烷)∶V(氘代二甲亚砜)=1∶2的混合溶剂中,1g、2g、3g、4g以及R-NEA和S-NEA浓度均为5 mmol/L.图5 1g (a)、2g (b)、3g (c)、4g (d)分别与R-/S-NEA作用结果的一级动力学拟合Fig.5First-order kinetic plots for the reactions of 1g (a),2g (b),3g (c) and 4g (d) with R-and S-NEA separately
对比1g~4g分别与R-/S-NEA作用的反应速率常数kR和kS可见:由于1g还不具有螺旋结构,1g与R-/S-NEA作用反应速率常数kR与kS基本没有区别.2g与R-/S-NEA作用反应速率常数kR与kS区别仍不显著,此时2g仅仅初步具有螺旋结构,在与手性NEA作用时仍未表达出明显的手性选择性.3g与R-/S-NEA作用的kS为1.38×10-2s-1,kR仅为0.33×10-2s-1,kS约为kR的4倍,说明与R-NEA相比较,3g较容易与S-NEA反应,表现出较好的手性选择性.由于此时3g恰好形成一个完整的螺旋环结构,说明螺旋结构的形成有利于3g对手性NEA选择性识别.4g与R-/S-NEA作用的kR为0.66×10-2s-1,kS为1.77×10-2s-1,说明与R-NEA相比较,4g也较容易与S-NEA反应,与3g结果一致.由于3g与4g结构上的区别,使得R-/S-NEA均较容易与4g作用,导致4g对R-/S-NEA手性选择性较3g差,因此在刚好形成一个完整的螺旋环结构(3g)时对R-/S-NEA手性选择性最好,此时较容易与S-NEA作用.

表1 1g~4g分别与R-/S-NEA作用的反应速率常数
2.21g~4g手性选择性竞争实验
运用NMR技术考察R-NEA和S-NEA等量共存时与1g~4g的作用情况,通过NMR吸收峰积分面积计算2种手性产物的含量,并对时间作图(图6).

实验条件:在室温25 ℃、V(氘代三氯甲烷)∶V(氘代二甲亚砜)=1∶2的混合溶剂中,1g、2g、3g、4g以及R-NEA和S-NEA浓度均为5 mmol/L.图6 1g(a)、2g(b)、3g(c)、4g(d)与R-/S-NEA竞争作用结果Fig.6Plots for the competition reaction of racemic NEA with 1g (a),2g (b),3g (c) and 4g (d)
手性分子只有在作用位点处与螺旋构型具有较高匹配度的情况下才能优先结合获得较大量的产物.实验数据表明,当1g与R-NEA和S-NEA消旋体系进行作用时产物质量比m(R1g)/m(S1g)=1.00/1.00,即1g有基本相同的机会与R-NEA和S-NEA作用,作用过程中没有表现出手性选择性.与R-NEA相比较,2g较容易与S-NEA反应(m(R2g)/m(S2g)=1.00/1.49),可见尽管2g没有形成一个完整的螺旋环结构,但已初步具有一定的手性选择性.3g对手性NEA的选择性最大(m(R3g)/m(S3g)=1.00/4.10),说明随着螺旋结构的逐渐形成,有利于3g对手性NEA的选择性识别.4g对手性NEA选择性(m(R4g)/m(S4g)=1.00/3.90)较3g有所降低,说明恰好形成一个完整的螺旋环结构时对手性NEA的选择性最好.此外,与R-NEA相比较,2g~4g均较容易与S-NEA作用.这一选择性结果总体与2g~4g分别同R-/S-NEA作用时反应速率结果基本一致.
3结论
以喹啉酰胺为结构单元,通过在折叠体羧基末端引入活性官能团结构醛基合成了具有单一螺旋方向的人工螺旋折叠体1g~4g.其中1g对手性NEA没有表现出手性选择性,2g对手性NEA选择性亦不明显.随着螺旋结构的逐渐形成,3g与4g可对不同手性NEA进行选择性识别,说明螺旋结构的形成有助于对手性分子的选择性识别,并且恰好形成一个完整的螺旋环结构时对手性NEA的选择性最好.相较于R-NEA,2g~4g均易与S-NEA作用,说明S-NEA在与醛基作用时,其构型与螺旋构型恰好具有较高匹配度.本文研究结果将为模拟生命物质螺旋结构在手性识别方面研究提供思路.
参考文献:
[1]SEEBACH D,MATTHEWS J L.β-peptides:a surprise at every turn[J].Chem Commun,1997,21:2015-2022.
[2]STIGERS K D,SOTH M J,NOWIEK J S.Designed molecules that fold to mimic protein secondary structures[J].Curr Opin Chem Biol,1999,3(6):714-723.
[3]SANFORD A R,GONG B.Evolution of helical foldamers[J].Curr Org Chem,2003,7(16):1649-1659.
[4]ZHANGTING L.Hydrogen bonded arylamide foldamers:from conformational control to functional evolution[J].Progress Chem,2011,23(1):1-12.
[5]HILL D J,MIO M J,MOORE J S,et al.A field guide to foldamers[J].Chem Rev,2001,101(12):3893-4012.
[6]NONOKAWA R,YASHIMA E.Detection and amplification of a small enantiomeric imbalance inα-amino acids by a helical poly(phenylacetylene) with crown ether pendants[J].J Am Chem Soc,2003,125(5):1278-1283.
[7]BROWN R A,DIEMER V,WEBB S J,et al.End-to-end conformational communication through a synthetic purinergic receptor by ligand-induced helicity switching[J].Nature Chem,2013,5(10):853-860.
[8]WU Z Q,NAGAI K,YASHIMA E,et al.Enantiomer-selective and helix-sense-selective living block copolymerization of isocyanide enantiomers initiated by single-handed helical poly(phenyl isocyanide)s[J].J Am Chem Soc,2009,131(19):6708-6718.
[9]GHOSN M W,WOLF C.Synthesis,conformational stability,and asymmetric transformation of atropisomeric 1,8-bisphenolnaphthalenes[J].J Org Chem,2011,76(10):3888-3897.
[10]BYRNE L,SOLA J,CLAYDEN J.Screw sense alone can govern enantioselective extension of a helical peptide by kinetic resolution of a racemic amino acid[J].Chem Commun,2015,51(54):10965-10968.
[11]JIANG H,LEGER J M,HUC I,et al.Aromatic δ-peptides:design,synthesis and structural studies of helical,quinoline-derived oligoamide foldamers[J].Tetrahedron,2003,59(42):8365-8374.
[12]KENDHAL A M,PONIMAN L,HUC I,et al.Absolute control of helical handedness in quinoline oligoamides[J].J Org Chem,2011,76(1):195-200.
Synthesis and Chiral Recognition of Aldehyde Group Functionalised Quinoline Helical Foldamers
WU Wenlu,LI Zhao,LIU Yuchen,LIN Jianbin,JIANG Yunbao*
(Key Laboratory of Spectrochemical Analysis & Instrumentation,Ministry of Education,College of Chemistry and Chemical Engineering,Xiamen University,Xiamen,361005,China)
Abstract:A series of oligoamides based on the 8-aminoquinoline-4-carboxylic acid repeating unit were designed and synthesized,in which the N-terminus was modified with the (1S,4R)-camphanoyl acyl group and the C-terminus was functionalised with an aldehyde group.These oligoamides were further served as a model compound to investigate the relationship between helical structure and chiral selectively.Our study revealed that 3g exhibited the largest chiral selectivity towards chiral naphthylamine (the relative ratio of competition reaction product m(R3g)/m(S3g)=1.00/4.10) in an exo recognition model,by taking advantage of the formation of a helical structure.
Key words:helical foldamers;chiral recognition;exo recognition
doi:10.6043/j.issn.0438-0479.2016.03.002
收稿日期:2015-08-23录用日期:2015-09-11
基金项目:国家自然科学基金(91127019,21275121,J1030415);国家重点基础研究发展计划(973计划)(2011CB910403)
*通信作者:ybjiang@xmu.edu.cn
中图分类号:O 657.39
文献标志码:A
文章编号:0438-0479(2016)03-0309-07
引文格式:吴雯路,黎朝,刘宇宸,等.醛基功能化喹啉螺旋折叠体的合成及手性识别研究.厦门大学学报(自然科学版),2016,55(3):309-315.
Citation:WU W L,LI Z,LIU Y C,et al.Synthesis and chiral recognition of aldehyde group functionalised quinoline helical foldamers.Journal of Xiamen University(Natural Science),2016,55(3):309-315.(in Chinese)
