基于肺部CT的肿瘤形态与纹理的三维变化检测
2016-06-22黄绍辉黄晓阳王连生王博亮
熊 婷,黄绍辉,黄晓阳,王连生,王博亮
(厦门大学信息科学与技术学院,福建厦门361005)
基于肺部CT的肿瘤形态与纹理的三维变化检测
熊婷,黄绍辉*,黄晓阳,王连生,王博亮
(厦门大学信息科学与技术学院,福建厦门361005)
摘要:提取4个阶段肺部肿瘤CT图像的肿瘤区域,进行三维重建,计算三维肿瘤的形态特征参数和纹理特征参数,研究这两部分参数与肿瘤的变化关系.基于体素和Quick Hull算法计算出肿瘤的形态特征参数,结合灰度共生矩阵计算出4个阶段三维肿瘤的纹理特征参数,组成判别肿瘤三维变化的特征参数组合.实验结果证明,形态特征参数可以判断肿瘤的体积大小变化,纹理特征参数可以判断肿瘤内部活性变化.肺部肿瘤在治疗阶段体积大小发生了先变小后变大的变化,肿瘤纹理均匀性和粗细程度也发生了变化,在阶段Ⅲ体积和最长径的值最小,共生矩阵的能量、熵值和逆差分矩最大,这说明肿瘤最小且内部发生了坏死,这与临床结论相一致,为进一步指导肿瘤疗效评估奠定了基础.
关键词:肺部肿瘤;CT图像;Quick Hull;纹理特征;灰度共生矩阵
肺部肿瘤是当今世界上最常见的内脏恶性肿瘤之一,对人群健康和生命造成了极大的威胁.根据资料显示[1],在2012年就有超过74万人死于肝癌,而且发病率还在呈抛物线式上升.因此,对肺癌的诊断效果和如何防治已经引发了世界医学界的极大关注[2].
肿瘤疗效评价是决定病人继续治疗与否的依据[3],现在采用的实体瘤疗效评价标准多为RECIST标准,即基于CT影像测出肿瘤的最大径,根据最大径判断肿瘤大小的变化.但实际上,CT影像提供的不仅仅只是肿瘤大小的变化,还可以根据各个部位的CT值判断出灰度变化和纹理变化.事实证明,除了大小变化,纹理特征在一定程度上也能反映肿瘤的变化,这对于肿瘤疗效评估也是有效的.纹理是自然界所有物体表面的一种基本的属性,可以作为描述和识别物体的重要特征.在医疗领域,基于CT影像的纹理特征主要被用来分类.譬如陈秋霞等基于灰度共生矩阵计算出11个乳腺肿瘤超声影像的纹理特征参数,来对肿瘤进行良性恶性的判别.马长东等将纹理特征分析应用在基于正电子发射计算机断层扫描成像系统(PET/CT)图像分析的肿瘤治疗效果研究中,获取肿瘤的共生矩阵特征参数,尝试由纹理特征对治疗结果作出预测.但是这些研究都是基于二维层面的CT影像,而事实上,三维影像表现的信息更多也更全面.
本文基于肿瘤的三维形态分析和三维纹理分析,对同一病人不同时期的4组肿瘤平扫CT影像数据的变化进行分析,提出一个三维肿瘤变化检测系统.首先引用了肿瘤疗效评价的RECIST标准,将肿瘤最长径的测量扩展到三维层面,利用Quick Hull算法算出肿瘤三维形态的最长径,并基于体素计算出肿瘤的体积,将这两组数据作为形态分析的参数.为了更进一步分析三维肿瘤的变化,本文还增加了三维纹理特征参数,将每组CT影像三维重建,分割出肿瘤部分,对其进行纹理分析.传统的应用于医学影像的纹理分析方法主要是灰度共生矩阵[6-7],所以本文考虑将CT影像和灰度共生矩阵相结合,计算出纹理特征对三维肿瘤进行分析.图1是三维肿瘤变化检测流程图.

DICOM:digital imageing and communications in medicine,ITK:insight segmentation and registration toolkit.图1 三维肿瘤变化检测流程图Fig.1Flow chart of 3D tumor change detection
1基于体素和Quick Hull算法的三维肿瘤形态分析
1.1实验数据介绍
本文的实验数据来自厦门某医院同一病人4个时期的平扫CT影像,阶段Ⅰ的CT采集时间为2013年7月4日,阶段Ⅱ时间为2013年9月25日,阶段Ⅲ时间为2013年10月15日,阶段Ⅳ时间为2013年12月3日.每个阶段的样本大小均为512×512,CT值从-1 024~3 071 Hu,共4 096个级别,分割后的肿瘤CT值在0~255 Hu之间.
1.2Quick Hull算法介绍
本文在计算肿瘤的三维最长径中采用三维凸包算法中的Quick Hull算法[8],先初始化一个四面体,然后在每轮迭代处理中,将三维点集中的任意一点p加入到当前凸包中去进行判断是否在凸包外,如果是则生成新的三角面,从而得到最终的凸包.

1.3基于体素的体积计算
为了排除肺部其他部分对肿瘤变化分析的影响,将肿瘤部分用基于ITK的区域增长和阈值分割的方法分割出来,并用VTK(visualizationtoolkit)来三维重建,如图2和图3所示.

图2 原始肺部CT图像(白色箭头所指部分为肿瘤)Fig.2Lung CT (arrow indicates the tumor)

图3 分割后的肿瘤三维重建Fig.33D reconstruction of the tumor
采用基于拟蒙特卡罗(quasi-Monte-Carlo)的方法测量肿瘤的体积,首先选取随机点在图像内进行随机分布,并且给每个点设置坐标系定义空间坐标.我们将分割出来的背景的灰度值定义为0,由图3可以看出,肿瘤区域的灰度值并不为0,由此可以根据每个坐标处点的灰度值来判断该点是否在肿瘤区域内.再统计肿瘤区域内的坐标点的数量和所有坐标点的数量比例,乘以该图像的面积,便可以得到肿瘤部分的面积Si.最后利用公式(1)算出体积.
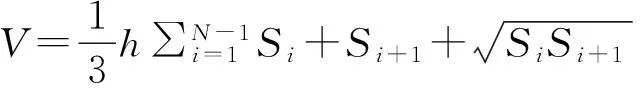
(1)
对4个阶段的CT序列分别提取出肺部肿瘤进行三维重建,然后计算出阶段Ⅰ~Ⅳ肿瘤体积分别为4.74,8.70,4.92,8.35cm3,可以发现,4个不同时期的肿瘤先变大后变小又变大,在阶段Ⅰ最小,阶段Ⅱ最大.为了更进一步地分析肿瘤的形态变化,本文接下来引用了RECIST中的最长径的定义.
1.4基于Quick Hull的最长径计算
当前使用较多的实体瘤疗效评定标准是RECIST[9],RECIST以单径测量法取代了原来的世界卫生组织(WHO)标准的双径测量法,临床医生在CT图片中找出病灶,并测量出肿瘤的最长径,对肿瘤疗效进行评估,如图4所示.但是因为病灶边缘不规则,人为测量误差很大,并且二维层面的测量也不能完全表现出肿瘤的变化.所以本文采用基于QuickHull来测量出肿瘤的三维最长径.

图4 测量病灶最长径Fig.4The longest diameter of tumor
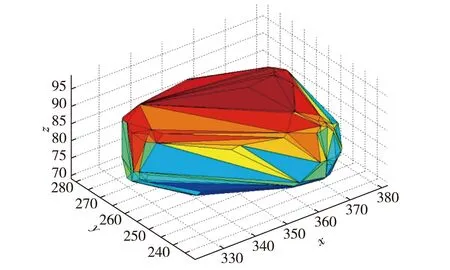
图5 肿瘤三维凸包Fig.53D hull of tumor
将肿瘤分割三维重建后,将其看成一个空间散乱点集,得到肿瘤每个体素的三维空间坐标,将三维点集记成P,通过QuickHull算法构造出P的凸包形状,如图5所示.计算肿瘤三维最长径,即计算三维点集P的最远点对的距离,使用QuickHull算法构造出P的轮廓,可以排除所有处于凸包内部的点,计算量大大减少,这是因为点集P的最远点对一定在其凸包上[10].
通过计算,我们可以得出4个阶段的CT数据构建出的肿瘤的三维最长径,并和临床医生给出的二维最长径作比较,如表1所示.通过实验结果可以看出,三维最长径的变化结果总体与二维变化趋势一致,并和体积大小变化成正比.三维最长径的测量消除了人为测量的误差性,并比RECIST标准的最长径更立体,因为肿瘤并不是平面而是立体,所以三维最长径的测量更具有实用性,本文将三维最长径的值加入肿瘤变化特征参数中.

表1 最长径对比结果
2基于灰度共生矩阵的三维肿瘤纹理分析
2.1灰度共生矩阵介绍
灰度共生矩阵是有关图像灰度的二阶统计度量,主要是基于空间两两像素点之间的灰度值来提取纹理特征,其可以反映出图像灰度分布有关局部邻域、方向、变化幅度等的综合信息[11].定义P(i,j,d,θ)为图像的灰度共生矩阵,其中i、j表示两个灰度值,d是两个像素点在方向θ下的间隔距离.P(i,j,d,θ)的计算公式如公式(2)所示.
P(i,j,d,θ)={(x1,y1),(x2,y2)∈M×
N|f(x1,y1)=i,f(x2,y2)=j)},
(2)
其中,M×N是图片f(x,y)的大小,(x1,y1)与(x2,y2)距离为d,且两者与坐标横轴的夹角为θ,P(i,j,d,θ)的值则表示一个灰度值为i,另一个灰度值为j的两个距离为d的像素对在角θ的方向上出现的次数.
2.2肿瘤纹理特征提取
无论是WHO还是RECIST肿瘤疗效评价标准,它们都有一个共同的特点,即忽略了治疗后肿瘤内部有可能存在坏死的情况,只考虑肿瘤体积变化的大小,无法更全面的体现肿瘤的变化.本文考虑肿瘤内部坏死这一情况,在分析肿瘤形态变化的基础上,再进行肿瘤的纹理变化分析.
重建后的三维肿瘤不仅提供了肿瘤每个像素点的空间坐标信息,还提供了每个点的CT值信息.考虑到医学图像的特殊性,在进行纹理分析时,本文采用的不是图片的灰度值,而是CT值.某物质的CT值等于该物质的衰减系数与水的吸收系数之差,再与水的衰减系数相比之后乘以分度因素,它反映了物质的密度,CT值越高相当于物质的密度越高.本文利用CT值这一性质,来分析肿瘤内部坏死情况和纹理变化信息.

表2 肿瘤三维变化分析结果
本文将灰度共生矩阵推广到三维空间,并和CT值相结合,计算出CT共生矩阵.定义P(i,j,d,θ)的计算公式如公下:
P(i,j,d,θ)={(x1,y1,z1),(x2,y2,z2)∈
M×N×L|f(x1,y1,z1)=i,
f(x2,y2,z2)=1)},
(3)
其中,f(x,y,z)表示空间坐标为(x,y,z)的像素点的CT值,单位为Hu.
三维空间中紧密分布的一个点集合中的一个点周围有26个与之相邻的相邻点,所以本文考虑采用26个方向来计算出P(i,j,d,θ),均一化得到p(i,j,d,θ),再对各特征参数求平均.
共生矩阵并不能直接反映纹理特征,本文主要利用下面4个统计量来描述纹理特征.
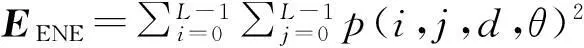

logp(i,j,d,θ),
p(i,j,d,θ),
[1+(i-j)2].
对4个阶段的CT数据分别进行肿瘤的26个方向CT共生矩阵计算,得出上面4个统计量,结果如表2所示.
能量EENE的值主要反映图像纹理的粗细,通过表2的结果可以看出,阶段Ⅲ的数据肿瘤能量值最大;熵EENT的值反应了图像纹理的复杂度和均匀度,阶段Ⅲ的数据EENT值最大,这说明了阶段Ⅲ的肿瘤纹理最为复杂且密度不均匀;GCON主要是反应了纹理的清晰度和沟纹的深浅度,阶段Ⅳ的GCON值最大说明这一组的肿瘤纹理沟纹较深且清晰;最后一个统计量HIDM主要和图像纹理的平滑度有关,图像纹理变化得越规律越平滑,HIDM值就越大.
3实验结果及分析
分别对这4个阶段的数据进行体积、最长径、CT共生矩阵等计算,可得出结果如表2所示,并为了更好的进行比较,额外加入了肿瘤部分的CT平均值这一参数.
由表2的数据可以发现,阶段Ⅲ数据的能量值、熵值、逆差分矩值最大,体积、最长径、CT平均值、对比度值最小,而阶段Ⅳ恰恰相反,最长径、CT平均值、对比度值在4个阶段数据中最大,其余3个统计量则最小.阶段Ⅰ数据和阶段Ⅱ数据对比,除了体积和GCON变化较大,其他几个参数变化都不大;可以看出,阶段Ⅱ的肿瘤明显变大,但纹理几乎没有变化,肿瘤内部也没有发生坏死或钙化的情况;阶段Ⅲ肿瘤再次变小,而且纹理发生了明显的变化,纹理最为复杂且密度不均匀,这说明肿瘤内部发生坏死,肿瘤情况好转;阶段Ⅳ的肿瘤再次变大,而且CT值上升,肿瘤恶化.这一分析情况与临床结论相吻合.
4结论
本文结合形态分析和纹理分析,主要基于Quick Hull算法和灰度共生矩阵,提出了一个三维肿瘤变化检测系统.首先对一个序列CT图像进行分割,提取出肺部肿瘤区域,并基于VTK进行三维重建,利用RECIST肿瘤疗效评估标准中的最长径定义,算出肿瘤的体积和三维最长径,以此对肿瘤进行形态分析.之后利用医学图像中的CT值含义,结合灰度共生矩阵算出4个阶段的纹理特征参数,对肿瘤进行纹理分析.依次对同一病人4个时间阶段的CT数据进行处理,从大小和CT变化两个层面对肿瘤变化进行分析,得到最终的实验结果.
实验结果证明,在评估肿瘤疗效时,除了从肿瘤大小变化来判断,还可以从CT值变化导致的纹理变化来辅助评价.肿瘤变小和肿瘤内部坏死均说明肿瘤有所好转,是否变小可以从体积和最长径的数值变化来判断,肿瘤内部是否坏死则可以从纹理的变化来分析.EENE、FENT和HIDM的值越大说明肿瘤纹理越粗、复杂度越高且密度越不均匀,肿瘤内部趋向坏死液化;GCON和CT平均值越大说明肿瘤沟纹越深且清晰,肿瘤密度变大趋向钙化.这一特征参数可以对临床肿瘤疗效评估提供辅助性的帮助,当肿瘤大小变化不明显时,可以考虑从纹理特征来进一步分析肿瘤的活性,进而对肿瘤是否好转进行全面的判断.
参考文献:
[1]LINDSEY A T,FREDDIE B,REBECCA L S,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015(1):5-29.
[2]GEOFFREY D,RUBIN J K,et al.Pulmonary nodules on multi-detector row CT scans:performance comparison of radiologists and computer-aided detection[J].Radiology,2005,234(1):274-283.
[3]陈智伟,廖美琳.RECIST标准在肿瘤治疗疗效评价中的应用[J].中国肿瘤,2004,13(10):616-618.
[4]陈秋霞,向军,刘奇,等.乳腺肿瘤超声图像纹理特征分析[J].激光杂志,2014,35 (3):65-67.
[5]马长东.基于PET/CT图像分析的肿瘤治疗效果研究[D].济南:山东大学,2012.
[6]阮秋琦.数学图像处理学[M].北京:电子工业出版社,2001:390-428.
[7]BHARATI M H,LIU J J,MACGREGOR J F.Image texture analysis methods and comparisions[J].Chemoetrics and Intelligent Laboratory Systems,2004,72(1):57-71.
[8]江建.寻找平面上点的凸壳[J].重庆工学院学报(自然科学版),2007,21(9):15-17.
[9]张京晶,孟琼,常巍,等.肿瘤临床疗效评价研究现状与进展[J].癌症,2010,29(2):250-254.
[10]曲吉林,寇纪淞,李敏强.一种确定点集最远点对的最优算法[J].模式识别与人工智能,2006,19(1):28-30.
[11]郭德军,宋蛰存.基于灰度共生矩阵的纹理图像分类研究[J].林业机械与木工设备,2005,33(7):21-23.
3D Change Detection of Pulmonary Tumor in Shape and Texture Based on Lung CT
XIONG Ting,HUANG Shaohui*,HUANG Xiaoyang,WANG Liansheng,WANG Boliang
(School of Information Science and Engineering,Xiamen University,Xiamen 361005,China)
Abstract:It is a challenging task to evaluate the tumor treatment effect from CT images,because the task mainly depends on experiences of doctors.For the purpose of establishing an objective evaluation method,a 3D tumor change detection method based on shapes and texturesis proposed in this paper.First,we reconstruct the 3D tumor in four periods using VTK,then calculate 3D tumor’s characteristic parameters,which are used to compare with the change of cancer during four periods.The experimental result shows that shape-characteristic parameters based on voxel and Quick Hull can be used to judge the size change of tumor,and that texture-characteristic parameters based on gray level co-occurrence matrix can be used to compare with the change of tumor internal activity.In period Ⅲ,the volume and longest diameter of tumor reaches the minimum;The energy,entropy and inverse-difference moment reach the maximum.This phenomenon explains that the tumor size is the least and the tumor becomes liquefied.This conclusion is consistent with the clinical validation.
Key words:pulmonary tumor;CT image;Quick Hull;texture features;gray level co-occurrence matrix
doi:10.6043/j.issn.0438-0479.2016.03.017
收稿日期:2015-05-08录用日期:2015-08-26
基金项目:国家自然科学基金(61001144,61102137,61301010,61327001)
*通信作者:hsh@xmu.edu.cn
中图分类号:TP 391
文献标志码:A
文章编号:0438-0479(2016)03-0401-05
引文格式:熊婷,黄绍辉,黄晓阳,等.基于肺部CT的肿瘤形态与纹理的三维变化检测.厦门大学学报(自然科学版),2016,55(3):401-405.
Citation:XIONG T,HUANG S H,HUANG X Y,et al.3D change detection of pulmonary tumor in shape and texture based on lung CT.Journal of Xiamen University(Natural Science),2016,55(3):401-405.(in Chinese)
