奶牛子宫角和卵巢子宫静脉插管方法的研究
2016-06-22吴永启董慧敏叶小康刘宗平李建基扬州大学兽医学院江苏扬州225009江苏省动物重要疫病与人兽共患病防控协同创新中心江苏扬州225009
王 亨,吴永启,董慧敏,叶小康,孟 霞,刘宗平,李建基(1.扬州大学兽医学院,江苏扬州225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
奶牛子宫角和卵巢子宫静脉插管方法的研究
王亨1,2,吴永启1,2,董慧敏1,2,叶小康1,2,孟霞1,2,刘宗平1,2,李建基1,2
(1.扬州大学兽医学院,江苏扬州225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
摘要:对12头奶牛进行卵巢子宫静脉和子宫角插管手术方法探讨,包括保定方式、麻醉方法、插管选择、插管要领和护理方法等。观察插管前后奶牛体温、呼吸、脉搏变化以及外周血和卵巢子宫静脉血白细胞总数的变化,评价插管手术对奶牛的影响。结果表明,运用该手术方法进行插管,术后奶牛体温、脉搏和白细胞总数出现一过性升高,呼吸仅在术后24 h出现显著性变化,之后恢复正常。12头奶牛插管,有1头发生阻塞,1头插管脱落,其余均可从血管采集到血液样本。该外科技术为子宫局部的生理和病理研究提供技术保障。
关键词:奶牛;子宫角;卵巢子宫静脉;插管术
吴永启(1985-),男,硕士,主要从事动物临床疫病研究,E-mail:wyqjjkk@163.com
注:吴永启与王亨对本文具有同等贡献
奶牛子宫内膜炎是引起奶牛生产性能下降的疾病之一,是奶牛疾病研究的热点。子宫局部的免疫对于子宫内膜炎的发生具有决定性意义。收集子宫局部血液观察子宫局部免疫在子宫内膜炎发生和发展中的作用,是研究子宫内膜炎发病机理的方法之一。血管插管术已经被广泛应用于医学临床和研究,为医学的发展提供技术保障。现在子宫内膜炎造模的方法有两种,一种是经阴道注菌法,Christoffersen等使用输精管向子宫内灌注大肠杆菌,制备马子宫内膜炎模型[1]。孔祥峰等通过子宫灌注细菌,建立兔子宫内膜炎模型[2];另一种是经子宫角插管注菌法,该方法本课题组已经在羊的子宫角进行插管并应用[3]。奶牛子宫角插管和卵巢子宫静脉插管方法,尚未见报道,而该方法的探索,可为奶牛子宫内膜炎的研究,提供技术保障,故进行该研究。
1 材料与方法
1.1试验动物12头健康奶牛,体重500~650 kg,购自扬州大学农牧场,经适应性饲养7 d,临床检查无异常。
1.2药品与材料2%盐酸利多卡因,速眠新,0.1%硫酸阿托品,16Ga中心静脉导管(ARROW,美国),2 mg/mL肝素钠,医用硅胶管(内径0.96 mm,外径1.56 mm),常规大动物腹腔器械及眼科器械各1套。
1.3手术方法
1.3.1术前准备术前24 h禁食,少量饮水。清理体表污物,并于术前0.5 h注射抗生素。
1.3.2麻醉与保定麻醉前用药,硫酸阿托品,0.04 mg/kg体重,10 min后注射速眠新,0.005 mL/ kg体重。插管手术保定方式:左后肢半仰卧保定;从腹壁引出插管保定方式:站立保定。后肢半仰卧保定确实后,术部常规准备,剃毛、消毒并采用利多卡因浸润麻醉;站立保定时,腹壁切开引出插管术,采用2%利多卡因腰旁神经传导麻醉,配合1%利多卡因术部浸润麻醉。
1.3.3中心静脉导管的预处理中心静脉导管连接注射器,用2 mg/mL肝素钠溶液充满中心静脉导管,封闭待用。
1.3.4卵巢子宫静脉插管手术方法以腹股沟外环内侧与腹中线的连线为起点,在腹股沟外环与乳腺基部之间,向前作平行于腹中线的切口,长约30~35 cm。依次切开皮肤,分离筋膜,切开肌肉和腹膜。将左侧子宫角缓慢牵引至切口外,纱布隔离。于子宫角近头侧的1/3与中1/3交界处的阔韧带上,钝性分离,游离卵巢子宫静脉0.5~1.0 cm,并作预置结扎线。在血管外侧做一切口,将导管迅速插入游离静脉内,直至15 cm左右,收紧结扎线,去掉中心静脉插管上的注射器,观察血液在插管内的回流情况,无异常,则用注射器注入肝素溶液,封管。然后缝合血管壁,用浆膜包埋插入部血管,将血管插管置于血管固定夹中,并将固定夹的双翼与阔韧带的浆膜或子宫角进行间断缝合,固定血管插管。血管插管与子宫角浆膜肌层进行数针结节缝合固定。固定完毕,再次观察导管的通畅性。
1.3.5子宫角插管手术方法在子宫角与输卵管交界处,做预置荷包缝合线,用眼科剪刀剪一小口,将医用硅胶管通过此口插入子宫腔,插入长度约5.0 cm,收紧荷包缝合线,固定插管。将子宫角插管、血管插管和子宫角还纳腹腔,常规关腹。
1.3.6卵巢子宫静脉插管和子宫角插管引出体外及固定的手术方法奶牛站立保定,左侧腹壁常规剃毛消毒,采用1.3.2进行传导麻醉和术部浸润麻醉。切口采用左侧腹壁中切口,依次切开皮肤、皮下筋膜、腹外斜肌、腹内斜肌、腹横肌和腹膜。打开腹壁后,进行骨盆腔周围的探查,寻找卵巢子宫静脉插管和子宫角插管,并确定奶牛卵巢子宫静脉和子宫角插管所对应的体表投影,做好标记。术者左手于腹腔内对应体表位置隔腹壁向外侧做出切口位置指示,右手持手术刀切开皮肤2 cm,后改用止血钳钝性分离,至腹腔。依次将卵巢子宫静脉插管、子宫角插管引出体外,并进行体表固定(见前插彩版图1)。
1.4术后护理术后,每头牛单独栓系饲养,自由饮水,饲草应少食多餐。3 d内,全身应用抗生素。每隔12 h检查卵巢子宫静脉插管的通畅性,并向卵巢子宫静脉插管推注肝素钠2 mL。收集血液样品时,应先丢弃抗凝液体,待新鲜血液流出后,收集样品,送检,同时重新注入肝素钠2 mL。
1.5手术前后生理指标和血液白细胞的观察
分别在术前0 h(子宫血于插管前收集,同时收集尾静脉血)、术后24,48,72,96,120 h记录奶牛体温、呼吸、脉搏和临床症状,同一时间采取尾静脉血和子宫血,进行白细胞计数。应用SPSS17.0软件对数据进行显著性检验。
2 结果
2.1卵巢子宫静脉和子宫角插管操作要领奶牛子宫位于骨盆腔入口头侧,采用左后肢半仰卧保定,充分暴露术部。切口应尽量靠近耻骨前沿,最大限度的接近子宫角。由于卵巢子宫静脉位于静脉丛中,应完整分离血管,并做预置结扎线。在分离和切开血管前,应注意奶牛麻醉状态和疼痛反应,并做好表面麻醉。PICC插管预先注入肝素钠溶液,待剪开血管后,即可顺势插入,调整插管方向,检查血液通畅性,确定无误后,即可结扎,并再次向PCC插管注入肝素钠溶液,防止血凝。子宫角插管时,由于子宫黏膜下层发达,应注意区分子宫腔和黏膜下层,确保子宫角插管位于子宫腔内。做好插管的固定,可借助浆膜肌层的包埋和固定夹,防止插管脱落。手术插管12头,子宫角插管术后一月内无异常,卵巢子宫静脉插管2头出现问题。其中1头术后20 d发生阻塞,另外1头由于奶牛磨蹭腹壁外插管,牵拉过度导致脱落,其余10例保持通畅。
2.2手术对奶牛体温、呼吸和脉搏的影响手术后24 h奶牛的呼吸次数出现升高,差异极显著(P<0.01),但在术后48 h后恢复正常。与手术0 h奶牛的体温、脉搏比较,奶牛在术后24、48、72、96、120 h的体温、脉搏均差异不显著(P>0.05)(见图2)。
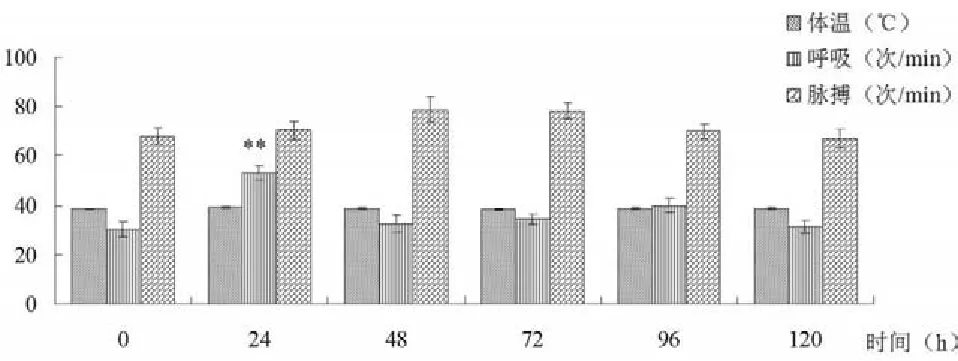
图2 奶牛体温、呼吸和脉搏在手术前后的变化注:与该组0 h比较,**:P<0.01
2.3手术对奶牛外周血和卵巢子宫静脉血中白细胞的影响奶牛外周血和子宫血中白细胞总数在术后24 h呈上升趋势,然后逐渐下降,但与0 h白细胞总数相比,术后24、48、72、96 h和120 h外周血和子宫血白细胞总数均差异不显著(P>0.05)(见图3)。
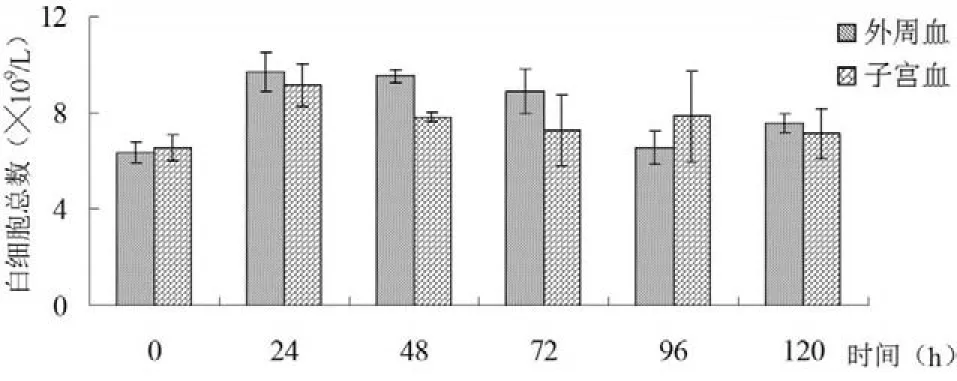
图3 奶牛白细胞总数在手术前后的变化
3 讨论
血管插管手术已被广泛应用于医学临床、教学和科研试验中,比如长期持续性药物输注、危重病例急救和监控、营养或药物代谢规律、胎儿生长发育和疾病发生机理研究等[4-9]。
课题组在前期已经成功应用医用硅胶管进行山羊卵巢子宫静脉插管的探讨[6],并应用该技术进行了子宫内膜炎的研究。由于奶牛体型较大,硅胶管较柔软,可能会随着动物体位的改变而弯折,影响采血。同时,瘤胃蠕动力强,卵巢子宫静脉丛分支多,故该实验选用医用PICC导管植入卵巢子宫静脉。经试验证实,采用PICC导管插管,可顺利导入静脉丛血管,且该导管具有很好的韧性和硬度,不易发生折叠阻塞。插入部带有的翼型固定夹便于固定导管,防止滑脱。PICC已经广泛应用于人类医学临床疾病的诊断和治疗,其优势已得到广泛认可[10-12],在体外操作时具有一定的硬度,进入体内后变柔软,不易损伤血管和形成血栓,感染几率小。采用肝素抗凝封管,可保障收集管畅通,减少阻塞的可能性。炎症是影响实验结果的重要因素。研究发现手术后外周血和子宫血出现一过性白细胞升高,但未超出生理范围,术前和术后生理指标除呼吸在24 h显著升高外,其余均差异不显著,呼吸的升高可能跟手术刺激有关,说明该手术方法经过手术愈合期后,恢复正常,能够满足对子宫生理和病理研究的需要。同时子宫角的插管为子宫灌注提供了无菌通道,减少从阴道灌注污染的几率。手术操作过程中应注意无菌操作,由于奶牛体型大,腹腔深,所以切口应尽量靠近耻骨,便于子宫的牵引和隔离。子宫无法牵引出腹腔的奶牛,应进行充分的腹腔内隔离,行腹腔内卵巢子宫插管,不应强行拉出,减少子宫阔韧带和系膜的撕裂。插管结束后,为了准确的定位子宫的位置,应将奶牛保定体位转为站立保定,更好的确定子宫在体表的投影,以减少插管在腹腔内的缠绕,防止胃肠蠕动时,使插管脱落。术后要每天检查切口部位,特别是腹壁出管处,应每日涂以抗生素软膏,抗感染,促进愈合。
参考文献:
[1]Christoffersen M,Baagoe C D,Jacobsen S,et al . Evaluation of the systemic acute phase response and endometrial gene expression of serum amyloid A and pro- and anti-inflammatory cytokines in mares with experimentally induced endometritis[J]. Vet Immunol Immunopathol,2010,138(1-2):95-105.
[2]孔祥峰,胡元亮,郭振环,等.家兔子宫内膜炎模型的建立和临床病理学观察[J].中国实验动物学报,2006,14(3):213-216-243.
[3]包喜军,吕俊锦,孙琳,等.大肠杆菌性子宫内膜炎对山羊血液和子宫内膜的影响[J].中国兽医学报,2010,30(2):219-221.
[4]Tomek S,Asch S . Umbilical vein catheterization in the critical newborn: a review of anatomy and technique[J]. EMS World,2013,42(2):50-52.
[5]李宏全,王俊东,于俊平,等.妊娠犬及其胎儿股动脉血管插管技术[J].中国兽医学报,2002,22(1):68-69.
[6]包喜军,孙琳,吕俊锦,等.山羊子宫卵巢静脉插管方法的探讨[J].中国奶牛,2008,6:46-47.
[7]华修国,候加法,李宏全,等.妊娠绵羊宫内胎儿血管插管手术的研究[J].上海农学院学报,1996,14(2):111-115.
[8]方正锋,彭健,齐智利,等.肠道营养物质代谢的仔猪动-静脉插管技术的建立[J].中国兽医学报,2010,30(8):1098-1102.
[9]Pairis-Garcia M D,Johnson A K,Bates J L,et al . Development and refinement of a technique for short-term intravascular auricular vein catheter placement in mature sows[J]. Lab Anim,2014,48(1):78-81.
[10]蒋元菊,姚芳,林芳,等.经外周至中心静脉插管与股静脉插管在呼吸科患者中的应用比较[J].解放军护理杂志,2004,21(12):22-24.
[11]吴文燕.经皮中心静脉插管血液透析导致患者感染的护理对策分析[J].中华医院感染学杂志,2013,23(6):1308-1309.
[12]Valentino J D,Rychahou P G,Mustain W C,et al.Murine portal vein catheterization to analyze liver-directed therapies[J]. J Surg Res,2013,185(2):690-696.
Study on themethod of catheterization of utero- ovarian vein and uterinehorn in dairy cattles
WANG Heng1,2,WU Yong-qi1,2,DONG Hui-min1,2,YE Xiao-kang1,2,MENG Xia1,2,LIU Zong-ping1,2,LI Jian-ji1,2
(1.College of Veterinary Medicine,Yangzhou University,Yangzhou 225009,China;2.Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses,Yangzhou 225009,China)
Abstract:Catheterization of utero-ovarian vein and uterine horn were applied on 12 dairy cattle.In the meanwhile,restraint method,anesthesia,cannula selection,operational keypoints and nursing attentions were discussed.The influence of catheterization was evaluated by examination on T,P,R and changes of WBC in peripheral and utero-ovarian vein.The results revealed that T,P and WBC had a transient increase and there was significant increase at 24 h post catheterization.But all indexes recovered quickly to normal physiological ranges.One cannula dropped,one was blocked and samples could be collected from other cattle.The technique of catheterization may provide the basis of study on the physiology and pathology about the bovine uterus.
Key words:Dairy cattle;uterine horn;utero-ovarian vein;catheterization Corresponding author:LI Jian-ji
中图分类号:S823.9
文献标志码:A
文章编号:0529- 6005(2016)03- 0028- 03
收稿日期:2014-07-22
基金项目:国家自然基金资助项目(31072176);江苏高校优势学科建设工程资助项目(PAPD);扬州大学中青年骨干教师境外研修资助项目
作者简介:王亨(1978-),男,副教授,博士,从事动物临床疫病的研究,E-mai:sdauelww@163.com
通讯作者:李建基,E-mail:yzjjli@163.com
