福建省猪伪狂犬病病毒新流行株gD、gE基因遗传变异分析
2016-06-22魏春华戴爱玲李晓华刘建奎陈泽铭杨小燕龙岩学院生命科学学院预防兽医学与生物技术福建省高等学校重点实验室福建省人畜寄生与病毒性疫病防控工程技术研究中心福建龙岩364012
魏春华,戴爱玲,李晓华,刘建奎,陈泽铭,杨小燕(龙岩学院生命科学学院预防兽医学与生物技术福建省高等学校重点实验室福建省人畜寄生与病毒性疫病防控工程技术研究中心,福建龙岩364012)
福建省猪伪狂犬病病毒新流行株gD、gE基因遗传变异分析
魏春华,戴爱玲,李晓华,刘建奎,陈泽铭,杨小燕
(龙岩学院生命科学学院预防兽医学与生物技术福建省高等学校重点实验室福建省人畜寄生与病毒性疫病防控工程技术研究中心,福建龙岩364012)
摘要:为了解福建地区猪伪狂犬病病毒(PRV)流行毒株的分子生物学特性与变异规律。本试验分离了2011-2013年福建省不同地区的11株PRV,并对其gD、gE基因进行遗传变异分析。结果表明,福建地区被检测的规模化猪场均存在野毒感染,病料接种PK-15细胞均能出现典型的细胞病变,分离的毒株接种家兔能出现典型的伪狂犬病症状。PRV gD、gE基因序列分析表明,自2011年福建地区PRV同源性较高且处于一个独立的分支,表明福建地区流行的PRV可能存在一定的抗原变异。
关键词:伪狂犬病病毒;分离鉴定;gD基因;gE基因;变异
伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的多种家畜和野生动物的一种高度接触性传染病,可导致怀孕母猪发生流产、死胎、木乃伊胎,哺乳仔猪出现神经系统症状,死亡率达90%以上,并有从单一感染向混合感染扩大的趋势,给全球养猪业造成了巨大的经济损失。PRV属于疱疹病毒科,基因组为线状双股DNA,基因组全长约为150 kb,gD糖蛋白为病毒增殖所必需,具有重要的抗原表位,在病毒感染和宿主免疫过程中起着重要作用,也是目前疫苗研究的热点[1]。gE基因是PRV的主要毒力相关基因,也是世界动物卫生组织(DIE)所规定基因缺失疫苗的首选缺失基因[3]。
自2011年开始,PRV在福建地区猪场中出现大面积感染现象,包括免疫了基因缺失苗的规模化猪场,阳性率普遍升高,疫情日趋严重。许多发达国家(如美国,丹麦等)已经成功施行PR净化工程。但为什么现有的疫苗尚不能完全有效地控制福建地区所有或大部分猪伪狂犬病流行,这是我们亟待解决的一个重大问题。本试验旨在通过对福建地区流行毒株的gD、gE基因的分子特征开展研究,初步分析不同病毒株间的感染力和免疫原性的差异,为该地区猪场的预防和控制PRV提供参考。
1 材料与方法
1.1病毒样品2011-2013年在福建地区无菌采集了临床表现为发热、脑脊髓炎、败血症症状、呼吸系统症状、流产、死胎、不育为特征的疑似PRV感染猪只的脑、肾脏、脾脏等组织,-70℃保存备用。
1.2主要试剂宿主菌细胞DH5α、PK-15细胞由本实验室保存。PCR相关试剂、pMD18-T载体、限制性内切酶、DNA Marker、组织基因组DNA提取试剂盒,均购自TaKaRa公司;胶回收试剂盒,购自天根生化科技(北京)有限公司产品。
1.3引物设计参考罗飞(2011)合成gD基因的特异性引物,参考魏春华(2012)和陆芹章(2005)合成gE基因的检测引物和gE全基因扩增的引物[3-5]。
1.4病毒分离将处理过的病料上清液接种于长成单层的PK-15细胞,PBS轻洗后加入DMEM维持液,每天观察细胞病变(CPE),当CPE出现80%时收毒,反复冻融,离心后取上清-70℃保存备用。
1.5病毒纯化及理化鉴定采用病毒蚀斑纯化的方法纯化病毒,理化性质鉴定参考吴云飞进行[6]。
1.6易感动物接种试验将经纯化后的病毒按照一定的比例进行稀释后接种家兔,对照组接种DMEM维持液。
1.7PRV gD、gE的扩增及测序分析按照TaKa-Ra DNA提取试剂盒说明书提取PRV DNA。gD、gE PCR扩增体系为25 μL反应体系:10×Ex PCR Buffer 2.5 μL、2.5 mmol/L dNTP 2 μL,DNA模板2 μL,20 mmol/L上下游引物各0.6 μL,Ex Taq DNA聚合酶0.25 μL,用ddH2O补至25 μL。试验采用降落式PCR方法进行目的片段的扩增。将PRV gD、gE目的基因经胶回收后连接至pMD18-T载体中,转化至DH5α中,经PCR和酶切鉴定后,送往上海生工生物工程技术服务有限公司测序,测序结果采用DNAStar软件绘制系统遗传进化树。
2 试验结果与分析
2.1病料检测将疑似PR的脑、肾组织进行匀浆,按照试剂盒提取病毒DNA,以其为模板,利用PRV gE检测引物进行PCR扩增,PCR扩增产物经1%琼脂糖凝胶电泳,紫外光下观察可见300 bp左右扩增出一特异条带,大小与预期结果相符(见图1),表明该猪场存在野毒感染。
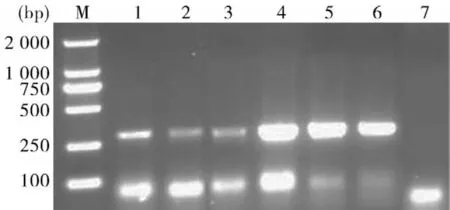
图1 PRV部分福建分离株gE基因的PCR扩增结果M:Marker DL-2 000;1~6:FJ01-FJ06,respectively;7:阴性对照
2.2病毒的分离在PK-15细胞上盲传至第3代时,于接毒后第36小时产生明显CPE,可见细胞肿胀,变圆,呈现明显的拉网状,共分离11株FJ01-FJ 11株,其中2011年3株,2012年4株,2013年4株。其中FJ05毒株接种病变如图2所示。
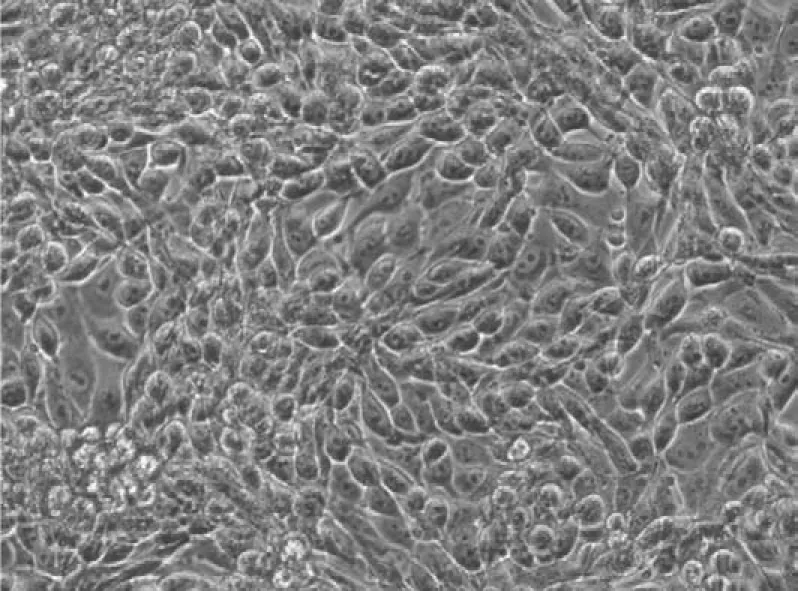
图2 A 36 h正常PK- 15细胞 (100×)
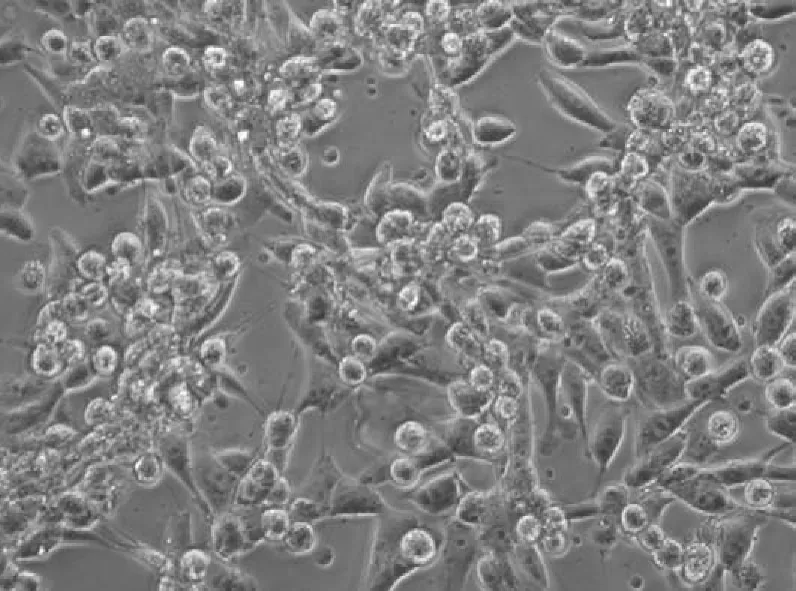
图2 B 接种FJ 05后36 h CPE(100×)
2.3病毒效价的测定按照Reed-Muench法计算病毒的TCID50为10-6.2~10-7.25/100 μL,均属于强毒株。
2.4兔体接种试验结果在接种40 h后,病兔啃咬注射部位皮肤,继之体温下降,四肢麻痹,最后角弓反张,抽搐死亡,对照组兔子正常。
2.5PRV gD、gE基因序列分析利用PCR方法扩增出完整的gD、gE基因编码序列,克隆到pMD-18T载体进行测序,测序结果表明,11株PRV gD彼此间核苷酸和氨基酸的同源性分别为98.2%~99.7%、98.6%~99.5%与参考毒株分别为97.7%~99.7%、98.2%~99.5%,推导的氨基酸序列也都仅在个别位点发生变异。11株PRV gE彼此间核苷酸和氨基酸的同源性分别为97.3%~100%、98.4%~100%与参考毒株分别为94.2%~99.7%、94.5%~99.5%,推导的氨基酸序列也都仅在个别位点发生变异。
利用生物学软件MEGA6.06对PRV的gD基因序列进行核苷酸比对的结果表明,所分离的毒株分为2大群,以FJ02为代表的3株毒株处于一个独立的分支,其余8株处于同一分支上,其中只有毒株FJ01与疫苗Bartha毒株亲缘关系较近,其余亲缘关系较远。福建2012年之后流行毒株与2011年福建农林大学分离的毒株FZ亲缘关系较远,处于不同的分支上(图3)。gE基因进行核苷酸序列比对,结果表明,本实验室分离的毒株分为2大群,以FJ03为代表的9株处于一个相对独立的分支,与以前分离的参考毒株的亲缘关系较远,2株与河南2011-2013年分离的毒株亲缘关系较近(图4)。综上所述,表明福建流行毒株自2011年可能发生了变异。
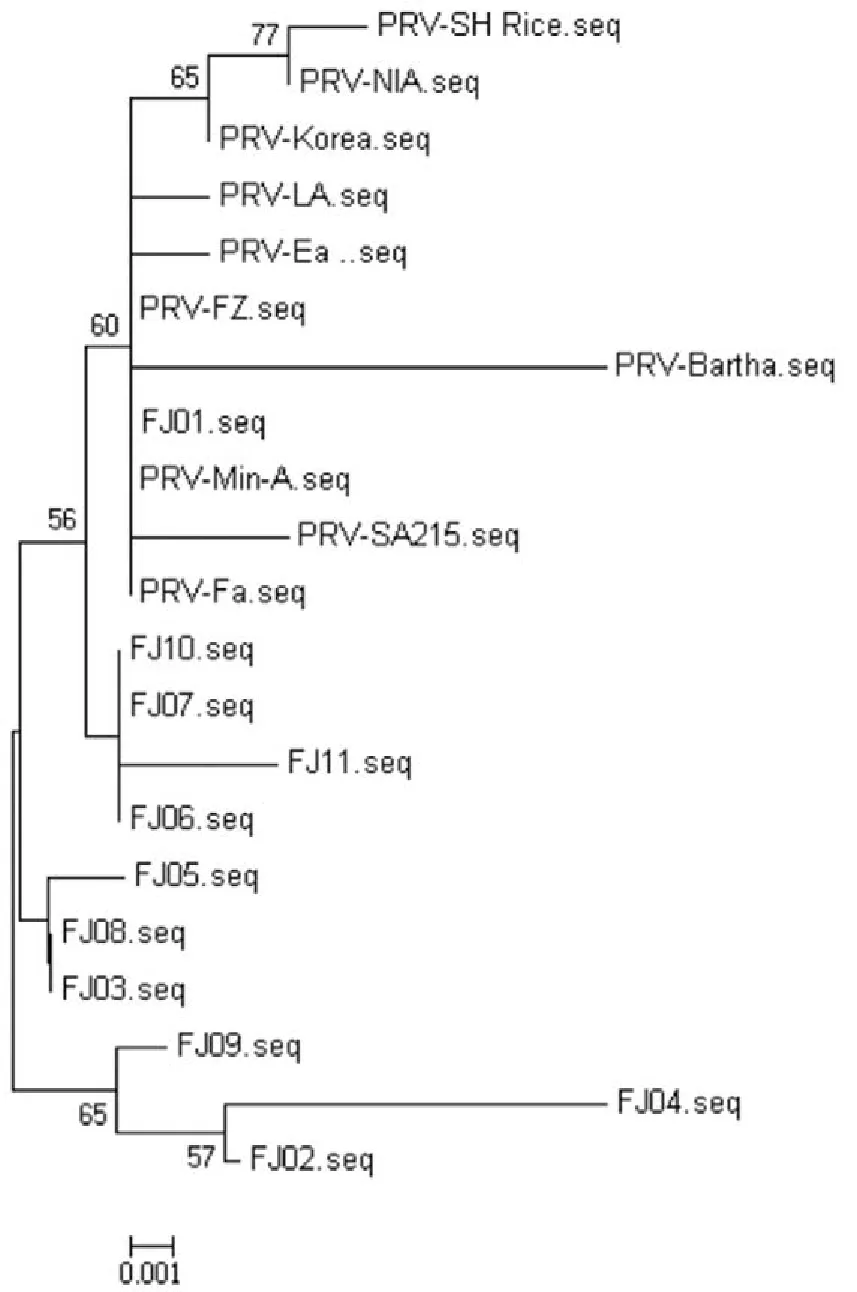
图3 PRV- gD基因的遗传进化树
3 讨论
目前国内防控PR主要依靠基因缺失苗,许多发达国家(如美国,丹麦等)通过基因缺失疫苗和鉴别诊断方法已经成功施行PR净化工程。我国借鉴欧盟的经验,成功引起PR基因缺失疫苗Bartha 61,并取得了较好的免疫效果,有效的控制了PR。但是自2011年开始,规模化猪场感染PR日趋严重,即使接种了基因缺失疫苗的猪场也发生PR野毒感染。
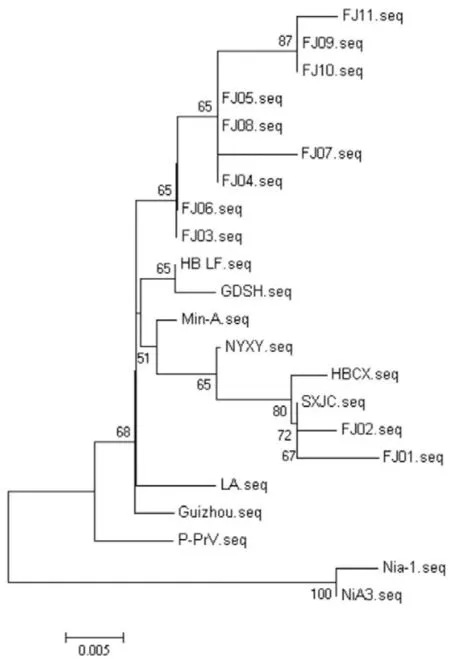
图4 PRV- gE基因的遗传进化树
为了更好地了解福建地区PRV的分子生物学特性与变异规律,为以后的该病的防控和新型疫苗的研究提供更加清楚的分子生物学背景,本试验对2011-2013年分离出的毒株gD、gE基因进行了克隆和序列分析。结果表明,11株PRV-gD基因彼此间核苷酸和氨基酸的同源性分别为98.2%~99.7%、98.6%~99.5%,11株PRV-gE基因彼此间核苷酸和氨基酸的同源性分别为97.3%~100%、98.4%~100%,表明2011年以来福建地区PRV变异程度较小,这为福建地区伪狂犬病的防控提供理论基础。PRV-gD遗传进化树表明,所分离的毒株分为2大群,以FJ02为代表的3株毒株处于一个独立的分支,其余8株处于同一分支上,其中只有毒株FJ01与疫苗Bartha毒株亲缘关系较近,其余亲缘关系较远。福建地区2012年之后流行毒株与2011年福建农林大学分离的毒株FZ亲缘关系较远,处于不同的分支上,亲缘关系稍远,表明流行毒株gD基因发生一定程度的变异。PRV-gE遗传进化树表明,本实验室分离的毒株分为两大群,除了2株与河南2011-2013年分离的毒株亲缘关系较近、处于同一分支外,其余以FJ03为代表的9株处于一个相对独立的分支,与以前分离的参考毒株的亲缘关系较远,推测福建地区流行的PRV-gE基因可能存在一定的抗原变异,这些病毒株是否形成一个新的流行毒株群,需要进一步研究。常洪涛[7]研究表明,现有的疫苗株能有效的抵御河南新PRV强毒的攻击,彭金美[8]研究表明,Bartha K 61活疫苗免疫猪仅能诱导对HeN1分离株低水平的中和抗体,部分省份猪场流行的PRV可能存在一定的抗原变异,现有的疫苗能否能对福建地区流行毒株起到免疫保护,需要动物试验进一步验证。
由于PRV野毒在我国猪场长期存在,且随着猪场养殖管理的改变、环境因素的变化,增加了PRV野毒的变异性[8-12]。我们应加强对该病的分子流行病学调查、监测及病原变异规律的研究工作,深入开展致病机制和免疫机理等基础研究,为我国研发更具针对性、安全、高效的疫苗提供科学依据。
参考文献:
[1]陈懿,聂奎.伪狂犬病病毒囊膜蛋白gD研究进展[J].动物医学进展,2006,27(6):20-23.
[2]Ch’ng T H,Enquist L W . Efficient axonal localization of alphaherpesvirus structural proteins in cultured sympathetic neurons requires viral glycoprotein E[J].Journal of virology,2005,79(14):8835-8846.
[3]罗飞,陈义平,陆明析,等.猪伪狂犬病病毒囊膜糖蛋白gD主要抗原表位区基因的克隆及原核表达[J].中国畜牧兽医,2011,11(38):83-85.
[4]魏春华,刘建奎,杨小燕,等.猪伪狂犬病病毒的分离鉴定及其gE基因序列分析[J].福建畜牧兽医,2012,34(4):1-3.
[5]陆芹章,覃广胜,黄伟坚,等.伪狂犬病病毒广西B、W株gE基因的扩增、克隆及序列分析[J].畜牧兽医学报,2005,36 (10):1106-1110.
[6]吴云飞,朱玲,徐志文,等.伪狂犬病病毒四川株的分离鉴定及增殖特性[J].中国兽医科学,2013,43(06):557-564.
[7]常洪涛,刘慧敏,郭占达,等.河南省及周边省份猪群中大面积感染猪伪狂犬病毒的病因分析[J].病毒学报,2014,30 (4):441-449.
[8]彭金美,安同庆,赵鸿远,等.猪伪狂犬病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报,2013,35 (1):1-4.
[9]白丽丽,王旭荣,刘建营,等.伪狂犬病毒GDSH株的分离鉴定及gE基因的序列分析[J].畜牧兽医学报,2008,25(1):23-25.
[10]Tirabassi R S,Enquist L W . Mutation of the YXXL endocytosis motif in the cytoplasmic tail of pseudorabies virus gE[J].J Virol,l99,73(4):2717-2728.
[11]刘文峰,邓舜洲,戴益民,等.猪伪狂犬病病毒的分离鉴定[J].江西农业大学学报.2007,29(6):880-882.
[12]肖少波,陈焕春,方六荣,等.伪狂犬病病毒Ea株gE基因的克隆、序列分析及其表达[J].畜牧兽医学报,2002,33(2):174-179.
Genetic variation analysis of thegD and gE geneof new epidemiology of Porcine Pseudorabies Virus in Fujian
WEI Chun-hua,DAI Ai-ling,LI Xiao-hua,LIU Jian-kui,CHEN Ze-ming,YANG Xiao-yan
(College of Life Sciences of Longyan University,Key Laboratory of Preventive Veterinary Medicine and Biotechnology,Engineering Research Center for the Prevention and Control of Zoonosis,Longyan 364012,China)
Abstract:To study the genetic diversity,the molecular epidemiology and phylogenetic relationship of Pseudorabies virus (PRV)in Fujian province,the gD and gE gene in 11 PRV isolated from 2011 to 2013 were sequenced and analyzed.The results showed that PRVs were found in all detected farms,and the isolated virus could cause typical cytopathogenic effect(CPE)in PK-15 cell and the rabbits injected with the isolated virus showed typical symptoms of pseudorabies,such as pruritus,palsy,opisthotonos and death in the end.Sequence alignments of gD and gE indicated that gD and gE genes were highly homologous,which belong to a relatively independent sub-branch in phylogenetic analysis.We speculate that the prevalence of PRVs might have antigenic variation to some extent since 2011 in Fujian province.
Key words:PRV;isolation and identification;gD gene;gE gene;Genetic variation
中图分类号:S852.65+5
文献标志码:A
文章编号:0529- 6005(2016)03- 0015- 03
收稿日期:2014-11-14
基金项目:福建省科技重大专项项目(2014NZ0002-3);龙岩市科技创新平台(2013LY07)
作者简介:魏春华(1983-),女,实验师,硕士,主要从事分子病原学研究,E-mail:weichunhua02@163.com
通讯作者:杨小燕,E-mail:lyyxy1988@126.com
Corresponding author:YANG Xiao-yan
