发育性髋关节脱位闭合复位后股骨头坏死自然演变过程的临床及实验观察
2016-06-21裴新红莫越强马瑞雪
裴新红,莫越强,马瑞雪
(复旦大学附属儿科医院骨科,上海 201102)
发育性髋关节脱位闭合复位后股骨头坏死自然演变过程的临床及实验观察
裴新红,莫越强,马瑞雪
(复旦大学附属儿科医院骨科,上海 201102)
目的 探讨发育性髋关节脱位闭合复位术后股骨头坏死的自然演变过程。方法 单侧髋关节脱位闭合复位术后出现股骨头坏死的患儿22例,平均复位年龄10.5月(5~23月)。K&M分型II型11例,III型8例,IV型3例。平均随访3.5年(2.5~5.5年),采用股骨头高度同骺线宽度比(Height-Wild Ratio,HWR)计算股骨头修复百分比。同时观察了异常应力髋关节发育不良动物模型中,去除应力前后股骨头的形态变化及其修复情况。结果 22例患儿,在去除外固定架后自然负重的情况下,股骨头形态均有不同程度的修复。22例患儿坏死侧股骨头同健侧对比,从(24.7±5.26)%修复至(80.3±17.9)%。出现股骨头坏死后随访≤2年(n=10)股骨头高宽比(HWR)修复为(72±2.7)%;随访>2年(n=12)股骨头HWR修复(81.2±9.4)%。其中II型(n=11)HWR修复(78.3±4.2)%;III型(n=8) HWR修复(74.1±6.9)%;IV型(n=3) HWR修复(59.3±7.7)%。造模动物的股骨头形态学观察结果显示,随应力时间延长股骨头形态改变越显著,去除应力后均有不同程度修复。去除应力越早,日后发育越接近正常形态的股骨头。结论 发育性髋关节脱位闭合复位后股骨头坏死在自然负重状态下具有逐步修复的趋势;出现股骨头坏死后可以继续随访2~4年,以发挥DDH患儿股骨头自我修复的最大潜能。
发育性髋关节脱位;股骨头缺血坏死
发育性髋关节脱位(developmental dislocation of the Hips,DDH)的发现已近百年[1],病因仍未明确,治疗方式也存在争议[2]。目前公认的观点强调早期诊断和治疗[3]。早期通过闭合复位,约70%患儿的髋关节能够接近正常髋,18%左右存在残余髋臼发育不良[4],此外被认为治疗后灾难性的并发症——股骨头缺血坏死的发生率6%~48%[5]。闭合复位后股骨头缺血坏死(avascular necrosis of femoral head,ANV)的主要可能因素之一是异常压力的作用[6],目前对于发生ANV后是否需要早期干预以及治疗时机均存在争议[7]。表现ANV后即免负重、佩戴行走支架或通过股骨近端外翻截骨、骨盆截骨等手术方式,治疗从3岁到青春期病例均有报道[8,9],本文拟通过临床病例的随访观察DDH闭合复位后发生的自然临床转归,以及DDH动物模型中去除应力后股骨头的生长情况,探讨 “头臼同心”后,坏死股骨头在自然负重情况下的重新塑形能力。
1 资料及方法
1.1 一般资料 我院2012年1~12月收治22例单侧髋关节脱位,闭合复位术后出现患侧股骨头坏死的患儿,平均复位年龄10.5月(5~23月)。女18例,男4例;左侧12例,右侧10例。实验动物造模:Wistar孕鼠(复旦大学实验动物科学部提供,动物生产合格证号SCXK(沪)2009-0019;动物使用合格证号SYXK(沪)2009-0082),体重200g。清洁级实验室,温度恒定25℃,湿度维持45%~55%。单笼喂养,基础饲料,自由摄食及饮水。每12小时灯光开关周期。孕鼠产新生大鼠,生后6小时内双后肢伸髋伸膝位移用胶带固定,制备髋关节发育不良实验动物模型。分别于固定后2天,4天,6天去除外固定,模拟去除异常应力状态。继续喂养至1个月,麻醉下处死观察大体、组织形态。
1.2 方法 本组患儿闭合复位后行石膏固定3个月,外展支架固定3个月。所有病例术后均行三维CT检测,均实现头臼同心。去除支架后患儿开始负重行走,每3~6个月复查骨盆正位像,平均随访3.5年(2.5~5.5年)。三位测量者分别测量结果,取平均值。动物造模:双髋双膝并拢,医用胶带襁褓体位固定,每天更换一次固定胶带,固定期间正常母乳喂养。造模组:分别在固定2、4、6天麻醉下处死,观察大体、组织形态;去除应力组:固定2、4、6天后去除应力,在喂养至1月龄,麻醉下处死观察大体及组织形态。同龄正常大鼠股骨头作为对照。组织切片:采用组织学及免疫组化的方法观察髋关节发育不良动物模型去除应力前后,股骨头的形态变化。
1.3 疗效评价标准 股骨头坏死诊断标准依据Salter1969[10]:①复位后1年股骨头骨骺核仍未出现;②复位后1年,现存骨骺核生长发育停滞;③复位后1年,股骨颈部变宽;④股骨头变扁、密度增加后出现碎裂现象;⑤股骨头残余畸形,包括头变大变扁、扁平髋、髋内翻、颈短宽。股骨头坏死分型依据[11]:Kalamchi & MacEwen分型,复位后股骨头骨骺核延迟出现,股骨颈受轻微影响,骨骺核高度少量丢失,偶尔出现髋内翻为Ⅰ型;骨骺核改变加上外侧骺板破坏为Ⅱ型;骨骺核改变加上中央骺板破坏为Ⅲ型;股骨头和骺板均破坏为Ⅳ型。本组病例中,II型11例,III型8例,IV型3例。股骨头修复的评价方法:采用同健侧对比,股骨头高度同骺线宽度比(Height-Wild Ratio HWR)计算股骨头修复百分比[12]。如图1所示。
1.4 统计学方法 应用SPSS 19.0统计学软件包进行数据处理。两组比较采用t检验,P< 0.05为差异有统计学意义。
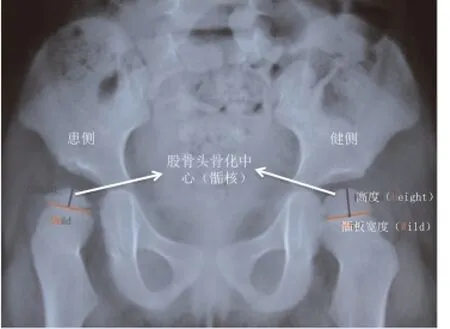
图1 股骨头高度同骺线宽度比(Height-Wild Ratio HWR)计算股骨头修复百分比示意图
2 结果
2.1 DDH闭合复位术后股骨头缺血坏死及恢复情况 22例AVN平均随访3.5年,股骨头HWR明显改善(P= 0.0047),从开始出现ANV的(24.7±5.26)%修复至(80.3±17.9)%,修复后的HWR与健侧比较,差异有统计学意义(P= 0.037),提示闭合复位后股骨头AVN具有一定自我修复的趋势,但随访期内股骨头骨化中心高度与HWR仍未达到健侧水平。
2.2 不同随访时间股骨头缺血坏死恢复情况 出现ANV随访≤2年(n=10)股骨头HWR修复为(72±2.7)%;随访>2年(n=12)股骨头HWR修复(81.2±9.4)%,两者之间差异有统计学意义(P= 0.023)。提示闭合复位后股骨头ANV在2年内修复速度较快,但随后仍有修复潜能。
2.3 不同分型股骨头缺血坏死恢复情况 ANV中II型(n=11)HWR修复(78.3±4.2)%;III型(n=8) HWR修复(74.1±6.9)%;IV型(n=3) HWR修复(59.3±7.7)%。II、III型之间差异无统计学意义,但两者与IV型之间的修复程度差异均有统计学意义(P= 0.0462)。提示闭合复位后骨骺核与骨骺全受累修复潜能较低,而其他部分骨骺受累的修复能力相对较强。
2.4 随访情况 单侧发育性髋关节脱位术后发生股骨头缺血坏死自然演变过程典型病例,见图2和图3。
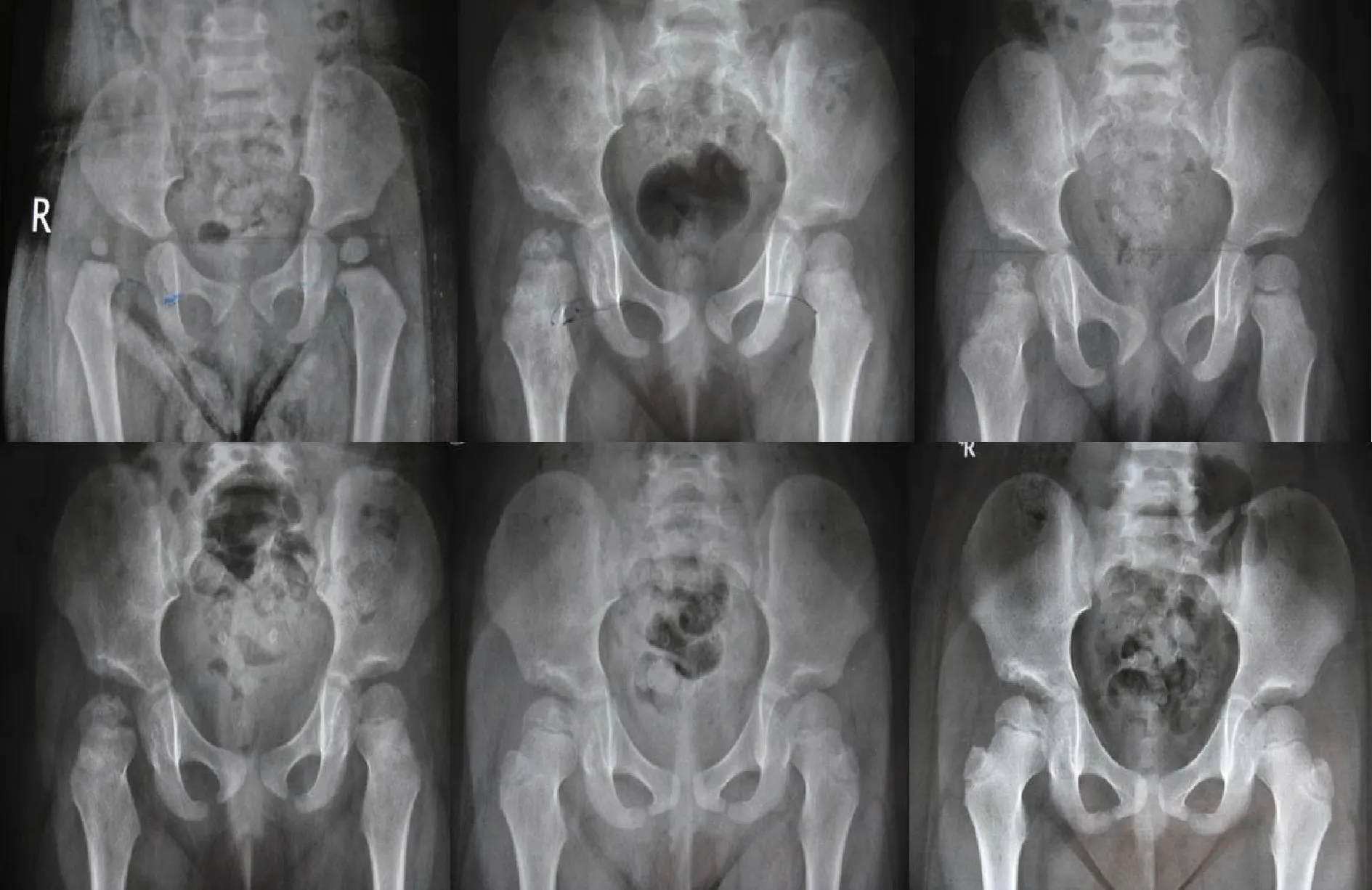
图2 典型病例1 患者,女,右髋关节脱位,复位年龄13月,闭合复位后右股骨头II型AVN,随访4.5年
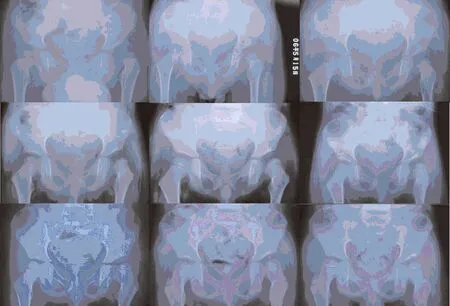
图3 典型病例2 患者,男,左髋关节脱位,复位年龄12月,闭合复位后左股骨头III型AVN,随访5.5年
2.5 实验动物模型的股骨头形态观察 利用髋关节发育异常动物模型,模拟复位后股骨头恢复情况。结果显示:大鼠髋关节及股骨头出现形态改变。股骨头骺板下陷,骨骺核变形,突入骺板。去除异常应力后,继续生长至1月,髋关节组织形态结果显示,随造模时间的延长,髋臼及股骨头均有形态失常,但较早期更接近于正常水平。股骨头骺板修复水平,骨骺核修复至骺板方。提示,随应力时间延长股骨头形态改变越显著,去除应力后均有不同程度修复。去除应力越早越能发育为接近正常形态的股骨头。见图4。

图4 时序性伸髋伸膝位固定新生大鼠后肢观察固定后及去除固定后股骨头形态
3 讨论
DDH自然病程或未治疗病例中,几乎不发生ANV[12,13]。在DDH治疗过程中,为了达到“头臼同心”,并尽量减小在成年的早期阶段,过早的出现退行性变及残疾,通过各种方式治疗的过程中,难以避免发生ANV[14]。在不同年龄段和不同的治疗方式中,ANV的发生率变异很大,从5%~50%[15]。DDH治疗后股骨头坏死的晚期并发症包括有:由于“头臼不匹配”引起的髋关节半脱位、由于股骨颈变短,导致的肢体不等长及外展受限[16]。由于ANV可能引起比DDH本身的病理改变更为严重的结局,因此也被称为灾难性的并发症[17]。
目前广泛应用的关于DDH治疗后ANV的分类方式是KM分类[18],分为I~IV型。Read和Evans发表的关于DDH治疗后ANV并发症处理的综述中指出[19],I型ANV基本可以修复,无需处理后遗畸形。II型主要的后遗畸形为髋外翻,通过内翻截骨治疗。III型常出现大转子高位及肢体不等长,可通过大转子下移或对侧肢体骨骺阻滞改善。IV型除III型的常见后遗畸形外还可能出现头臼不匹配,可行Salter骨盆截骨术。但综述中未提及对于DDH闭合复位后出现股骨头坏死病例的干预时机以及早期是否可以负重等目前仍存在争议的问题。本研究通过随访22例闭合复位后出现ANV DDH患儿,在自然负重情况下的自然病程,结果显示坏死股骨头均有不同程度恢复,且随随访时间越长(>2年)恢复越多的趋势。K&M IV型的恢复程度较其他差,在随访期间各型均未发生明显的肢体不等长。以上的结果提示,闭合复位后股骨头ANV具有一定自我修复的趋势;闭合复位后股骨头ANV在2年内修复速度较快,随后仍有修复潜能,但随访间期内仍未达到健侧水平;当骨骺核与股骨近端骺板全受累时,股骨头形态的修复潜能减低,而其他部分骨骺受累的修复能力相对较强。
机械力在骨骼发育及骨量增加中发挥重要作用,骨组织通过对机械力反应,维持正常的稳态及损伤后的修复[20]。组织损伤后重新塑形的过程中,修复和机械应力之间的关系是“双刃剑”,过小的机械应力和过于暴力的机械应力均可以导致骨骼重新塑形能力的减低[21]。体内外的实验结果提示,适当的机械力盈利对骨骼重塑的保护性作用机制,可能是通过防止骨及软骨细胞外基质中的胶原降解实现的[22]。尽管有些学者建议为防止股骨头进一步塌陷,在发现股骨头坏死后应尽量避免负重,本研究中,在实现稳定的头臼同心复位后,患儿开始自然负重,尽量避免长时间剧烈活动,并鼓励进行游泳等锻炼,结果提示在负重的应力作用下坏死的股骨头仍具有塑形能力。
伸髋伸膝位固定实验动物后肢,是目前制备异常应力下髋关节发育不良及脱位的通用模型[8,9]。本研究通过时序性的观察造模动物,在去除异常应力,修复负重后股骨头及髋臼的形态改变,结果显示:随着异常应力时间延长,股骨头及髋臼的形态失常越显著,去除应力后,早期髋臼及股骨头形态改变越小、修复越好;当异常应力持续存在一定的时期后,髋臼及股骨头形态将不可逆,但较早期略有重新塑形的趋势。为临床早期诊断及治疗提供了实验证据。本研究的不足之处在于例数少,无多中心横向资料比较。
综上所述,发育性髋关节发育不良/髋关节脱位闭合复位后股骨头坏死能够在自然负重状态下具有逐步修复的趋势;建议在出现股骨头坏死后,可以继续随访2~4年以发挥股骨头自我修复的最大潜能,以期用最简单的方法使患儿获得最佳的治疗结局。
[1] De Hundt M,Vlemmix F,Bais JM,et al.Risk factors for developmental dysplasia of the hip:a meta-analysis[J].J Obstet Gynecol Reprod Biol,2012,165(1):8-17.
[2] Ortiz-Neira CL,Paolucci EO,Donnon T.A meta-analysis of common risk factors associated with the diagnosis of developmental dysplasia of the hip in newborns[J].European Journal Radiologist,2012,81(3):e344-351.
[3] Bo N,Peng W,Xinghong P,et al.Dual function of β-catenin in articular cartilage growth and degeneration at different stages of postnatal cartilage development[J].Int Orthop,2012,36(3):655-664.
[4] Xinhong P,Yueqiang M,Bo N,et al.The role of TGF-β1 stimulating ROCK I signal pathway to reorganize actin in a rat experimental model of developmental dysplasia of the hip[J].Molecular and Cellular Biochemistry,2014,391(1-2):1-9.
[5] Kim HW,Morcuende JA,Dolan LA,et al.Acetabular development in developmental dysplasia of the hip complicated by lateral growth disturbance of the capital femoral epiphysis[J].J Bone Joint Surg Am,2000,82-A(12):1692-1700.
[6] Hadley NA,Brown TD,Weinstein SL.The effects of contact pressure elevations and aseptic necrosis on the long-term outcome of congenital hip dislocation[J].J Orthop Res,1990,8(4):504-513.
[7] Bittersohl B,Hosalkar HS,Wenger DR.Surgical treatment of hip dysplasia in children and adolescents[J].Orthop Clin North Am,2012,43(3):301-315.
[8] Cech O,Vávra J,Zídka M.Management of ischemic deformity after the treatment of developmental dysplasia of the hip[J].J Pediatr Orthop,2005,25(5):687-694.
[9] Mehmet B,Murat G,Oktay B,et al.Management of developmental dysplasia of the hip in less than 24 months old children[J].Indian J Orthop,2013,47(6):578-584.
[10]Salter RB,Kostuik J,Dallas S.Avascular necrosis of the femoral head as a complication of treatment for congenital dislocation of the hip in young children:A clinical and experimental investigation[J].Can J Surg,1969,12:44-60,
[11]Kalamchi A,MacEwen GD.Avascular necrosis following treatment of congenital dislocation of the hip[J].J Bone Joint Surg,1980,62A:876-888.
[12]Gardner RO,Bradley CS,Howard A,et al.The incidence of avascular necrosis and the radiographic outcome following medial open reduction in children with developmental dysplasia of the hip[J].Bone Joint J,2014,96-B(2):279-286.
[13]Andreas R,Deborah R,Evangelia P,et al.Osteonecrosis complicating developmental dysplasia of the hip compromises subsequent acetabular remodeling[J].Clin Orthop Relat Res,2013,471(7):2318-2326.
[14]Wedge JH,Kelley SP.Strategies to improve outcomes from operative childhood management of DDH[J].Orthop Clin North Am,2012,43(3):291-299.
[15]Gardner RO,Bradley CS,Howard A,et al.The incidence of avascular necrosis and the radiographic outcome following medial open reduction in children with developmental dysplasia of the hip:a systematic review[J].Bone Joint J,2014,96 (2):279-286.
[16]Bhuyan BK.Outcome of one-stage treatment of developmental dysplasia of hip in older children[J].Indian J Orthop,2012,46(5):548-555.
[17]McGillion S,Clarke NM.Lateral growth arrest of the proximal femoral physis:a new technique for serial radiological observation[J].J Child Orthop,2011,5(3):201-207.
[18]Agus H,Omeroglu H,Bicimoglu A,et al.Is Kalamchi and MacEwen Group I avascular necrosis of the femoral head harmless in developmental dysplasia of the hip[J].Hip Int,2010,20(2):156-162.
[19]Sllamniku S,Bytyqi C,Murtezani A,et al.Correlation between avascular necrosis and the presence of the ossific nucleus when treating developmental dysplasia of the hip[J].J Child Orthop,2013,7(6):501-505.
[20]Hideki K,Keisuke K,Masahiko I,et al.Effect of cytokines on osteoclast formation and bone resorption during mechanical force loading of the periodontal membrane[J].Hindawi pulishing corporation The scientific world journal,2014,2014(5):1-7.
[21]Lee CS,Szczesny SE,Soslowsky LJ.Remodeling and repair of orthopedic tissue:role of mechanical loading and biologics:part II:cartilage and bone[J].Am J Orthop (Belle Mead NJ),2011,40(3):122-128.
[22]Saunders MM,Simmerman LA,Reed GL,et al.Biomimetic bone mechanotransduction modeling in neonatal rat femur organ cultures:structural verification of proof of concept[J].Biomech Model Mechanobiol,2010,9(5):539-550.
Clinical and experimental observation on the natural processes of the femoral head avascular necrosis in DDH patients after close reduction
PEI Xin-hong,MO Yue-qiang,MA Rui-xue
(Department of Orthopaedics,The Children’s Hospital of Fudan University,Shanghai 201102,China)
MARui-xue
Objective To explore the natural processes of the femoral head avascular necrosis in patients developmental dislocation of the hips (DDH) after close reduction.Methods Twenty-two DDH patients with single dislocation hip who presented femoral head avascular necrosis after close reduction were enrolled in this study.The average age was 10.5 months ranged from 5 to 23 months.Based on Kalamchi & MacEwen classification,there were 11 cases with K&M type II,8 cases with K&M type III,and 3 cases with type IV.The average follow-up was 3.5 years ranged from 2.5 years to 5.5 years.Height-Wild Ratio (HWR) of femoral head was used to calculate percentage of recovery.In the mean time,we also observed the morphologic feature in hip dysplasia animal model.Results In the 22 patients,the morphology of necrosis femoral head had all recovered partially with natural body weight loading after releasing brace.Compared with normal side,HWR of femoral head was changed from (24.7 ± 5.26)% to (80.3 ± 17.9)%.The HWR recovery was (72 ± 2.7)% (n= 10) when followed up for less than 2 years while HWR recovery was (81.2 ± 9.4)% (n= 12) when followed up for more than 2 years.Moreover,HWR recovery was (78.3 ±4.2)% in the type II patients,(74.1 ± 6.9)% in the type III and (59.3 ±7.7)% in the type IV.In animal model,we observed that the shape of femoral head changed dramatically in abnormal stress loading,somehow the morphology of the femoral head recovered partially after stress overloading removed.Conclusion The avascular necrosis of femoral head has capability to recover partially in DDH close reduction with natural body weight loading after releasing brace.The patients could be followed-up for 2~ 4 years after occurrence of femoral head necrosis in order to the patients play the biggest potential for femoral head self healing.
Developmental Dislocation of the Hips;Avascular necrosis of femoral head
马瑞雪,女,博士,主任医师。中华小儿外科学会骨科学组副组长,亚太地区骨科学会小儿骨科学组成员。研究方向:小儿骨科先天畸形、创伤、肿瘤、炎症及小儿骨科疑难杂症。
R726.8
A
1672-6170(2016)04-0035-04
2016-05-30;
2016-06-06)
