雷帕霉素的三氮唑新衍生物FIM-X13对人胃癌细胞株AGS的作用及机制的初步研究
2016-06-21杨丹陈晓明李夸良谢立君潘福生黄捷
杨丹,陈晓明,李夸良,谢立君,潘福生,黄捷
雷帕霉素的三氮唑新衍生物FIM-X13对人胃癌细胞株AGS的作用及机制的初步研究
杨丹,陈晓明,李夸良,谢立君,潘福生,黄捷
【摘要】
目的研究雷帕霉素的三氮唑新衍生物 FIM-X13 对人胃癌细胞株 AGS 的作用,探讨其作用机制并分别与雷帕霉素和依维莫司比较。
方法磺酰罗丹明 B 检测 FIM-X13 对 AGS 增殖的抑制活性;流式细胞术检测 FIM-X13 对 AGS 细胞凋亡及周期影响;Western blot 分析 AGS 细胞内 mTOR、p70S6K1、S6 和 4EBP1 的磷酸化水平。
结果FIM-X13 能显著抑制 AGS 细胞的增殖,IC50为(9.32 ± 0.70)μmol/L,抑制能力强于雷帕霉素和依维莫司;FIM-X13 能显著诱导 AGS 细胞凋亡及阻滞细胞周期于G1期,其诱导 AGS 细胞凋亡和阻滞细胞周期的能力均强于雷帕霉素及依维莫司;FIM-X13 能显著抑制 AGS 细胞内 mTOR、p70S6K1、S6 和 4EBP1 的磷酸化,抑制能力与雷帕霉素和依维莫司相当。
结论雷帕霉素的三氮唑新衍生物 FIM-X13 对人胃癌细胞株 AGS 的抑制活性强于雷帕霉素和依维莫司。与雷帕霉素和依维莫司一样,FIM-X13 主要通过抑制 AGS 的mTOR 信号通路抑制细胞增殖、诱导细胞凋亡及阻滞细胞周期于 G1期等发挥抗肿瘤作用。
【关键词】胃肿瘤;哺乳动物雷帕霉素靶蛋白;雷帕霉素三氮唑衍生物
www.cmbp.net.cn中国医药生物技术, 2016, 11(3):224-228
作者单位:350122 福州,福建中医药大学药学院(杨丹、黄捷);350007福州,福建省微生物研究所(杨丹、陈晓明、李夸良、谢立君、黄捷);310012 杭州华东医药集团新药研究院有限公司(潘福生)
哺乳动物雷帕霉素靶蛋白(mTOR)是一种保守的丝-苏氨酸蛋白激酶,直接或间接参与细胞增殖、生长和代谢有关环节的调控,处于复杂的细胞内信号转导途径的中心,mTOR 信号转导途径过度激活与肿瘤细胞的生长、增殖、代谢和转移密切相关[1]。mTOR 抑制剂雷帕霉素衍生物依维莫司和替西罗莫司已作为抗癌药物应用于临床。
胃癌是常见恶性肿瘤之一,世界范围内的发病率和死亡率一直居高不下[2]。研究表明,60% ~ 80%胃癌中存在 mTOR 信号通路过度激活[3],激活与mTOR 上游的关键蛋白基因如 PIK3R3[4]、PIK3CA[5]和 PTEN[6-7]等突变及与 mTOR 相关的信号通路失调[8]有关。依维莫司治疗胃癌的 I/II 期临床试验已取得较好效果[9-10]。本文报道雷帕霉素的三氮唑新衍生物 FIM-X13 对胃癌细胞株 AGS的作用,与雷帕霉素和依维莫司进行比较,探讨其用于治疗胃癌的可能性。
1 材料与方法
1.1材料
人胃癌细胞株 AGS 购自中科院上海细胞库;FIM-X13(纯度 > 95%)由福建省微生物研究所合成,雷帕霉素(纯度 > 95%)由福建科瑞药业有限公司生产,依维莫司(纯度 > 95%)购自成都雅途生物医药公司,三种化合物用二甲基亚砜(DMSO)配成 1 mmol/L 储存液,-20℃ 保存;兔抗 mTOR、p-mTOR(Ser2448)、p70S6K1、p-p70S6K1(Thr389)、4EBP1、p-4EBP1(Ser65)、S6、p-S6(Ser235/236)和 GAPDH 抗体购自美国 Cell Signaling Technology公司;HRP 标记的兔抗羊 IgG 二抗购自美国Bioworld Technology 公司;F12 培养基、胎牛血清、消化胰酶和磷酸盐缓冲液(PBS)购自美国 Gibco公司;NC 膜和 ECL 发光试剂均购自美国 Biorad公司;磺酰罗丹明 B(sulforhodamine B,SRB)购自美国 Sigma 公司,以 1% 乙酸配制成 4% 溶液,4 ℃ 储存;三氯乙酸(TCA)购自国药集团股份有限公司;Annexin V-FITC/PI 双染检测细胞凋亡试剂盒和细胞周期检测试剂盒购自南京诺唯赞生物科技有限公司;BCA 蛋白定量试剂盒购自上海碧云天生物技术有限公司;硫酸庆大霉素购自福建汇天生物药业有限公司。
1.2方法
1.2.1人胃癌细胞株 AGS 的培养AGS 细胞在含 10% 胎牛血清、0.08 U/L 庆大霉素的 F12培养基中,于 37 ℃、5% CO2饱和湿度条件下培养。
1.2.2SRB 蛋白染色法检测 FIM-X13 对胃癌细胞株 AGS 增殖的影响操作方法参照文献[11]进行,将对数生长期的 AGS 细胞以 10 000 个/孔接种于 96 孔培养板,培养 24 h 后,加入用培养基稀释至终浓度分别为 10、15 和 20 μmol/L 的FIM-X13,以相同浓度梯度的雷帕霉素和依维莫司作为阳性对照,不加药培养基作空白对照。每个浓度设 3 个重复孔。培养 48 h,用预冷体积分数10% 的 TCA 固定细胞,4 ℃ 放置 1 h 后蒸馏水洗涤 5 次,室温自然干燥。加入由体积分数 1% 冰醋酸配制的 0.4% SRB 溶液,室温染色 15 min,去上清液,以 1% 醋酸洗涤 5 次,室温自然干燥。最后加入 10 mmol/L Tris 溶液(pH 10.5),酶标仪540 nm 波长下测定 OD 值。细胞增殖抑制率(%)=(1 - OD实验组/OD空白对照组)× 100%。并计算各化合物对 AGS 细胞的 IC50。
1.2.3Annexin V-FITC/PI 双染法检测 FIM-X13 对 AGS 细胞凋亡的影响将对数生长期的 AGS细胞以 6 × 105个/孔种入 6 孔板并培养 24 h,倾去培养基,加入用培养基稀释至终浓度分别为 10、15 和 20 μmol/L 的 FIM-X13,另设 15 μmol/L 雷帕霉素和依维莫司作为两个阳性对照组及不加药培养基作为空白对照组,继续培养 48 h 后,采用AnnexinV-FITC/PI 凋亡试剂盒测定细胞凋亡率:不含 EDTA 的胰酶消化细胞后,PBS 洗涤 2 次,用结合缓冲液 500 μl 重悬细胞后加入 5 μl AnnexinV-FITC 和 PI,室温黑暗条件下反应 5 min后,流式细胞仪检测细胞凋亡情况。
1.2.4PI 标记检测 FIM-X13 对 AGS 细胞周期的影响细胞培养和药物处理同 1.2.3,采用细胞周期检测试剂盒测定细胞周期。以不含 EDTA 的胰酶消化细胞后 PBS 洗涤 2 次。细胞用 75% 预冷的乙醇 4 ℃ 固定 12 h 后,预冷 PBS 洗涤细胞1 次,然后加入 200 μl 预冷的 PBS 重悬细胞。向细胞悬液中加入 20 μl RNase A 溶液,37 ℃ 水浴30 min,400 目筛网过滤。向滤液中加入 400 μl PI染液,摇匀后,4 ℃ 避光孵育 30 min,流式细胞仪检测细胞周期。
1.2.5Western blot 检测 FIM-X13 对 AGS 细胞mTOR 及其下游蛋白磷酸化的影响细胞培养同1.2.3。倾去培养基,加入用培养基稀释至终浓度分别为 0.01、0.1 和 1 μmol/L 的 FIM-X13,另设0.1 μmol/L 雷帕霉素和依维莫司作为两个阳性对照组,不加药培养基作为空白对照组。继续培养 48 h后,倾去培养基,用 PBS 洗涤细胞 2 次后,用2% SDS 100 μl 裂解细胞并收集细胞裂解液,沸水浴 10 min 后,10 000 r/min 离心 10 min,弃细胞残渣,收集蛋白。BCA 蛋白试剂盒测定细胞裂解液蛋白含量并将各样品蛋白含量定量至一致。根据不同待测蛋白质的分子量选择不同浓度的 SDS-聚丙烯酰胺凝胶电泳分离蛋白,半干式转膜仪将目标蛋白转移至 NC 膜,5% 脱脂牛奶封闭空白位点,特异性一抗 4 ℃ 振摇孵育过夜。次日,蛋白条带在 TBST 中润洗 3 次,每次 15 min。二抗孵育 1 h后,TBST 润洗 3 次,每次 15 min。ECL 发色法显影。以 GAPDH 作为内参蛋白。Image-Pros Plus 6.0 计算 Western blot 条带灰度值。
1.3统计学处理
2 结果
2.1FIM-X13 抑制 AGS 细胞增殖
FIM-X13 作用 AGS 细胞 48 h 后,AGS 细胞增殖受到抑制,FIM-X13 对 AGS 细胞增殖的抑制活性随浓度升高而增强,其 IC50为(9.32 ± 0.70)μmol/L,强于雷帕霉素(14.68 ± 1.07)μmol/L 和依维莫司(14.66 ± 1.11)μmol/L,差异具有统计学意义(P < 0.05)(图1)。
2.2FIM-X13 诱导 AGS 细胞凋亡
与空白对照组相比,FIM-X13 显著诱导 AGS细胞的凋亡(P < 0.05),诱导能力随浓度增加而增强。在相同浓度下,FIM-X13 诱导细胞凋亡能力显著高于雷帕霉素和依维莫司,差异具有统计学意义(P < 0.05)(图2)。

图1 FIM-X13、雷帕霉素和依维莫司对 AGS 细胞增殖的抑制作用比较(与雷帕霉素或依维莫司相比,#P < 0.05,##P < 0.01)Figure 1 In comparison of FIM-X13 with rapamycin and everolimus on inhibiting cell proliferation in AGS cell line (#P < 0.05,##P < 0.01 vs rapamycin or everolimus)
2.3FIM-X13 阻滞 AGS 细胞周期于 G1期
FIM-X13 能够阻滞 AGS 细胞周期于 G1期,其 G1期细胞百分比与空白对照组相比,差异具有统计学意义(P < 0.01),随着 FIM-X13 浓度增大,其阻滞细胞周期的能力增强。在相同浓度下,FIM-X13 阻滞 AGS 细胞周期的能力强于雷帕霉素和依维莫司,差异具有统计学意义(P < 0.05)(图3)。
2.4FIM-X13 抑制 AGS 细胞 mTOR 及其下游蛋白的磷酸化
Western blot 检测表明,FIM-X13 显著抑制mTOR、p70S6K1、S6 和 4EBP1 的磷酸化(P <0.05)并具有浓度梯度效应。与相同浓度的雷帕霉素和依维莫司相比,活性相近(P > 0.05)(图4)。上述结果表明,与雷帕霉素和依维莫司一样,FIM-X13 能抑制 mTOR 信号转导途径的过度活化,为 mTOR 信号转导途径抑制剂。
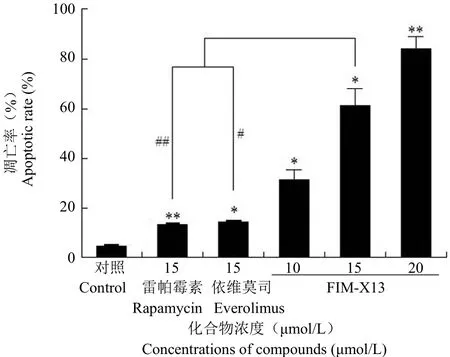
图2 FIM-X13、雷帕霉素和依维莫司诱导 AGS 细胞凋亡的比较(与空白组相比,*P < 0.05,**P < 0.01;与雷帕霉素或依维莫司相比,#P < 0.05,##P < 0.01)Figure 2 In comparison of FIM-X13 with rapamycin and everolimus on reducing cell apoptosis in AGS cell line (*P <0.05,**P < 0.01 vs control;#P < 0.05,##P < 0.01 vs rapamycin or everolimus)
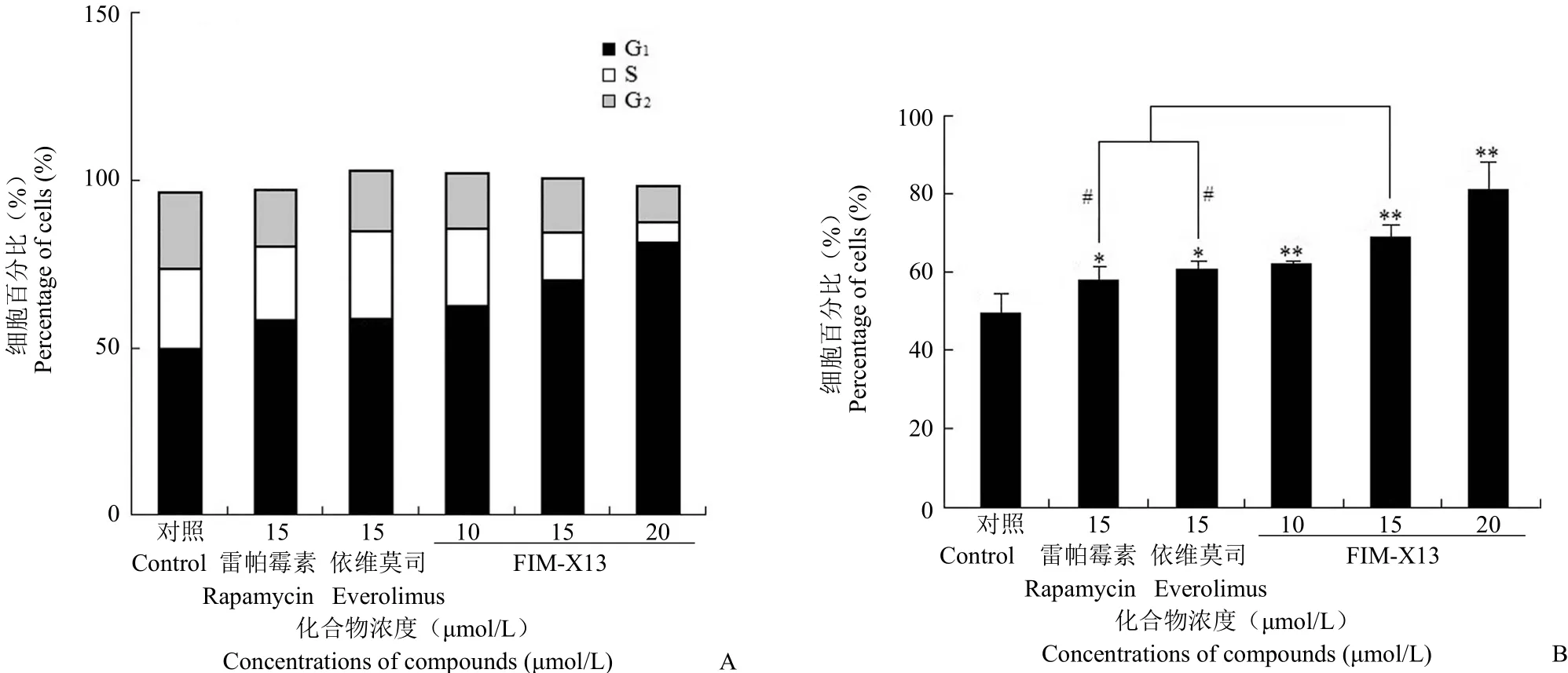
图3 FIM-X13、雷帕霉素和依维莫司阻滞 AGS 细胞周期作用的比较(A:各细胞周期所占比例分析结果;B:G1期细胞百分比分析结果;与空白组相比,*P < 0.05,**P < 0.01;与雷帕霉素或依维莫司相比,#P < 0.05)Figure 3 In comparison of FIM-X13 with rapamycin and everolimus on cell cycle arresting AGS cell line (A: The comparision of percentage of different cell cycle; B: The analysis of G1percentages;*P < 0.05,**P < 0.01 vs control;#P < 0.05 vs rapamycin or everolimus)

图4 FIM-X13、雷帕霉素和依维莫司对 AGS 细胞 mTOR 及其下游蛋白磷酸化抑制作用的比较(与空白组相比,**P <0.01)Figure 4 In comparison of FIM-X13 with rapamycin and everolimus on inhibiting the phosphorylation of mTOR and its downstream proteins in AGS cell line (**P < 0.01 vs control)
3 讨论
综上所述,FIM-X13 具有很强的抑制胃癌细胞株 AGS 增殖的作用,抑制能力强于雷帕霉素和依维莫司。与雷帕霉素和依维莫司一样,FIM-X13 通过抑制 mTOR 信号转导途径、诱导 AGS 细胞凋亡、阻断 AGS 细胞于 G1期等达到抑制 AGS细胞增殖的作用。提示 FIM-X13 作为 mTOR 抑制剂,在治疗胃癌方面值得开展进一步体内外药效研究。
含有三氮唑基团的衍生物具有包括抗肿瘤在内的多种生物学活性,一直是药物研究的热点。其原理是三氮唑五元芳香唑环上的 3 个氮原子很容易与生物体内的各种酶和受体以非共价键相互作用。三氮唑衍生物的抗癌机制多样,如 1,2,3-三氮唑衍生物抑制热休克蛋白合成、抑制组氨酸去乙酰化酶活性、抑制微管聚合作用、抑制蛋白酪氨酸激酶活性等[12],抑制芳香化酶活性的三氮唑衍生物来曲唑、阿那曲唑和伏氯唑已作为治疗乳腺癌的药物应用于临床。FIM-X13 为 1,2,3-三氮唑 C43-雷帕霉素,其对 AGS 细胞增殖抑制能力强于雷帕霉素和依维莫司,说明 1,2,3-三氮唑骈合雷帕霉素增强了雷帕霉素的抗胃癌活性,其机制是否达到预期的三氮唑和 mTOR 抑制联合发挥作用还有待进一步探讨。本研究为雷帕霉素与三氮唑类化学半合成及雷帕霉素类 mTOR 抑制剂与三氮唑类药物联合治疗胃癌提供借鉴。此外,从化学结构分析,三氮唑的 3 个氮原子增加了化合物的极性,可能从药代动力学方面也比母核雷帕霉素有更好的表现。
PI3K/AKT/TSC/mTOR 信号转导途径中,PI3K接受来自胰岛素或胰岛素样生长因子的信号,通过级联反应磷酸化 AKT 的苏氨酸 308 位点激活AKT,后者抑制了 TSC 从而激活 mTORC1[1]。mTORC1 上游任何激酶如 PI3K、AKT、TSC 基因的突变和缺失都促进 mTOR 信号途径的活化,mTOR 通过对其下游 4EBP1 和 S6K1 的磷酸化激活了与核糖体发生、细胞增殖和代谢相关蛋白的翻译,促进肿瘤的生长、增殖和转移[3]。AGS 为PI3K 基因 PIK3CA 突变的胃癌细胞株细胞,PIK3CA 基因的突变使 PI3K 异常表达,造成AGS 细胞的 mTOR 信号途径过度活化。继手术、放化疗后,针对癌症发生、发展相关信号途径关键激酶的靶向治疗成为晚期肿瘤治疗的重要手段,其中的小分子靶向药物数量有限。因此,可通过其他胃癌株进一步研究,以明确 FIM-X13是否是由PIK3CA 基因突变造成的 mTOR 信号途径过度激活的胃癌潜在治疗药物。
参考文献
[1] Porta C, Paglino C, Mosca A. Targeting PI3K/Akt/mTOR signaling in cancer. Front Oncol, 2014, 4:64.
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin, 2015, 65(1):5-29.
[3] Advani SH. Targeting mTOR pathway: a new concept in cancer therapy. Indian J Med Paediatr Oncol, 2010, 31(4):132-136.
[4] Zhou J, Chen GB, Tang YC, et al. Genetic and bioinformatic analyses of the expression and function of PI3K regulatory subunit PIK3R3 in an Asian patient gastric cancer library. BMC Med Genomics, 2012,5:34.
[5] Samuels Y, Wang Z, Bardelli A, et al. High frequency of mutations of the PIK3CA gene in human cancers. Science, 2004, 304(5670):554.
[6] Li M, Sun H, Song L, et al. Immunohistochemical expression of mTOR negatively correlates with PTEN expression in gastric carcinoma. Oncol Lett, 2012, 4(6):1213-1218.
[7] Wen YG, Wang Q, Zhou CZ, et al. Mutation analysis of tumor suppressor gene PTEN in patients with gastric carcinomas and its impact on PI3K/AKT pathway. Oncol Rep, 2010, 24(1):89-95.
[8] Shimobayashi M, Hall MN. Making new contacts: the mTOR network in metabolism and signalling crosstalk. Nat Rev Mol Cell Biol, 2014,15(3):155-162.
[9] Xu B, Wu Y, Shen L, et al. Two-dose-level confirmatory study of the pharmacokinetics and tolerability of everolimus in Chinese patients with advanced solid tumors. J Hematol Oncol, 2011, 4:3.
[10] Doi T, Muro K, Boku N, et al. Multicenter phase II study of everolimus in patients with previously treated metastatic gastric cancer. J Clin Oncol, 2010, 28(11):1904-1910.
[11] Huang J, Yang GX, Yu H, et al. Sirolimus F904 and its derivative FIM-A (AP23573) anticncer activity in vitro. J Fujian Normal Univ (Nat Sci Ed), 2010, 26(5):63-66. (in Chinese)黄捷, 杨国新, 余辉, 等. 西罗莫司F904及其衍生物FIM-A (AP23573)的体外抗癌活性. 福建师范大学学报(自然科学版),2010, 26(5):63-66.
[12] Zhou CH, Wang Y. Recent researches in triazole compounds as medicinal drugs. Curr Med Chem, 2012, 19(2):239-280.
Author Affiliations: Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China (YANG Dan, HUANG Jie); Fujian Institute of Micbiology, Fuzhou 350007, China (YANG Dan, CHEN Xiao-ming, LI Kua-liang, XIE Li-jun, HUANG Jie); Hangzhou HuaDong Medicine Group Pharmaceutical Research Institute Co. Ltd., Hangzhou 310012, China (PAN Fu-sheng)
www.cmbp.net.cnChin Med Biotechnol, 2016, 11(3):224-228
Preliminary study on effect and mechanism of a novel rapamycin containing triazole derivative FIM-X13 on gastric carcinoma AGS cell line
YANG Dan, CHEN Xiao-ming, LI Kua-liang, XIE Li-jun, PAN Fu-sheng, HUANG Jie
【Abstract】
ObjectiveOur purpose is to investigate the inhibitory effect and mechanism of a novel rapamycin containing triazole derivative FIM-X13 on gastric carcinoma as compared with rapamycin or everolimus separately.
MethodsThe proliferation of cancer cells was tested by sulforhodamine B assay. The apoptosis and cell cycle of cancer cells were individually analyzed by flow cytometry. The expressions of mTOR, p70S6K1, S6, 4EBP1 and their phosphorylation level were separately detected by Western blot.
ResultsFIM-X13 inhibited the proliferation of gastric carcinoma AGS cells in a dose-dependent manner with IC50value of (9.32 ± 0.70) μmol/L and the inhibitory effect was even more potent than that of rapamycin and everolimus. It also induced apoptosis and G1phase cell cycle arrested in AGS cells. In addition, FIM-X13 suppressed the phosphorylation level of mTOR and its downstream targets of 4EBP1, p70S6K1 and S6, which was consistent with rapamycin and everolimus.
ConclusionThe novel triazole-containing rapamycin derivate FIM-X13 exerts more potent effect on cell proliferation than rapamycin and everolimus do. Similar to rapamycin and everolimus, FIM-X13 significantly inhibits proliferation of gastric cancer cell, induces cell apoptosis and G1phase cell cycle arrest via blocking mTOR pathway. FIM-X13 may become a promising mTOR inhibitor candidate for the treatment gastric carcinoma.
【Key words】Stomach neoplasms;TOR serine-threonine kinases;Rapamycin triazole containing derivative
DOI:10.3969/j.issn.1673-713X.2016.03.005
基金项目:国家自然科学基金(81502935);福建省属工艺类科研院所基本科研专项(2015R1009-7)
通信作者:黄捷,Email:xlms2003@163.com
收稿日期:2015-12-21
Corresponding Author:HUANG Jie, Email: xlms2003@163.com
