天然香辛料中抗肥胖成分的研究进展
2016-06-20杨潇,李锐
杨 潇,李 锐
(西华大学食品与生物工程学院,四川 成都 610039)
天然香辛料中抗肥胖成分的研究进展
杨潇,李锐
(西华大学食品与生物工程学院,四川 成都610039)
摘要:目前的研究已在多种天然香辛料中发现了辣椒碱、胡椒碱、吴茱萸碱、异硫氰酸丙烯酯、姜辣素等多种具有抗肥胖功能的化学成分。文章主要对这几种抗肥胖化学成分的来源及其通过TRPV1产生抗肥胖功能的作用机制进行介绍,提示未来从食品中筛选抗肥胖成分的研究重点很可能集中在天然辛辣香辛料方面。
关键词:TRPV1;天然香辛料;抗肥胖成分
随着社会经济的发展和人们饮食结构的变化,由于能量摄入和消耗不平衡造成的肥胖现象已越来越普遍,其中以内脏脂肪过度积累造成的腹部肥胖对健康的危害最大[1]。近年来肥胖人口数量的增加也非常迅猛,由此造成了由肥胖引起的非传染性并发症(如糖尿病、高血压和高血脂症)的泛滥,不仅给人类健康带来极大威胁,而且给各国医疗保障系统带来巨大的经济负担;但是目前已批准用于临床和在研的肥胖治疗药物却并不多,主要包括抑制食欲、抑制肠道消化吸收和增加能量消耗3类。然而由于肥胖所涉及的因素十分复杂,许多治疗靶点还涉及到其他生理过程的调节,使得目前的抗肥胖药物在治疗肥胖的同时还带来了许多严重的副作用。由于肥胖治疗药物研究领域惨淡的历史,目前可以有效并且安全的用于抗肥胖治疗的药物为数甚少,使得人们对具有抗肥胖功能的天然产物十分关注,特别是从具有长期食用历史的食品中寻找抗肥胖成分的研究已成为抗肥胖领域的一个研究热点。
1天然香辛料中存在的具有抗肥胖功效的有效成分
香辛料是一类能够使食品呈现各种典型风味的食用香料的简称。天然香辛料主要来源于植物的种子、果实、茎叶、树皮、花蕾等部位,在我国有数千年的食用历史,是我国饮食文化中不可或缺的一环。目前已列入我国国家标准( GB/T 12729. 1—2008《香辛料和调味品》)的品种已达68种。由于我国具有独特的饮食文化和适宜主要香辛料生长的自然环境,使得我国已成为全世界主要的香辛料生产和出口国。我国的大多数香辛料都具有赋予食品麻、辣、鲜、辛等独特风味的功能,是传统食品加工中的一种重要原料。最近的研究表明,人体对麻、辣、辛等刺激性口味的感知并不是通过味蕾发生的,而是通过在口鼻部位大量表达的一种离子通道受体的激活而实现的。当食物中的某些成分激活这种离子通道受体后会通过感觉神经元直接形成对刺激性口味的感觉,因此这种感觉也被称为“化学合成味觉(Chemesthesis)”[2]。目前的研究[2]已确认瞬时受体电位香草酸亚家族 1 (Transient receptor potential vanilloid subfamily, member 1,TRPV1)即为这种产生麻、辣、辛等刺激性口味的主要受体。辣椒素就是最早被发现的TRPV1受体激动剂,TRPV1也因辣椒素属于香草酸类化合物而得名[3]。由于TRPV1抑制肥胖中扮演的角色已被最近的研究[2-5]所证明(见下文),这暗示了在有辛辣口味的食品中可能普遍存在着具有抗肥胖功效的有效成分。目前的研究[3-7]已在多种天然香辛料中发现了具有抗肥胖功能的化学成分。
1.1辣椒素类物质
在众多抗肥胖食品中,辣椒是较早受人关注的。在早期的研究中就已发现在日本女性的高脂、高碳水化合物膳食中加入红辣椒成分可以显著的增加膳食诱导的产热和脂肪氧化,从而平衡能量摄入[4]。在高脂饮食诱导的肥胖小鼠模型的研究中也发现辣椒成分可以显著降低肥胖小鼠的体质量,而目前的研究已证明辣椒中具有抗肥胖功效的有效成分包括辣椒素(capsaicin)和辣椒素酯类物质(capsinoids)[5]。辣椒素又名辣椒碱、辣椒辣素,是辣椒中的主要辛辣成分,化学名称是N-香草基-8-甲基-6-壬烯酰胺,分子式为C18H27O3N。天然辣椒素由一系列同类物族酰胺类化合物所组成,按其结构的不同可划分为辣椒素族、二氢辣椒素族、对甲基辣椒素族、对甲基辣椒素烯链族、对甲基辣椒素饱和链烃族及对苯甲基辣椒素族,其中每一族又含有若干个成分。辣椒素酯类物质(capsinoids)是近年来在辣椒中新发现的一类抗肥胖有效成分,主要由辣椒素酯、二氢辣椒素酯、降二氢辣椒素酯等构成,不过辣椒素酯类物质无辛辣刺激性味道,且刺激性和毒性低于辣椒素;因此其在临床应用方面可能比辣椒素具有更多的优势[6]。目前在对人和动物的研究中都发现在膳食结构里增加辣椒素及其类似物时可以显著增加能量消耗和脂肪氧化水平,同时减少脂肪在内脏部位的沉积,从而有助于控制腹部肥胖的发生[7],而流行病学的研究也表明膳食里加入辣椒的人群中肥胖的发病率更低[7]。在一系列的临床研究中也证实了辣椒素及其类似物在治疗肥胖中的作用[8-9]。
1.2胡椒碱
胡椒碱(piperine)是从胡椒中提取得到的一种活性化学物质,属于桂皮酞胺类生物碱。在自然界中广泛存在,尤其在胡椒科植物中大量存在。在早期的研究中主要关注胡椒碱的抗氧化、免疫调节、抗肿瘤、促进药物代谢等功能[10-11];而最近的研究已证实胡椒碱也是一种TRPV1的激动剂,并且其对TRPV1的信号激活效果要强于辣椒碱类物质[12]。由于TRPV1与肥胖的紧密联系,使得人们对胡椒碱的抗肥胖功能产生了兴趣。随后在细胞水平的研究中发现在前脂肪细胞3T3-L1分化过程中,胡椒碱可以通过上调脂联素的表达、下调过氧化物酶体增殖物激活受体γ(PPARγ)活性并抑制PPARγ表达从而抑制脂肪细胞的分化和脂肪的生成[13-14]。在动物水平的研究中也发现在高脂饮食诱导的小鼠肥胖模型中,胡椒碱不仅可以显著减少模型小鼠的体重,血液中甘油三酯、总胆固醇、LDL、VLDL的含量和脂肪量,而且增加了高密度脂蛋白的水平,却不会对小鼠的食欲造成影响[15]。这些实验结果都暗示了胡椒碱在肥胖治疗中的潜在价值。
1.3吴茱萸碱
吴茱萸(Evodiarutaecarpa(Juss.)Benth. )属芸香科吴茱萸属植物,其干燥近成熟果实不仅作为一种辛辣调味品,也是我国传统中药的一种。吴茱萸碱(evodiamine)是从吴茱萸果实中提取的一种生物碱类活性物质,具有抗肿瘤、降血压、抗感染等多种功效[16]。在早期已有研究发现,雄性C3H小鼠采用含吴茱萸碱的饲料喂养后,其肾周脂肪和附睾脂肪组织的重量要显著低于对照组[17];而在高脂饲料诱导的SD大鼠肥胖模型中,吴茱萸果实的乙醇提取物(主要成分为吴茱萸碱)可以显著地降低模型大鼠的体重、外周脂肪组织重量和血脂水平。此外对禁食小鼠进行皮下注射吴茱萸碱后会引起小鼠体温下降,而这一作用可以被TRPV1受体抑制剂所阻断。而饱食小鼠皮下注射吴茱萸碱后,会引起其尾部皮肤温度升高,这暗示了吴茱萸碱可能与辣椒素具有类似的抗肥胖作用,即通过激活TRPV1增加热量散失促进能量消耗,防止内脏外周脂肪的积累和体重增加[17]。在随后的研究中也证实了吴茱萸碱是一类新型的非刺激性TRPV1受体抑制剂[18];而最新的研究进一步发现,在3T3-L1和C3H10T1/2的脂肪细胞分化模型中,吴茱萸碱可以显著抑制脂肪细胞的分化和脂肪代谢相关基因的表达。在糖尿病的小鼠模型中吴茱萸碱与罗格列酮联合作用可以显著的改善胰岛素抵抗和脂肪相关的肝损伤及糖原沉积[19]。
1.4异硫氰酸丙烯酯
异硫氰酸丙烯酯(allyl isothiocyanate)是芥末中产生辛辣风味的有效物质。在早期的膳食营养调查中就发现在膳食中联合添加芥末酱可以显著地提高餐后机体的能量代谢速率[20]。之后的研究中发现芥末的水提物(主要成分为异硫氰酸丙烯酯)具有抑制3T3-L1前脂肪细胞向脂肪细胞分化和脂肪生成的功能,同时还可以显著地抑制脂肪生成相关基因的表达[21]。而在该高脂饮食诱导的小鼠肥胖模型中,芥末的水提物也可以减轻肥胖小鼠的体重,减少肝脏和白色脂肪组织中的脂质沉积,同时瘦素、 PPARγ和 C/EBPα等脂肪生成相关基因的表达也被抑制,而联素等促进脂肪酸氧化的基因的表达却显著增强[22]。不过,虽然异硫氰酸丙烯酯对TRPV1的激活作用已被证明,但是异硫氰酸丙烯酯是通过TRPV1还是通过TRPA1(另一种瞬时受体电位通道)发挥增强碳水化合物氧化和抑制肥胖的作用还存在着争议[23-25]。此外,最近的研究还发现异硫氰酸丙烯酯具有可通过抑制脂肪组织中巨噬细胞的募集和MCP-1的释放从而发挥抑制肥胖诱导的炎症反应的功能,以及通过调节线粒体改善胰岛素抵抗的功能[26-27]。
1.5姜辣素
姜辣素(gingerol)是生姜中产生辛辣风味物质的总称。关于姜辣素成分的研究迄今已有100多年的历史,已确认的姜辣素主要成分根据其所连接脂肪链的不同可分为姜酚(gingerols)、姜酮(zingerone)、姜烯酚(shogaols)、副姜油酮(paradols)、姜二酮(gingerdirones)与姜二醇(gingerdiols)等6大类[28]。长期以来对于姜辣素药理作用的研究主要集中在抗炎抗氧化、降脂降血糖、止吐抗晕、抗菌抗肿瘤方面。随后的研究[29]中证实了姜辣素对TRPV1的激活作用,暗示了其也可能具有抗肥胖作用,而从最近几年的研究[30]中人们才逐渐对姜辣素的抗肥胖功能有了一定的认识。在3T3-L1前脂肪细胞的诱导分化模型中发现姜辣素可以通过下调PPARg活性并抑制脂肪酸合酶和脂肪细胞脂结合蛋白(AP2)的活性来显著地抑制罗格列酮所诱导的3T3-L1细胞分化过程中的脂肪生成作用,从而暗示了姜辣素可能通过抑制脂肪生成的方式来控制肥胖[30-31]。最新的研究[32-33]也表明在高脂饮食诱导的肥胖大鼠模型中通过口服姜辣素处理可以显著地降低模型鼠的体重、脂肪组织质量、血脂、血糖、胰岛素等生理病理指标和脂肪合成酶、脂蛋白脂酶等与脂肪生成相关酶类的活性,在动物水平上进一步证明了姜辣素的抗肥胖功能。
在以上发现的这5类抗肥胖成分中除辣椒素类物质和姜辣素类物质具有相似的结构外,胡椒碱、吴茱萸碱和异硫氰酸丙烯酯却具有完全不同的化学结构(见图1),这暗示了TRPV1激动剂所存在的多样性和其调节肥胖功能的复杂性。
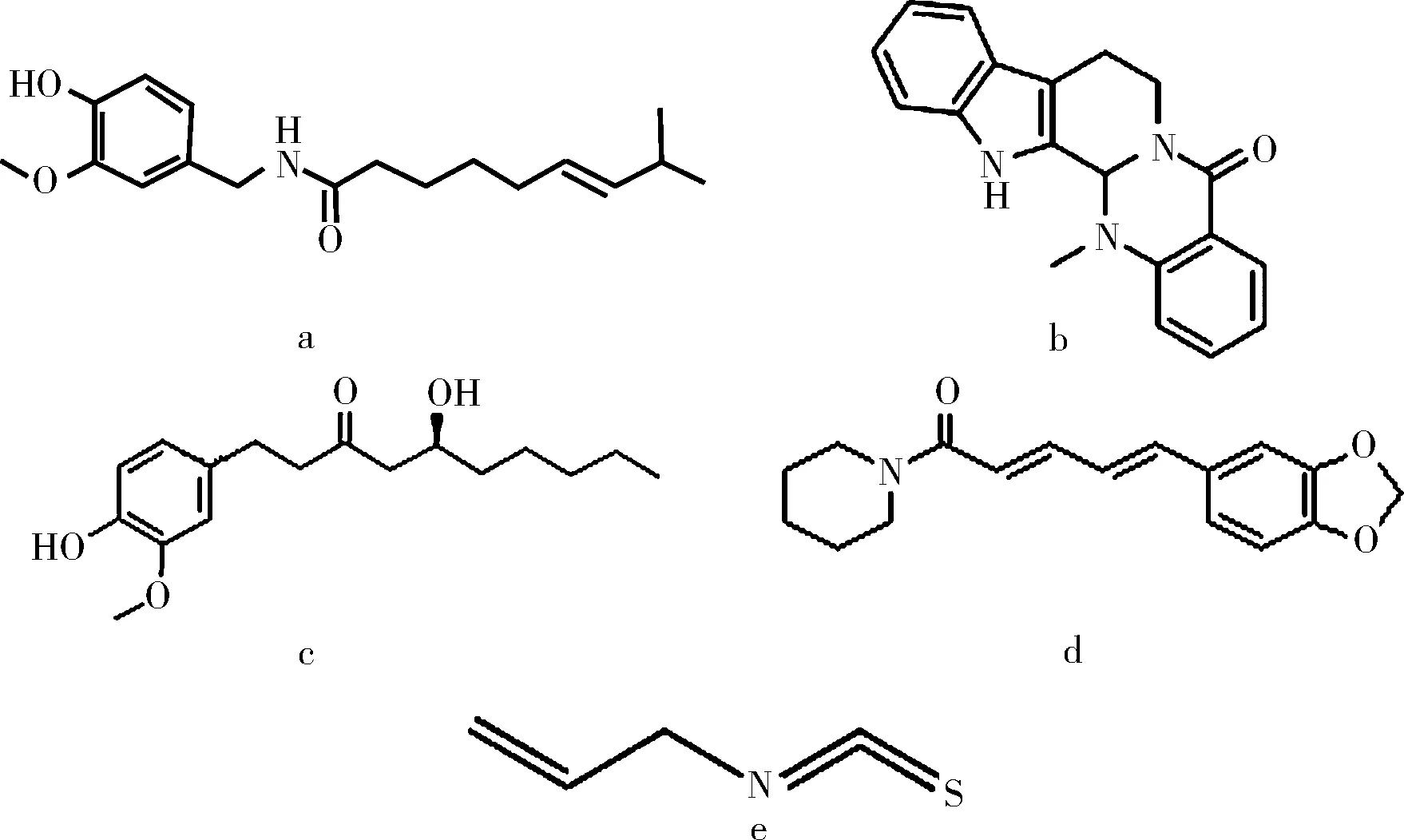
图1 5种抗肥胖成分的化学结构
2香辛料中的辛辣成分通过激活TRPV1产生抗肥胖功效
随着对外周系统在影响能量摄入与消耗方面的研究逐渐深入,使得以外周系统为靶点寻找更加安全有效的治疗策略成为抗肥胖研究的趋势。近年来有多条涉及调节食物摄入和体重的信号通路被阐明,为抗肥胖药物的研究提供了潜在的作用靶点[34]。在众多潜在靶点中, TRPV1是近年来倍受关注的一个。TRPV1属于瞬时感受器电位离子通道超家族,是一类具有6个跨膜区的膜蛋白,其中跨膜的5或6区内,有一个以疏水片段为核心的区域。TRPV1的阳离子通道受体可以被辣椒素和香草酸类化合物、酸性环境(pH<6.0)、热刺激(>43 ℃)等理化因素激活,激活后会引起Ca2+、Mg2+和Na2+等阳离子内流,其中Ca2+和Mg2+具有相对更高的透过性[35]。TRPV1的组织分布十分广泛,在中枢神经系统和外周感觉神经元均有表达,并在痛觉传导中发挥着重要的作用;因此,此前一直将TRPV1作为镇痛药物研发的靶点之一[35]。不过最近的研究发现,TRPV1在很多非神经细胞,特别是在人和鼠的内脏脂肪组织和3T3-L1前脂肪细胞中也有表达,暗示了其可能参与了脂肪代谢的生理调节活动[36]。
在近年的人体试验中发现高BMI值人群摄入TRPV1激动剂capsinoids,尽管只能轻微地减轻体重,但却可以增强脂肪氧化并显著减少腹围[37-38]。在进一步的研究中发现TRPV1敲除的小鼠在高脂诱导下比野生型小鼠具有更低体重增加和脂肪生成量,暗示了TRPV1在调节能量和脂肪代谢中可能也发挥着重要的作用[39]。而另一个研究则发现3T3-L1前脂肪细胞在辣椒素刺激下可增加胞内钙离子浓度并抑制脂肪生成,且存在剂量依赖效应;辣椒素的长期膳食摄入可以让野生型小鼠预防高脂饮食引起的肥胖,但在TRPV1敲除鼠中却无此作用。这一研究直接证明了在脂肪细胞中辣椒素通过激活TRPV1通路来发挥预防脂肪生成和肥胖的功能[36]。尽管也有研究表明摄入TRPV1激动剂并没有直接调节体重的作用[40],但是更多的研究已证明TRPV1与能量代谢、脂肪吸收和脂肪重分布等调节体重的生理功能相关;因此大多数的研究都把TRPV1的激活作为一个抑制肥胖发生的潜在机制。
由于肥胖的发生本身十分复杂,通过激活TRPV1的抗肥胖机制并不十分清楚。目前的研究表明可能涉及4个方面的机制:1)TRPV1激活可以促进速激肽类的释放,增强肠胃的运动能力,提高胃排空时间,从而影响营养的吸收并产生饱腹感[1];2)表达TRPV1的肠黏膜传入神经可影响内脏脂肪组织中的血管收缩,从而使脂肪优先地沉积在皮下而不是内脏脂肪组织中[41];3)表达在脂肪细胞中的TRPV1可影响脂肪细胞的生理活动,从而抑制脂肪的生成和脂肪细胞的分化[42-43],或通过激活caspase-3引起细胞的凋亡[44];4)TRPV1激活可以触发棕色脂肪组织(BAT)中的产热反应,从而增加机体的能量消耗[45]。
3展望
由于目前的肥胖治疗药物大多因其副作用以失败告终[46]。如具有抑制食欲功能的“Fen-phen”由于长期服用会带来心脏瓣膜损伤及肺脏高血压的风险,已于1997年被美国FDA禁止用于减肥用途。而之前被FDA批准使用的一种大麻素受体拮抗剂“利莫那班”和一种脑部神经传导代谢物的抑制剂“西布曲明”,也因为有较强的副作用而于2009年和2010年先后退出市场。即使目前唯一可用于长期服用治疗的“奥利司他”,也存在着各种副作用。近15年来,FDA唯一批准的用于严重肥胖患者治疗的处方药“盐酸氯卡色林”,也因其存在副作用而倍受争议;因此,从具有长期食用历史的天然香辛料中寻找抗肥胖有效成分,在安全性上具有先天的优势。具有辛辣风味的天然香辛料除上述几种外还包括花椒、山葵、扶留藤、葱、蒜、肉豆蔻、丁香、八角、辣根等许多种。这些辛辣调味品无论种属、食用部位,还是产生的辛辣口味都不尽相同,这意味着其中的TRPV1激动剂在种类和结构上也可能完全不同,不同的化学结构意味着可能会有不同的抗肥胖功效。对这些辛辣调味品的进一步深入研究,不仅可以揭示这些香辛料产生不同辛辣口味的物质基础,加深对通过TRPV1通路调控的脂肪代谢的理解。同时也为减肥保健食品的开发提供明确的有效成分,为以TRPV1为靶点的抗肥胖药物的开发提供可能的先导化合物。
参考文献
[1]De Man J, Boeckx S, Anguille S, et al. Functional Study on TRPV1‐Mediated Signalling in the Mouse Small Intestine: Involvement of Tachykinin Receptors [J]. Neurogastroenterology & Motility, 2008, 20(5): 546.
[2]Roper S D. TRPs in Taste and Chemesthesis [C]//Mammalian Transient Receptor Potential (TRP) Cation Channels. Berlin:Springer, 2014: 827.
[3]Caterina M J, Schumacher M A, Tominaga M, et al. the Capsaicin Receptor: a Heat-Activated Ion Channel in the Pain Pathway [J]. Nature, 1997, 389(6653): 816.
[4]Yoshioka M, St-Pierre S, Suzuki M, et al. Effects of Red Pepper Added to High-Fat and High-Carbohydrate Meals on Energy Metabolism and Substrate Utilization in Japanese Women[J]. British Journal of Nutrition, 1998, 80(06): 503.
[5]Leung F W. Capsaicin as an Anti-Obesity Drug [C]// Capsaicin as a the Rapeutic Molecule. Berlin:Springer. 2014: 171.
[6]Yoon J Y, Jung K O, Kil J H, et al. Antiobesity Effect of Major Korean Spices (Red Pepper Powder, Garlic and Ginger) in Rats Fed High Fat Diet[J]. Journal of Food Science and Nutrition, 2005, 10(1): 58.
[7]Wahlqvist M L, Wattanapenpaiboon N. Hot Foods—Unexpected Help with Energy Balance [J]. the Lancet, 2001, 358(9279): 348.
[8]Westerterp-Plantenga M, Smeets A, Lejeune M. Sensory and Gastrointestinal Satiety Effects of Capsaicin on Food Intake [J]. Int J Obes (Lond), 2005, 29(6): 682.
[9]Yoneshiro T, Aita S, Kawai Y, et al. Nonpungent Capsaicin Analogs (Capsinoids) Increase Energy Expenditure Through the Activation of Brown Adipose Tissue in Humans [J]. the American Journal of Clinical Nutrition, 2012, 95(4): 845.
[10]Bano G, Raina R K, Zutshi U, et al. Effect of Piperine on Bioavailability and Pharmacokinetics of Propranolol and the ophylline in Healthy Volunteers[J]. European Journal of Clinical Pharmacology, 1991, 41(6): 615.
[11]Sunila E S, Kuttan G. Immunomodulatory and Antitumor Activity of Piper Longum Linn and Piperine[J]. Journal of Ethnopharmacology, 2004, 90(2): 339.
[12]Mcnamara F N, Randall A, Gunthorpe M J. Effects of Piperine, the Pungent Component of Black Pepper, at the Human Vanilloid Receptor (TRPV1)[J]. British Journal of Pharmacology, 2005, 144(6): 781.
[13]Zhang H, Matsuda H, Nakamura S, et al. Effects of Amide Constituents From Pepper on Adipogenesis in 3T3-L1 Cells[J]. Bioorganic & Medicinal Chemistry Letters, 2008, 18(11): 3272.
[14]Park U H, Jeong H S, Jo E Y, et al. Piperine, a Component of Black Pepper, Inhibits Adipogenesis by Antagonizing PPARΓ Activity in 3T3-L1 Cells[J]. Journal of Agricultural and Food Chemistry, 2012, 60(15): 3853.
[15]Shah S S, Shah G B, Singh S D, et al. Effect of Piperine in the Regulation of Obesity-Induced Dyslipidemia in High-Fat Diet Rats[J]. Indian Journal of Pharmacology, 2011, 43(3): 296.
[16]张志仙, 蒋美玲, 王欣慧,等. 吴茱萸碱的药理学研究进展[J]. 现代生物医学进展, 2014, 21(21):4189.
[17]Kobayashi Y , Nakano Y , Kizaki M, et al. Capsaicin-Like Anti-Obese Activities of Evodiamine From Fruits of Evodia Rutaecarpa, a Vanilloid Receptor Agonist[J]. Planta Medica, 2001, 67(7):628.
[18]Pearce L V, Petukhov P A, Szabo T, et al. Evodiamine Functions as an Agonist for the Vanilloid Receptor TRPV1[J]. Organic & Biomolecular Chemistry, 2004, 2(16): 2281.
[19]Bak E J, Park H G, Kim J M, et al. Inhibitory Effect of Evodiamine Alone and in Combination with Rosiglitazone on in Vitro Adipocyte Differentiation and in Vivo Obesity Related to Diabetes[J]. International Journal of Obesity, 2010, 34(2): 250.
[20]Henry C J, Emery B. Effect of Spiced Food on Metabolic Rate[J]. Human Nutrition Clinical Nutrition, 1986, 40(2): 165.
[21]Ogawa T, Tabata H, Katsube T, et al. Suppressive Effect of Hot Water Extract of Wasabi (Wasabia Japonica Matsum.) Leaves on the Differentiation of 3T3-L1 Preadipocytes[J]. Food Chemistry, 2010, 118(2): 239.
[22]Yamasaki M, Ogawa T, Wang L, et al. Anti-Obesity Effects of Hot Water Extract from Wasabi (Wasabia Japonica Matsum.) Leaves in Mice Fed High-Fat Diets[J]. Nutrition Research and Practice, 2013, 7(4): 267.
[23]Alpizar Y A, Boonen B, Gees M, et al. Allyl Isothiocyanate Sensitizes TRPV1 to Heat Stimulation[J]. Pflugers Archiv European Journal of Physiology, 2014, 466(3):507.
[24]Tamura Y, Iwasaki Y, Narukawa M, et al. Ingestion of Cinnamaldehyde, A TRPA1 Agonist, Reduces Visceral Fats in Mice Fed a High-Fat and High-Sucrose Diet[J]. Journal of Nutritional Science and Vitaminology, 2012, 58(1): 9.
[25]Mori N, Kawabata F, Matsumura S, et al. Intragastric Administration of Allyl Isothiocyanate Increases Carbohydrate Oxidation via TRPV1 but not TRPA1 in Mice[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2011, 300(6): R1494.
[26]Woo H M, Kang J H, Kawada T, et al. Active Spice-Derived Components can Inhibit Inflammatory Responses of Adipose Tissue in Obesity by Suppressing Inflammatory Actions of Macrophages and Release of Monocyte Chemoattractant Protein-1 from Adipocytes[J]. Life Sciences, 2007, 80(10): 926 .
[27]Ahn J, Lee H, Im S W, et al. Allyl Isothiocyanate Ameliorates Insulin Resistance Through the Regulation of Mitochondrial Function[J]. Journal of Nutritional Biochemistry, 2014, 25(10):1026.
[28]刘笑笑, 石林, 卢晓霞. 姜辣素与姜挥发油的化学成分、提取技术及药理研究进展[J]. 天然产物研究与开发, 2010, 8(B08):226.
[29]Iwasaki Y, Morita A, Iwasawa T, et al. a Nonpungent Component of Steamed Ginger-10-Shogaol-Increases Adrenaline Secretion via the Activation of TRPV1[J]. Nutritional Neuroscience, 2006, 9(3/4): 169.
[30]Tzeng T F, Liu I M. 6-Gingerol Prevents Adipogenesis and the Accumulation of Cytoplasmic Lipid Droplets in 3T3-L1 Cells[J]. Phytomedicine International Journal of Phytotherapy & Phytopharmacology, 2013, 20(6):481.
[31]Tzeng T F, Chang C J, Liu I M. 6‐Gingerol Inhibits Rosiglitazone-Induced Adipogenesis in 3T3‐L1 Adipocytes[J]. Phytotherapy Research, 2014, 28(2): 187.
[32]Ganapathy S, Ponnusamy P, Machampalayam Arumugam D, et al. Anti‐Obesity Action of Gingerol: Effect on Lipid Profile, Insulin, Leptin, Amylase and Lipase in Male Obese Rats Induced by a High-Fat Diet[J]. Journal of the Science of Food & Agriculture, 2014, 94(14):2972.
[33]Naidu P B, Uddandrao V V S, Naik R R, et al. Ameliorative Potential of Gingerol: Promising Modulation of Inflammatory Factors and Lipid Marker Enzymes Expressions in HFD Induced Obesity in Rats[J]. Molecular and Cellular Endocrinology, 2015:62.
[34]Field B C, Chaudhri O B, Bloom S R. Obesity Treatment: Novel Peripheral Targets [J]. British Journal of Clinical Pharmacology, 2009, 68(6): 830.
[35]Xia R, Dekermendjian K, Lullau E, et al. TRPV1: A the Rapy Target That Attracts the Pharmaceutical Interests [C]//Transient Receptor Potential Channels. Berlin:Springer, 2011: 637.
[36]Zhang L L, Liu D Y, Ma L Q, et al. Activation of Transient Receptor Potential Vanilloid Type-1 Channel Prevents Adipogenesis and Obesity [J]. Circulation Research, 2007, 100(7): 1063.
[37]Inoue N, Matsunaga Y, Satoh H, et al. Enhanced Energy Expenditure and Fat Oxidation in Humans with High BMI Scores by the Ingestion of Novel and Non-Pungent Capsaicin Analogues (Capsinoids) [J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(2): 380.
[38]Snitker S, Fujishima Y, Shen H, et al. Effects of Novel Capsinoid Treatment on Fatness and Energy Metabolism in Humans: Possible Pharmacogenetic Implications [J]. the American Journal of Clinical Nutrition, 2009, 89(1): 45.
[39]Motter A L, Ahern G P.TRPV1-Null Mice are Protected from Diet-Induced Obesity [J]. FEBS Letters, 2008, 582(15): 2257.
[40]Galgani J, Ryan D, Ravussin E. Effect of Capsinoids on Energy Metabolism in Human Subjects [J]. The British Journal of Nutrition, 2010, 103(1): 38.
[41]Leung F W, Go V L W, Scremin O U, et al. Pilot Studies to Demonstrate that Intestinal Mucosal Afferent Nerves are Functionally Linked to Visceral Adipose Tissue [J]. Digestive Diseases and Sciences, 2007, 52(10): 2695.
[42]Park U H, Jeong H S, Jo E Y, et al. Piperine, a Component of Black Pepper, Inhibits Adipogenesis by Antagonizing PPARΓ Activity in 3T3-L1 Cells [J]. Journal of Agricultural and Food Chemistry, 2012, 60(15): 3853.
[43]Baboota R K, Singh D P, Sarma S M, et al. Capsaicin Induces “Brite” Phenotype in Differentiating 3T3-L1 Preadipocytes [J]. Plos One, 2014, 9(7): E103093.
[44]Hsu C L, Yen G C. Effects of Capsaicin on Induction of Apoptosis and Inhibition of Adipogenesis in 3T3-L1 Cells [J]. Journal of Agricultural and Food Chemistry, 2007, 55(5): 1730.
[45]Ono K, Tsukamoto-Yasui M, Hara-Kimura Y, et al. Intragastric Administration of Capsiate, a Transient Receptor Potential Channel Agonist, Triggers the rmogenic Sympathetic Responses [J]. Journal of Applied Physiology, 2011, 110(3): 789.
[46]Derosa G, Maffioli P. Anti-Obesity Drugs: a Review about their Effects and their Safety [J]. Expert Opinion on Drug Safety, 2012, 11(3): 459.
(编校:叶超)
Anti-obesity Agents of Natural Spices Ingredients:a Review
YANG Xiao,LI Rui
(SchoolofFoodandBioengineering,XihuaUniversity,Chengdu610039China)
Abstract:The current study had found that anti-obesity elements of chemical composition in a variety of natural spices, such as capsaicin, capsinoids, piperine, evodiamine, allyl isothiocyanate, gingerol, etc.. We focuses on the sources of these anti-obesity agents and the mechanisms of anti-obesity function by TRPV1. The sources and mechanisms of different kinds of anti-obesity agents indicate that future research for screening anti-obesity component from food is likely to focus on natural spices.
Keywords:TRPV1;natural spices;anti-obesity agents
收稿日期:2015-12-03
基金项目:国家自然科学基金资助项目(81302742)。
中图分类号:R285.5
文献标志码:A
文章编号:1673-159X(2016)03-0016-5
doi:10.3969/j.issn.1673-159X.2016.03.004
第一作者:杨潇(1981—),男,高级实验师,博士,主要研究方向为食品生物技术。
·生物工程·
