阿仑膦酸钠、辛伐他汀在糖尿病大鼠下颌骨骨折愈合过程中的作用
2016-06-18孟子煊李金源
孟子煊,李金源,石 鹰
阿仑膦酸钠、辛伐他汀在糖尿病大鼠下颌骨骨折愈合过程中的作用
孟子煊,李金源,石鹰
[摘要]目的:通过观察骨保护素(OPG)表达情况,探讨阿仑膦酸钠及辛伐他汀对1型糖尿病大鼠下颌骨骨折愈合过程作用差异。方法:选择120只雄性Wistar大鼠随机均分为5组:对照组、糖尿病组、胰岛素治疗组、胰岛素+阿仑膦酸钠治疗组、胰岛素+辛伐他汀治疗组。除对照组外,其余4组成功建立糖尿病模型,5组大鼠手术建立单侧下颌骨骨折模型,术后第2天开始药物干预。于骨折后第2、4、6、8周检测血清OPG含量。结果:应用阿仑膦酸钠、辛伐他汀组愈合情况均明显较糖尿病组好,骨折后OPG表达水平也均明显高于糖尿病组(P<0.01)。结论:阿仑膦酸钠及辛伐他汀均可通过调节OPG含量促进糖尿病骨折愈合,辛伐他汀的作用效果更显著。
[关键词]合页骨折;糖尿病;骨保护素;阿仑膦酸钠;辛伐他汀;大鼠
糖尿病是一种消耗性疾病,对骨骼的影响非常明显。因高血糖会影响胶原形成,进而出现骨质疏松、缺钙、弹性减弱等情况。所以糖尿病患者骨质相对脆弱,骨折愈合慢、不愈合率或延迟愈合率及假关节形成率高。二膦酸盐是治疗骨质疏松常用药物,持续服用能显著增加骨量,提高骨质强度,降低骨折发生率,有较好临床疗效[1]。其主要作用机制是抑制破骨细胞的骨吸收。他汀类药物是常用的降血脂药物,近来研究发现该类药物有增加骨密度和降低骨折风险的作用[2]。本实验通过观察阿仑膦酸钠、辛伐他汀对糖尿病大鼠骨折愈合过程的影响,探讨两药的作用差异,以期为临床合理用药提供依据。
1材料与方法
1.1材料与试剂成年雄性Wistar大鼠120只,质量250~300 g,SPF级[许可证号:SCXK(冀)2008-1-003]。试剂及仪器有:阿仑膦酸钠,辛伐他汀,链脲佐菌素(STZ)(美国Sigma 公司),中效胰岛素,齿科打磨机,手术器械等。
1.2动物模型制作
1.2.1糖尿病模型大鼠适应性喂养 1 周,随机分为对照组(n=24)和实验组(n=96),对照组记为A组。实验组大鼠于造模前一晚禁食不禁水12 h,(50 mg/kg)腹腔注射法对禁食后大鼠建立糖尿病模型。STZ注射72 h后测随机血糖,>16.7 mmol/L者视为造模成功。造模前,保证随机血糖处于正常水平(5.9~7.6 mmol/L)。
1.2.2骨折模型糖尿病模型建立后,全部大鼠通过手术建立单侧下颌骨骨折模型。用10%水合氯醛3 mL/kg 行腹腔麻醉后,采用颌下切口暴露一侧下颌骨体下缘及其颊舌侧面,用慢速手机(1 500 r/s)于下颌骨体下缘咬肌嵴的远中末端处制作1 mm×3 mm的贯穿颊舌侧的不完全骨折模型。
1.3造模术后的处理及观察根据干预手段不同,再将实验组随机平均分为B、C、D、E 4组。A组(对照组):每天等容0.9%氯化钠注射液进行灌胃;B组(糖尿病组):每天等容0.9%氯化钠注射液进行灌胃;C组(胰岛素治疗组):每天3 IU胰岛素颈背部皮下注射,并等容0.9%氯化钠注射液灌胃;D组(胰岛素+阿仑膦酸钠治疗组):除每天3 IU胰岛素外,另5 mg/kg阿仑膦酸钠悬浊液灌胃;E组(胰岛素+辛伐他汀治疗组):除每天3 IU胰岛素注射外,另10 mg/kg辛伐他汀溶液灌胃。术后第2天即开始药物干预,持续8周。
1.4标本采集与免疫组织化学各组于术后第2、4、6、8周随机处死6只大鼠,测定血清骨保护素(OPG)含量。同时取出下颌骨,截取骨折处0.5 cm×0.5 cm的组织块,制作石蜡切片。按标准步骤行免疫组织化学染色。用Image-pro-plus图像分析系统,测定OPG阳性染色区域的平均吸光度值。
1.5统计学方法采用方差分析和q检验。
2结果
2.1大鼠糖尿病成模率应用STZ 50 mg/kg建立的糖尿病模型复制成功率为91.89%。
2.25组大鼠骨折愈合过程中血清OPG含量比较2周时A组血清OPG均明显高于B、C、D和E组(P<0.01),D组和E组差异无统计学意义(P>0.05);4周时D组血清OPG明显高于A、B、C和E组(P<0.01);6周时D、E组血清OPG含量显著高于B、C组(P<0.01),D组和E组差异无统计学意义(P>0.05);8周时A、D、E 3组仍明显高于B、C组(P<0.01),但A组血清OPG含量显著高于D组和E组(P<0.01)(见表1)。
2.3骨痂区OPG表达结果OPG主要表达在成骨细胞质内,以细胞膜、细胞质呈棕黄色为阳性表现。
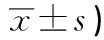
表1 5组大鼠不同时间血清OPG含量比较(ni=6;
q检验:与A组比较**P<0.01;与B组比较△P<0.05,△△P<0.01;与C组比较##P<0.01;与D组比较++P<0.01
骨折后A组与C、D、E组均较B组骨痂组织内阳性表达多(见图1)。通过平均吸光度值比较,发现A组在2、4、6和8周均明显高于B组(P<0.01);2周时D、E组阳性表达均高于B、C组(P<0.05~P<0.01),与A组差异均无统计学意义(P>0.05);4周时OPG在D组、E组均较A组骨痂组织内阳性表达明显增多(P<0.01);6周时A、D、E组阳性表达均显著强于B、C 2组(P<0.01),E组阳性表达强于A组(P<0.01);8周时A、D、E 3组阳性表达均明显高于B、C组(P<0.01),而A组与D、E组阳性表达差异均无统计学意义(P>0.05)(见表2)。
3讨论
糖尿病状态下,骨矿化降低,骨的生物力学性能改变,结构强度降低。国外学者[3-4]在糖尿病动物模型骨折愈合观察中发现,其骨折愈合处抗折弯力明显小于非糖尿病组,一般在愈合时间上落后于非糖尿病组1周左右。
阿仑膦酸钠是最常用二磷酸盐类制剂之一。有动物实验[5]提示二膦酸盐虽会抑制骨重建,但对骨痂形成具有促进作用。阿仑膦酸钠可抑制骨吸收并干扰破骨细胞附着使破骨细胞的超微结构发生改变,也可通过抑制成骨细胞中细胞因子产生而抑制破骨细胞修复使骨密度增加[6]。WANG等[7]发现辛伐他汀局部应用能促进卵巢切除后大鼠骨折的愈合。MUNDY等[8]发现他汀类药物能明显促进骨形成。严鹏霄等[9]通过体外实验发现,辛伐他汀能同时发挥促进骨形成、抑制骨吸收的作用。以上述为基础,本实验将此两种药物应用于糖尿病骨折的治疗,探究其作用效果异同。
OPG是骨代谢中的关键因子,可缩短动物骨折愈合的时间,在下颌骨骨折愈合过程中的表达变化可显示骨折愈合的程度。本实验中糖尿病组OPG含量明显低于其余4组,对照组在2、4、6、8周与糖尿病组差异均有统计学意义(P<0.01),显示糖尿病骨折后OPG的表达降低,OPG生成明显减少,提示糖尿病组在愈合过程中破骨细胞逐渐分化与成熟,数量增加且功能活跃,骨吸收增强。而经阿仑膦酸钠及辛伐他汀治疗后的2组OPG表达水平明显高于糖尿病组及胰岛素治疗组,提示阿仑膦酸钠及辛伐他汀可能促进成骨细胞和骨髓基质细胞分泌OPG,显著提高糖尿病骨折后OPG的表达,使骨重建向促进成骨方向发展,减少糖尿病对骨折愈合的负面影响。研究[10]发现二磷酸盐能调节成骨细胞,使OPG分泌增多,使骨吸收作用减弱。KAJI等[11-12]也发现辛伐他汀作用于成骨细胞会增强OPG的表达。对于OPG表达的促进作用,阿仑膦酸钠组、辛伐他汀组均在骨折后4周即出现OPG表达的高峰,6、8周逐渐减弱,提示两药可能在骨折愈合早期作用显著。但是,4周时辛伐他汀组OPG含量略高于阿仑膦酸钠组,6周时虽也有所减少,但明显低于阿仑膦酸钠组在同一时间段内的减少量,表明辛伐他汀对糖尿病骨折大鼠OPG分泌的促进作用稍强于阿仑膦酸钠或者其促OPG分泌作用时间较阿仑膦酸钠稍长。
综上所述,阿仑膦酸钠、辛伐他汀能够增加糖尿病骨折后的OPG含量,促进骨折愈合。发现药物治疗糖尿病骨折,在糖尿病骨折后的早期应用阿仑膦酸钠有促进愈合作用,而辛伐他汀的持续应用疗效可能好于阿仑膦酸钠。但是本研究关于其对骨折愈合的最终影响尚未明确,关于药物最佳干预时间、药物剂量及给药方式等仍需进一步研究。
q检验:与A组比较**P<0.01;与B组比较△P<0.05,△△P<0.01;与C组比较#P<0.05,##P<0.01;与D组比较+P<0.05
[参考文献]
[1]薛江义,张晶晶,卢向东,等.阿仑膦酸钠联合辛伐他汀对骨质疏松骨折的影响[J].中国医药科学,2014,4(10):20.
[2]徐华,何毅,张鸣号,等.1型糖尿病大鼠模型的建立及糖尿病并发症相关指标的测定[J].宁夏医科大学学报,2010,32(1):90.
[3]LAMME J,AERSSENS J,NIJS J,etal.Bioehemieal and density assessment of the new bone in later emodeling after eallus distraetion[J].Ortho Paedie Res,1997,15(3):391.
[4]VIERECK V,EMONS G,LAUCK V,etal.Bisphosphonates pamidronate and zoledronic acid stimulate osteoprotegerin production by primary human osteoblasts[J].Biochem Biophys Res Commun,2002,291(3):680.
[5]LI YF,ZHOU CC,LI J,etal.The effects of combined human parathyroid hormone(1-34)and zoledronic acid treatment on fracture healing in osteoporotic rats[J].Osteoporos Int,2012,23(4):1463.
[6]MARTIN T,GOOI JH,SIM NA.Molecular mechanisms in coupling of bone formation to resorption[J].Crit Rev Eukaryot Gene Expr,2009,19(1):73.
[7]WANG JW,XU SW,YANG DS,etal.Locally applied simvastatin promotes fracture healing in ovariectomized rat[J].Osteoporos Int,2007,28(12):1641.
[8]MUNDY G,GARRETT R,HARRIS S,etal.Stimulation of bone formationinvitroand in rodenby statins[J].Science,1999,286(5446):1946.
[9]严鹏霄,崔维顶,胡继坤,等.阿仑膦酸钠、辛伐他汀联合应用治疗大鼠骨质疏松的作用[J].南京医科大学学报,2009,29(8):1099.
[10]FUNK JR,HALE JE,CARMINES D,etal.Biomechanical evaluation of early fraeture healing in normal and diabetie rats[J].J Orthop Res,2000,18(1):126.
[11]KAJI H,KANATANI M,SUGIMOTO T,etal.Statins modulate the levels of osteoprotegerin/recetivator of NFκB ligand mRNA in mouse bone-cell cultures[J].Horm Metab Res,2005,37(10):589.
[12]KAJI H,NATIO J,INOUE Y,etal.Statin suppresses apoptosis in osteoblastic cells:role of transforming growth factor-β-smad3 pathway[J].Horm Metab Res,2008,40(11):746.
(本文编辑刘畅)
[文章编号]1000-2200(2016)03-0296-04·基础医学·
[收稿日期]2014-12-30
[作者简介]孟子煊(1987-),女,硕士.[通信作者] 李金源,硕士研究生导师,教授.E-mail:kouqiangxi2008@163.com
[中图法分类号]R 782.4;R 587.1
[文献标志码]A
DOI:10.13898/j.cnki.issn.1000-2200.2016.03.005
[作者单位] 华北理工大学口腔医学院 口腔颌面外科,河北 唐山 063000
