尾吊小鼠感染空间诱变大肠杆菌炎症反应增强
2016-06-17裴雪枫王静宇王俊锋张学林刘长庭石河子大学医学院新疆石河子8000石河子大学第一附属医院检验科新疆石河子8000辽宁医学院辽宁锦州00中国航天员科研训练中心航天医学基础与应用国家重点实验室北京0009解放军总医院南楼呼吸科北京008
姚 静,程 江,裴雪枫,王静宇,王俊锋,张学林,刘长庭,袁 明(.石河子大学医学院,新疆石河子 8000;.石河子大学第一附属医院检验科,新疆石河子 8000;.辽宁医学院,辽宁锦州 00;.中国航天员科研训练中心,航天医学基础与应用国家重点实验室,北京 0009;.解放军总医院南楼呼吸科,北京 008)
尾吊小鼠感染空间诱变大肠杆菌炎症反应增强
姚 静1,程 江2,裴雪枫3,王静宇4,王俊锋5,张学林5,刘长庭5,袁 明4
(1.石河子大学医学院,新疆石河子 832000;2.石河子大学第一附属医院检验科,新疆石河子 832000;3.辽宁医学院,辽宁锦州 121001;4.中国航天员科研训练中心,航天医学基础与应用国家重点实验室,北京 100094;5.解放军总医院南楼呼吸科,北京 100853)
【摘要】目的 观察空间诱变大肠杆菌感染尾吊模拟失重小鼠后炎症反应变化。方法 将40只C57BL/6小鼠随机分为对照、对照染菌、尾吊及尾吊染菌组,采用ELISA和RT-qPCR方法分别检测小鼠血浆和肠道组织中炎症因子TNF-α、IL-1β、IL-6的含量及mRNA表达,HE染色观察小肠组织形态学的改变。结果 血浆炎症因子ELISA及肠道组织炎症因子PCR结果显示,与对照组相比,实验组小鼠血浆及肠道组织中炎症因子TNF-α、IL-1β、IL-6的表达均升高,且尾吊染菌组最为显著(P<0. 01或P<0. 001);小肠组织HE染色结果显示,实验组小肠粘膜均出现不同程度的损伤,且尾吊染菌组最为严重。结论 空间诱变大肠杆菌感染尾吊小鼠后可显著升高血浆及肠道组织中炎症因子表达,导致更严重的肠道黏膜屏障受损,提示尾吊模拟失重后感染空间诱变大肠杆菌可致机体的炎症反应增强。
【关键词】空间诱变大肠杆菌;模拟失重;炎症因子;肠道组织
随着我国载人航天事业的发展,尤其是后续载人空间站任务的实施,需要航天员在太空环境停留的时间越来越长。因此,对影响航天员健康的危险因素评估及防护措施研究就显得非常重要。航天员在飞行过程中可受到失重、辐射、超重、振动、噪声、心理紧张等多种不利因素的影响。这些因素会对机体造成损害,如出现空间运动病、肌肉萎缩、骨质脱钙、心血管功能失调等[1-2]。也有研究显示,航天飞行可造成机体多项免疫学参数的改变,导致机体免疫功能降低,使得机体受感染的机会大大增加[3]。同时在空间环境中,微生物出现毒力及耐药性的改变,除了腐蚀航天设备,也对航天员的健康产生巨大威胁[4]。因此,研究失重/模拟失重下空间诱变菌感染所致炎症反应的机制,对于其有效防控具有重要意义。本研究采用前期筛选出的空间诱变大肠杆菌T1-13菌株,通过模拟失重小鼠感染模型,探讨空间诱变菌感染模拟失重小鼠对炎症反应的影响。
1 材料和方法
1.1材料
1.1.1实验动物40只SPF级C57BL/6雄性小鼠,体重18~22 g,周龄6~8周,购自北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】,实验在中国航天员科研训练中心实验动物中心【SYXK(军)2012-0020】开展,给予自由进食、饮水、23±2℃环境温度、每昼夜保持12 h光照与12 h黑暗交替循环条件下饲养。
1.1.2空间诱变大肠杆菌菌株空间诱变型大肠杆菌T1-13由解放军总医院南楼呼吸科提供,该菌株搭载神舟十号飞船在轨飞行15 d,返回后测序分析发现存在耐药及毒力基因突变。
1.1.3实验试剂和药物炎症因子ELISA检测试剂盒,购自上海蓝基生物科技有限公司;TRIzol试剂购自invitrogen;反转录试剂盒、SYBRⓇGreen荧光定量试剂盒购自大连宝生物公司。
1.1.4仪器和设备伯乐Model680酶标仪;电恒温培养箱;离心机;eppendorf realplex PCR扩增仪;EDTA抗凝真空采血管,一次性注射器,灌胃针等。
1.2方法
1.2.1动物模型的建立及分组将40只C57BL/6小鼠随机分为对照(Con)、对照染菌(Con + T1- 13)、尾吊(TS)及尾吊染菌组(TS + T1-13),每组10只。参照陈杰等[5]改良的方法对小鼠进行头低位30°尾部悬吊30 d后,将T1-13菌株配置成1. 2 ×108CFU/ mL溶度菌液,以灌胃法[6]对小鼠进行接种,0. 2 mL/鼠。72 h后1%戊巴比妥钠腹腔注射麻醉小鼠,进行后续试验。
1.2.2ELISA方法检测血浆炎症因子试验当天以1%戊巴比妥钠0. 2 mL/鼠腹腔注射麻醉小鼠,消毒后于心脏搏动最强处迅速进针行心脏采血,离心分离血浆,按ELISA试剂盒操作说明书分别检测血浆中炎症因子TNF-α、IL-1β、IL-6含量。
1.2.3肠道组织形态学观察心脏采血完毕后颈椎脱位处死小鼠,消毒后暴露腹腔,无菌剪取小肠约2 cm,清除肠内容物后置于4%多聚甲醛中固定48 h,常规石蜡包埋、切片、HE染色、封片,光学显微镜观察并拍照。
1.2.4肠道组织炎症因子mRNA表达水平检测TRIzol法提取小肠组织总RNA,按反转录试剂盒反转录为cDNA后,以其为模版进行real-time PCR分别检测小肠组织中炎症因子TNF-α、IL-1β、IL-6 mRNA的表达,引物序列见表1。设置反应程序:95℃预变性30 s;95℃变性5 s,60℃退火30 s,72℃延伸20 s,40个循环;95℃15 s、60℃15 s、95℃15 s进行溶解曲线分析。
1.2.5统计学处理采用GraphPad Prism5. 0分析软件对实验数据进行统计分析,组间比较采用ANOVA,两两比较采用Newman-Keuls检验方法,P <0. 05为差异有统计学意义。

表1 实时荧光定量PCR扩增引物Tab. 1 Primer pairs for the real-time PCR

图1 血浆中炎症因子的含量Note.*P<0. 05,**P<0. 01,***P<0. 001 vs Con;#P<0. 05,##P<0. 01,###P<0. 001 vs TS;n =10.Fig. 1 Inflammatory cytokines production in plasma
2 结果
2.1血浆中炎症因子的含量
与对照组相比,Con + T1-13组血浆中TNF-α (P<0. 05)、IL-1β(P<0. 001)、IL-6(P<0. 001)含量均明显升高;TS组血浆中IL-1β(P<0. 05)和IL-6(P<0. 001)含量明显升高,TNF-α升高但无明显差异;TS + T1-13组血浆中TNF-α(P<0. 01)、IL-1β(P<0. 001)、IL-6(P<0. 001)含量均明显升高,且升高最为显著。与TS组相比,TS + T1-13组血浆中IL-1β(P<0. 001)和IL-6(P<0. 05)含量明显升高,TNF-α升高但无明显差异(图1)。
2.2肠道组织形态学观察
组织形态学观察结果可见,对照组小肠结构没有明显变化,从黏膜层到浆膜层结构完整,绒毛上皮细胞排列整齐(图2A)。与对照组相比,Con + T1 -13组小肠绒毛顶端坏死脱落,有的地方整个绒毛坏死溶解,绒毛肿胀,固有层内可见炎性细胞浸润,绒毛长度变小,肠腔内可见少量脱落的细胞碎片(图2B);TS组小肠绒毛上皮轻微增生(图2C);与Con + T1-13组相比,TS + T1-13组小肠绒毛出现类似病变,而且肠绒毛坏死情况较为严重,有的地方出现凝固性坏死,有的地方出现溶解性坏死,仅残存部分结构,肠腔内出现大量坏死脱落的细胞碎片(图2D)。
2.3肠道组织炎症因子mRNA水平的表达
与对照组相比,Con + T1-13组小肠组织中TNF-α(P<0. 05)、IL-1β(P<0. 01)、IL-6(P<0. 05)表达均明显升高;TS组小肠组织中IL-6(P<0. 05)表达明显升高,TNF-α和IL-1β升高而无明显差异;TS + T1-13组小肠组织中TNF-α(P<0. 001)、IL-1β(P<0. 01)、IL-6(P<0. 001)表达均明显升高,且升高最为显著。与TS组相比,TS + T1 -13组小肠组织中TNF-α(P<0. 01)、IL-1β(P<0. 01)表达明显升高,IL-6升高而无明显差异(图3)。
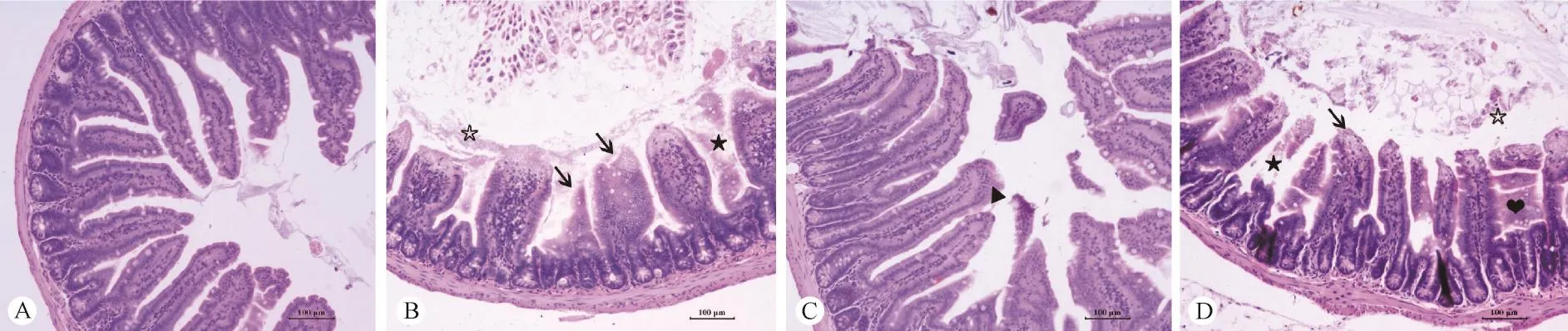
图2 小肠组织病理改变(HE染色,×20)Note. A:Con;B:Con + T1-13;C:TS;D:TS + T1-13.(↑Necrosis in the top of intestinal villi;★Necrolysis of intestinal villi;☆cell debris from necrosis;▲Slight hyperplasia of chorioepithelium;♥Coagulative necrosis).Fig. 2 Histopathological changes in small intestine tissue(HE staining,×20)
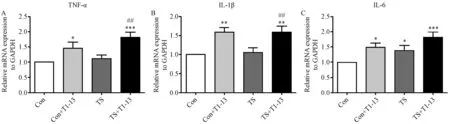
图3 肠道组织炎症因子mRNA水平的表达Note.*P<0. 05,**P<0. 01,***P<0. 001 vs Con;#P<0. 05,##P<0. 01,###P<0. 001 vs TS;n =10.Fig. 3 mRNA expression level of inflammatory cytokines in intestinal tissue
3 讨论
人类在进行太空探索、执行空间任务过程中,常会受到失重、超重、辐射、震动、噪声等多种不利因素的影响。大量航天医学研究结果表明,失重可造成航天员的免疫功能下降,且随时间的延长而程度加重,从而导致机会性感染的机率增加,成为严重的健康风险及影响空间任务的主要障碍[7]。同时,在载人航天活动中,一些正常定植的细菌会随着航天员或航空部件进入太空,并在太空舱内形成微生物群区。在特殊的空间环境下,微生物基因表达发生变化,毒力增加,生长速度加快,耐药性增强,使得机体受感染机会大大增加[4,8-9]。大肠杆菌是哺乳动物常见的肠道正常寄生菌群,当机体免疫力低下、肠道正常菌群紊乱时可机会性致病,引起机体相应的肠道疾病。Raja Vukanti等[10]研究发现,在模拟失重条件下,大肠杆菌活力和生长速度明显加快,细菌代谢产物明显增多。
在一项模拟失重对小鼠T细胞亚群和某些细胞因子的影响的研究中发现[11],尾部悬吊7 d后,小鼠CD8+、CD4+T细胞数量明显降低,且IL-6活性呈增强趋势,另外一项长期飞行对机体免疫力影响的研究中发现[12],不同时间的空间飞行后,血浆炎症因子TNF-α、IL-1β均有不同程度的升高。我们参考既往已成功建立的多种地面模拟失重模型[13],通过前期实验筛选出空间诱变型大肠杆菌T1-13,感染模拟失重小鼠,建立模拟失重小鼠肠道感染模型,在尾吊30 d后染菌3 d观察血浆及肠道组织中炎症因子TNF-α、IL-1β、IL-6的表达,发现三种炎症因子在实验组中均升高,且TS + T1-13组最为显著,说明模拟失重及空间致病菌确可使机体免疫力下降、炎症反应增强,且三种炎症因子在全身感染性疾病和肠道黏膜免疫中均发挥重要作用。TNF-α是由单核巨噬细胞产生的具有多种功能的细胞因子,在炎症的级联反应中首先被激活,并诱导IL-1β、IL-6、IL-8等的产生。当细菌感染时,TNF-α水平迅速升高,但其高峰期时间较IL-6短,并很快下降至正常水平[14]。在一项长期飞行的研究中发现,血浆中TNF-α在飞行中升高,飞行后较飞行前无明显改变[12]。我们实验显示,TS组TNF-α表达较对照组虽有升高,但不明显,认为与上述所述TNF-α表达峰值时间有关。另外,有研究表明暴露于不同时间的空间飞行,机体产生的免疫应答效应不尽相同,且免疫功能的恢复与飞行后返回地面的时间可能相关[3,12]。
关于失重对机体消化系统的影响,有研究人员利用尾部悬吊大鼠模型,观察模拟失重14 d和21 d小肠组织结构,光镜和电镜结果均显示小肠黏膜绒毛和微绒毛稀少,变短变宽,表面积减少,小肠粘膜紧密连接蛋白表达减少,黏膜通透性增加,推测小肠粘膜微观结构的改变可能是航天员在航天飞行中出现消化系统不良症状的重要原因之一[15]。我们在实验过程中观察小鼠状态,发现实验组小鼠均出现不同程度的厌食、消瘦、精神萎靡,进一步观察小肠组织结构,证实了模拟失重会改变肠道黏膜屏障的观点[16]。另外在失重不良刺激作用下,胃肠道应激反应、蠕动紊乱、血管床淤血、微生态失调等一系列因素造成肠黏膜受损,细菌及其代谢产物由门静脉入血,导致机体出现全身炎症反应。
综上所述,空间诱变菌及模拟失重可使小鼠血浆及肠道组织中炎症因子表达升高、肠道黏膜屏障受损,提示空间环境较地面更易使机体炎症反应增强。
参考文献:
[1] Hirayanagi K,Iwase S,Kamiya A,et al. Functional Changes in Autonomic Nervous System and Baroreceptor Reflex Induced by 14 Days of 6 Degrees Head-Down Bed Rest[J]. Eur J Appl Physiol,2004. 92(1-2):160-167.
[2] Herault S,Fomina G,Alferova I,et al. Cardiac,Arterial and Venous Adaptation to Weightlessness During 6-Month MIR Spaceflights with and without Thigh Cuffs(Bracelets)[J]. Eur J Appl Physiol,2000. 81(5):384-390.
[3] Crucian B,Stowe R,Quiriarte H,et al. Monocyte Phenotype and Cytokine Production Profiles are Dysregulated by Short-Duration Spaceflight[J]. Aviat Space Environ Med,2011. 82 (9):857-862.
[4] Wilson JW,Ott CM,Honer zu Bentrup K,et al. Space Flight Alters Bacterial Gene Expression and Virulence and Reveals a Role for Global Regulator Hfq[J]. Proc Natl Acad Sci USA,2007. 104(41):16299-16304.
[5] 陈杰,马进,丁兆平,等.一种模拟长期失重影响的大鼠尾部悬吊模型[J].空间科学学报,1993(02):159-162.
[6] 陈超,郑成中.致病性大肠杆菌胃肠感染小鼠模型血浆Th1、Th2、Th17淋巴细胞因子变化及意义[J].中国医药导报,2013(19):37-39.
[7] Crucian B,Stowe R,Mehta S,et al. Immune System Dysregulation Occurs During Short Duration Spaceflight on Board the Space Shuttle[J]. J Clin Immunol,2013. 33(2):456 -465.
[8] Rosenzweig JA,Abogunde O,Thomas K,et al. Spaceflight and Modeled Microgravity Effects on Microbial Growth and Virulence [J]. Appl Microbiol Biotechnol,2010. 85(4):885-891.
[9] Charles D. Science on the Shuttle. Nasa's Busload of Science [J]. Science,2011. 333(6038):28-29.
[10] Vukanti R,Model MA,Leff LG. Effect of Modeled Reduced Gravity Conditions on Bacterial Morphology and Physiology[J]. BMC Microbiol,2012. 12:4.
[11] Wen XL,Yang GH,Wang T,et al. Effects of Simulated Weightlessness on T Cell Subpopulations and Activity of IL-2 and IL-6 in Mice[J]. Space Med Med Eng(Beijing),2001. 14(1):60-62.
[12] Crucian BE,Zwart SR,Mehta S,et al. Plasma Cytokine Concentrations Indicate That in vivo Hormonal Regulation of Immunity is Altered During Long-Duration Spaceflight[J]. J Interferon Cytokine Res,2014. 34(10):778-786.
[13] 董丽,王琼,刘新民,等.地面模拟失重实验方法概况[J].中国实验动物学报,2013,21(05):90-94.
[14] Panero A,Pacifico L,Rossi N,et al. Interleukin 6 in Neonates with Early and Late Onset Infection[J]. Pediatr Infect Dis J,1997. 16(4):370-375.
[15] 陈英,杨春敏,毛高平,等.模拟失重对大鼠小肠黏膜紧密连接蛋白表达的影响[J].航天医学与医学工程,2011(05):327-331.
[16] 白树民,黄纪明,朱德兵,等.模拟失重对大鼠肠道菌群影响的研究[J].中国微生态学杂志,2001(06):20-21.
〔修回日期〕2016-01-25
Increased inflammatory reaction in tail-suspension mice infected by E. coli in spaceglight
YAO Jing1,CHENG Jiang2,PEI Xue-feng3,WANG Jing-yu4,WANG Jun-feng5,ZHANG Xue-lin5,LIU Chang-ting5,YUAN Ming4
(1. The Medical College of Shihezi University,Xinjiang Shihezi 832000,China;2. Department of Clinical Laboratory,The First Affiliated Hospital of Shihezi Medical University,Xinjiang Shihezi 832000,China;3. Liaoning Medical College,Liaoning Jinzhou 121001,China;4. The Key Laboratory of Space Medicine Fundamentals and Application,China Astronaut Research and Training Center,Beijing 100094,China;5. Nanlou Respiratory Diseases Department,Chinese PLA General Hospital,Beijing 100853,China)
【Abstract】Objective To observe the changes of inflammatory reaction in tail-suspension mice after infected by E. coli in spaceflight. Methods 40 C57BL/6 mice were randomly divided into four groups:control group(Con),control + E. coli T1-13 group(Con + T1-13),tail suspension group(TS),tail suspension + E. coli T1-13 group(TS + T1-13). The inflammatory cytokines TNF-α,IL-1β and IL-6 production in plasma and mRNA level in intestinal tissue were detected by ELISA and RT-qPCR,and HE staining was used to represent the morphology changes in small intestine tissue. Results Compared with the control group,the expression of inflammatory cytokines in plasma and intestinal tissue of allexperimental groups were increased,and the TS + T1-13 group was most significant(P<0. 01 or P<0. 001). HE staining showed that the small intestine mucosa in the experimental groups were damaged in different degrees,and the damage of TS + T1-13 group was most serious. Conclusions The E. coli from spaceflight increased significantly the expression of inflammatory cytokines in plasma and intestinal tissue from infected tail-suspension mice,and brought more serious damages to the small intestinal mucosal barrier,which suggested that the inflammatory reaction would be increased in tailsuspension mice infected by E. coli from spaceflight.
【Key words】Space mutation E. coli;Simulated microgravity;Inflammatory cytokines;Intestinal tissue
【中图分类号】R-332
【文献标识码】A
【文章编号】1671-7856(2016)03-0001-05
doi:10. 3969. j. issn. 1671-7856. 2016. 03. 001
[基金项目]国家重点基础研究发展计划(973计划)(2014CB744404)。
[作者简介]姚静(1988-),女,硕士,研究方向:临床分子生物学诊断,E-mail:yaojing_hnzz@163. com。
[通讯作者]袁明(1977-),男,副研究员,博士,研究方向:空间生物学,E-mail:yuanming7711@ aliyun. com;程江(1963-),男,教授,硕士,研究方向:实验室管理及分子生物学,E-mail:chengjiang1980@ sina. com。
