H-1细小病毒抗体ELISA检测方法的建立与应用
2016-06-17李晓波王淑菁岳秉飞贺争鸣中国食品药品检定研究院北京100050
付 瑞,李晓波,王淑菁,王 吉,卫 礼,巩 薇,岳秉飞,贺争鸣(中国食品药品检定研究院,北京 100050)
H-1细小病毒抗体ELISA检测方法的建立与应用
付 瑞,李晓波,王淑菁,王 吉,卫 礼,巩 薇,岳秉飞,贺争鸣
(中国食品药品检定研究院,北京 100050)
【摘要】目的 建立H-1细小病毒抗体的ELISA检测方法,并进行初步应用。方法 采用大鼠神经胶质瘤细胞C6培养大鼠H-1细小病毒,制备包被抗原,采用纯化后抗原建立该病毒的ELISA检测方法;将建立的方法与国外同类试剂盒进行比对,考察该方法的特异性和灵敏度。同时,应用该方法对35份大鼠血清进行检测。结果所建立的方法可检测出稀释1280倍的阳性血清;与犬细小病毒、小鼠微小病毒和猪细小病毒阳性血清均无交叉反应;与大鼠细小KRV病毒有交叉反应;对35份大鼠血清进行检测,结果均为阴性,与国外同类试剂盒结果一致。结论 所建立的H-1细小病毒ELISA检测方法具有良好的种属特异性和灵敏度,可用于大鼠血清中H-1细小病毒抗体检测。
【关键词】H-1细小病毒;ELISA;抗体检测
大鼠细小病毒(Rat parvovirus,RPV)是对实验大鼠危害最为严重的病毒之一。成年大鼠感染多无临床症状,免疫抑制等因素可激发本病。RPV还可污染肿瘤移植物和细胞系,对实验研究产生严重干扰[1]。Toolan[2]从经大鼠传代的人肿瘤细胞系(HEP-1)分离到第2株大鼠细小病毒,通常称为H-1细小病毒,又称Toolan病毒。H-1细小病毒属于细小病毒科,其天然宿主为大鼠,病毒粒子直径为20~25 nm,为无囊膜单链DNA病毒,其核酸约为5100 nt[3]。
我国实验动物国家标准(GB 14922. 2-2011)规定大鼠细小病毒KRV和H-1株为SPF实验大鼠病毒的必检项目。本研究采用可传代的大鼠神经胶质瘤细胞C6培养H-1细小病毒[4],从而建立了H-1细小病毒抗体的ELISA检测方法。
1 材料和方法
1.1毒株和细胞
H-1细小病毒购自美国标准培养物保存中心(ATCC,VR-356),大鼠神经胶质瘤细胞C6中国科学院典型培养物保藏委员会细胞库。
1.2其它试剂及样品
商品化H-1 ELISA抗体检测试剂盒购自美国XpressBio公司;猪细小病毒、小鼠微小病毒和犬细小病毒阴阳对照血清均为科室制备保存;山羊抗大鼠IgG-HRP、山羊抗小鼠IgG-HRP、山羊抗猪IgGHRP和山羊抗犬IgG-HRP均购自KPL公司;DMEM培养基和胎牛血清购自Gibco公司;35份清洁级与SPF级大鼠血清样本来自北京地区实验动物监督检验收集样品。
1.3病毒培养
将C6细胞按照6×104个/ mL的浓度接种于细胞培养瓶,采用含5%胎牛血清的DMEM培养及培养6 h后将H-1病毒液以0. 02 MOI的比例加入培养瓶中。置含有5%二氧化碳的37℃培养箱中培养36 h,待细胞长满单层后,弃去瓶中培养液,加入等体积的含2%胎牛血清的DMEM培养基,继续培养36 h,完全病变的病毒冻存于-70℃保存。
1.4病毒滴定
将C6细胞按照6×104个/ mL的浓度接种于96孔细胞培养板,培养6 h后将H-1病毒液以10-1~10-11作系列倍比稀释,依次加入培养有C6细胞的96孔细胞培养板(1~11列),每个稀释度接种1列(8孔),第12列不加病毒,作为细胞对照。置含有5%二氧化碳的37℃培养箱中观察10 d,记录结果。
1.5抗原的制备及纯化
正常抗原:C6细胞按照6×104个/ mL的浓度接种于细胞培养瓶,待长满单层后,用10%ATV常规法消化,PBS洗涤,1000 r/ min离心10 min,沉淀溶于适量PBS冻融3次后,超声破碎,10000 r/ min离心30 min,取上清,测定蛋白含量。分装后作为正常抗原冻存于-70℃备用。
特异抗原:收获H-1病毒,于4℃,10000 r/ min离心1 h,取上清于4℃,40000 r/ min离心3 h,收集沉淀于适量PBS中。超声破碎后,再经20%蔗糖离心,采用紫外分光光度法测定抗原蛋白含量。分装后作为正常抗原冻存于-70℃备用。
1.6毒种的PCR鉴定
常规方法提取病毒DNA,进行PCR扩增,琼脂糖电泳后应能观察到183 bp的可见目的条带。PCR产物送测序,测序结果与NCBI核酸数据库比对。
1.7判断标准的确定
依据实验动物国家标准选择OD490来读取吸光度。在阴、阳对照血清成立的情况下,待检血清特异抗原孔A值≥0. 2、待检血清特异抗原孔A值/阴性对照特异抗原孔A值(P/ N值)≥2. 1,判为阳性。
1.8正常抗原与特异抗原、酶结合物最佳工作浓度的确定
将阳性血清、阴性血清、包被抗原、HRP标记的山羊抗大鼠IgG进行系列倍比稀释,根据方阵滴定法确定试验的最适工作条件。
1.9精密性测定
取阴性血清与阳性血清各一份,1∶40稀释后,各用一块纯化后H-1细小病毒包被的96孔板测定。得到的结果分别计算平均值及标准差,计算板内变异系数(CV)。
1.10特异性测定
用已建立的ELISA法和XpressBio公司检测试剂盒分别检测大鼠细小KRV病毒、小鼠微小病毒(MVM)、犬细小病毒(CPV)和猪细小病毒(PPV)阴、阳性血清,同时设H-1病毒标准阴、阳性血清对照。
1.11重复性测定
取纯化后H-1抗原包被的96孔板,分别对20份血清(其中阴性血清15份,阳性血清5份)重复测定三次,计算结果的符合率。
1.12稳定性测定
用纯化后H-1抗原包被96孔ELISA板11块,其中一块保存于4℃,其余10块置于37℃,分别于第1-10天每天取出一块放4℃保存,同时检测同一批15份阴性血清和5份阳性血清。
1.13敏感性测定
将H-1阳性对照血清1∶40至1∶2560系列稀释后,用所建立的ELISA方法检测,以确定所建立方法的敏感性。
1.14与商品化试剂盒的比较
用购自XpressBio公司的Toolan’s H-1 Virus Rat检测试剂盒与本研究所建立的ELISA方法同时检测20份大鼠血清(其中15份阴性血清,5份阳性血清),对所建立的ELISA检测方法进行验证。
1.15H-1ELISA抗体检测方法的应用
用所建立的方法检测来自北京地区实验动物监督检验的35份大鼠血清。
2 结果
2.1病毒培养结果
病毒经C6细胞培养72 h后完全病变,正常细胞对照与病变细胞结果见图1与图2。

图1 正常C6细胞培养72 h后Fig. 1 C6 cell was cultured 72 h
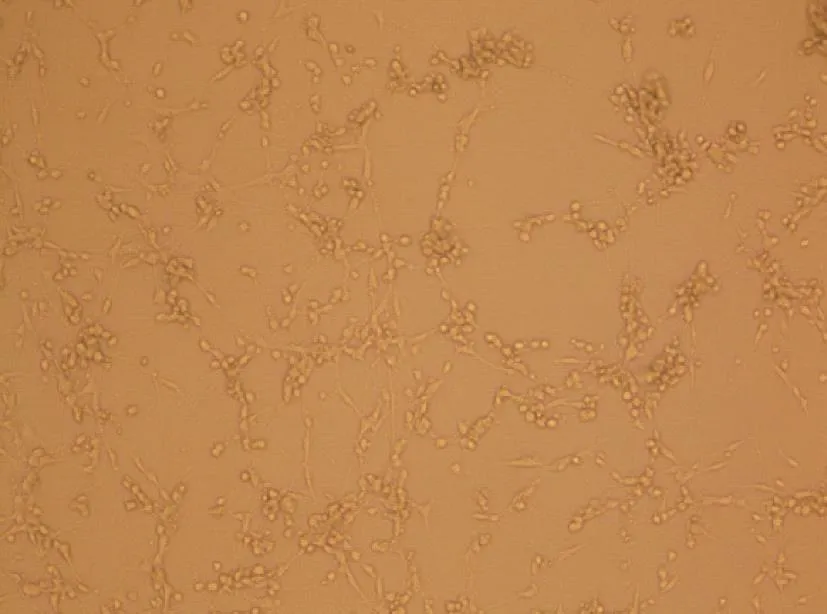
图2 H-1培养72 h后Fig. 2 H-1 virus was cultured 72 h
2.2病毒滴定结果
采用C6细胞96孔细胞病变法对H-1细小病毒进行滴定,重复测定二次滴定结果按照Karber法计算。(Karber法是计算病毒感染力的一种方法,其公式为:LgTCID50= L-d(S-0. 5)其中:L =最高稀释度的对数;d =稀释对数之间的差;s =阳性孔比率总和),H-1细小病毒滴度为6. 5 LgTCID50/0. 1 mL。
2.3抗原的制备和纯化
分别制备和纯化C6细胞和H-1细小病毒作为正常抗原和特异抗原,采用分光光度法测定正常抗原和特异抗原的浓度,其中C6细胞正常抗原浓度为0. 509 mg/ mL;H-1细小病毒特异抗原浓度为6. 597 mg/ mL。
2.4毒种的PCR鉴定
用建立的PCR方法分别扩增H-1、KRV、小鼠微小病毒(MVM)、猪细小病毒(PPV),结果显示,在以H-1为模板时出现183 bp的单一目的条带,以KRV、小鼠微小病毒(MVM)、猪细小病毒(PPV)为模板时无目的条带出现(图3)。
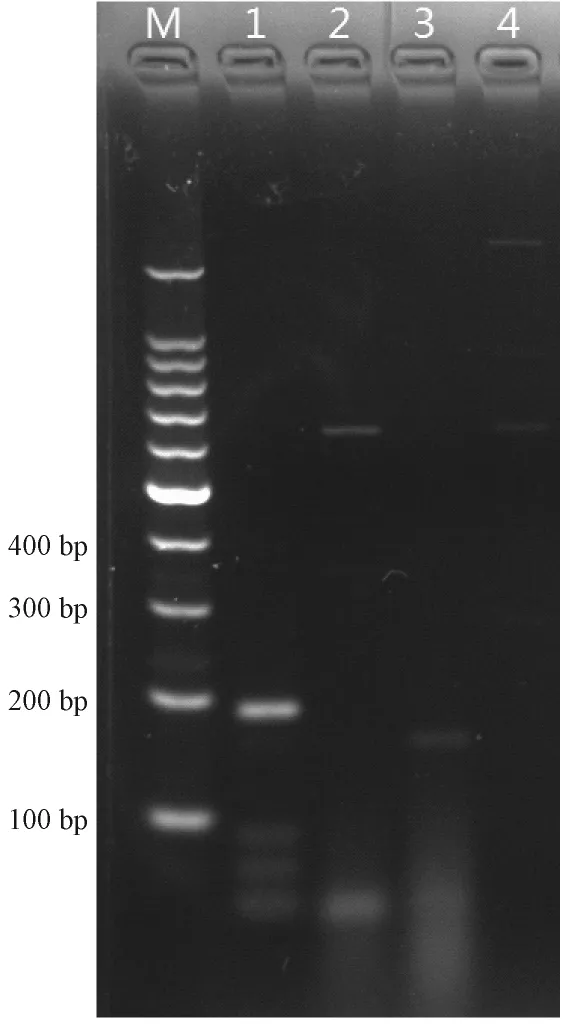
图3 H-1细小病毒株PCR特异性结果Note:M:100 bp marker;1:H-1;2:KRV;3:MVM;4:PPV.Fig. 3 Specificity of H-1 Virus PCR
以H-1 DNA为模板,能扩增到183 bp的可见目的条带,PCR产物送生工测序,测序结果与NCBI核酸数据库比对,与H-1细小病毒同源性达到97%。
2.5最佳工作条件确定
采用棋盘滴定法确定H-1细小病毒ELISA方法中正常抗原、特异抗原及HRP标记山羊抗大鼠IgG最佳工作浓度,其中正常抗原工作浓度为0. 2 μg/ mL,特异抗原工作浓度为5 μg/ mL,HRP标记山羊抗大鼠IgG工作稀释度为1∶10000。
2.6精密性测定
取阴性血清与阳性血清各一份,1∶40稀释后,各用一块纯化后H-1细小病毒包被的96孔板测定。得到的结果分别计算平均值及标准差,计算板内变异系数(CV),经计算,阴性血清与阳性血清CV值均小于15%(表1)。
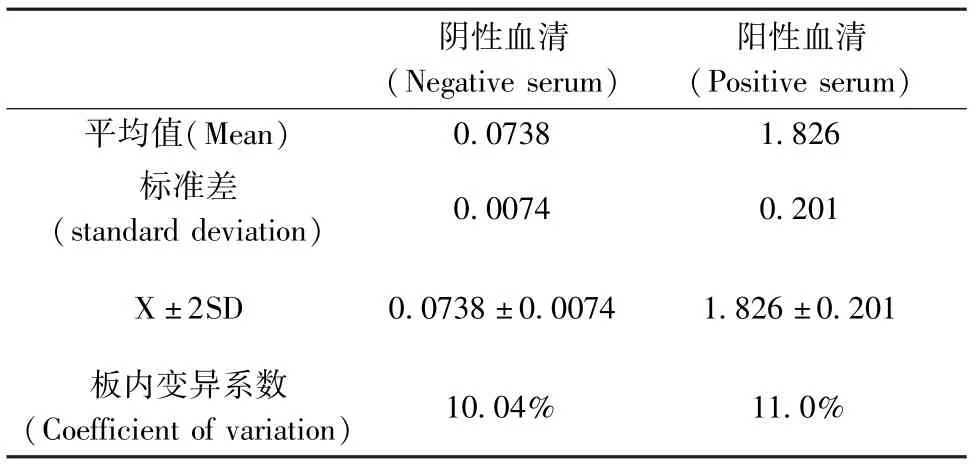
表1 H-1细小病毒ELISA方法精密性检测Tab. 1 The precision of ELISA method for H-1 parvovirus
2.7特异性测定
用已建立的ELISA法和XpressBio公司的H-1检测试剂盒分别检测大鼠细小KRV病毒、小鼠微小病毒(MVM)、犬细小病毒(CPV)和猪细小病毒(PPV)阴、阳性血清,同时设H-1病毒标准阴、阳性血清对照。结果显示H-1细小病毒和KRV病毒阳性血清检测为阳性,其余病毒阴性及阳性血清检测均为阴性,所建立的H-1细小病毒ELISA方法有良好的种属特异性(表2)。
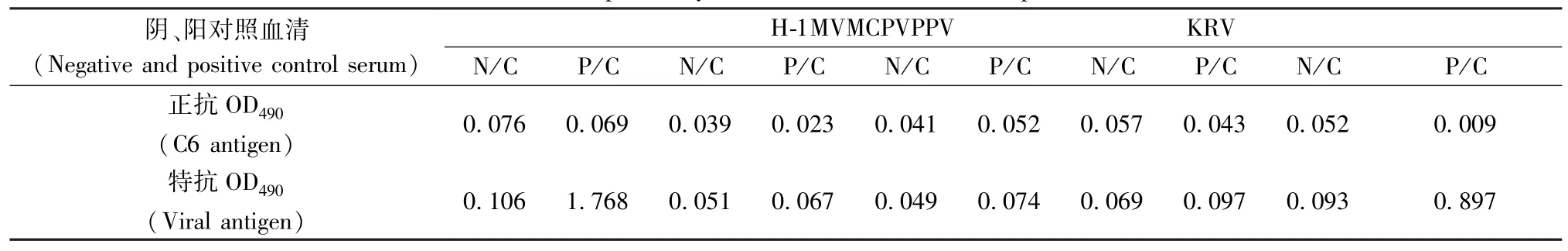
表2 H-1细小病毒ELISA方法特异性试验结果Tab. 2 The specificity of ELISA method for H-1 parvovirus
2.8检测方法重复性测定
将15份阴性血清和5份阳性血清1:40稀释后,重复测定三次,经计算分析三次测定的总符合率为100%。三次测定阴性血清与阳性血清各自的符合率见表3.

表3 H-1细小病毒ELISA方法重复性检测Tab. 3 Repeatability of ELISA method for H-1 parvovirus
2.9检测方法稳定性测定
37℃放置0~10 d的H-1细小病毒包被11块抗原包被板,同时检测阳性血清5份,阴性血清15份。比较检测结果的P/ N值(表4)。其中阴性血清P/ N值均小于2. 1,阳性血清P/ N值均大于2. 1,符合判断标准。
2.10检测方法敏感性测定
用所建立的ELISA方法检测经倍比稀释的阳性血清,以确定该方法的敏感性(表5)。经检测,阳性血清进行1280倍稀释后P/ N值仍大于2. 1,该方法敏感性为1∶1280。
2.11与商品化试剂盒的比较
用所建立的H-1细小病毒ELISA检测方法与XpressBio公司的H-1 ELISA检测试剂盒同时对15份阴性血清和5份阳性血清进行检测,检测结果显示所建立的方法与商品化试剂盒的符合率为100%(表6)。
2.12H-1细小病毒ELISA检测方法的初步应用
采用建立的H-1细小病毒ELISA检测方法检测XpressBio公司H-1试剂盒检测为阴性的大鼠血清35份,经检测均为阴性。
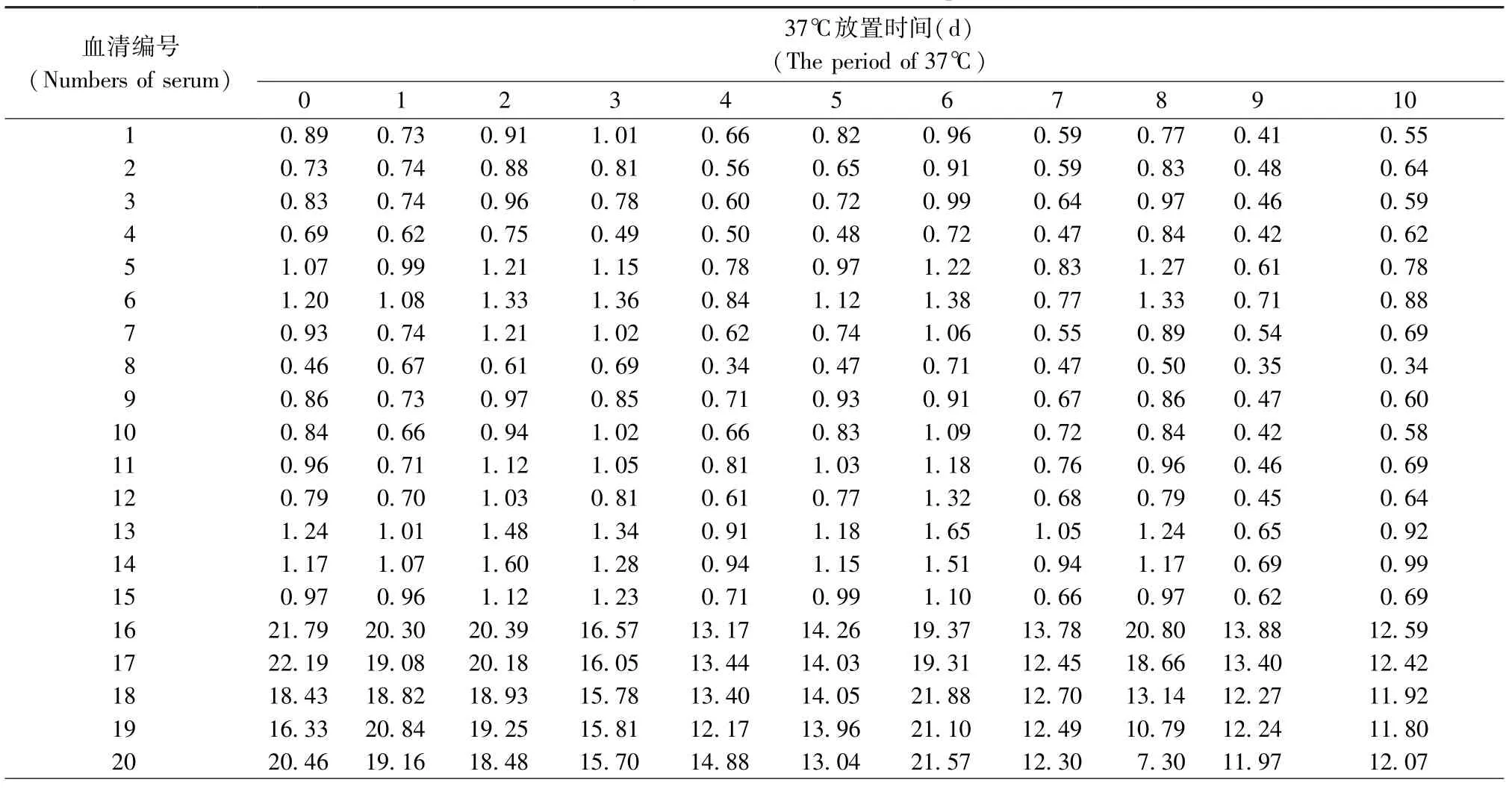
表4 H-1细小病毒ELISA方法稳定性检测Tab. 4 Stability of ELISA method for H-1 parvovirus
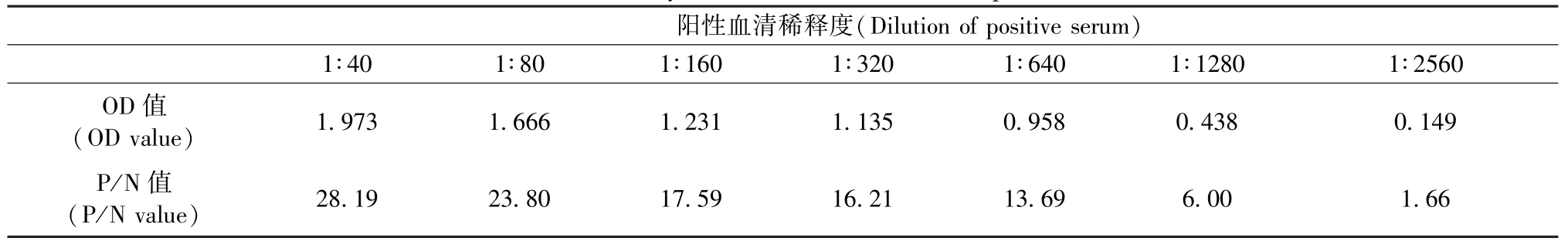
表5 H-1细小病毒ELISA方法敏感性测定Tab. 5 Sensitivity of ELISA method for H-1 parvovirus
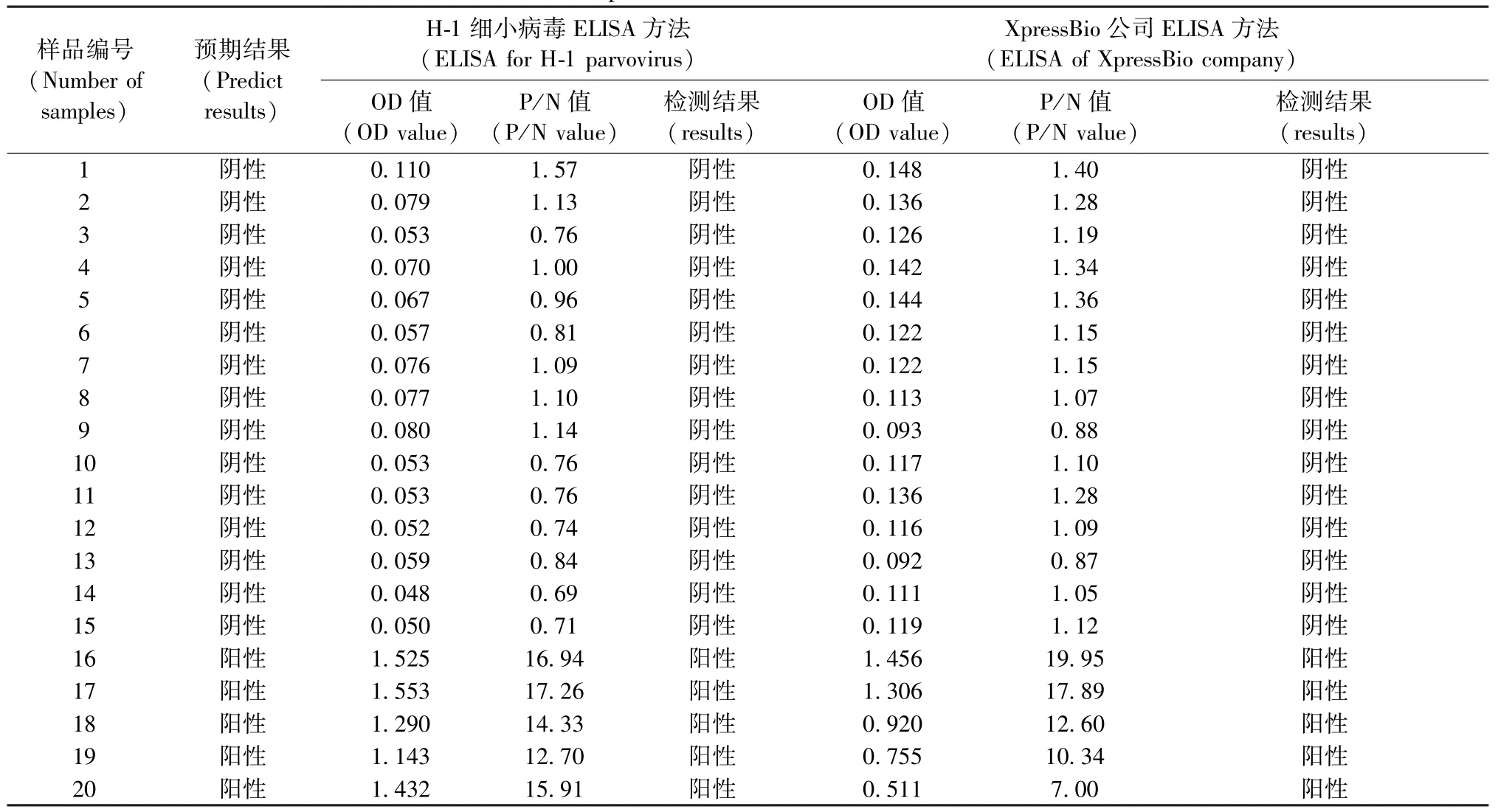
表6 两种ELISA检测试剂结果比较Tab. 6 Comparison of two kinds of ELISA methods
3 讨论
GB / T 14926. 31-2001中建议采用大鼠胚胎原代细胞(primary rat embryo cells,RE)培养H-1病毒。用RE细胞培养H-1病毒,费时、费力、易污染,并需要使用大量怀孕大鼠,在给H-1病毒的培养带来了诸多困难的同时也不符合动物福利的原则。刘先菊等[4]报导可通过大鼠神经胶质瘤细胞C6可传代培养H-1细小病毒,为该病毒的大规模培养与制备提供了基础。
本研究首次建立了通过传代细胞培养H-1细小病毒的ELISA检测方法。采用大鼠脑胶质瘤细胞C6对H-1细小病毒进行培养,得到病毒滴度为为6. 5LgTCID50/0. 1 mL的病毒。该病毒经PCR方法验证为H-1细小病毒,与NCBI的序列进行比对,符合率为97%。通过对获得的病毒进行超速离心和蔗糖梯度密度离心进行纯化,得到纯化的H-1细小病毒抗原,抗原浓度为6. 597 mg/ mL。用该抗原作为包被抗原,建立H-1细小病毒的全病毒ELISA抗体检测方法。通过对方法的敏感性、稳定性、重复性、特异性和精确性进行验证,确定该方法可检测出大于1:1280稀释的阳性血清,37℃放置10 d不影响其检测效果。所建立的检测方法与XpressBio公司的H-1检测试剂盒均与犬细小病毒、猪细小病毒和小鼠细小病毒阳性血清间无交叉反应,但两种方法均与大鼠细小病毒KRV有交叉反应,经NCBI比对,H-1细小病毒与大鼠细小病毒KRV的序列同源性达到90%,其中两种病毒非结构蛋白NS-1同源性为99%,非结构蛋白NS-2同源性为98%,结构蛋白VP-1同源性为81%,结构蛋白VP-2同源性为78%,通过序列比对说明H-1细小病毒和KRV细小病毒之间具有交叉抗原,需要针对两种病毒结构蛋白的差异分别建立检测方法来进行区分,有待进一步研究。
本方法的建立,可有效补充国家标准中H-1细小病毒检测方法,并可代替国外同类试剂盒对大鼠血清中H-1细小病毒抗体进行检测。
参考文献:
[1] 田克恭.实验动物病毒性疾病[M].北京:农业出版社. 1992:126-132.
[2] 田克恭,贺争鸣,刘群,等.实验动物疫病学[M].北京:中国农业出版社. 2014:205.
[3] Karsten Geletneky,Andreas D. Hartkopf,Robert Krempien,et al. Therapeutic implications of the enhanced short and longtermcytotoxicity of radiation treatment followed by oncolytic parvovirusH-1 infection in high-grade glioma cells[J]. Bioengineered Bugs,2010,1:429-433.
[4] 刘先菊,佟巍,张丽芳,等.大鼠细小病毒H-1株培养方法的建立[J].中国实验动物学报,2011,19:495-498.
〔修回日期〕2015-11-08
Establishment and application of ELISA method for H-1 parvovirus
FU Rui,LI Xiao-bo,WANG Shu-jing,WANG Ji,WEI Li,GONG Wei,YUE Bing-fei,HE Zheng-ming
(National Institutes for Food and Drug Control,Beijing 100050,China)
【Abstract】Objective To establish ELISA method for H-1 parvovirus,and to apply it in detection. Method Cultured the H-1 parvovirus in rat glioma cell line C6,prepared the viral antigen for coating. Used the purified viral antigen to establish the ELISA method,and compared the ELISA method with the ELISA kit from XpressBio company. Then applied the ELISA method in detection of 35 rat serums. Results The positive serum which be diluted to 1280 can be detected by the ELISA method,there have not cross reaction with positive serum of CPV,MVM and PPV,but there has cross reaction with KRV. 35 pieces of rat serums were detected by the ELISA method,they were all negative,the results were consistent with the kit from XpressBio company. Conclusions The sensitivity and species specificity of the ELISA method for H-1 parvovirus were suitable,the method can be used in detection of H-1 parvovirus in rat serum.
【Key words】H-1 parvovirus;ELISA;Detection of antibody
【中图分类号】R-332
【文献标识码】A
【文章编号】1671-7856(2016)03-0075-06
doi:10. 3969. j. issn. 1671-7856. 2016. 03. 015
[基金项目]国家科技支撑计划“实验用动物病原分子生物学快速检测新技术研究与应用”(2015BAI07B02)。
[作者简介]付瑞(1978-),男,副研究员,研究方向:实验动物病毒学,Email:furui78@126. com。
[通讯作者]贺争鸣(1957-),男,研究员,研究方向:实验动物微生物学,Email:zhengminghe57@163. com。
