从电子效应谈把握《有机化学基础》的学科内涵
2016-06-16陈益孙夕礼
陈益+孙夕礼
摘要:阐述了诱导效应、共轭效应等电子效应的内涵、特点和一般规律。通过典型性和代表性例子,说明了电子效应在把握有机物分子的空间结构、诠释不同氢的反应活性、比较不同羰基的化学性质、解读有机反应的选择性等方面的应用。指出适时、适度、适当地引入电子效应,能帮助学生更准确和深入地理解《有机化学基础》的学科内涵以及“结构决定性质、性质反映结构”这一化学最核心和最基础的学科思想。
关键词:电子效应;分子空间结构;有机反应机理;有机化学基础;学科内涵
文章编号:1005–6629(2016)5–0003–05 中图分类号:G633.8 文献标识码:B
1 问题的提出
电子效应作为大学基础有机化学一个重要的结构概念,在解释有机物的空间结构、反应活性、反应的选择性和物质的稳定性以及反应机理等方面有着极为广泛的应用。普通高中从必修2到选修5的有机化学,教材的编写基本上沿用实验感知式和事实陈述式的叙事法,鲜有对结构与性质关系的深入探究。基于表象和经验的归纳与概括,所得结论或“规律”往往流于片面。事实上,学生或多或少、或浅或深具备了相关的非金属性(电负性)、非金属性强弱(电负性大小)、共用电子对的偏移(键的极性)、大π键(共轭π键)等概念,为电子效应解读有机物的空间结构、性质和反应奠定了一定的知识基础。根据教学对象和进度,适时、适度、适当地引入电子效应,能帮助学生更准确和深入地把握《有机化学基础》的学科内涵,进一步彰显“结构决定性质、性质反映结构”这一化学最核心和最基础的学科思想。
2 电子效应
电子效应是在总结大量实验事实的基础上提出的用来解释化学现象的一种理论。从本质上讲,电子效应就是由于不同原子之间存在的电负性差别导致了化学键的极化。这种极化的结果可以沿着化学键传导,从而对分子本身的物理性质和化学性质产生影响。根据传递方式的不同,可分为诱导效应、共轭效应(包括超共轭效应)、场效应等,又以诱导效应和共轭效应更常见、更重要。
2.1 诱导效应
因分子中原子或基团的极性(电负性)不同而引起成键电子云沿着原子链向某一方向移动的效应称为诱导效应。
诱导效应一般以氢为比较标准,如果取代基的吸电子能力比氢强,则称其具有吸电子诱导效应,用-I表示。如果取代基的给电子能力比氢强,则称其具有给电子诱导效应,用+I表示[1]。如: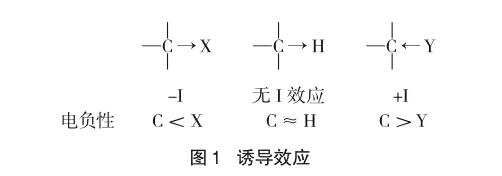
原子或基团间电负性相对大小是决定诱导效应方向的主要因素。
诱导效应有以下三个基本特征:
一是传递性,电子云偏移沿着σ键传递,并随着碳链的增长而减弱或消失,一般只考虑三根键的影响。
二是正比性,诱导效应的强弱与电负性成正比。杂化轨道中s成分越多,电负性越大,-I效应越强。如-I:sp>sp2>sp3,则有-I:-C≡CR>-CH=CR2>-CH2CR3。
三是加和性,即当几个原子或基团性质相同时,这一键所受的诱导效应是这几个诱导效应的和,原子或基团性质相反时,可以相互消减。如-I:-CF3>-CHF2>-CH2F。
吸电子基团往往带有正电荷、电负性大、含有不饱和键。给电子基团往往为带有负电荷、饱和脂肪族烃基。
吸电子诱导效应: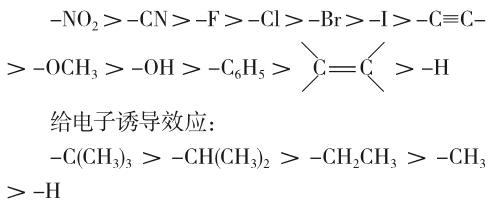
上面各原子或原子团的诱导效应大小,常常因为所连母体化合物的不同以及原子间的相互影响等一些复杂因素的存在而有所不同,因此,在不同的母体化合物中,它们的诱导效应顺序是不完全一样的[2]。
2.2 共轭效应
在共轭分子中,由于π电子的离域,任何一个原子受到外界的影响,均会影响到分子的其余部分,这种电子效应通过共轭体系传递的现象,称为共轭效应(C效应)。
共轭体系中必须含有①三个或三个以上、②相邻、③共平面的原子,这些原子都具有相互平行、且垂直于原子所在平面的p轨道,可侧面重叠形成多中心、多电子的大π键。
共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,结果使共轭体系的分子产生一系列特征:①电子离域运动,键长趋向平均化,电子云趋向平均分布;②分子内能降低,分子更稳定;③对称体系,电子云平均分布;不对称体系,电子云交替(δ+δ-)分布[3]。
共轭作用类型有以下两种:
一是π-π共轭体系,其结构特征是:不饱和键、单键、不饱和键交替连接。不饱和键可以是双键,也可以是叁键;组成该体系的原子也不是仅限于碳原子,还可以是氧、氮等其他原子。如:
二是p-π共轭体系,其结构特征是:与双键碳原子直接相连的原子上有p轨道,这个p轨道与π键的p轨道平行,从侧面重叠构成p-π共轭体系。能形成p-π共轭体系的除具有未共用电子对的中性分子外,还可以是正、负离子或自由基。如: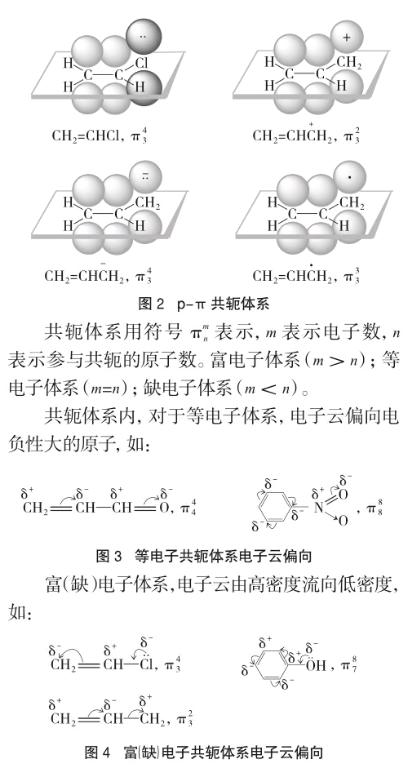
共轭效应分为吸电子效应(-C)和供电子效应(+C)两种类型。
卤素、羟基、氨基、碳负离子等与双键直接相连时,X、O、N、C等原子的孤对电子对与π键共轭。由于是由一个原子向共轭体系提供两个电子,相当于使π电子密度增大,所以有给出电子的能力,称为+C效应。一般富电子p-π共轭都属于供电子共轭。
当参与共轭的O、N,只提供一个电子,而本身电负性大于C原子,所以有使共轭体系电子向O、N转移的能力,因此有-C效应。电负性大于C的原子参与的等电子共轭是吸电子共轭。endprint
常见具有供电子共轭效应的基团及其一般强弱次序为:-NH2>-OH>-OCH3。
常见具有吸电子共轭效应的基团及其一般强弱次序为:-COOH>-CHO>-COR>-COOR>-SO3H[4]。
共轭效应的特点是,各原子上出现正负电荷更迭现象,电子转移可由共轭链的一端到另一端等效传递,即共轭效应的强度不会随共轭链的长度增加而减小,这是与诱导效应的重要区别。因此,一个分子中同时存在两种效应时,通常共轭效应大于诱导效应。如,双键连有主族元素X、O、N等强电负性元素时,p-π共轭效应强于诱导效应,此时,一般主要考虑共轭效应(+C效应)[5]。
2.3 超共轭效应
π键或p轨道与α-碳原子上的C-H σ键之间可产生微弱重叠(轨道部分重叠),形成一个整体结构,这种作用称为超共轭效应。由于轨道不是完全重叠,超共轭效应比π-π共轭、p-π共轭作用弱得多。
超共轭效应类型有以下两种:
一是σ-π超共轭体系,即α-碳上C-H σ键与π键的p轨道侧面交盖。结果使σ键的电子偏离原来轨道,倾向于π轨道。
二是σ-p超共轭体系,通常能形成σ-p超共轭体系的可以是碳正离子或碳自由基。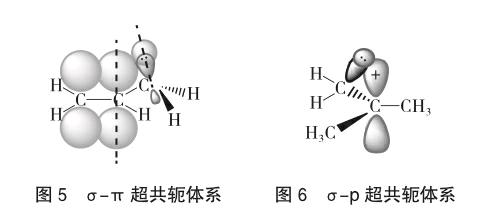
超共轭效应的特点是,超共轭效应只存在于含C-H σ键的分子中,且只是供(推)电子效应,即+C;强度与C-H σ键数目成正比。因此,参与超共轭的σ键越多,碳正离子、碳自由基越稳定,如碳正离子或自由基的稳定性[6]: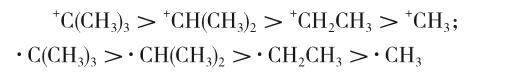
3 从电子效应理解《有机化学基础》的学科内涵
官能团对物质性质的决定观、基团间相互影响与作用的辩证观、有机物相互衍生的变化观,是中学有机化学教学的基本逻辑线索。电子效应则是统领这些逻辑线索的一个有效抓手。
3.1 把握有机物分子的空间结构
有机物分子的空间结构是指分子中原子在空间的分布,主要取决于中心原子的价键取向,总是倾向于形成能量最低的稳定构型和构象。
烷烃分子中的碳原子为sp3杂化,原子间形成σ键,决定了以碳为中心的四面体型是烷烃分子的空间结构特征;烯烃分子中的双键碳原子为sp2杂化,双键碳原子间形成π键,决定了以双键碳原子为中心的平面型是烯烃分子的空间结构特征;炔烃分子中的叁键碳原子为sp杂化,叁键碳原子间形成正交的π键,决定了以叁键碳原子为中心的直线型是炔烃分子的空间结构特征;苯的同系物分子中苯环上碳原子为sp2杂化,苯环上碳原子间形成π66键,决定了以苯环为中心的平面型是苯的同系物分子的空间结构特征。常常根据这些单元的空间结构特征,以及σ键的可旋转性、π键的不可旋转性,判断其他复杂分子的空间结构。

3.2 诠释不同氢的反应活性
氢是有机化合物中种类和数目最多的元素之一。有机化学的许多反应其实就是氢或关于氢的反应。中学有机化学中,烃中氢(饱和碳上氢、不饱和碳上氢、芳环上氢)、羟基氢(醇羟基氢、酚羟基氢)、醛基氢、羧基氢、氨基氢以及与官能团直接相连的α-H等,其性质和反应有很大的不同。
3.3 比较不同羰基的化学性质
或是因为教学中的过分强化,抑或是“观察有机物结构式中的官能团判断性质”一类试题训练导致的思维定势,学生常常孤立地从官能团判断有机物的性质,而忽视了官能团与相邻基团的相互影响和作用,导致认识僵化甚至错误。以醛或酮中羰基与氢的还原反应,类推羧酸也能与氢发生还原反应,就是一个典型。
3.4 解读有机反应的选择性
取代反应和加成反应是两个最基本的有机反应。虽然有机反应机理不作为中学教学的基本要求,但通过电子效应适当的引导和揭示,对学生理解反应实质和过程还是非常有益的。
对于有机物的取代或加成反应,电性选择性是反应的普遍特征,这在离子型反应中表现得尤为显著。
羰基是一个极性的不饱和基团,与极性试剂加成时进攻基团和被进攻基团具有明显的电性选择性,总是电性相反的基团交叉进攻。
从产物形式上看,前者符合“马氏规则”,而后者反“马氏规则”,就是因为-CH3具有给电子诱导效应,-CF3具有吸电子诱导效应,使得π电子极化,两个碳原子显现不同的电性,这种反应的区域选择性,本质上都是电性选择性的结果,形不同而实相同。
苯的衍生物苯环上取代基的定位效应、基团的活化作用或钝化作用,也可以通过电子效应得到解释[10]:
-CH3具有给电子的诱导效应(+I)和σ-π超共轭效应,两个效应的叠加,使得甲苯分子中苯环的电子密度增大,π电子产生交替极化的结果,使甲基邻对位的电子密度增加得更多,见图9;-OH具有吸电子的诱导效应(-I)和p-π共轭效应(+C),由于+C>-I,使得苯酚分子中苯环的电子密度增大,π电子产生交替极化的结果,使羟基邻对位的电子密度增加得更多,见图10。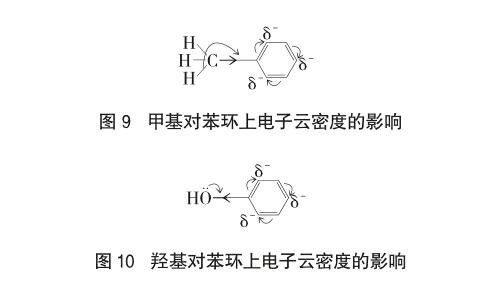
由于苯环上发生亲电取代反应,取代时进攻基团具有明显的负电选择性,因此,-CH3和-OH是苯环邻位和对位的活化基团。
综上分析,就解释了苯酚和苯分别与溴反应的差异,见表1。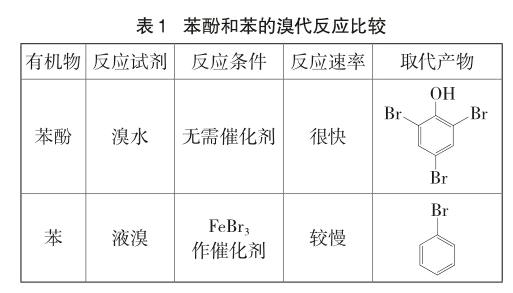
类似地也可解释甲苯和苯分别发生硝化反应的差异。
4 结语
从本质上讲,电子效应(诱导效应、共轭效应、场效应等)就是重视事物各构成要素间的联系、作用和变化,而这种联系、作用和变化是普遍存在的。许多有机化学试题中作为新信息给出的所谓“新反应”,其反应原理都可以从电子效应得到理解。因此,在分析和解决这类问题时,就可以不再仅仅是“依样画葫芦”,止于表象。
在教学策略上,若能将《物质结构与性质》模块教学顺序前置,则更有利于电子效应在《有机化学基础》教学中的渗透和应用;将《物质结构与性质》模块教学顺序后置,则可将《有机化学基础》中有关有机物的结构、性质以及有机反应历程作为教学资源,从电子效应视角得到本质上的全面和深入的理解,从而实现相关模块教学内容的互通和互动。
参考文献:
[1][2][3][6][9]邢其毅,徐瑞秋,裴伟伟,裴坚.基础有机化学[M].北京:人民教育出版社,2005:243~247;18;140;569.
[4]裴文.高等有机化学[M].杭州:浙江大学出版社,2006:96~103.
[5]魏荣宝.高等有机化学(第2版)[M].北京:高等教育出版社,2011:261~268.
[7]王澄.基于PCK的高中化学教学实录和反思──以苏教版“酚的性质和应用”为例[J].化学教学,2015,(4):43.
[8]陈益.衍生观引领下的“乙醇”教学实践[J].化学教学,2013,(1):36~39.
[10]程绍玲,王华静,谢运甫.电子效应对单取代苯定位效应和反应活性的影响[J].化学教育,2015,(22):19~21.endprint
