野鸦椿种子内源抑制物活性初探
2016-06-16廖源林蔡仕珍
廖源林, 蔡仕珍, 李 西, 林 瑞
( 四川农业大学 风景园林学院, 成都 611130 )
野鸦椿种子内源抑制物活性初探
廖源林, 蔡仕珍*, 李西, 林瑞
( 四川农业大学 风景园林学院, 成都 611130 )
摘要:以野鸦椿(Euscaphis japonica)种壳和胚为材料,甲醇浸提得到种壳浸提液和胚浸提液,配制浸提液浓度梯度为原浸提液浓度的10%、20%、30%、40%,研究不同浓度的种壳和胚浸提液对白菜、小麦、绿豆种子底物酶活性、发芽率、幼苗根长和苗高的影响,萃取和分离种壳和胚甲醇浸提液中的内源抑制物质,探讨野鸦椿种子内源抑制物质的活性与成分。结果表明:随着种壳和胚浸提液浓度的增加,白菜种子酸性磷酸酶活性和发芽率均显著降低(P<0.05),表现为抑制作用递增,种壳的抑制作用小于胚,而幼苗的根长和苗高则表现为低促高抑,在10%浸提液处理下根长和苗高达最大值,种壳的促进效果弱于胚;小麦种子淀粉酶活性及幼苗的根长和苗高递减(P<0.05),表现为抑制作用递增,而发芽率则在浓度≤20%时差异不明显(P>0.05),浓度为30%时显著降低(P<0.05),40%时发芽率为0,种壳的抑制作用大于胚;绿豆种子蛋白酶活性、发芽率、幼苗根长和苗高均在浸提液浓度≥20%时显著下降(P<0.05),且种壳的作用效果小于胚。种子内源抑制物萃取及分离表明,外壳中含酚酸类较胚多,含碱类较胚少。综上认为,野鸦椿种壳和胚中均含有较高活性的内源抑制物,但性质、成分及含量存在差异,外壳内源抑制物主要作用对象为淀粉类物质,胚乳内源抑制物主要作用于油脂类和蛋白类物质。
关键词:野鸦椿, 甲醇浸提液, 内源抑制物质, 生物测定
野鸦椿(Euscaphisjaponica),又名鸡眼睛、鸡肾果、山海椒、芽子木,为省沽油科(Staphyleaceae)野鸦椿属(Euscaphis)的落叶小乔木或灌木,同属在我国的还有福建野鸦椿(E.fukienensis)和圆齿野鸦椿(E.konishii)(中国科学院中国植物志编辑委员会,1981;中国科学院华南植物研究所,1995)。野鸦椿株型优美,高为3~6 m,小枝及芽红紫色,春夏开花,秋、冬及来年的春季挂果,是一种理想的“一季观花,三季观果”树种。此外,野鸦椿兼具药用价值,有理气止痛、消肿散结、抗炎镇痛等功效(李先辉 等,2009)。种子繁殖是野鸦椿的主要繁殖途径。然而,野鸦椿种子具有深度休眠特性,萌发时间长、发芽率低。如果不对种子进行预处理,种子萌发非常困难。在野生环境中,野鸦椿以单株形式存在于林缘、荒坡、溪边群落中,且植株附近不见小苗。近年来,随着对野鸦椿属价值的认可,野鸦椿野生资源受到严重破坏,濒临灭绝危险。目前,基于对野鸦椿资源的保护及利用,国内已率先在其药理和繁殖方面进行了研究(左敏等,2008;葛玉珍,2004),但较少涉及休眠机理方面。
种子休眠的原因大致包括胚未成熟、种皮构造特殊和含有内源抑制物质三个方面(中山包,1988;卡恩,1989)。前人通过对种子内源抑制物活性研究,为研究种子破眠技术和休眠机理提供了科学依据。宋会兴等(2012)通过对四川牡丹种子内源抑制物活性的研究,发现内源抑制物是导致四川牡丹种子休眠的重要原因;年慧慧等(2012)通过研究不同方法处理后的南方红豆杉种子内源抑制物的活性,找到了科学的破除休眠的方法;李兵兵等(2013)研究不同药剂处理下的麻花秦艽种子内源抑制物活性的变化,发现高锰酸钾可减弱其种子内源抑制物活性;覃嘉佳等(2011)发现内源抑制物的存在是引起野鸦椿属种子休眠的原因之一。本文通过研究野鸦椿种子不同部位的内源抑制物对油脂类、淀粉类及蛋白类种子的化感作用,进一步讨论野鸦椿内源抑制物的活性、总类及分布,旨在为野鸦椿种子破休眠技术及休眠机理的深入研究提供参考。
1材料与方法
1.1 材料
供试的野鸦椿种子于2012年9月采自四川省宜宾马家林场,阴干后常温储藏备用。生物活性的测定材料采用市售白菜(Brassicapekinensis)、小麦(Triticumaestivum)、绿豆(Vignaradiata)的种子。试验在成都市温江区四川农业大学风景园林重点实验室进行。
1.2 方法
1.2.1 内源抑制物的生物测试(1)甲醇浸提液的制备:参照戴萍(2011)和程汉亭等(2012),将野鸦椿种子小心砸开,分离种壳和胚,各称取5 g粉碎后分别置于锥形瓶中,用50 mL 80%的甲醇浸提,保鲜膜封口,放入0 ℃冰箱中,每隔一定时间震荡1次,36 h后取出过滤,得到种壳和胚的甲醇浸提液。再将甲醇浸提液分别稀释,使其浓度为原浓度的10%、20%、30%、40%(相当于质量浓度为0.01、0.02、0.03、0.04 g·mL-1的甲醇浸提液浓度),同时分别取5、10、15、20 mL的80%甲醇稀释到50 mL作为以上梯度对照。(2)种子内源抑制物活性测定:用上述不同浓度的种壳、胚甲醇浸提液和甲醇稀释溶液浸泡一批大小、形状、色泽基本一致且饱满的白菜、小麦及绿豆种子,蒸馏水浸种作为对照。随机选取,每个处理设3个重复,每个重复100粒,浸种白菜(3 h)、小麦(5 h)、绿豆(5 h)后,将浸泡好的种子放于铺有滤纸的培养皿中,在25 ℃(白菜、绿豆)、20 ℃(小麦)恒温培养箱内进行发芽实验,48 h后统计白菜、小麦、绿豆籽的发芽率(以露出子叶为发芽的标准),5 d后将苗拔出测其苗高和根长。(3)白菜、小麦及绿豆种子底物酶活性的测定:用上述浸泡好的白菜、小麦及绿豆种子,随机选取,参照刘子凡(2011)和王学奎(2006),测定酸性磷酸酶(白菜)、淀粉酶(小麦)、蛋白酶(绿豆)的活性。
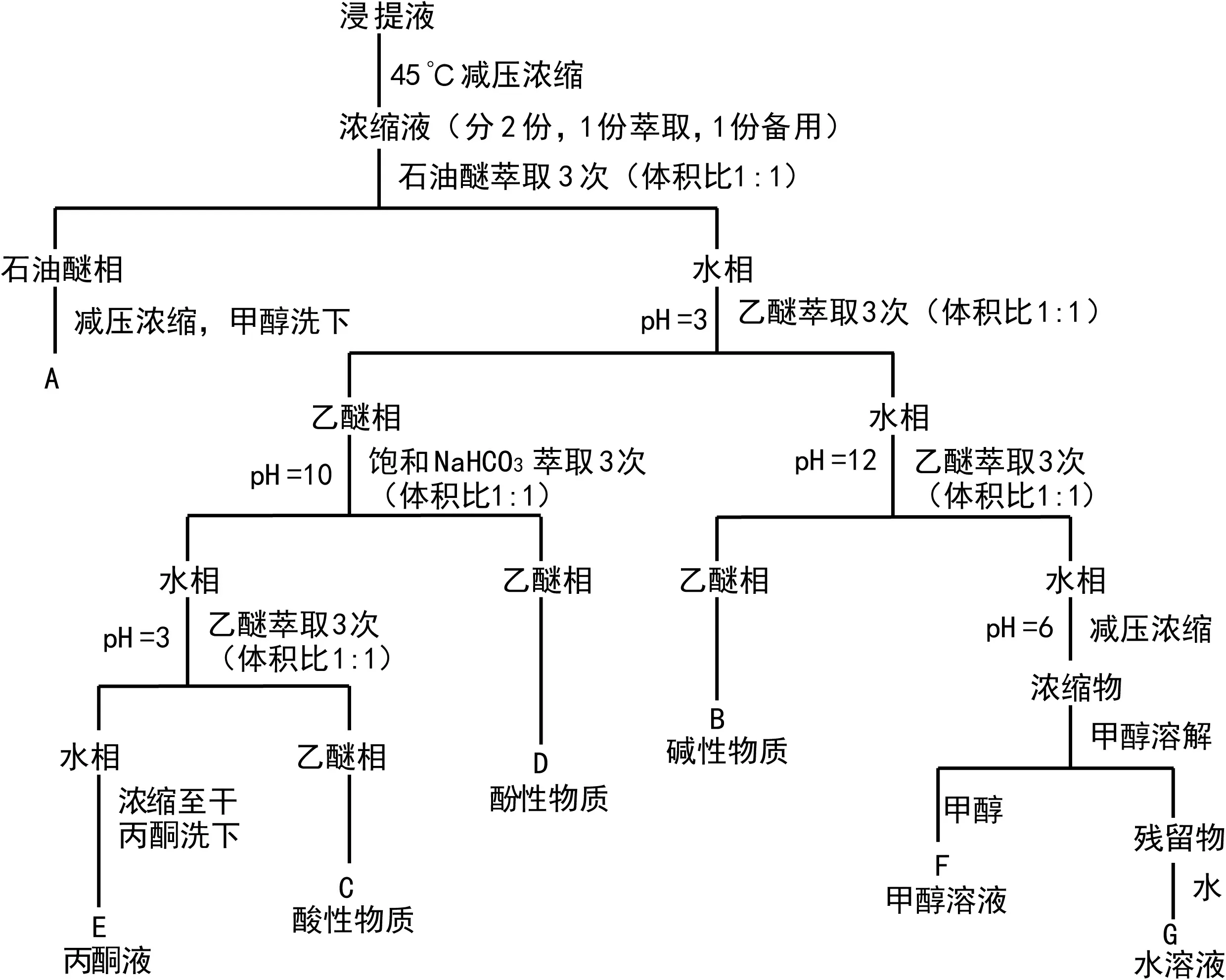
图 1 野鸦椿种子内源抑制物的分离流程Fig. 1 Procedure for separating endogenous inhibitors from Euscaphis japonica seeds
1.2.2 内源抑制物提取及分离(1)野鸦椿种子内源抑制物的提取:参考王小平等(1998)和覃嘉佳等(2011)的方法,取水浸24 h的野鸦椿种子450粒,分种壳(23.91 g)、胚(4.53 g)两部分,分别用80%甲醇在0 ℃下浸泡,每隔一定时间震荡1次,36 h后过滤。其中80%甲醇用量,按1 g鲜重组织用10 mL溶剂提取的比例来计算(Hillman,1983)。(2)内源抑制物的萃取分离:参照郑彩霞等(1991),将上诉得到的含内源抑制物的浸提液,按照图1的分离流程进行分离,将分离得到的7个组分,分别减压浓缩至干,称取重量。
1.3 数据统计分析
采用Excel软件和SPSS 19.0数据处理系统进行统计与分析。
2结果与分析
2.1 野鸦椿种子甲醇浸提液对白菜、小麦、绿豆种子萌发的影响
由图2可知,白菜、小麦和绿豆种子发芽率都随着浸提液浓度的增加而呈降低趋势。其中白菜种子发芽率随着种壳和胚浸提液浓度的增加显著降低,当浓度为40%时,发芽率依次比对照降低了84%、91%,比相同浓度的甲醇降低了18%、25%。胚较种壳对白菜种子萌发的抑制效果更显著。
在浓度低于20%时,小麦种子发芽率随着浓度增加下降不明显,在浓度高于20%,发芽率大幅度降低,浓度为30%时,种壳和胚的发芽率依次比对照降低了80%、76%,比同浓度的甲醇降低了24%、20%,浓度40%时发芽率为0。种壳较胚对小麦种子萌发的抑制效果更明显。
绿豆种子的发芽率随着甲醇浓度、种壳及胚浸提液浓度的增加而下降,在浓度范围为0%~10%时下降不明显,在浓度为10%~40%时下降明显。相比甲醇,在浓度范围为10%~20%条件下,胚和种壳的甲醇浸提液对绿豆种子的萌发有促进作用,且胚的促进作用更显著;而在浓度范围为30%~40%时,胚和种壳的浸提液对绿豆种子的萌发具有抑制效果,且胚的抑制效果更为明显。
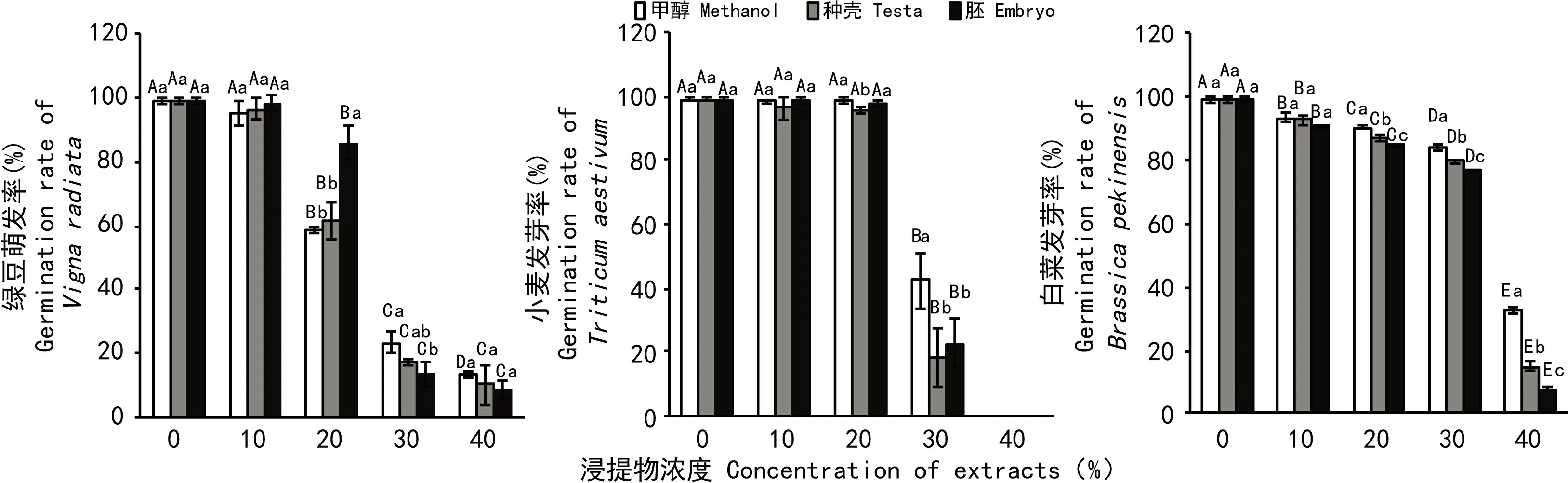
图 2 野鸦椿种子甲醇浸提液对白菜、小麦及绿豆种子萌发的影响 不同大写字母表示相同物质不同浓度处理间差异显著 (P<0.05)。不同小写字母表示相同浓度不同物质处理间差异显著。下同。Fig. 2 Effects of methanol extract of Euscaphis japonica seeds on germination of Chinese Cabbage,Triticum aestivum and Vigna radiate Different capital and lowercase letters indicate significant differences (P<0.05) among different concentrations with same substance, and of different substance treatments at the same concentration,respectively. The same below.
2.2 野鸦椿种子甲醇浸提液对白菜、小麦、绿豆种子幼苗生长的影响
由图3可知,随着处理浓度的增大,野鸦椿种壳和胚浸提液对白菜幼苗根长和苗高均呈现低促高抑的现象,而且都在浓度为10%时根长和苗高达最大值,即种壳浸提液的根长和苗高分别为2.0 cm和2.2 cm,胚浸提液上述两个指标依次为3.3 cm、3.7 cm;在同浓度下,种壳和胚浸提液处理的根长和苗高均大于甲醇,种壳浸提液处理的根长和苗高较胚低,表明两者对白菜幼苗生长均存在促进作用,胚的促进作用较种壳的显著。
小麦根长和苗高随着种壳和胚浸提液浓度的升高而显著降低,在种壳和胚浸提液浓度为40%时均无变化。在同浓度下,种壳和胚浸提液处理的根长和苗高均小于甲醇,种壳浸提液的根长和苗高较胚低,表明野鸦椿种壳和胚浸提液对小麦幼苗生长均存在抑制作用,种壳的抑制作用较胚的明显。
随着处理浓度的增加,绿豆幼苗的根长和苗高呈降低的趋势,在浓度范围为10%~20%时,种壳和胚浸提液处理的根长和苗高均大于甲醇,种壳浸提液处理下根长和苗高较胚低;在浓度高于20%时,根长大幅度的降低,即在种壳和胚浸提液处理下分别由1.4cm、2.9cm在30%降至为0,在浓度范围为30%~40%时,种壳和胚浸提液处理下的苗高均低于甲醇,种壳浸提液处理的苗高较胚高。这表明在浓度范围为10%~20%时,种壳和胚浸提液对绿豆幼苗生长均存在促进作用,胚的促进作用更显著;而在浓度范围为30%~40%时,两者对绿豆幼苗生长存在抑制作用,胚的抑制效果更明显。
2.3 野鸦椿种子甲醇浸提液对3种底物酶活性的影响
由图4可知,白菜种子酸性磷酸酶活性随着浓度的增加显著降低。在同浓度下,种壳和胚浸提液处理下的酸性磷酸酶活性较甲醇低,种壳浸提液处理下的酸性磷酸酶活性较胚高。说明种壳和胚浸提液对白菜种子酸性磷酸酶活性存在抑制作用,胚的抑制作用更为显著。
随着处理浓度的增加,小麦种子淀粉酶活性显著降低。在同浓度下,种壳和胚浸提液处理下淀粉酶活性较甲醇低,种壳浸提液处理下的淀粉酶活性较胚低。说明种壳和胚浸提液对小麦淀粉酶活性存在抑制作用,种壳的抑制效果更为明显。
绿豆蛋白酶活性随着各处理浓度的增加呈逐渐降低的趋势。在同浓度下,当浓度范围为10%~20%时,种壳和胚浸提液处理下蛋白酶活性较甲醇高,种壳浸提液处理下的蛋白酶活性较胚低;而在浓度为30%~40%时,种壳和胚浸提液下的蛋白酶活性较甲醇低,且在浓度30%时,种壳浸提液处理下的蛋白酶活性较胚低,但差异不明显(P>0.05),而在浓度为40%时, 种壳浸提液处理下的蛋白酶活性较胚高,差异显著(P<0.05)。由此表明,在浓度范围10%~20%时,种壳和胚的浸提液对绿豆蛋白酶活性具有促进作用,胚的促进作用更明显,而在浓度范围30%~40%时,种壳和胚的浸提液对绿豆蛋白酶活性具有抑制作用,胚的抑制作用更显著。
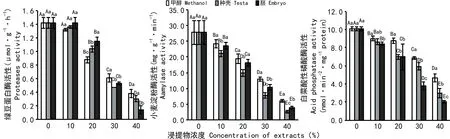
图 4 野鸦椿种子甲醇浸提液对3种底物酶活性的影响Fig. 4 Effects of methanol extract of Euscaphis japonica seeds on activities of acid phosphatase, aamylase and proteases
种壳浸提液对白菜种子萌发及酶的抑制效果较胚弱;对小麦的抑制作用较胚强;而对绿豆,则在浓度低时,种壳浸提液的促进作用较胚弱,在浓度高时,种壳浸提液的抑制作用较胚弱。由此说明,野鸦椿种壳和胚中都存在较高活性的内源抑制物质,且在种类、性质及含量上均存在差异,其中外壳的抑制物主要作用对象为淀粉类类物质,而胚乳的抑制物作用于油脂类和蛋白类物质。
2.4 野鸦椿种子内源抑制物的分离结果
分离结果表明,野鸦椿种子的种壳和胚中均含有内源抑制物,且其种类繁多,成分复杂;其中,种壳和胚中含有的内源抑制物在种类和含量上存在差异。如表1所示,野鸦椿种壳和胚的分离组分中E、F、G三类物质含量相对其它4类较高,胚中的A、B类物质明显比种壳的多,其中B类为碱性物质;种壳中的C、D类物质较胚中的多,C、D分别为酸性物质和酚性物质。
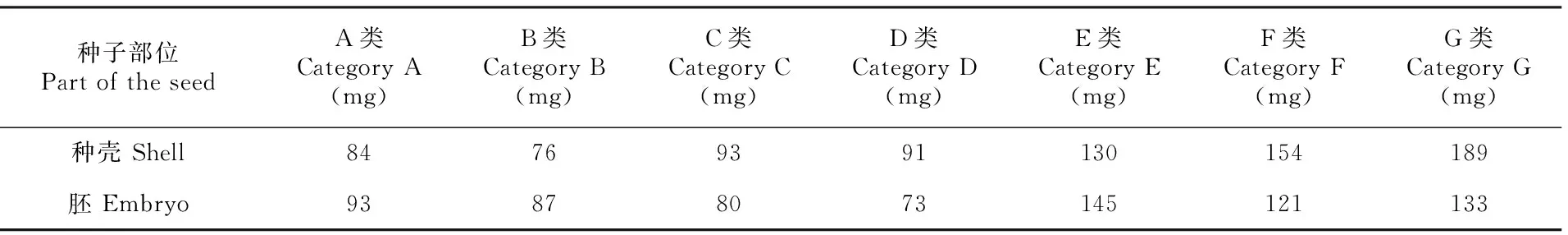
表 1 野鸦椿种子种壳和胚中内源抑制物的分离结果
3讨论与结论
种子萌发是一个复杂的过程,脂肪酶、淀粉酶和蛋白酶,在不同种类的种子萌发过程中扮演重要角色。脂肪在脂肪酶作用下降解为脂肪酸,再经β-氧化过程,转化为蔗糖供胚利用;淀粉在淀粉酶作用下水解为糊精与麦芽糖,再进一步分解为葡萄糖和果糖运送到胚部作为呼吸原料;蛋白质在萌发过程中,经蛋白酶的降解作用生成各种游离氨基酸,以供重组蛋白质利用和脱氢后转化为糖类供胚利用(郑光华,2004)。酶的功能会由于化感物质的存在而受到抑制(Turk & Tawaha,2002),影响种子萌发。
不同类型的种子对内源抑制物质的感受性不同(中山包,1988;唐凤鸾等,2014),选取的白菜、小麦和绿豆种子分别代表了油脂类、淀粉类和蛋白类种子。本研究中,酸性磷酸酶和淀粉酶活性受到显著的抑制作用,蛋白酶随着处理浓度的增加逐渐受到抑制作用。其中酸性磷酸酶活性受胚的浸提液的抑制效果最明显,淀粉酶活性受种壳的抑制作用最强,蛋白酶则在浓度大于20%时才出现被抑制的现象。这表明野鸦椿种子种壳和胚含有的内源抑制物质存在成分差异,且本研究内源抑制物的分离结果也佐证了这一点。
内源抑制物质在休眠性种子中普遍存在,种类繁多,且存在于种子的不同部位,影响种子萌发和幼苗生长。其中,生物碱在低浓度下可促进萌发,在高浓度则表现强抑制作用(Evenari,1949;中山包,1988)。本研究中绿豆的萌发情况、生长状况和内源抑制物的分离结果表明,野鸦椿种子中含有碱性或其他类似物质,且胚中的含量高于种壳中的含量,这与覃嘉佳等(2011)的研究结果一致。阿魏酸是由纤维素酶的作用所产生的酸,会与小麦胚芽鞘的非维管细胞壁的碳水化合物缔合,是一种常见的萌发抑制剂(郑光华 等,1990),本研究从小麦萌发情况、生长状况及内源抑制物的分离结果可推测,野鸦椿种子中含有的酚类物质可能为阿魏酸等类似抑制物质,且种壳中的含量多于胚中的含量,这与黄云等(2014)的研究结果一致。而对白菜种子萌发受到抑制,幼苗生长则受到促进作用的原因可能是在白菜种子发芽时,由于化学变化,抑制物质变成了促进物质所致(中山包,1988)。
在种子休眠和萌发机理研究上,Amen(1968)提出休眠与萌发取决于抑制物资与促进物质的平衡,这一理论在Webb & Wareing(1972)对欧槭种子休眠的研究中得到证实,即胚中的ABA和中性化合物的存在导致种子萌发受到抑制,种子休眠依赖于细胞分裂素和抑制剂的相对水平。野鸦椿种子的休眠机理具有复杂性。游双红等(2013)发现经过层积9月后的圆齿野鸦椿种子的内源抑制物质的活性仍较强,杨燕凌(2008)认为低温沙藏和GA都能显著提高圆齿野鸦椿种子的萌发,这表明通过低温层积,野鸦椿种子的内源抑制物质的含量可能并无显著减少,而主要促进种子萌发的原因是低温促进了胚的生长,同时使促进物质(如GA)增加,从而抑制物质的作用被抵消,萌发开始。本研究从野鸦椿种子中分离出的C类酸性物质可能为ABA类,这与郑彩霞等(1991)的研究结果一致。由此可推测,外源施加促进物质(如GA、CK等)可在一定程度上打破野鸦椿种子的休眠。
野鸦椿种子的内源抑制物质是野鸦椿种子深度休眠的主要原因。首先,野鸦椿种壳和胚中均含有较高活性的内源抑制物物质,且性质存在差异,外壳内源抑制物主要作用对象为淀粉类类物质,胚乳内源抑制物主要作用于油脂类和蛋白类物质;其次,野鸦椿种子内源抑制物种类繁多,其在外壳和胚中存在成分及含量差异,外壳中含酚酸类抑制物较胚多,胚中含碱类抑制物较外壳多,且其成分还需进一步的鉴定。种子萌发是一个复杂的过程,野鸭椿种子萌发除酶活化程度影响外,还受吸胀吸水、呼吸等作用影响,白菜、小麦及绿豆种子的萌发受到野鸦椿种子甲醇浸提液的影响,可能影响种子的吸胀吸水,随着浸提液浓度的增加,测试种子对水的吸收会受到显著的抑制作用(Han et al,2008;Turk & Tawaha,2003);也可能与呼吸作用有关,在大多数情况下,抑制物质会使呼吸发生障碍,如在氰氢酸的作用下,呼吸作用会受到显著的影响(中山包,1988)。因此,在种子萌发的吸水、呼吸等阶段还应研究,以求了解其抑制的机理;且野鸦椿种子的内源抑制物与促进物质的平衡关系也有待进一步探究。
参考文献:
AMEN RD, 1968. A model of seed dormancy[J]. Botanical Review, 34(1):1-31.
CHENG HT,FAN ZW,LI MG, et al, 2012. Probing the cause of the low germination rate ofMerremiaboisianaseed[J]. Guihaia, 32(4):522-526.[程汉亭,范志伟,李鸣光,等, 2012. 金钟藤种子低萌发率原因探讨[J]. 广西植物, 32(4):522-526.]
CHUN-MEI HAN, KAI-WEN PAN,NING WU,et al, 2008. Allelopathic effect of ginger on seedgermination and seedlinggrowth of soybean and chive[J]. Sci Hortic,116(3): 330-336.
DAI P, 2011. Studies on seed germination physiological characteristics and methods to break dormancy of cornus wileoniana wangerin[D]. Nanjing:Nanjing Forestry University. [戴萍, 2011. 光皮树种子萌发的生理特性及破眠技术研究[D]. 南京:南京林业大学.]
FLORA OF CHINA EDITORIAL COMMITTEE OF CHINESE ACADEMY, 1981. Flora of China[M]. Beijing:Science Press,46:23-24. [中国科学院中国植物志编辑委员会, 1981. 中国植物志[M]. 北京: 科学出版社,46:23-24.]
GE YZ, 2004. Resources and utilization ofEuscaphisjaponica[J]. Chin Wild Plant Resour,23(5):24-25. [葛玉珍, 2004. 野鸦椿资源及其利用[J]. 中国野生植物资源,23(5):24-25.]
HILLMAN JR, 1983. Isolation of plant growth substances[M]. Beijing: Science Press:1-7. [J. R. 希尔曼) , 1983. 植物生长物质分离法[M]. 北京: 科学出版社:1-7.]
HUANG Y,XIANG DB, HU QM, et al, 2014. Phenolic acids from fruits ofEuscaphisfukienensis[J]. Chin Trad Herb Drugs(中草药),45(18):2 611-2 613. [黄云,向德标, 胡乔民, 等, 2014. 福建野鸦椿籽中的酚酸类化学成分[J]. 中草药,45(18):2 611-2 613.]
KHAN AA, 1989. The physiological and biochemical of seed dormancy and germination [M]. Beijing: China Agriculture Press, 37-40. [卡恩, 1989. 种子休眠和萌发的生理生化 [M]. 北京: 中国农业出版社, 37-40.]
LI BB,WEI XH,XU Y, 2013. The causes ofGentianastramineaMaxim. seeds dormancy and the methods for its breaking[J]. Acta Ecol Sin, 33(15):4 631-4 638. [李兵兵,魏小红,徐严, 2013. 麻花秦艽种子休眠机理及其破除方法[J]. 生态学报, 33(15):4 631-4 638.]
LI XH, LI CY, JIA W,et al, 2009. Study on the anti-inflammatory and analgesic effects of extract ofEuscaphisjaponica[J]. Lishizhen Med Mat Med Res,20(8):2 041 -2 042. [李先辉, 李春艳, 贾薇,等, 2009. 野鸦椿提取物抗炎镇痛效应的研究[J]. 时珍国医国药,20(8):2 041 -2 042.]
LIU ZF, 2011. Seed science experiment guide[M]. Beijing: Chemical Industry Press: 64-96. [刘子凡, 2011. 种子学实验指南[M]. 北京: 化学工业出版社: 64-96.]
MICHAEL EVENARI, 1949. Germination inhibitors[J]. Bot Rev, 15(3):153-194.
NIAN HH,ZHANG CC,LI XX,et al, 2012. Preliminary study on the activity of endogenesis inhibitory substances of extracts ofTaxusMairei(Lemee et levi. )S. Y. Hu ex liu seeds handled by different treatments[J]. J Zhejiang Univ Trad Chin Med,36(9):1 021-1 024. [年慧慧,张春椿,李效贤,等, 2012. 不同处理方法南方红豆杉种子浸提液内源抑制物活性研究初探[J]. 浙江中医药大学学报,36(9):1 021-1 024.]
QIN JJ,HU B,HUANG YH,et al, 2011. Extraction, separation and biological measurement of growth regulating substance of seeds ofEuscaphiskonishiiHayata [J]. J Anhui Agric Sci,39(32):19 693-19 694. [覃嘉佳,胡滨,黄焱辉,等, 2011. 圆齿野鸦椿种子内含物的提取·分离以及生物测定 [J]. 安徽农业科学,39(32):19 693-19 694.]SONG HX,LIU GL,GAO SP,et al, 2012. Effects of crude extracts ofPaeoniadecompositaseeds on germinationand activities of antioxidant enzyme ofBrassicapekinensis[J]. Acta Hortic Sin,39(2):370-374. [宋会兴,刘光立,高素萍,等, 2012. 四川牡丹种子浸提液内源抑制物活性初探[J]. 园艺学报,39(2):370-374.]
SOUTH CHINA INSTITUTE OF BOTANY, CHINESE ACADEMY OF SCIENCES, 1995. Flora of Guangdong[M]. Guangzhou:Guangdong Science and Technology Press,3:282-283. [中国科学院华南植物研究所, 1995. 广东植物志[M]. 广州:广东科技出版社,3:282-283.]TANG FL,CHEN YY,LI DP, et al, 2011. Allelopathic effects ofEucalyptusgrandis×E.urophllaleaf volatile on seed germination and seedling growth[J]. Guihaia, 34(4):450-454. [唐凤鸾,陈月圆,李典鹏,等, 2011. 巨尾桉叶片挥发物对三种植物种子萌发及幼苗生长的化感效应[J]. 广西植物, 34(4):450-454.]
TURK MA, ABDEL-RAHMAN, TAWAHA M, 2002. Inhibitory effects of aqueous extracts of black mustard on germination and growth of lentil[J]. J Agr,1(1):28-30.
TURK MA, TAWAHA AM, 2003. Allelopathic effect of black mus-tard (BrassicanigraL. ) on germination and growth of wild oat (AvenafatuaL. ) [J]. Crop Prot, 22(4): 673-677.
WANG XK, 2006. The principle and technology of plant physiology and biochemistry experiment [M]. Beijing:Higher Education Press,174-176. [王学奎, 2006. 植物生理生化实验原理和技术 [M]. 北京: 高等教育出版社, 174-176.]
WANG XP,WANG JL, 1998. Extraction, separation and biological measurement of growth regulating substance of seeds ofPinusbungeanaZucc. [J]. Seeds,(5):19-22. [王小平,王九龄, 1998. 白皮松种子内含物的提取、分离及生物测定 [J]. 种子,(5):19-22.]
WEBB DP, WAREING PF, 1972. Seed dormancy inAcer: Endogenous germination inhibitors and dormancy inAcerpseudoplatanusL[J]. Planta (Berl. ),104(2):115-125.
YANG YL, 2008. Research on relieving seed dormancy and study on alternative induction of explant ofEuscaphiskonishiiHayata [D]. Fujian Agric Univ. [杨燕凌, 2008. 打破圆齿野鸦椿种子休眠及外植体选择诱导实验研究 [D]. 福建农业大学.]YOU SH,ZHONG C,TU SP, 2013. Changes of physiologically activity of inhibitor inEuscaphiskonishiiseeds during variable temperature stratification[J]. Nonw For Res,31(3):41-47. [游双红,钟诚,涂淑萍, 2013. 变温层积过程中圆齿野鸦椿种子内含抑制物的生理活性变化[J]. 经济林研究,31(3):41-47.]
ZHENG CX,GAO RF, 1991. The effect of ABA and endogenous inhibitors onFraxinuspennsylvanicaseed dormancy[J]. J Beijing For Univ,13(4):39-46. [郑彩霞,高荣孚, 1991. 脱落酸和内源抑制物对洋白蜡种子休眠的影晌[J]. 北京林业大学学报,13(4):39-46.]
ZHENG GH, 2004. Studies of seed physiology[M]. Beijing: Science Press: 301-322. [郑光华, 2004. 种子生理学研究[M]. 北京: 科学出版社: 301-322.]
ZHENG GH,SHI ZL,ZHAO TF, et al, 1990. Practical seed physiology[M]. Beijing:China Agriculture Press:158-181. [郑光华,史忠礼,赵同芳, 等, 1990. 实用种子生理学[M]. 北京:中国农业出版社:158-181.]ZHONG SB, 1988. Germination physiology[M]. Beijing:China Agriculture Press: 181-196. [中山包, 1988. 发芽生理学[M]. 北京:中国农业出版社: 181-196.]ZUO M,NI ZY,XU L,et al, 2008. Anti-proliferative activity and the mechanisms ofEuscaphisJaponicaKanitzin HeLa cell line. [J]. Carcin Terat Mut, 20(5):350-353. [左敏,倪志宇,许立,等, 2008. 野鸦椿对HeLa细胞的抗增殖作用及其机制的初步研究[J]. 癌变. 畸变. 突变,20(5):350-353.]
(Continueonpage538)(Continuefrompage606)
Preliminary study of endogenous inhibitors activity ofEuscaphisjaponicaseeds
LIAO Yuan-Lin, CAI Shi-Zhen*, LI Xi, LIN Rui
(SchoolofLandscapeArchitecture,SichuanAgriculturalUniversity, Chengdu 611130, China )
Abstract:We studied the substrate enzyme activity, germination rate, seedling root length and seedling height of Brassica pekinensis seeds, Triticum aestivum seeds and Vigna radiate seeds, through the methanol extract the shell and embryo of Euscaphis japonica, with different original extract concentrations of 10%, 20%, 30% and 40% and extracted and separated the endogenous inhibitors in methanol leaching liquid of shell and embryo, the activity and ingredients of endogenous inhibitors in Euscaphis japonicaseeds. The results showed that with the increase of leaching solution concentration, the acid phosphatase activity and germination rate of Brassica pekinensis seeds significantly decreased (P<0.05), the inhibitory effects were showed increasing, and the inhibitory effects of shell were less than that of embryo; the root length and seedling heights promotion in low concentrations and inhibitory in high concentrations, and the maximum at the concentration of 10%, the promotion of shell less than embryo. The amylase activity, germination rate, root length and seedling height of Triticum aestivum seeds decreased gradually(P<0.05), the inhibitory effects were showed increasing gradually, while the germination rate was not significantly different at the concentration less than 20% (P>0.05)and it significantly decreased at 20% concentration(P<0.05), it was 0 at 40% concentration, the inhibitory effects of shell were than that of embryo. The protease activity, germination rate and seedling root length and shoot height of Vigna radiata seeds significantly decreased in the leaching solution concentration higher than 20%(P<0.05), and the effects of shell less than embryo. The results of extraction and separation of endogenous inhibitors showed that there were more phenolic acids and less alkaloids in shell than in embryo. It was concluded that high activating endogenous inhibitors existed in shell and embryo of Euscaphis japonica, which showed differences on properties, composition and content. Endogenous inhibitors in shell were mainly starchy materials, which in embryo mainly affected oil and protein materials.
Key words:Euscaphis japonica, methanol extract, endogenous inhibitor, bioassay
DOI:10.11931/guihaia.gxzw201408031
收稿日期:2014-08-25录用日期: 2014-12-01
基金项目:国家“十二五”科技支撑计划项目(2011BAC09B05);四川省科技支撑计划项目(2012ZA0116)[Supported by the National Technology R & D Program during the 12th Five-Year Period(2011BAC09B05); Technology R & D Program of Sichuan Province(2012ZA0116)]。
作者简介:廖源林(1989-),女,四川资阳人,在读硕士研究生,研究方向为野生观赏花木驯化与培育,(E-mail)1063734909@qq.com。*通讯作者: 蔡仕珍,硕士,高级实验师,研究方向为野生观赏花木驯化与培育,(E-mail)415455088@qq.com。
中图分类号:Q945.34, S686
文献标识码:A
文章编号:1000-3142(2016)05-0600-07
廖源林,蔡仕珍,李西,等. 野鸦椿种子内源抑制物活性初探[J]. 广西植物, 2016, 36(5):600-606
LIAO YL,CAI SZ,LI X,et al. Preliminary study of endogenous inhibitors activity ofEuscaphisjaponicaseeds [J]. Guihaia, 2016, 36(5):600-606
