重组枯草芽孢杆菌发酵产青霉素G酰化酶的条件优化
2016-06-16吴卓颖邵威平张永玲杨富民田常庆
吴卓颖,邵威平,张永玲,杨富民,田常庆
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.临夏州人民医院,甘肃 临夏 731100;3.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
重组枯草芽孢杆菌发酵产青霉素G酰化酶的条件优化
吴卓颖1,邵威平1,张永玲2,杨富民1,田常庆3
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州730070;2.临夏州人民医院,甘肃 临夏731100;3.甘肃农业大学生命科学技术学院,甘肃 兰州730070)
摘要:【目的】研究提高PGA酶活力及稳定性.【方法】 以重组枯草芽孢杆菌10397(pMA5-PGA)产PGA酶活力为研究对象,在单因素试验基础上,采用响应面设计,对重组菌发酵产PGA的培养基及发酵条件进行了研究.【结果】 以葡萄糖20.39 g/L、胰蛋白胨15.48 g/L、糊精6.1 g/L为培养基,在三角瓶装液量16.23%、接种量4.32%、温度35.43 ℃、时间48.34 h、摇床转速220 r/min的条件下,所产PGA的酶活力为14.167 U/mL,比初始发酵条件下发酵重组菌产PGA的酶活提高了1.14倍.【结论】 通过条件优化,可提高重组枯草芽孢杆菌PGA的酶活力,并为工业化生产PGA提供科学依据.
关键词:重组枯草芽孢杆菌;发酵;青霉素G酰化酶;工艺优化
青霉素G酰化酶(Penicillin G Acylase,简称PGA)是一种重要的工业用酶,不仅可以催化青霉素水解生产6-APA和7-ADCA,还能催化6-APA、7-ADCA与侧链化合物缩合生成各种高效的半合成类抗生素[1-2].并且,作为关键的生物催化剂,PGA在许多具有潜在价值的反应中也发挥着重要作用[3].
目前关于PGA的研究,在分离提纯、PGA菌种筛选、构建重组工程菌等方面已经取得了一定进展,但对产酶菌种的最适发酵条件、产酶活性与稳定性、工程菌的高效表达等有待进一步提高,以便为工业化生产提供技术支持[4-5].戴易兴等[6]对重组巨大芽孢杆菌产PGA发酵条件作了研究,并利用响应面法优化了培养基配方和培养条件,与初始条件相比将PGA的酶活力提高了85%.杨海波等[7]对产PGA重组菌的发酵条件进行了研究,发现在温度22 ℃、摇床转速180 r/min、装液量60%、发酵时间96 h的培养条件下,酶活力可达到94 U/100mL.梁鹏飞等[8]对重组PGA的培养条件作了相关研究,发现培养基中不添加任何诱导剂的情况下,将重组菌在28 ℃下培养40 h时,PGA酶活性最大,可达1.4 U/L.黄鹤等[9]构建了基因工程枯草芽孢杆菌菌株,它能分泌表达巨大芽孢杆菌PGA,还对其表达条件进行了研究,结果显示PGA的表达量由3~6 U/mL提高至35~40 U/mL,是目前生产用巨大芽孢杆菌表达量的6倍.Lin Y H等[10]利用重组枯草芽孢杆菌表达大肠杆菌PGA的绝对酶活力已经达到37.500 U/L等.
为提高重组菌发酵产PGA的最佳发酵工艺条件,本试验以重组枯草芽孢杆菌10397(pMA5-PGA)产PGA酶活力为研究对象,在单因素试验的基础上,采用响应面设计,对重组菌发酵产PGA的培养基成分与发酵条件进行了研究,旨在提高PGA酶活力及稳定性,更为工业化生产PGA提供技术支持.
1材料与方法
1.1试验材料
重组菌株枯草芽孢杆菌10397(pMA5-PGA),由甘肃农业大学食品科学与工程学院实验室保存;胰蛋白胨、蛋白胨、牛肉膏、琼脂、MnSO4·H2O、MgCl2·6H2O、葡萄糖、糊精、蔗糖等购于试剂公司,均为分析纯或生化试剂.
1.2试验仪器
试验所用主要仪器为:高压蒸汽灭菌锅、超净工作台、电子天平、pH计、恒温水浴锅、离心机、分光光度计、恒温震荡摇床.
1.3试验方法
1.3.1斜面培养基蛋白胨5 g、牛肉膏3 g、氯化钠5 g、琼脂15 g、MnSO4·H2O 5 mg、蒸馏水1 000 mL,121 ℃灭菌20 min,调pH值至7.0.
1.3.2发酵培养基优化
1.3.2.1最佳碳源的确定取5个250 mL摇瓶,分别加入10 g/L的麦芽糖、蔗糖、葡萄糖、糊精、果糖作为碳源,在蛋白胨10 g/L、糊精2 g/L的基础上,补充其他营养物质;按重组菌1%的接种量接种到含上述营养物质的120 mL液体培养基中,恒温震荡摇床发酵36 h,发酵完成后,参照Balasingham K等[11]的方法测定酶活,测定PGA酶活力,确定最佳碳源.
1.3.2.2最佳碳源质量浓度的确定取5个摇瓶,以步骤(1)确定的最佳碳源作为发酵培养基的碳源,分别按照10、15、20、25、30 g/L加入碳源,再以蛋白胨10 g/L、糊精2 g/L为基础,补充其他营养物质,后续操作同步骤(1),测定PGA酶活力,确定最佳碳源质量浓度.
1.3.2.3最佳氮源的确定取5个摇瓶,根据步骤(1)所得最佳碳源及步骤(2)所得最佳碳源质量浓度向培养基中加入碳源,以糊精2 g/L为基础,分别加入10 g/L的蛋白胨、胰蛋白胨、硫酸铵、酸水解酪蛋白、硝酸铵作为氮源,补充其他基础营养物质,后续操作同步骤(1),测定PGA酶活力,确定最佳氮源.
1.3.2.4最佳氮源质量浓度的确定取5个摇瓶,根据上述步骤确定的最佳碳源及质量浓度与最佳氮源,向培养基中添加适宜的碳源、氮源,再以糊精2 g/L为基础,分别按照5、10、15、20、25 g/L加入该氮源,补充其他营养物质,后续操作同步骤(1),测定PGA酶活力,确定最佳氮源质量浓度.
1.3.2.5最佳糊精质量浓度的确定取5个250 mL摇瓶,根据上述步骤确定的最佳碳源质量浓度与最佳氮源质量浓度,分别按照2、4、6、8、10 g/L质量浓度向摇瓶中加入糊精,补充其他营养物质,后续操作同步骤(1),测定PGA酶活力,确定最佳糊精质量浓度.
1.3.2.6响应面设计依据单因素试验结果,选择葡萄糖质量浓度(g/L)、胰蛋白胨质量浓度(g/L)、糊精质量浓度(g/L)3个因素作为自变量,采用Box-Behnken设计方法,以酶活力为响应值,对重组菌产PGA培养基进行优化.
1.3.3发酵条件优化
1.3.3.1单因素试验参考徐志南等[5]的方法,以接种量6%、温度30 ℃、装液量12%、发酵时间36 h、摇床转速220 r/min为基础,固定其他条件,设置温度25、30、35、40、45 ℃,接种量2%、4%、6%、8%、10%,装液量8%、12%、16%、20%、24%,发酵时间12、24、36、48、72 h,重复3次,以酶活力为指标,进行单因素对比试验.
1.3.3.2响应面设计依据单因素试验结果,选择温度(℃)、发酵时间(h)、装液量(%)、接种量(%)4个因素作为自变量,按照Box-Behnken设计方法,以酶活力为响应值,进行四因素五水平响应面试验,对重组菌产PGA的发酵条件进行优化.
1.3.4对照组试验取葡萄糖10 g/L,蛋白胨10 g/L,糊精6 g/L,补充其他营养物质,作为发酵培养基;在接种量6%、温度30 ℃、装液量12%、发酵时间36 h、摇床转速220 r/min的条件下发酵重组菌株,重复进行3次,测其PGA酶活.
1.3.5青霉素G酰化酶产量及活力测定酶活力测定:参考Balasingham K等[11]的方法,6-氨基青霉烷酸显色标准曲线制作及酶活力测定具体方法如下:准确称取6-氨基青霉烷酸50.0 mg,置于50 mL容量瓶中,用0.05 mol/L、pH7.5的磷酸盐缓冲液溶解并定容至刻度;用0.05 mol/L、pH7.5的磷酸盐缓冲液配置20 mg/mL的青霉素G钾盐溶液,37 ℃预热10 min;按表1将各成分加入到1.5 mL离心管中;37 ℃水浴中反应30 min;反应液于13 000 r/min离心1 min,吸取上清液1 mL加入各试管中,试管中预先加入3 mL终止液(20%乙酸与0.05 mol/LNaOH溶液2∶1体积混合),加入0.5 mL显色液(0.5%对二甲氨基苯甲醛的甲醇溶液);用0号管调零点,在415 nm波长处,测出1~6号管的光密度值.以光密度值为纵坐标,6-APA质量浓度(mg/mL)为横坐标,绘制6-APA标准曲线.

表1 标准曲线制作的试剂添加量
酶活力测定步骤:取1 mL菌液,13 000 r/min离心1 min,弃上清液,用1 mL 0.05 mol/L、pH7.5的磷酸盐缓冲液(PBS)重悬,取50~500 μL重悬菌液,补加0.05 mol/L磷酸盐缓冲液(pH7.5)至体积为500 μL;重悬菌液中加入600 μL 37 ℃预热10 min的底物(用0.05 mol/LpH7.5的磷酸盐缓冲液配20 mg/mL青霉素G钾盐溶液);37 ℃水浴反应30 min;反应液于13 000 r/min离心1 min,吸取上清液1 mL加入各试管中,试管中预先加入3 mL终止液(20%乙酸与0.05 mol/L NaOH溶液2∶1体积混合),加入0.5 mL显色液(0.5%对二甲氨基苯甲醛的甲醇溶液);静置15 min,在415 nm波长处测定光吸收值.
酶活力计算公式:
Activity(U/L)= 106xC6-APAxV反/M6-APAxtxV菌
式中:M6-APA:6-氨基青霉烷酸分子量,为216;t:反应时间,通常为30 min;V菌:参与反应的菌液体积,mL;V反:反应体系体积,mL;C6-APA:6-氨基青霉烷酸的质量浓度,g/L.
2结果与分析
2.1标准曲线绘制
6-氨基青霉烷酸标准曲线见图1.线性回归方程为y=0.582 9x+0.006 2,R2=0.998 9,表明线性关系较好.在测定酶活力时,将测定的吸光值代入上述回归方程求出6-氨基青霉烷酸浓度,再依据酶活力定义计算酶活力大小.
2.2.1单因素试验
2.2.1.1不同碳源对PGA酶活力的影响由图2可以看出,当以葡萄糖作为培养基碳源时重组枯草芽孢杆菌产PGA酶活达到最高,为12.967 U/mL,与其他水平有显著性差异(P<0.05);而以麦芽糖作为发酵培养基的碳源时,PGA酶活力最低,为6.596 U/mL;可能是由于重组枯草芽孢杆菌比较容易代谢单糖,从而使PGA酶活达到最高.
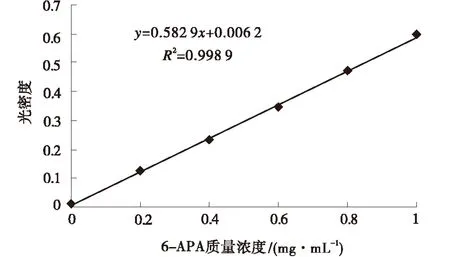
图1 6-氨基青霉烷酸标准曲线Fig.1 6-APA standard curve

图2 不同碳源对PGA酶活力的影响Fig.2 Effect of different carbon sources on the PGA activity
2.2.1.2葡萄糖质量浓度对PGA酶活力的影响由图3可以看出,随着PGA酶活力增大葡萄糖质量浓度先升高,到达一定值时有所降低,直至保持平稳状态的规律.即当葡萄糖质量浓度达到20 g/L时,PGA的酶活达到最高13.038 U/mL,并与其他水平有显著性差异(P<0.05);当葡萄糖质量浓度为10~20 g/L时,PGA的酶活迅速增高;但当进一步加大葡萄糖质量浓度时,PGA酶活有轻微下降趋势.故最适宜葡萄糖质量浓度为20 g/L.
2.2.1.3不同氮源对PGA酶活力的影响如图4所示,在使用有机氮源的培养液中PGA酶活明显高于使用无机氮源的培养液;且当以胰蛋白胨为氮源时,PGA酶活力最高,为12.808 U/mL,与其他水平有显著性差异(P<0.05);以无机氮源硝酸铵作为氮源时,发酵液中的PGA酶活才达到9.94 U/mL.
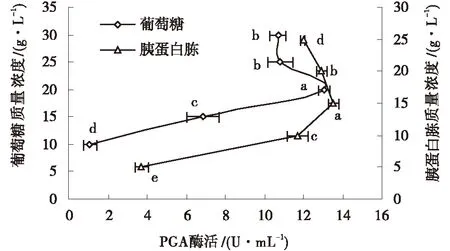
图3 葡萄糖和胰蛋白胨浓度对PGA酶活力的影响Fig.3 Effect of different glucose and tryptone concentrationon on the PGA activity

图4 不同氮源对PGA酶活力的影响Fig.4 Effect of different nitrogen sources on the PGA activity
2.2.1.4胰蛋白胨质量浓度对重组菌产PGA的酶活力的影响由图3可以看出,当培养基中胰蛋白胨质量浓度为15 g/L时,PGA的酶活力最高,达到13.532 U/mL,与其他水平有显著性差异(P<0.05).而当胰蛋白胨质量浓度在10~20 g/L时,PGA酶活随着胰蛋白胨质量浓度的升高而迅速升高.进一步增加胰蛋白胨质量浓度时,PGA表达则缓慢下降.
2.2.1.5糊精质量浓度对重组菌产PGA酶活力的影响由图5可以看出,当糊精质量浓度为2~6 g/L,随着糊精质量浓度的增加,PGA酶活力缓慢上升;当糊精质量浓度为6 g/L时,PGA的酶活达到最高,为14.538 U/mL,与其他水平有显著性差异(P<0.05);当糊精质量浓度达到6~10 g/L时,酶活力则迅速降低.故培养基适宜的糊精质量浓度为6 g/L.
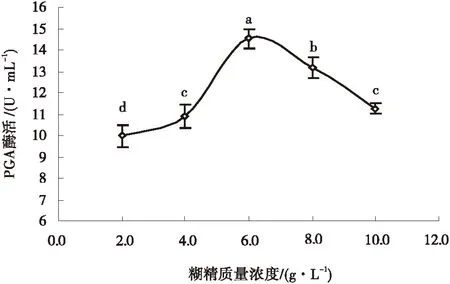
图5 糊精质量浓度对PGA酶活力的影响Fig.5 Effect of strach concentration on the PGA activity
2.2.2响应面试验响应面试验结果见表2、3、4.
试验结果采用Design-Expert Trial软件的ANOVA程序,进行二次回归分析,得到酶活力的变化对A(葡萄糖质量浓度)、B(胰蛋白胨质量浓度)、C(糊精质量浓度)的标准回归方程为:
酶活=14.25+0.26A+0.33B+0.25C-0.16AB-0.44AC-0.32BC-0.51A2-0.58B2-0.83C2

表2 Box-Behnken试验设计及结果

表3 ANOVA分析结果
**极显著水平(P<0.01);*显著水平(P<0.05);ns不显著.

表4 方差分析表
如表3、4所示,二次响应面回归模型的P=0.000 9,R2=0.950 0,RADJ=0.885 8,该模型能解释95%响应值的变化,且该模型拟合程度较好,试验误差小.从模型的方差分析可以看出,失拟项(P=0.942 0>0.05)差异不显著,说明该模型较稳定.
葡萄糖与胰蛋白胨之间的交互作用对重组菌产PGA酶活力的影响如图6所示,葡萄糖和胰蛋白胨用量对PGA均有一定影响.当糊精质量浓度固定时,PGA的酶活力随着葡萄糖和胰蛋白胨用量的增加,呈明显的上升趋势.随着葡萄糖质量浓度的继续增加,酶活力的上升趋势变的较为平缓,即影响较小;但随着胰蛋白胨质量浓度的持续增加,酶活力呈明显的上升趋势,即影响较显著.
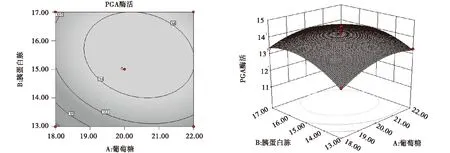
图6 葡萄糖与胰蛋白胨交互作用对PGA酶活力的影响Fig.6 Effect of interaction between glucose and tryptone on the PGA activity
从图7可以得出,葡萄糖质量浓度与糊精质量浓度对PGA的酶活力均有相当大的影响.研究表明,当固定作为氮源的胰蛋白胨质量浓度时,随着糊精质量浓度的增加,PGA的酶活力呈现先上升后下降的趋势;而随着葡萄糖质量浓度的不断增大,与糊精相比,酶活力呈现的先上升后下降的趋势较为平缓.
由图8可以看出,胰蛋白胨质量浓度与糊精质量浓度对PGA的酶活力均有较显著的影响,而且两个因素之间也存在着很明显的交互作用;研究表明,这二者对PGA酶活力的增加产生相互促进作用.
通过对重组菌产PGA的二次多项数学模型解逆矩阵,重组枯草芽孢杆菌发酵产PGA的最佳培养基配方为:葡萄糖20.39 g/L,胰蛋白胨15.48 g/L,糊精6.1 g/L,并得到在上述发酵培养基条件下,PGA酶活力的预测值为14.322 U/mL.
为了检验上述模型预测的准确性,用最优培养基做了三次平行试验,其酶活力平均值可达到14.167 U/mL.说明该模型较理想.
2.3重组枯草芽孢杆菌产PGA的发酵条件优化
2.3.1单因素试验
2.3.1.1发酵时间发酵时间对重组菌产PGA酶活力的影响见图9A.

图7 葡萄糖与糊精交互作用对PGA酶活力的影响Fig.7 Effect of interaction between glucose and starch on the activity of PGA

图8 糊精与胰蛋白胨交互作用对PGA酶活力的影响Fig.8 Effect of interaction between tryptone and glucose on the PGA activity
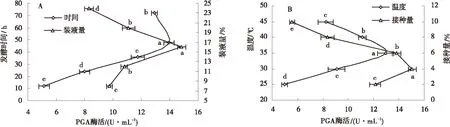
图9 各因素对青霉素G酰化酶活力的影响Fig.9 Effect of different factors on the PGA activity
随着发酵时间的逐渐增加,PGA酶活力迅速升高.当发酵时间到达48 h时,PGA的酶活力达到最高,为13.947 U/mL,与其他水平有显著性差异(P<0.05).随着发酵时间的进一步增加,PGA酶活力缓慢下降.所以,重组枯草芽孢杆菌产PGA的最适宜发酵时间是48 h.
2.3.1.2装液量由图9A可以看出,随着发酵装液量的逐渐增加,PGA的酶活力也在逐渐增强;当发酵装液量为16%时,PGA的活力最高,达到14.838 U/mL,与其他水平有显著性差异(P<0.05);随着发酵装液量的进一步增加,PGA酶活力有所下降.所以,重组枯草芽孢杆菌产PGA的最适宜发酵装液量是16%.
2.3.1.3温度由图9B可知,在一定温度范围内,重组菌产PGA的酶活力随着发酵温度的升高而迅速升高;而当温度达到35 ℃时,PGA的酶活力达到最高,为12.967 U/mL,与其他水平有显著性差异(P<0.05);随着发酵温度的进一步升高,PG的活力缓慢下降.故重组枯草芽孢杆菌产PGA的最适宜的发酵温度为35 ℃.
2.3.1.4接种量由图9B得出,随着发酵接种量的增加,PGA的活力迅速增大.当发酵接种量达到4%时,PGA的活力最高,达到15.05 U/mL,与其他水平有显著性差异(P<0.05).但是随着发酵接种量的持续增大,酶活力呈现缓慢下降趋势.结果表明:重组枯草芽孢杆菌产PGA的发酵最适谊的接种量为4%.
2.3.2响应面试验响应面试验结果见表5、6、7.
试验结果采用Design-Expert Trial软件的ANOVA程序,进行二次回归分析,得到酶活力变化对A(温度)、B(时间)、C(接种量)、D(装液量)的标准回归方程为:
酶活力=14.40+0.40A+0.19B+0.25C+0.34D+0.055AB-0.17AC-0.11AD+0.30BC-0.32BD-0.56CD-0.85A2-0.63B2-0.62C2-0.73D2
表5 响应面试验结果

表6 ANOVA分析结果
**极显著水平(P<0.01);*显著水平(P<0.05);ns不显著.

表7 方差分析表
由表6和7的方差分析可知,P<0.000 1说明所得回归方程极显著.由F值可知,4个因素的影响顺序依次是A>D>C>B.失拟检验P=0.659 2>0.05不显著,说明此回归模型比较理想,可信度较高.模型校正系数R2为0.932 9>0.9,说明该模型能解释93.29%的试验结果.模型精密度为12.412>4,说明试验精度很高.综合以上分析得知,该模型能准确地模拟温度、时间、接种量、装液量4个因素对PGA酶活力的影响,模型与实际情况拟合较好.
在模型中,四因素之间交互作用对重组枯草芽孢杆菌产PGA的影响如图10所示.
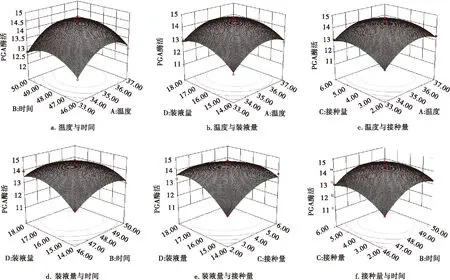
图10 四因素之间交互作用对PGA酶活力的影响Fig.10 Effect of four-factors interaction on the PGA activity
由图10a可以看出,重组菌产PGA的酶活力随着温度的升高、发酵时间的延长,呈现先上升后下降的变化趋势.图10b表明,在发酵液中装液量较少的情况下,PGA的酶活力随着发酵温度的逐渐升高呈现先上升后下降的趋势,但下降幅度并不大.如图10c所示,PGA酶活力随着温度与发酵接种量的增加,呈现先上升后下降的趋势;研究发现,当发酵温度固定在一定的范围内时,接种量对PGA活性的影响并不显著.从图10d可以看出,发酵时间与装液量之间的交互作用比较显著.图10e表明,当发酵装液量处于较低水平时,酶活力随着发酵接种量的增大先上升后下降.图10f显示,当发酵接种量较低时,酶活力随时间的延长先上升后下降,但趋势线比较平滑,说明装液量与发酵时间之间的交互作用不显著.
通过对PGA的二次多项数学模型解逆矩阵,发现重组菌产PGA的最佳发酵条件为:发酵温度35.37 ℃,装液量16.12%,时间48.5 h,接种量4.44%,得到在该工艺条件下,酶活力的预测值可到达14.537 U/mL.
为验证上述模型预测的准确性,采用最佳条件进行3次重复试验,酶活力平均值可达到13.97 U/mL.所以,证明该模型较理想.
3讨论
3.1发酵培养基对重组枯草芽孢杆菌产PGA的影响
培养基中的碳源及碳源质量浓度与氮源及氮源质量浓度对微生物发酵是一个非常关键的影响因素.本研究确定的培养基碳源为葡萄糖且适宜质量浓度为20 g/L,这与范超等[1]研究的结果基本一致,葡萄糖质量浓度在20 g/L时,PGA的酶活达到最大,超过或低于该水平时,PGA酶活都呈下降趋势;这可能是因为添加高质量浓度的葡萄糖会形成高渗的培养基从而降低发酵过程中杂菌污染的机率.但是,培养基中的葡萄糖质量浓度过高又可能会产生葡萄糖效应从而抑制了PGA的表达而导致PGA的酶活力下降.研究确定的培养基氮源为胰蛋白胨且适宜质量浓度为15 g/L,而仇晶晶[12]研究的最适氮源为蛋白胨,这可能是因为试验条件及原料的不同造成的.研究发现,当胰蛋白胨的质量浓度高于15 g/L增加时,PGA的产量呈下降趋势,这可能是因为胰蛋白胨除了用以提供有机氮外,还包含有大量菌体所必需的生长因子;所以,在过高胰蛋白胨质量浓度下,可能会导致菌体的生长过于旺盛而不适宜菌体的发酵产酶.
3.2发酵条件对重组枯草芽孢杆菌产PGA的影响
确定最适的发酵周期,对提高重组菌产酶量和较好的经济效益都是非常重要的.本研究确定的最佳发酵时间为48 h及最适发酵温度为35 ℃,这分别与范超等[1]和仇晶晶[12]的研究结果保持一致.研究发现,随着发酵时间的延长,PGA的酶活缓慢下降,这是因为发酵时间的增加会使一些其他代谢产物积累,对PGA的分离纯化造成一定影响,同时也不利于工业化大规模生产,甚至造成大量浪费.而对于发酵温度低于35 ℃时,使菌体的生长代谢缓慢,从而导致PGA的产量降低;而当温度高于40 ℃时,使酶的合成受阻,重组菌提前进入衰老期而导致菌体自溶速度加快,致使PGA产量降低.
本研究确定的最适接种量为4%及最适装液量为16%.研究发现,随着发酵装液量的持续增加,酶活力则逐渐下降;而且过高的装液量会导致酶活力的下降,这可能是因为供氧气不充足造成的.对于发酵接种量的研究发现,如果接种量过大,会使菌体迅速生长,代谢产物积累过多,使发酵液中的营养物质消耗加快,抑制菌体的后期生长;不但影响PGA的产酶量,更不利于工业生产.但是,如果接种量过少,则会延长菌体延迟期、容易污染,增加了遗传变异的机会,不利于外源基因的表达,从而导致产量降低,造成浪费增加生产成本.
在上述优选的培养基及发酵条件下,PGA的酶活为14.167 U/mL,比初始发酵条件下发酵重组菌产PGA的酶活提高了1.14倍.比2013年颜丽等[13]通过巨大芽孢杆菌产PGA的酶活提高了将近6倍.
4结论
1)重组枯草芽孢杆菌发酵产PGA的最佳培养基为:葡萄糖20.39 g/L,胰蛋白胨15.48 g/L,糊精6.1 g/L;并在该培养基条件下,PGA酶活力可达到14.321 6 U/mL.
2)重组枯草芽孢杆菌发酵产PGA的最优发酵条件为:温度35.37 ℃,装液量16.12%,时间48.5 h,接种量4.44%;并在该条件下发酵可知,PGA的酶活力达到13.97 U/mL.
3)在上述优选的培养基及发酵条件下,PGA的酶活可达到14.167 U/mL,比初始发酵条件下发酵重组菌产PGA的酶活提高了1.14倍.
参考文献
[1]范超,黎继烈,吴浩,等.重组巨大芽孢杆菌产青霉素G酰化酶发酵条件的研究[J].中南林业科技大学学报,2011,31(7):124-129
[2]Thomas R M,Barends H Y,Bauke W D.Three-dimensional structures of enzymes useful for P-lactam antibiotic production[J].Current Opinion in Biotechnology,2004,15:356-363
[3]徐威,周丽娜,郭晓艳.胞外青霉素酰化酶产生菌的筛选及产酶条件[J].沈阳药科大学学报,2007,14(4):269-272
[4]崔鹏,万敏.霉素酰化酶的生产与应用新进展[J].化学工业与工程技术,2005,26(6):42-45
[5]徐志南,陈秀奇,陈新爱,等.重组枯草芽抱杆菌生产青霉素G酰化酶发酵条件的研究[J].高效化学工程学报,2003,17(3):266-271
[6]戴易兴.基因工程菌产PGA发酵条件的研究[D].无锡:江南大学,2012
[7]杨海波,虞星炬,曲大明,等.含青霉素酰化酶的重组大肠杆菌的发酵培养[J].化学反应工程与工艺,2006,15(3):333-336
[8]梁鹏飞.重组青霉素G酰化酶在大肠杆菌中的重组型表达及其固定化[D].北京:北京化工大学,2008
[9]黄鹤,杨晨,李仁宝,等.重组青霉素G酰化酶在枯草芽抱杆菌中的表达条件优化[J].中国生物化学与分子生物学报,2001,17(2):173-177
[10]Lin Y H,Hsiao H C,Chou C P.Strain improvement to enhance the production of recombinant penicillin acylase in high-cell-density[J].Escherichia colicultures Biotechnology,2002,18(6):1458-1461
[11]Balasingham K,Wathurton D,Dunnili P,et al.The isolation and kincties ofPenicillinAmidasefromEscherichiacoli[J].Biochemical and Biophysical,1972,276:250-256
[12]仇晶晶.响应面法优化重组枯草芽孢杆菌发酵生产青霉素G酰化酶[D].杭州:浙江理工大学,2012
[13]颜丽,张永玲,杨富民,等.巨大芽孢杆菌产青霉素G酰化酶的条件优化[J].甘肃农业大学学报,2013,48(6):140-148
(责任编辑赵晓倩)
Optimization of fermentation for Penicillin G acylase with recombinantBacillusmegaterium
WU Zhuo-ying1,SHAO Wei-ping1,ZHANG Yong-ling2,YANG Fu-min1,TIAN Chang-qing3
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Linxia First People's Hospital,Linxia 731100,China;3.College of Life Science and Technology,Gansu Agricultural University,Lanzhou 730070,China)
Abstract:【Objective】This paper was aimed at improving the activity and stability of Penicillin G acylase.【Method】It was focused on PGA activities of recombinant Bacillus megaterium(10937),the medium and fermentation conditions for Penicillin G acylase production with recombinant Bacillus megaterium were studied basing on single factor test by response surface method.【Result】 The medium should contain glucose 20.39 g/L,tryptone 15.48 g/L,starch 6.1 g/L and the fermentation conditions were determined as volume of liquid 16.23%,the amount of inoculation 4.32%,temperature 35.4 ℃,fermentation time 48.34 h,shaking speed 220 r/min.The activity of Penicillin G acylase reached 14.167 U/mL and increased 1.14 times more than that under initial conditions.【Conclusion】With the optimization of conditions,the activity of PGA from recombinant Bacillus megaterium (10937) can be improved and provide important basis for industrialized production.
Key words:Bacillus megaterium;fermentation ;penicillin G Acylase;process optimization
通信作者:邵威平,男,副教授,硕士生导师,主要从事发酵工程研究.E-mail:shaowp99@163.com
基金项目:甘肃省科技重大专项(1102NKDN058).
收稿日期:2015-02-24;修回日期:2015-04-07
中图分类号:Q 814
文献标志码:A
文章编号:1003-4315(2016)02-0116-11
第一作者:吴卓颖(1988-),女,硕士研究生,研究方向为食品科学.E-mail:wuzy20126@163.com
