产纤维素酶真菌菌株的分离筛选及产酶条件优化
2016-06-16魏姣万学瑞吴润畅通马亚茹刘磊张小丽张天亮杨润霞贾晓蕊
魏姣,万学瑞,吴润,畅通,马亚茹,刘磊,张小丽,张天亮,杨润霞,贾晓蕊
(甘肃农业大学动物医学院,甘肃 兰州 730070)
产纤维素酶真菌菌株的分离筛选及产酶条件优化
魏姣,万学瑞,吴润,畅通,马亚茹,刘磊,张小丽,张天亮,杨润霞,贾晓蕊
(甘肃农业大学动物医学院,甘肃 兰州730070)
摘要:【目的】 由于真菌的纤维素酶系较全,且可分泌至胞外,易分离,所以试验致力于筛选高产纤维素酶真菌菌株.【方法】 利用羧甲基纤维素钠培养法、刚果红染色法、纤维素酶活性测定法从样品中分离筛选出产纤维素酶菌株,同时结合菌落形态观察、显微镜观察和ITS序列同源性分析进行鉴定.【结果】 通过初筛,筛选出15株Hc值较大的产纤维素酶真菌菌株,再经过液体发酵复测羧甲基纤维素酶活和滤纸酶活,筛选出一株产纤维素酶活最高的菌株B-2-3,经鉴定B-2-3为烟曲霉(Aspergillus fumigatus),其羧甲基纤维素酶活为2 341.76 U/mL,滤纸酶活为398.18 U/mL.经过产酶条件优化,确定其最适产酶条件为温度25 ℃、接种量4 μL、蛋白胨0.5~0.6 g/L、CMC-Na 0.3~0.35 g/L、pH 6.5.【结论】 筛选出一株产纤维素酶活较高的烟曲霉菌株B-2-3.
关键词:纤维素酶;筛选;鉴定;烟曲霉
能源短缺、粮食匮乏以及环境污染等许多与人类生存息息相关的问题逐渐成为国内外关注的焦点,为保证人类社会的安定繁荣,促进可持续发展,通过新的途径寻求可替代资源以缓解能源和环境等问题已刻不容缓[1].纤维素是木质纤维中含量最高的组分,也是全球最大的可再生有机物资源[2],我国是一个农业大国,纤维素资源更是取之不尽,然而纤维素本身结构复杂、难以分解,这给纤维素的利用带来了极大地阻碍.高活力的纤维素酶可以很好地将纤维素分解为可溶性的单分子葡萄糖,可作为动物饲料添加剂,或进一步通过各种途径转化成可被人类利用的生物燃料乙醇并逐渐代替化石燃料.目前,世界各国虽已筛选分离出一定数量的产纤维素酶菌株,并被广泛用于食品、饲料、制药、纺织品、衣物、纸浆和造纸工业[3],但高产纤维素酶菌株较少、酶活较低等因素极大限制了纤维素工业化利用的发展,造成资源浪费.因此,选育高产纤维素酶菌种是关键所在[4-6],进一步对其产酶条件进行合理优化,探究产纤维素酶的最佳条件以用于工业化生产具有极大的现实意义.
纤维素酶是可降解纤维素的一类复杂酶系的总称,自然界中很多真菌都能分泌纤维素酶.由于真菌的纤维素酶系较全,且可分泌至胞外,易分离,因此本研究着重从自然界中分离筛选高产纤维素酶真菌菌株,探索选育纤维素酶高产真菌的有效途径,对筛选出的高产菌株进行形态学初步鉴定与分子生物学鉴定以确定其种属,并通过单因素试验与正交试验进一步优化产酶条件,为将来更有效地利用产酶菌株,筛选表达优良纤维素酶基因以及构建高酶活工程菌奠定基础.
1材料与方法
1.1试验材料
1.1.1试验样品纤维素分解菌分离材料采自兰州市安宁区黄家滩附近的腐败植物、秸秆、碎木屑及牛羊粪、枯枝落叶、土壤等共35份.
1.1.2培养基羧甲基纤维素钠培养基、复筛产酶培养基及马铃薯斜面培养基、马铃薯液体培养基、真菌增值培养基,按文献[7]所述配制.
1.1.3试剂及药品羧甲基纤维素钠(CMC-Na)、碳酸钙(CaCO3)、碳酸钠(Na2CO3)、氯化铵(NH4Cl)、硝酸铵(NH4NO3)、硫酸铵[(NH4)2SO4]、尿素、琼脂糖、葡萄糖、三氯甲烷、氯仿、异戊醇、异丙醇、RNaseA、无水乙醇、柠檬酸、柠檬酸钠等为国产分析纯试剂;酵母提取物(Yeast extract)、胰蛋白胨(Tryptone)、琼脂粉(Agar)均为OXOID公司产品;真菌DNA提取试剂盒、DNA DL2000 Marker、2×PCR Master Mix、IPTG(异丙基硫代-β-半乳糖苷)、X-gal(5-溴-4-氯-3吲哚-β-D-半乳糖苷)、氨苄青霉素(Amp)购自上海Invitrogen公司.
1.2试验方法
1.2.1产纤维素酶菌株分离与初筛参照文献[7-8]进行产纤维素酶菌株的分离筛选,挑选羧甲基纤维素钠培养基平板上水解圈与菌落直径比值(Hc)较大者作为纤维素酶产生菌初选菌株.操作流程:采样→富集培养→划线分离→CMC刚果红平板初筛→初选目的菌株.
1.2.1.1样品处理准确称取样品25 g,加入到一个盛有225 mL无菌生理盐水带有玻璃珠的三角瓶中,将样品充分打散混匀,于37 ℃恒温摇床摇动2 d备用.
1.2.1.2菌株分离和初筛①用无菌生理盐水稀释样品溶液,取10-1、10-2、10-33个稀释度.②将配制好的羧甲基纤维素钠培养基灭菌后乘热倒入平皿中,培养基厚度约0.5 cm放至培养基冷却凝固.③取稀释度为10-2和10-3的样液0.1 mL涂布到羧甲基纤维素钠培养基上.涂布均匀,待培养基上水分稍干,就将培养基倒置放入恒温培养箱中,28 ℃培养4~5 d.④选择一些生长旺盛的菌落,在初筛培养基上划线分离,得到纯培养,再将纯培养后的单个菌落点种到初筛培养基上,28 ℃培养4 d.将点种生长的菌株接种到PDA培养基上,做短期保存.⑤用配制好的1 mg/mL的刚果红染色液染色点种菌株30 min,弃去染液.再用1 mol/mL NaCl刚果红脱色液脱色30 min,弃去脱色液,观察.若菌株产生纤维素酶,就会在菌落四周出现清晰的透明水解圈,依据透明水解圈的直径与菌落直径的比值(Hc)大小选择产纤维素酶活性较高的菌株.
1.2.2产纤维素酶菌株的羧甲基纤维素酶活和滤纸酶活测定及其复筛参考文献[9]的方法,进行分离菌株的羧甲基纤维素酶(carboxymethyl cellulase activity,CMCA)及滤纸酶活(filter paper enzyme activity,FPA)测定.将初选菌株接种于复筛产酶培养基中经发酵产酶后,测其粗酶液的酶活,测3次取平均值,以酶活值为复筛标准,筛选出CMCA和FPA同时较高的菌株.
1.2.2.1羧甲基纤维素酶活测定取0.5 mL粗酶液,加1 mL CMC-Na柠檬酸缓冲液,混匀后,于50 ℃水浴30 min,然后加入DNS显色液3 mL,沸水浴10 min,冷却,540 nm处测吸光度.同时使用100 ℃煮沸10 min后失活的酶液做对照,其他步骤相同.
1.2.2.2滤纸酶活测定取0.5 mL稀释的粗酶液,加入pH4.8 0.1 mol/L柠檬酸-柠檬酸钠缓冲液1 mL,加入一条滤纸(1 cm×6 cm)于带塞试管中,50 ℃水浴1 h,然后加入DNS显色液3 mL,沸水浴10 min显色,冷却至室温,加蒸馏水定容至10 mL,混匀,静置20 min,540 nm处测吸光度.同时用100 ℃煮沸10 min后失活的酶液做对照,其他步骤相同.
1.2.3产纤维素酶菌株的形态学鉴定将复筛出的产纤维素酶菌株划线接种于马铃薯平板培养基,经28 ℃培养2~3 d后观察菌落形态,镜检菌丝及分生孢子梗、孢子链、孢子形态,并结合《真菌鉴定手册》[10]对复筛产纤维素酶菌株进行初步鉴定.
1.2.4产纤维素酶菌株的ITS区序列鉴定
1.2.4.1基因组DNA的提取应用真菌DNA提取试剂盒提取酶源菌株基因组DNA,操作步骤详见试剂盒说明.
1.2.4.2ITS区序列的PCR扩增与测序参考文献[11]中真菌ITS区序列扩增通用引物,进行产纤维素酶分离菌株ITS区序列的PCR扩增.正向引物 5′-TCCGTAGGTGAACCTGCGG-3′,反向引物 5′-TCCTCCGC- TTATTGATATGC-3′,引物由上海Invitrogen公司合成.
扩增体系:上游引物2 μL、下游引物2 μL、模板DNA 2 μL、rTAP预混酶25 μL、灭菌ddH2O 19 μL,总体积50 μL.反应条件:94 ℃预变性1 min;94 ℃ 1 min、51 ℃ 1 min、72 ℃ 1 min,共34个循环;72 ℃延伸10 min,4 ℃保存.
PCR扩增产物经凝胶电泳检测及凝胶回收试剂盒纯化,克隆到pMD18-T vector,转化E.coliDH5α感受态细胞,划线接种在含有氨苄青霉素(Ampicillin,Amp)的LB琼脂平板上培养后,挑选白色菌落并接种在LB液体培养基中培养.将筛选的疑似阳性克隆送上海生工生物工程技术服务有限公司测序.
1.2.4.3ITS序列分析与菌株鉴定将分离菌株的ITS区序列测序结果提交GenBank数据库进行BLAST分析,利用BLAST软件从GenBank数据库中搜索相关菌株的ITS相应序列,进行分离菌株种的鉴定.
1.2.5产纤维素酶菌株的产酶条件优化分析产纤维素酶真菌菌株液态发酵条件下产纤维素酶的影响因素,应用复筛产酶培养基,保持培养基中其他成分不变,在培养温度为25 ℃的条件下,比较碳源(CMC-Na、葡萄糖、麸皮、CaCO3、Na2CO3)、氮源[NH4Cl、NH4NO3、尿素、蛋白胨、(NH4)2SO4]、pH(6.5、7.0、7.5、8.0、8.5)、接种量(1、2、3、4、5 μL)及在保持培养基中其他成分不变,改变培养温度(15、25、35、45、55 ℃)这5个单因素,筛选出影响分离菌株产纤维素酶的最佳单因素.以单因素试验为基础,设计L9(33)正交试验,探究碳源、氮源和pH值3种因素对羧甲基纤维素酶活和滤纸酶活的影响,探究最佳发酵产酶条件组合.
2结果与分析
2.1产纤维素酶菌株的分离与初筛
将样品稀释液依次涂布于羧甲基纤维素钠培养基平板,培养至第7天,用刚果红染色法观察水解圈,有200多个菌落周围产生了清晰水解圈,菌落有透明、粉红、乳白、墨绿、青绿、灰绿、黄绿、黄褐、桔黄等.挑选水解圈与菌落直径比值Hc较大的纤维素酶产生菌为初选菌株.经形态观察,初选菌株以真菌为主,还有较多细菌和个别放线菌,真菌中以霉菌为主(图1).
由于CMC属于大分子多糖衍生物,纤维素分解菌能分泌纤维素酶而将CMC平板培养基中的纤维素降解成小分子的低聚糖及纤维二糖、葡萄糖等.刚果红能将CMC染成红色,但对CMC降解后产生的小分子低聚糖类物质无染色作用,因此在产生CMC酶的菌落周围会形成清晰的水解圈.刚果红纤维素平板培养是较好的分离筛选培养基,其水解圈直径/菌落比值大致反映酶活力高低.

图1 菌株B-2-3在CMC-Na平板上产生的水解圈Fig.1 Hydrolysis circle on CMC-Na flat of strain B-2-3
2.2分离菌株滤纸酶活和羧甲基纤维素酶活的测定
经初选菌株的滤纸酶活和羧甲基纤维素酶活测定,复筛出滤纸酶活和羧甲基纤维素酶活同时较高的分离菌15株.由表1可知,菌株B-2-3酶活最高,其羧甲基纤维素酶活为2 341.76 U/mL、滤纸酶活为398.18 U/mL.羧甲基纤维素酶活主要代表了外切-β-1-4葡聚糖苷酶和内切酶的活力总和,滤纸酶活所反映的是纤维素酶的总活力,二者酶活的高低基本可以反应出一个菌株产纤维素酶能力的大小.

表1 纤维素酶产生菌酶活
同列数字肩标不同小写字母表示差异显著(P<0.05).
2.3产纤维素酶菌株的形态学特征
将菌株B-2-3接种于PDA培养基培养,菌落生长非常快,棉花样,开始为白色,2~3 d后转为绿色,数日后变为中间深绿色,菌落边缘白色,呈粉末状(图2).初期,菌丝体产生大量的分生孢子梗.然后顶端膨大成为顶囊,一般呈球形,顶囊表面长满一层或两层辐射状小梗(初生小梗与次生小梗),最上层小梗瓶状,顶端着生成串的球形.然后顶端膨大成为顶囊,一般呈球形,顶囊表面长满一层或两层辐射状小梗(初生小梗与次生小梗),最上层小梗瓶状,顶端着生成串的球形分生孢子(图3).据菌落形态及镜检结果,同时对比《真菌鉴手册》[10],初步鉴定此菌株为真菌门、曲霉属(Aspergillus).
2.4产纤维素酶菌株的ITS区序列鉴定
2.4.1ITS区序列的PCR扩增经菌株B-2-3基因组DNA的PCR扩增,获得到大约650 bp的扩增条带,与预期ITS区序列扩增片段大小相符(图4).

图2 菌株B-2-3的菌落形态Fig.2 Colony morphology of the strain B-2-3
图3 菌株B-2-3的菌丝形态Fig.3 Mycelium morphology of the strain B-2-3

M:DNA分子质量标准DL2 000;1:ITS的PCR扩增产物.图4 PCR扩增结果Fig.4 The results of PCR amplification
2.4.2ITS序列分析与菌株鉴定将菌株B-2-3的ITS区序列扩增片段测序结果在GenBank数据库中进行BLAST分析及相关菌株的ITS序列搜索,其与烟曲霉(Aspergillusfumigatus)登录号为KF841561.1菌株的ITS序列相似度为99%,因此鉴定菌株B-2-3为曲霉属的烟曲霉.
分析真菌ITS区序列作为种属鉴定的依据,主要是因为ITS区不含成熟核糖体,承受的选择性压力较小,可以允许更多的变异,而且ITS区片段较小,易于分析.ITS片段进化速率是18S rDNA的10倍.因此,ITS区更适合对真菌种属鉴定的研究.
2.5菌株B-2-3的产酶条件优化
2.5.1碳源对酶活的影响 如图5所示,在其他条件恒定的情况下,菌株B-2-3以CMC-Na为碳源时的羧甲基纤维素酶活远远高于其他碳源时的酶活,滤纸酶活也较高,其次是麸皮和葡萄糖,Na2CO3作用最差,表明以CMC-Na为碳源时菌株B-2-3产酶性能最高,可作为最佳碳源考虑.纤维素酶是一种诱导酶,碳源是纤维素酶合成的主要诱导因素.CMC-Na是可溶性碳源,没有结晶区,发酵期间更易被菌株分解、利用,诱导期相对较短,纤维素酶对其分解也更为容易,所以能获得相对较大的酶活.

图5 碳源对菌株B-2-3酶活的影响Fig.5 Effects of carbon sources on enzyme activity of strain B-2-3
2.5.2氮源对酶活的影响如图6所示,在其他条件恒定的情况下,菌株B-2-3产酶最佳氮源是蛋白胨,相比其他氮源更符合该菌株产酶性能发挥的营养需求.这可能是由于蛋白胨作为有机氮源,营养丰富,因而微生物在含有机氮源的培养基中常表现出生长旺盛、菌体浓度增长迅速等特点.
2.5.3pH对酶活的影响如图7所示,在其他条件恒定的情况下,菌株B-2-3在pH6.5时的纤维素酶活远远高于其他pH时的酶活,pH高于6.5以后酶活急剧降低,在pH 6.5时滤纸酶活也最高,表明初始培养基合适的pH值有利于真菌发酵产酶,菌株B-2-3的最适产酶初始培养基pH为6.5,与欧阳蒲月等[12]筛选出来的烟曲霉最适pH差不多.微生物要进行正常的生长代谢,就要求培养基有适宜的pH值,但由于他们的代谢活动又会改变培养基的pH值.所以在培养基的配制过程中,要适当调节培养基的pH值,使其符合微生物生长的同时,也要考虑到培养基的pH缓冲能力.

图6 氮源对菌株B-2-3酶活的影响Fig.6 Effect of nitrogen sources on enzyme activity of strain B-2-3

图7 pH对菌株B-2-3酶活的影响Fig.7 Effect of pH on enzyme activity of strain B-2-3
2.5.4接种量对酶活的影响如图8所示,在其他条件恒定的情况下,接种量为4 μL时(即12%),菌株B-2-3的纤维素酶活与滤纸酶活均达到最高,表明该菌株的产酶最佳接种量为12%(4 μL/33μL)时为最佳接种量.接种量的大小一般受限于生产菌株在发酵体系内的生长、代谢、繁殖的速度.接种量过大或者过小,均会影响发酵.过大会引起溶氧不足,影响产物合成;而且会过多移入代谢废物,也不经济;过小会延长培养时间,降低酶活产生效率.根据实际需求,要在营养物利用、菌体密度及代谢产物之间建立一个平衡.
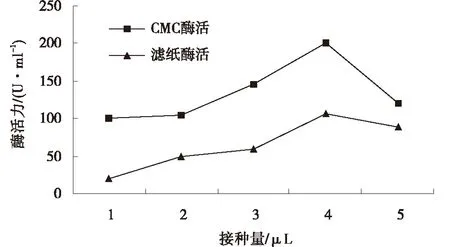
图8 接种量对菌株B-2-3酶活的影响Fig.8 Effect of inoculation amount on enzyme activity of strain B-2-3
2.5.5培养温度对酶活的影响如图9所示,其他条件恒定的情况下,菌株B-2-3在温度为25 ℃时的羧甲基纤维素酶活与滤纸酶活均达到最大值,超过25 ℃时羧甲基纤维素酶活迅速降低,而滤纸酶活变化较小,曲线比较平稳,说明B-2-3的最适发酵温度均为25 ℃.温度对微生物的生长繁殖及其生理代谢有重要影响.在发酵过程中,温度的影响主要表现在微生物生长繁殖、代谢合成、发酵液理化性质等方面.因此,在筛选纤维素酶菌株的培养过程中,要选择合适的培养温度,以已达到酶活最高的目的.
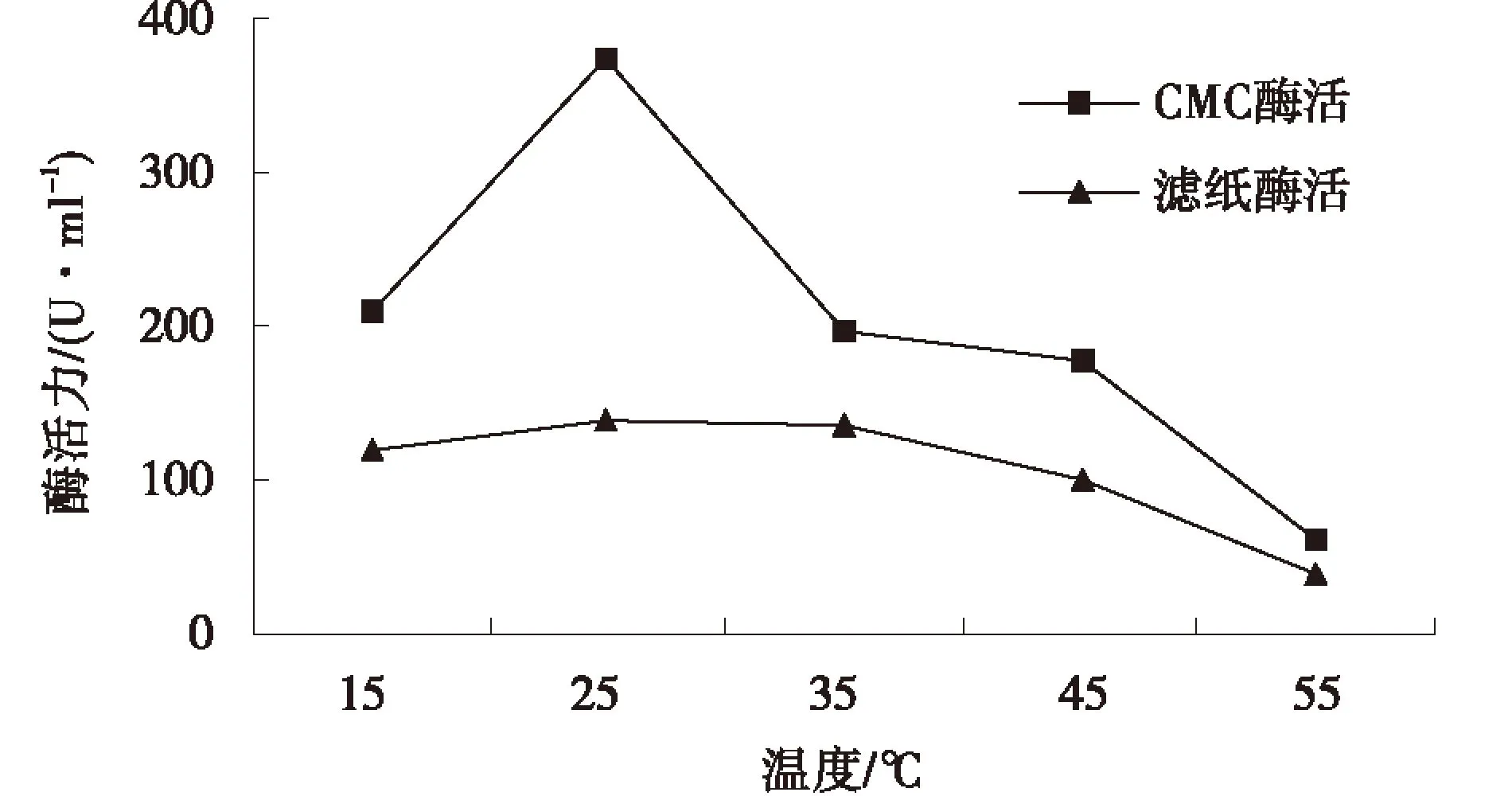
图9 培养温度对菌株B-2-3酶活的影响Fig.9 Effect of culture temperature on enzyme activity of strain B-2-3
2.5.6菌株B-2-3最佳产酶条件的正交试验由表2可知,对于烟曲霉菌株B-2-3而言,比较极差R,当以羧甲基纤维素酶活作为判别标准时,碳源、氮源和pH值3个影响因子的主次顺序为C>B>A,最佳组合为A1B3C1,即pH6.5、蛋白胨0.6 g/L、CMC-Na 0.3 g/L;当以滤纸酶活作为判别标准时,3个影响因子的主次顺序为B>A>C,最佳组合为A2B1C1,即蛋白胨0.5 g/L、CMC-Na 0.35 g/L、pH6.5.以上结果表明,不同的纤维素酶活性之间存在差异,对各自影响最大的因素是不完全相同的.从表3中可知,各影响因素对两种酶活影响的差异显著性.综合分析可知,当培养基含蛋白胨为0.5~0.6 g/L、CMC-Na 为0.3~0.35 g/L、pH6.5时为烟曲霉菌株B-2-3发酵产酶最佳培养条件组合.

表2 菌株B-2-3产酶最佳培养条件正交试验

表3 方差分析结果
3讨论
在西北地区,由于气候和气温、土壤、湿度等条件比较特殊,再加上有机质丰富多样,微生物的种类很多,有利于分离筛选多种产纤维素酶菌株.本试验利用羧甲基纤维素钠培养法、刚果红染色法、纤维素酶活性测定法筛选出产纤维素酶真菌菌株B-2-3,结合菌落形态观察、显微镜观察和ITS序列同源性分析,与烟曲霉(Aspergillusfumigatus)菌株(登录号KF841561.1)ITS序列的相似度为99%,确定该菌株为曲霉属的烟曲霉.微生物的代谢是由一系列的生化反应组成,影响微生物生长代谢的因素包括营养条件和培养条件,具体表现为培养基的组成、接种量、培养温度、pH等.分析菌株B-2-3在复筛产酶培养基上的产纤维素酶的影响因素,比较碳源、氮源、接种量、培养温度、pH等在单因素条件下对纤维素酶活的影响及通过L9(33)正交试验显示,烟曲霉菌株B-2-3的最适产酶条件为温度25 ℃、接种量4 μL、蛋白胨0.5~0.6 g/L、CMC-Na 0.3~0.35 g/L、pH 6.5.
微生物发酵产酶,影响因素很多,培养基的成分和添加比例对微生物的生长、代谢及产物积累都有很大的影响,因而,微生物培养基成分和配比的优化极其重要.本试验筛选出来的烟曲霉菌株B-2-3,在产酶条件上和文献中报道的已经筛选出来的烟曲霉菌株的产酶条件在碳源、氮源、pH、培养温度等方面都不太相同,如金伟等[13]从武汉市和厦门市周边地区土壤中分离和筛选到一株产纤维素酶能力较强的耐热烟曲霉E4,该菌株的最佳产纤维素酶的基质为稻草,其最适产酶pH值为5.0,最适产酶温度为42 ℃,50 ℃摇瓶培养72 h时可达到产酶最高峰,其羧甲基纤维素酶(CMCase)活和滤纸酶(FPA)活分别达到3.5 U/mL和3.2 U/mL;欧阳蒲月等[12]从广州近郊腐烂树叶中分离获得一株纤维素降解能力较强的烟曲霉菌株OY-01,该菌株最适生长温度和pH分别为35 ℃和6.0~7.0,氮源为硫酸铵,体积分数0.15%,培养48~60 h,其最高酶活达1.75 U/mL;封晔等[14]对烟曲霉FG10的产酶条件优化得出,FG10的最适产酶条件为豆粕0.3 g/kg、pH4.8、35 ℃培养48 h;陈红漫等[15]从温泉热源地中筛出一株烟曲霉菌株,其产酶最适初始pH6.5,最适反应温度65 ℃,碳、氮源分别为结晶纤维素、牛肉膏时有利于产酶.本试验筛选出来的烟曲霉菌株B-2-3除了与欧阳蒲月等[12],陈红漫等[13]筛选出来的烟曲霉菌株在pH值上相似外,其他条件均不相同.推测可能是由于试验操作方法等方面存在区别或者菌株来源的不同造成的.本试验筛选出来的烟曲霉菌株B-2-3与以上菌株相比,产酶活力较高,如果再通过适当改造[16],使烟曲霉菌株B-2-3的酶活稳定,同时使酶的产量提高和酶的活性增强,提高烟曲霉菌株的利用率,具有很好的研究意义及发展前景.
目前,国内虽然有了大量筛选纤维素酶的研究,来自自然界中的土壤、水体、腐殖质及生物体内等环境条件下纤维素酶不断被发掘,但迄今为止,我国仍未很好地解决规模生产纤维素酶的难题.长期以来,酶的产量、比活力低一直是制约纤维素酶实际应用的一个重要原因.因此,不断地筛选高产纤维素酶菌株,对纤维素资源的利用有着重要的意义.
4结论
本试验筛选出一株产纤维素酶真菌菌株B-2-3,结合菌落形态观察、显微镜观察和ITS序列同源性分析,确定该菌株为曲霉属的烟曲霉.通过产酶条件优化得出,烟曲霉菌株B-2-3的最适产酶条件为温度25 ℃、接种量4 μL、蛋白胨0.5~0.6 g/L、CMC-Na 0.3~0.35 g/L、pH6.5.试验为下一步进行纤维素酶相关研究打下一定的基础.
参考文献
[1]陈燕,王小芬,金伟,等.产纤维素酶霉菌的筛选及初步鉴定[J].武汉工业学院学报,2011,30(3):6-8
[2]陆晨,陈介南,王义强,等.一株产纤维素酶真菌的筛选及产酶条件优化[J].中南林业科技大学学报,2012,32(6):118-122
[3]Geng A L,Zou G,Yan X,et al.Expression and characterization of a novel metagenome-derived cellulase Exo2b and its application to improve cellulase activity in Trichoderma reesei[J].Appl Microbiol Biotechnol,2012,96(4):951-962
[4]李悦,李世俊,薛桥丽,等.大围山森林土壤中高产纤维素酶菌株的筛选及鉴定[J].Innovadion and knowledge Transfer,2014,33(6):128-131
[5]武香玉,徐海燕,辛国芹,等.纤维素酶及其研究进展[J].饲料博览,2013(10):27-29
[6]胡格华,苏香萍,潘虹,等.纤维素酶产生菌的筛选及产酶条件的研究[J].三峡大学学报:自然科学版,2013,35(4):100-102
[7]Wang D,Sun J,Yu H L,et al.Maximum saccharification of cellulose complex by an enzyme cocktail supplemented with cellulase from newly isolated Aspergillus fumigatus ECU0811[J].Appl Biochem Biotechnol,2012,166(1):176-186
[8]Xu C,Long M N,Wu X B,et al.Screening and characterization of the high-cellulase-producing strainAspergillusglaucusXC9[J].Frontiers of Biology in China,2006,1(1):35-40
[9]Nathan V K,Rani M E,Rathinasamy G,et al.Process optimization and production kinetics for cellulase production by Trichoderma viride VKF3[J].Archives of Disease in Childhood,2014,17(3):92-95
[10]金萍,徐尔尼,史立康,等.高产纤维素酶生产方法的研究[J].食品科技,2007(2):73-76
[11]燕勇,李卫平,高雯洁,等.rDNA-ITS序列分析在真菌鉴定中的应用[J].2008,18(10):1958-1961
[12]欧阳蒲月,郭成栓,黄智璇,等.一株纤维素降解菌的分离,鉴定及产酶条件初步研究[J].现代生物医学进展,2009,9(18):3447-3450
[13]金伟,陈文静,姚斌,等.一株产纤维素酶的耐热烟曲霉筛选及产酶条件研究[J].中国酿造,2012,31(6):61-64
[14]封晔,来航线,郑真,等.高产纤维素酶菌株的筛选及其产酶条件研究[J].西北农林科技大学学报:自然科学版,2007,35(10):133-138
[15]陈红漫,孙玉辉,阚国仕,等.产耐热纤维素酶菌株的分子鉴定及产酶条件优化[J].食品与发酵工业,2011,37(7):28-33
[16]唐嘉徽,杨富民,王曙阳,等.重离子辐照诱变黑曲霉产纤维素酶菌株的筛选[J].甘肃农业大学学报,2012,47(3):143-148
(责任编辑赵晓倩)
Isolation and screening of fungi strains producing cellulase and optimization of conditions for enzyme production
WEI Jiao,WAN Xue-rui,WU Run,CHANG Tong,MA Ya-ru,LIU Lei,ZHANG Xiao-li,ZHANG Tian-liang,YANG Run-xia,JIA Xiao-rui
(College of Veterinary Medicine,Gansu Agricultural University,Lanzhou 730070,China)
Abstract:【Objective】 Using fungi to screen fungal strains with high cellulases activity because it has large cellulase enzymes,can be secreted into the extracellular and easily be separated.【Method】 Sodium carboxymethyl cellulose culture,Congo red staining,cellulase activity assays were used to isolate and screen strains producing cellulose from samples,and identification was conducted combining with colony morphology,microscopic characteristics and ITS sequence homology analysis.【Result】 15 fungal strains producing cellulases with higher Hc value was screened,through liquid fermentation retest CMC activity and filter paper activity,screening a strain B-2-3 producing the highest cellulase activity,and it was identified as Aspergillus fumigatus with the CMC activity of 2 341.76 U/mL and filter paper activity of 398.18 U/mL.The optimum conditions for enzyme production were as follows:temperature of 25 ℃,inoculation of 4 μL,peptone of 0.5~0.6 g/L,CMC-Na of 0.3~0.35 g/L,pH of 6.5.【Conclusion】 Aspergillus strains B-2-3 was screened with higher production of cellulase activity.
Key words:cellulase;screening;identification;Aspergillus fumigatus
通信作者:吴润,男,教授,博士生导师,研究方向为兽医微生物学与免疫学.E-mail:wurun@gsau.edu.cn
基金项目:甘肃省科技支撑计划项目(1204NKCA103);甘肃农业大学盛彤笙科技创新基金(GSAU-STS-1232);甘肃省农业生物技术研究与应用开发项目(GNSW-2012-25).
收稿日期:2015-01-12;修回日期:2015-03-25
中图分类号:Q 556
文献标志码:A
文章编号:1003-4315(2016)02-0008-08
第一作者:魏姣(1989-),女,硕士研究生,研究方向为兽医微生物学与免疫学.E-mail:306310799@qq.com
