试管微环境对马铃薯‘GSAP-H’愈伤组织花青素含量的影响
2016-06-16魏彩霞牛智敏窦富强王清
魏彩霞,牛智敏,窦富强,王清
(1.甘肃农业大学作物遗传改良和种质创新重点实验室,甘肃农业大学干旱生境重点实验室,甘肃 兰州 730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
试管微环境对马铃薯‘GSAP-H’愈伤组织花青素含量的影响
魏彩霞1,2,牛智敏2,窦富强2,王清1,2
(1.甘肃农业大学作物遗传改良和种质创新重点实验室,甘肃农业大学干旱生境重点实验室,甘肃 兰州730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州730070)
摘要:【目的】 为获得愈伤组织生长及花青素积累的最佳培养条件.【方法】 针对马铃薯“GSAP-H”试管苗茎叶诱导出的紫色愈伤组织进行了外源激素、糖源、不同N素比例、光温和pH等条件的研究.【结果】 随NAA、2,4-D浓度的增加,愈伤组织快速生长,花青素含量呈先升后降的趋势,于1.5 mg/L 2,4-D和1.0 mg/L NAA浓度下达到高峰,分别为863.15、880.65 nmol/g;高浓度BAP不利于愈伤组织的生长,但花青素含量在4 mg/L BAP下达到高峰,为848.745 nmol/g.蔗糖是花青素生产的最好碳源,45 g/L蔗糖下的愈伤组织生长最快且花青素含量最高(887.035 nmol/g);培养基中NO3-与NH4+比例为3:1时,愈伤组织花青素含量最高(895.54 nmol/g).此外,全光照利于花青素产量的提高.pH 4.8及25 ℃的培养条件可明显促进愈伤组织花青素的积累.【结论】 研究结果将为利用紫色马铃薯愈伤组织进行工厂化生产花青素奠定一定基础.
关键词:马铃薯“GSAP-H”;花青素;激素;糖源;温度;pH
我国马铃薯品种繁多,块茎皮肉色泽多样,有白色、黄色、粉红、金黄、黑色、浅紫和深紫等颜色[1],尤其是黑紫色马铃薯富含花青素,一经上市即引起人们的关注和喜爱.马铃薯花青素属于黄酮类多酚化合物,是一类羟基、甲基化的1-苯基并吡喃阳离子[2],与一个或多个糖分子通过糖苷键结合而显现出颜色[3].黑紫色马铃薯中的花青素不仅具有极高的经济价值和药用价值[4],如抗氧化、延缓衰老、保护心血管、抗肿瘤活性、美容护肤等[5],也可以作为天然色素提取的原始材料.
已有报道表明,花青素生物合成受到诸多因素的影响,如激素、糖类、光照、温度等[6-8],改变组织培养环境,如碳源、氮源等水平,将导致离体培养的植物组织花青素产量的变化[7],这类研究在花卉和果蔬中报道较多,如葡萄、月季、矮牵牛、苹果、拟南芥等[9-13].马铃薯花青素的研究,更多集中于花青素品种的筛选[14],花青素含量的检测及与花色苷合成相关基因表达差异的研究[15],除卢其能等报道了2,4-D、BAP、蔗糖和卡那霉素对花青素含量影响的研究论文外[16],尚未有更多涉及愈伤组织花青素含量的报道.故本研究从试管微环境着手,研究了不同外源激素、不同糖源、不同氮素比例、培养基pH及培养条件(光照、温度)对愈伤组织生长及花青素产量的促进效应,旨在找出最适宜于紫色马铃薯‘GSAP-H’愈伤组织花青素生产的最佳培养基及培养条件,以期为进一步开发和利用紫色马铃薯进行工厂化生产花青素提供参考.
1材料和方法
1.1试验材料
‘GSAP-H’是一种富含花青素的马铃薯栽培种(引自于美国,由甘肃农业大学作物遗传改良和种质创新重点实验室白江平教授提供),2010年通过对块茎芽无菌消毒培养成试管苗并长期继代培养.
将试管苗以单节切段转移于不含任何激素的MS培养基中,待生长20 d后,将叶片或茎段剪切成0.5 cm2小块或0.3~0.4 cm的小段接入含有2 mg/L NAA,2 mg/L BAP的MS培养基中(pH 5.8),于(24±2)℃,24 h,2 000 lx不间断光照下诱导愈伤组织.待诱导出较好的愈伤组织后,选择紫色愈伤组织于继代培养基(MS +1 mg/L NAA+1 mg/L 2,4-D+2 mg/L BAP+1 mg/L KT+30 g/L蔗糖+5 g/L琼脂)中继代培养,每3周继代1次,继代3次后作为本次实验的基本材料.
1.2试验方法
激素处理: 取继代培养21 d的紫色愈伤组织,接种于含有5种NAA浓度(0、0.5、1.0、1.5和2.0 mg/L)的MS+2 mg/L BAP+1 mg/L KT+30 g/L蔗糖的愈伤组织培养基中;接种于含有5种2,4-D浓度(0、0.5、1.0、1.5和2.0 mg/L)的MS+2 mg/L BAP+1 mg/L KT+30 g/L蔗糖的愈伤组织培养基中;接种于含有5种BAP浓度(0、1.0、2.0、3.0和4.0 mg/L)的MS+1 mg/L NAA+1 mg/L KT及MS+1 mg/L 2,4-D+1 mg/L KT+30 g/L蔗糖的愈伤组织培养基中.
糖源处理:以蔗糖、麦芽糖、葡萄糖为愈伤组织培养基(MS+1 mg/L NAA+1 mg/L 2,4-D+2 mg/L BAP+1 mg/L KT)的渗透压调节剂,三种糖源均设置4个浓度水平(15、30、45、60 g/L).
N素和pH处理:调节培养基中NO3-∶NH4+为2∶1、3∶1和4∶1.将愈伤组织接种于MS+1 mg/L NAA+1 mg/L 2,4-D+2 mg/L BAP+1 mg/L KT+30 g/L蔗糖的培养基中.另外,调整愈伤组织培养基MS+1 mg/L NAA+1 mg/L 2,4-D+2 mg/L BAP+1 mg/L KT+30 g/L蔗糖的pH分别为3.8、4.8、5.8、6.8、7.8.
上述试验在每一供试因子的每一水平下均接入5瓶愈伤组织,每瓶约2 g;于(24士2)℃,24 h不间断光照条件下培养25 d后,测定愈伤组织的生长量及花青素含量.
光照及培养温度的处理: 将接入到MS+1 mg/L NAA+1 mg/L 2,4-D+2 mg/L BAP+1 mg/L KT + 30 g/L蔗糖培养基中的愈伤组织分别放置于黑暗、全光照和16 h/8 h光照/黑暗条件下培养,25 d后检测愈伤组织花青素含量.将接入到与光照培养基相同的愈伤组织于4、15、25 ℃的温度条件培养25 d后,测定愈伤组织的花青素含量.
1.3愈伤组织花青素含量的测定及计算
取0.5 g愈伤组织于冰预冷且质量分数为1% 的HC1甲醇溶液中研磨,定容至10 mL,储存于4 ℃的黑暗条件下抽提花青素24 h,再于5 000 r/min,4 ℃下离心15 min,利用UV-1200型分光光度计测定530、620、650 nm的D值.
花青素的计算按照刘延吉等的方法进行[17].
愈伤组织生长量(g)=25 d的愈伤组织鲜质量-接种量
2结果与分析
2.1外源激素对‘GSAP-H’愈伤组织花青素含量的影响
2.1.1BAP对愈伤组织花青素含量的影响在生长素为1mg/L NAA或1mg/L 2,4-D的培养基中,愈伤组织生长量均随BAP浓度的升高而降低,但花青素含量却随BAP浓度的增加而提高,并于3~4 mg/L BAP浓度下花青素含量最高,分别为(833.77~848.62 nmol/g,NAA)和(838.70~848.75 nmol/g,2,4-D)(图1-2),但两者的花青素平均含量具有显著差异,以添加NAA培养基中的愈伤组织花青素含量更高,其平均含量为758.94 nmol/g,而1 mg/L 2,4-D为生长素的培养基中,平均花青素含量仅为624.72 nmol/g.综合愈伤组织生长和花青素含量的变化,培养基中BAP的适宜浓度为2~3 mg/L.
2.1.22,4-D、NAA对愈伤组织花青素含量的影响固定培养基中BAP浓度为2 mg/L,探讨生长素对愈伤组织生长及花青素含量的影响,发现愈伤组织的生长量均随生长素浓度的升高而增加(图3).不同2,4-D处理浓度间的愈伤组织花青素含量均达到极显著的差异,随2,4-D浓度的增加,愈伤组织花青素含量逐渐提高,并于1.5 mg/L2,4-D浓度下达到最高,为880.65 nmol/g,比对照、0.5 mg/L及1.0 mg/L 2,4-D的花青素含量分别提高了120.50%、87.86%和64.02%.随着2,4-D浓度的继续升高(2.0 mg/L),愈伤组织颜色变浅,花青素含量下降(801.34 nmol/g).与2,4-D相似,不同NAA浓度的愈伤组织花青素含量与对照间均达到极显著的差异水平,且随NAA浓度的增加呈先升后降的趋势,并于1.0 mg/L NAA浓度时达到峰值(863.15 nmol/g),次之为1.5 mg/L NAA浓度下,花青素含量为766.45 nmol/g(图4).故培养基中的生长素应选择1.0 mg/L NAA或1.5 mg/L 2,4-D.

图1 BAP对愈伤组织花青素含量的影响(1 mg/L NAA)Fig.1 The effect of BAP on the anthocyanin content from the callus tissue(1 mg/L NAA)

图2 BAP对愈伤组织花青素含量的影响(1 mg/L 2,4-D)Fig.2 The effect of BAP on the anthocyanin content from the callus tissue(1 mg/L 2,4-D)
2.2糖源对愈伤组织花青素含量的影响
将愈伤组织分别接种于附加不同浓度蔗糖、葡萄糖和麦芽糖的培养基中,生长25 d后检测愈伤组织生长量及花青素含量.结果表明,蔗糖最适宜于‘GSAP-H’愈伤组织的生长,其平均生长量为4.04 g/瓶,较葡萄糖和麦芽糖增长了9.80%和42.02%,且在45 g/L蔗糖和麦芽糖及30 g/L葡萄糖浓度下,愈伤组织生长量最大,分别为4.94 g/瓶、3.67 g/瓶和4.02 g/瓶(图6).此外,糖源及其浓度对花青素含量具有显著影响,以蔗糖为碳源的培养基中,愈伤组织平均花青素含量最高(792.47 nmol/g),葡萄糖次之(675.01 nmol/g),麦芽糖较差(649.31 nmol/g).不同糖浓度的愈伤组织花青素含量也有显著差异,30~45 g/L蔗糖明显促进了花青素含量的增加,其含量高达840.26~887.04 nmol/g;葡萄糖和麦芽糖均在30 g/L浓度下的花青素含量最高,分别为784.55和800.74 nmol/g,当糖浓度增加到45 g/L以上时,花青素含量急剧下降,比最大值分别降低了20.36~24.79%(葡萄糖)和12.65~30.03%(麦芽糖)(图5).综上所述,生产花青素的最佳碳源为蔗糖,最佳浓度为45 g/L.

图3 2,4-D对愈伤组织花青素含量的影响Fig.3 The effect of 2,4-D on the anthocyanin content from the callus tissue
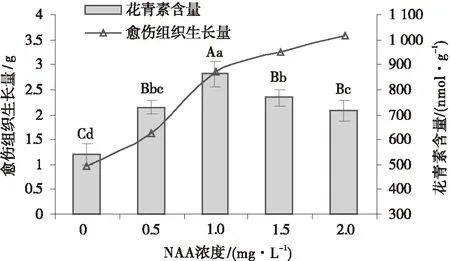
图4 NAA对愈伤组织花青素含量的影响Fig.4 The effect of NAA on the anthocyanin content from the callus tissue

图5 糖源及糖浓度对愈伤组织花青素含量的影响Fig.5 The effect of source of sugar and glucose concentration on the anthocyanin content from the callus tissue

图6 糖源及糖浓度对愈伤组织生长量的影响Fig.6 The effect of sugar sources and glucose concentration on the callus growth from the callus tissue
2.3硝态氮与铵态氮比例对花青素含量的影响
氮素是植物生长必需的大量元素之一,硝态氮与铵态氮的比例极显著影响着植物花青素含量的高低.在NO3-∶NH4+为2∶1、3∶1、4∶1的培养基中,以NO3-∶NH4+为3∶1的愈伤组织花青素含量最高,达895.54 nmol/g;而2∶1和4∶1下的花青素含量低于上述水平,仅为744.156 nmol/g和685.455 nmol/g(图7).
2.4pH对花青素含量的影响
愈伤组织花青素含量随培养基pH 的增加呈先升后降的趋势,并于pH 4.8时达到最高,为770.22 nmol/g;随着pH继续升高,花青素含量逐渐下降,当pH为7.8时,花青素含量最低,仅为553.57 nmol/g(图8),可见酸性条件利于花青素含量的积累.但适宜于花青素含量增加的pH并不利于愈伤组织的生长,尽管未做愈伤组织生长量检测,但肉眼观察到pH 3.8和pH 7.8培养基中的愈伤组织近乎停滞生长并略有褐化,pH 5.8时愈伤组织生长最好.

图7 硝态氮与铵态氮比例对愈伤组织花青素含量的影响Fig.7 The effect of NO3-∶NH4+ on the anthocyanin content from the callus tissue

图8 pH对愈伤组织花青素含量的影响Fig.8 The effect of pH on the anthocyanin content from the callus tissue
2.5温度及光照对花青素含量的影响
低温(4 ℃)既不利于愈伤组织生长也不利于花青素的积累,此时花青素含量仅为798.70 nmol/g;而适宜于愈伤组织生长的温度(25 ℃),同样利于花青素的积累,在此培养温度下花青素含量达935.15 nmol/g(图9).
光照时间的长短同样影响愈伤组织的生长和花青素积累.尽管全光照对愈伤组织生长的促进效应差于其他两种光照条件,却极显著促进了花青素的积累,其含量高达986.93 nmol/g;暗培养下的愈伤组织生长最快,相对于全光照,花青素含量却明显降低(746.58 nmol/g);16h/8h光照黑暗交替既保证了愈伤组织快速生长,且花青素含量也明显高于黑暗培养,为899.05 nmol/g(图10).

图9 培养温度对愈伤组织花青素含量的影响Fig.9 The effect of incubation temperature on the anthocyanin content from the callus tissue
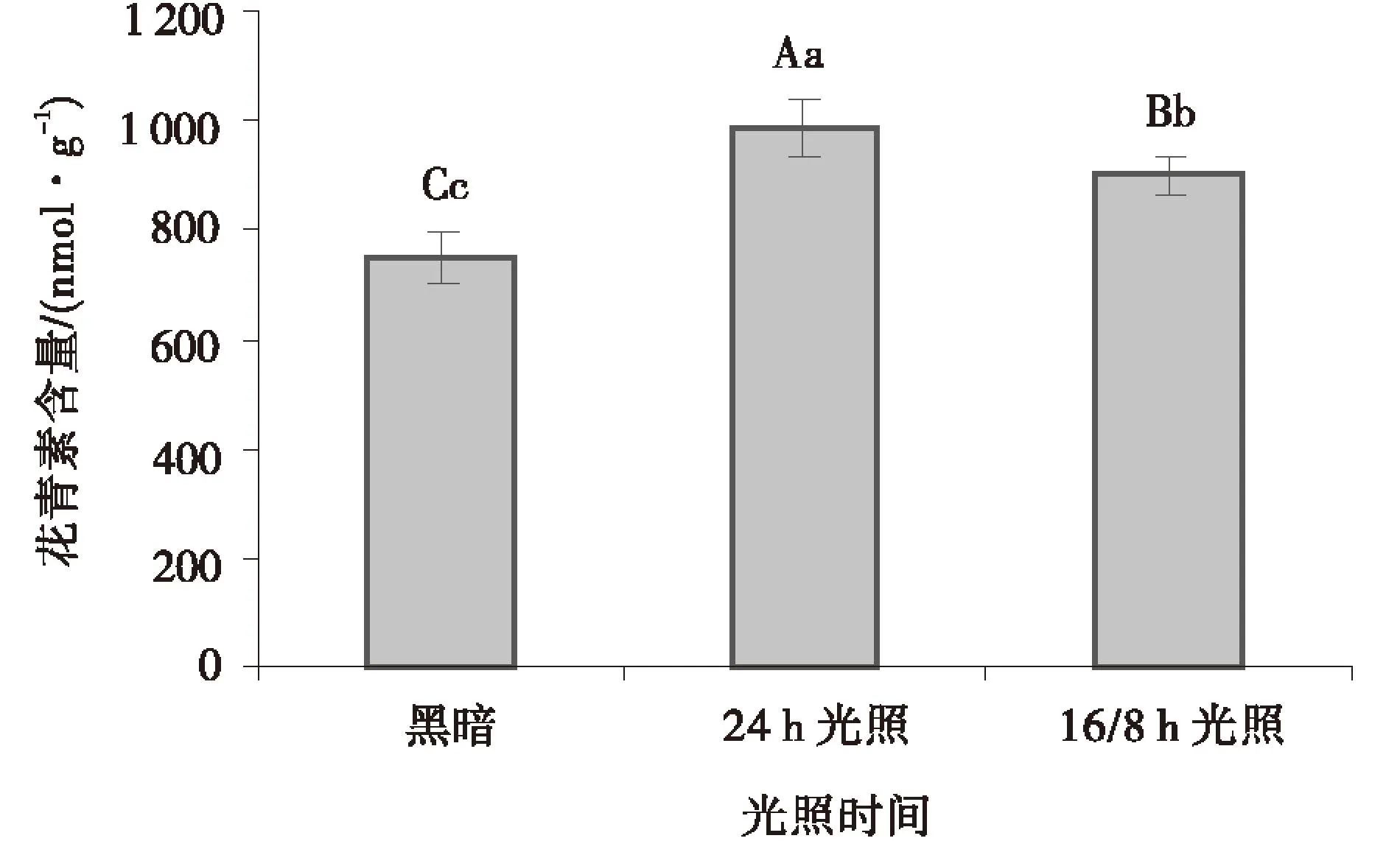
图10 光照时间对愈伤组织花青素含量的影响Fig.10 The effect of light time on the anthocyanin content from the callus tissue
3讨论
3.1激素对愈伤组织花青素含量的影响
外源激素是植物组织培养不可缺少的一类物质,生长素和细胞分裂素的比例不仅影响着植物生长的快慢和愈伤组织再生植株的能力,也影响着细胞内众多生理生化反应和组织培养中次生代谢物质的种类和含量[16-17,19].作为植物二级代谢产物的花青素,无论是生长素还是细胞分裂素均对其有显著的影响.Ozeki等发现,2,4-D通过影响PAL和CHS基因的转录水平而引起花色苷生物合成的改变,1 mg/L 2,4-D可明显促进草莓悬浮细胞的生长和花青素产量的增加[18];邓日烈的研究结果表明,0.2~1.0 mg/L 2,4-D以及2.0~10.0 mg/L NAA下的鸡冠花愈伤组织的花色苷含量最高[19],卢其能则认为高浓度的2,4-D虽然利于愈伤组织细胞的增殖,却不利于花色苷的积累,随着2,4-D浓度的增加到3mg/L,马铃薯愈伤组织花色苷产量急剧下降,而花色苷积累的最好浓度为2 mg/L[16],说明适宜于不同植物花色苷生产的激素种类和浓度并不一致.细胞分裂素亦是如此,如BAP能够明显促进纤细单冠菊花花色苷的合成[20],2 mg/L BAP和5 mg/L KT明显增进了鸡冠花愈伤组织花色苷的产量,但随浓度的继续升高花色苷的产量反而下降[19].研究表明,低浓度的生长素对花色素苷的积累具有促进作用,较高浓度的2,4-D 和NAA 通常会抑制花色素苷的积累.本试验中,愈伤组织花青素含量均随NAA、2,4-D浓度的增加呈先升后降的趋势,并于1.5 mg/L 2,4-D和1.0 mg/L NAA浓度下的花青素含量最高(880.65 nmol/g和863.15 nmol/g),其变化趋势与前人研究的结果相同[16,19],但‘GSAP-H’愈伤组织似乎对BAP比较青睐,无论在含有NAA还是2,4-D的培养基中,在供试的BAP浓度范围内,最高量的BAP(4 mg/L)收获到最大量的花青素含量(848.75 nmol/g和856.62 nmol/g).可见,作为信号物质的激素,有可能会激活或抑制花色苷生物合成相关基因的表达并改变相关酶的活性[21],从而促进或抑制花色苷合成与积累,但这种作用的强弱往往与植物种类及品种有关[22].
3.2外界条件对花青素含量的影响
糖是组织培养中常用的碳源,是组织和细胞生长不可缺少的物质,同时它又是调节渗透压的重要物质.糖浓度过高必然会引起渗透胁迫,影响愈伤组织的正常生长.此外,在花青素合成中,糖是代谢过程中的前体物质,是花色苷结构的一个组分,并作为信号分子通过特异的信号传导途径调节花色苷合成相关酶的基因表达,影响植物的着色[23].已有研究表明,蔗糖是刺激花青素苷呈色的最主要糖类物质之一,以蔗糖为碳源的培养基可大大提高非洲菊、香石竹、鸡冠花的花青素含量[19,23];蔗糖能够特异性的增加拟南芥花青素苷的积累,而果糖和葡萄糖却收效甚微[23,24],蔗糖或葡萄糖利于玫瑰茄细胞的生长和花青素积累[25],但鼠李糖却利于提高葡萄细胞花青素合成酶CHFI的活性及花青素产量[26].在马铃薯愈伤组织的花色苷研究中,卢其能发现,随着培养基中蔗糖浓度的增加(20~80 g/L),愈伤组织的花色苷含量也随之增加[16].与其结果不同,本研究发现蔗糖促进‘GSAP-H’愈伤组织花青素含量增进的最好浓度为45 g/L(花青素含量高达887.04 nmol/g),而葡萄糖和麦芽糖则以30 g/L为好,但增进效果差于蔗糖,这或许与选用的马铃薯品种不同有关.
光照、温度等外界条件在花青素的合成过程中同样发挥着重要作用,已有研究表明,强光可以同时诱导结构基因和调节基因的表达,使花青素苷的积累量增加;黑暗或弱光却抑制或下调基因的表达[27].Weiss在矮牵牛的研究中发现,相对高能量的光量子通量若长时间照射矮牵牛,可使CHS基因表达量和色素积累量达到最高水平,离体培养条件下的矮牵牛花冠的生长和花青素苷积累均被强烈抑制[28].本研究也获得了一致的结果,全光照培养下,马铃薯愈伤组织花青素积累量最大,较16 h/8 h黑暗交替和暗培养下花青素含量提高了20%~40%,可见离体条件下,暗培养时间越长,光诱导花色素苷积累的作用越弱[29].此外,有研究表明,适宜于细胞生长及花青素积累的温度并不一致,如最适于紫苏细胞生长和花青素积累的温度分别为22~28 ℃和25 ℃[15],最适于草莓细胞生长和花青素积累的温度为30 ℃和20 ℃[30],在我们的研究中,当愈伤组织处于4 ℃时,植物组织近于冷害条件,不利于愈伤组织生长和花青素积累,而适合于愈伤组织生长的温度同样适合于马铃薯‘GSAP-H’花青素的积累(25 ℃),可见,试管微环境如:外源激素种类及浓度、糖源及浓度、pH等以及适宜的光温条件对提高愈伤组织花青素产量至关重要.
参考文献
[1]郭赵娟,吴焕章.彩色马铃薯营养价值与主要品种[J].现代农业科技,2008,17:107-109
[2]杨智勇,李新生,马娇燕,等.彩色马铃薯花青苷研究现状及展望[J].中国酿造,2013,32(7):5-7
[3]于东,陈桂新,方忠祥.花青苷提取、分离纯化及鉴定的研究进展[J].食品与发酵工业,2009,33(3):127-133
[4]Ravinder K,Hari,Thakor R P,et al.An overview of pigment production in biological systems:Function,biosynthesis,and applications in food industry[J].Food Review International,1994,10(1):49-70
[5]Tsuda T,Horio F,Osawa T.The role of anthocyanins as an antioxidant under oxidative stress in rats[J].Biofactors,2000,13(1-4):133-139
[6]Kentaro M,Sumiko S,Hiroshi G.Decreased anthocyanin biosynthesis in grape berries grown under elevated night temperature condition[J].Scientia Horticulturae,2005,105(3):319-330
[7]Chi B D,François C.Effects of low nitrate and high sugar concentrations on anthocyanin content and composition of grape (VitisviniferaL.) cell suspension[J].Plant Cell Reports,1991,9(9):500-504
[8]Kenji S,Mamoru N,Jun-ichi S.Culturing conditions affecting the production of anthocyanin in suspended cell cultures of strawberry[J].Plant Science,1996,113(1):91-98
[9]Poudel P R,Mochioka R,Beppu K,et al.Influence of temperature on berry composition of interspecific hybrid wine grape ‘Kadainou R-1’(Vitisficifoliavar.ganebu×V.vinifera‘Muscat of Alexandria’)[J].J Jpn Soc Hortic Sci,2009,78:169-174
[10]Biran I,Halevy A H.Effects of varying light intensities and temperature treatments applied to whole plants,or locally to leaves or flower buds,on growth and pigmentation of ‘Baccara’ roses[J].Physiology Plant,1974,31:175-179
[11]Shvarts M,Borochov A,Weiss D.Low temperature enhances petunia flower pigmentation and induces chalcone synthase gene expression[J].Physiology Plant,1997,99:67-72
[12]Ban Y,Honda C,Hatsuyama Y,et al.Isolation and functional analysis of a MYB transcription factor gene that is a key regulator for the development of red coloration in apple skin[J].Plant Cell Physiology,2007,48:958-970
[13]王曼,王小菁.蓝光和蔗糖对拟南芥花色素苷积累和CHS基因表达的影响[J].热带亚热带植物学报,2004,12(3):252-256
[14]杨琼芬,白建明,杨万林,等.云南省彩色马铃薯产业的发展趋势和方向[J].中国马铃薯,2006,20(4):254-255
[15]卢其能,杨清,沈春修.马铃薯愈伤组织中色素含量与4个花色苷合成相关基因的表达差异[J].基因组学与应用生物学,2009,28(4):678-684
[16]卢其能,杨清.激素等外源物质对马铃薯愈伤组织花色苷积累的影响[J].西北植物学报,2007,27(11):2233-2239
[17]刘延吉,向文娟,田晓艳,等.南果梨愈伤组织及花青素诱导的初步研究[J].食品与生物技术学报,2008,27(3):83-87
[18]Ozeki Y,Komamine A.Effects of growth regulators on the induction of anthocyanin synthesis in carrot suspension cultures[J].Plant Cell Physiology,1986,27:1361-1368
[19]邓日烈,王惠珍,吴文花,等.植物生长调节剂对鸡冠花愈伤组织生长及花色素苷积累的影响[J].生物技术通报,2008,3:170-173
[20]Constable F,Shyluk J P,Gamborg O L.The effect of hormones on anthocyanin accumulation in cell cultures of Haplopappus gracilis[J].Planta,1971,96:306-316
[21]程海燕,李德红.光、糖与激素影响植物花色素苷合成与积累的研究进展[J].亚热带植物科学,2010,39(3):82-86
[22]赵利敏,马绍英,杨海荣,等.响应面分析法优化葡萄籽原花青素的提取工艺[J].甘肃农业大学学报,2012,47(2):121-125[23]Minakuchi S,Ichimura K,Nakayama M,et al.Effects of high-sucrose concentration treatments on petal color pigmentation and concentrations of sugars and anthocyanins in petals of bud cut carnations (Dianthuscaryophyllus)[J].Hortic Res (Japan),2008,7:277-281
[24]Solfanelli C,Poggi A,Loreti E,et al.Sucrose-specific induction of the anthocyanin biosynthetic pathway inArabidopsis[J].Plant Physiology,2006,140:637-646
[25]郑穗平,郭勇.主要营养成分对悬浮培养玫瑰茄细胞生长和花青素合成的影响[J].广西植物,1998,18(7):70-74
[26]郭成栓,欧阳蒲月,杜敏.培养条件对植物组织培养生产花青素影响的研究进展[J].安徽农业科学,2010,38(12):6109-6111
[27]Mol J,Jenkins G,Schafer E,et al.Signal perception,transduction,and gene expression involved in anthocyanin biosynthesis[J].CRC Crit Rev Plant Sci,1996,15:525-557
[28]Weiss D,Halevy A H.The role of light reactions in the regulation of anthocyanin synthesis inPetuniacorollas[J].Physiology Plant,1991,81:127-133
[29]王小菁,孟祥春,彭建宗.花色形成与花生长的调节控制[J].西北植物学报,2003,23(7):1105-1110
[30]赵昶灵,郭华春,刘福翠.马铃薯‘转心乌’块茎色素的组成和含量[J].西北植物学报,2007,27(10):1953-1961
(责任编辑李辛)
Effect of microenvironment on the anthocyanin content from the callus of potato ‘GSAP-H’
WEI Cai-xia1,2,NIU Zhi-min2,DOU Fu-qiang2,WANG Qing1,2
(1.Gansu Key Laboratory of Crop Improvement and Germplasm Enhancement,Gansu Provincial Key Laboratory of Aridland Crop Science,Gansu Agricultural University,Lanzhou 730070,China;2.College of Life Science and Technology,Gansu Agricultural University,Lanzhou 730070,China)
Abstract:【Objective】 In order to obtain the optimal condition for callus growth and anthocyanin accumulation.【Method】 Potato purple callus was induced from the leaves and stems of ‘GSAP-H’ in vitro.The purple callus was treated by different level of exogenous hormones,sugar source,nitrogen source,illumination time,cultural temperature and pH value.【Result】 The results showed that callus grew rapidly with the increasing concentration of NAA and 2,4-D,anthocyanin content rose first then decreased and reached the maximum under 1.5 mg/L 2,4-D and 1.0 mg/L NAA,by 863.15 nmol/g and 880.65 nmol/g,respectively.High concentration of BAP was against callus growth,but the anthocyanin content reached the peak under 4 mg/L BAP concentration level (848.75 nmol/g).Sucrose was the best carbon source for anthocyanin accumulation by purple callus cultivation,the callus grew quickly and the anthocyanin content was the highest (887.04 nmol/g) after the purple callus was cultured in medium with 45 g/L sucrose.With the ratio of NO3- to NH4+ reaching 3∶1,the anthocyanin content also rose up to the highest (895.54 nmol/g.FW).In addition,the culturing condition of 25 ℃ and full exposure could obviously promote the anthocyanin accumulation of purple callus growing in medium with pH 4.8.【Conclusion】 The results could be applicable for industrializing production of anthocyanin with purple potato callus in the future.
Key words:potato ‘GSAP-H’;anthocyanin;hormone;sugar source;temperature;pH
通信作者:王清,女,教授,硕士生导师,主要从事马铃薯生物技术育种研究.E-mail:wangqing@gsau.edu.cn
基金项目:甘肃省干旱生境作物学重点实验室开放基金(GSCS-2012-12).
收稿日期:2015-03-15;修回日期:2015-04-24
中图分类号:S 532
文献标志码:A
文章编号:1003-4315(2016)02-0047-07
第一作者:魏彩霞(1990-),女,硕士研究生,主要从事马铃薯生物技术育种研究.E-mail:1004278491@qq.com
