秦皇岛海域褐潮暴发区中溶解氨基酸分布特征及季节变化❋
2016-06-16米铁柱王国善于志刚
乔 玲, 米铁柱❋❋, 甄 毓, 古 彬, 王国善, 于志刚
(1.海洋环境与生态教育部重点实验室,山东 青岛 266100; 2.中国海洋大学环境科学与工程学院,山东 青岛 266100;3.海洋国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071; 4.中国水产科学研究院黄海水产研究所,山东 青岛 266071;5.海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
秦皇岛海域褐潮暴发区中溶解氨基酸分布特征及季节变化❋
乔玲1, 2, 3, 米铁柱1, 2, 3❋❋, 甄毓1, 2, 3, 古彬4, 王国善3, 5, 于志刚3, 5
(1.海洋环境与生态教育部重点实验室,山东 青岛 266100; 2.中国海洋大学环境科学与工程学院,山东 青岛 266100;3.海洋国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071; 4.中国水产科学研究院黄海水产研究所,山东 青岛 266071;5.海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
摘要:通过现场调查,对秦皇岛海域抑食金球藻褐潮暴发区的溶解氨基酸的含量、水平分布、季节变化、组成特征以及与理化因子之间的相关性进行了研究。结果表明:该海区含有较高浓度的溶解结合态氨基酸(DCAA),平均浓度为3.02μmol/L,是总溶解氨基酸(DTAA)的主要组成部分,约占DTAA含量的85%;而溶解游离态氨基酸(DFAA)的含量较低,平均浓度为0.52μmol/L。DCAA和DFAA均有明显的季节变化趋势:3—6月有所升高,7月份明显下降,12月又有所回升。对氨基酸和理化因子的相关性进行分析可知,海水中溶解氨基酸与尿素呈显著正相关(p<0.01)。海水中DFAA的个体氨基酸组成以及酸性氨基酸和碱性氨基酸含量的相对大小存在季节差异,这可能与不同种类氨基酸的来源、保存以及抑食金球藻(Aureococcus anophagefferens)对其利用能力不同有关。
关键词:秦皇岛;褐潮;抑食金球藻;溶解氨基酸
引用格式:乔玲, 米铁柱, 甄毓,等. 秦皇岛海域褐潮暴发区中溶解氨基酸分布特征及季节变化[J]. 中国海洋大学学报 (自然科学版), 2016, 46(5): 95-103.
QIAO Ling, MI Tie-Zhu, ZHEN Yu, et al. Spatial distributions and seasonal variations of dissolved amino acids in the coastal waters of Qinhuangdao during brown tide[J]. Periodical of Ocean University of China, 2016, 46(5): 95-103.
秦皇岛海域是中国重要的扇贝养殖区域,海湾扇贝养殖已成为当地社会经济的重要支撑产业。近年来,该海域扇贝养殖区频繁出现扇贝滞长、死亡等问题,严重影响了当地养殖业的发展。经调查研究,发现这一现象与抑食金球藻(Aureococcusanophagefferens)褐潮的暴发密切相关[1-2]。
氮是浮游植物生长所必须的营养元素之一,它构成浮游植物细胞的蛋白质分子,并参与海洋生物的新陈代谢。溶解氨基酸是海水中溶解有机物的重要组成部分,主要由溶解游离态氨基酸(Dissolved free amino acids, DFAA)和溶解结合态氨基酸(Dissolved combined amino acid, DCAA)构成,可作为氮源直接被藻类吸收利用[3-4]。抑食金球藻的室内和野外培养实验已表明,该藻可以从多种含氮有机化合物中吸收氮元素[5],其中氨基酸是抑食金球藻所需氮源的重要组成部分,特别在夏末,该藻从氨基酸中吸收的氮可占总氮吸收量的50%[5]。抑食金球藻的细胞密度较高时还能水解多肽,且水解速率与其细胞密度具有显著相关性,这明显促进了抑食金球藻吸收利用溶解游离氨基酸、小分子多肽和多肽水解产物[5]。在现场实验中,通过添加适宜浓度的谷氨酸,抑食金球藻的增长速度和相对丰度也都有一定程度的增加[6],且增长速度比假微海链藻(Thalassiosirapseudonana)等微藻快[7]。这些研究都表明,抑食金球藻可以直接吸收或通过多肽水解间接利用海水中的溶解氨基酸。此外,在贝类养殖过程中,滤食性贝类的分泌物及代谢产物经生物化学作用进入营养物质循环,必然会改变海水中溶解氨基酸的负荷,因此也可能为抑食金球藻褐潮的暴发提供了合适的营养物质条件。
目前,已有不少研究者对不同海域的溶解氨基酸进行了大量调查[8-13],研究目标多为溶解氨基酸的分布、含量及组成等方面。秦皇岛海域作为中国重要的扇贝养殖区及褐潮高发区,有必要对该海域中溶解氨基酸的含量、季节变化以及与理化因子之间的相关性进行深入研究,以分析其与褐潮形成之间的关系。本文于2013年通过对秦皇岛褐潮暴发区海域5个航次的调查数据进行分析,研究了该海域溶解氨基酸的含量、水平分布、季节变化、组成特征以及与理化因子之间的相关性,结合抑食金球藻的细胞密度,分析了海水中溶解氨基酸和抑食金球藻褐潮之间的关系,以期为认识抑食金球藻褐潮的暴发机制和防治提供科学依据。
1材料与方法
1.1 样品采集
分别于2013年3、6、7、9及12月对秦皇岛海域褐潮暴发区的6个站位进行现场调查,调查海区及站位如图1所示。调查过程中用高密度聚乙烯水桶采集表层水,经200目筛绢过滤1L海水于量筒中,滤液再经0.45μm醋酸纤维滤膜过滤,滤膜放入液氮保存,用于分析采样点抑食金球藻的相对密度,过滤的水样于-20℃冷冻保存,用于营养元素的分析测定。
1.2 样品的测定
海水中溶解氨基酸测定方法为邻苯二甲醛柱前衍生高效液相色谱法[8],所用仪器为Agilent 1260 Infinity液相色谱仪,配有1260 Quat Pump VL四元低压梯度系统、1260 ALS自动进样器、1260 FLD荧光检测器和1260 TCC柱温箱。所用色谱柱为Agilent ZORBAX Eclipse氨基酸分析(AAA)柱(5μm,4.6mm×150mm)。柱温为40℃,激发波长330nm,发射波长450nm。
海水中DFAA的浓度可直接测定,DTAA的浓度在测定前要先用浓盐酸对海水样品进行水解,然后按照DFAA的测定方法进行定性定量分析,DTAA的浓度减去DFAA的浓度即为DCAA的浓度。
海水中尿素的浓度采用二乙酰一肟法[14]进行测定。
采用定量PCR方法测定抑食金球藻18S rDNA拷贝数。抑食金球藻18S rDNA特异性引物为Aa1685f(5’-ACC TCC GGA CTG GGG TT)和Euk B(5’-GAT CCT TCT GCA GGT TCA CCT AC),定量PCR反应程序如下:50℃ 2min,95℃ 10min,95℃ 15s,58℃ 1min,40个循环。以18S rDNA拷贝浓度(copy/L)代表抑食金球藻的细胞密度,方法详见文献[16]。
现场表层海水的温度(T)、盐度(S)和溶解氧(dissolved oxygen, DO)等环境参数[15]用HQd多参数水质分析仪(美国哈希公司)现场测定。
2结果与讨论
2.1 不同季节溶解氨基酸和抑食金球藻密度的时空分布特征
2013年秦皇岛海域褐潮暴发区DFAA、DCAA和DTAA的浓度范围分别为0.32~1.43、1.10~8.26和1.59~9.17μmol/L,平均浓度分别为0.52、3.02和3.53μmol/L,与黄海[8,10-13]和东海[8]的调查结果相近。其中,DCAA含量占DTAA的绝大部分,而DFAA含量较低[17],这主要是因为DFAA的周转速度极快[18],其释放和摄取与浮游植物和细菌有着密切的关系[9,19],浮游生物会优先吸收利用DFAA[20];与之不同,DCAA则是由小分子多肽、蛋白质、糖基化合物等氨基酸复合物组成,其稳定性相对较高,周转速度较慢[21]。

图2 2013年表层海水中各站位溶解游离态氨基酸、溶解
图2为2013年表层海水中各站位DFAA、DCAA平均浓度和抑食金球藻平均密度的季节变化图。由图可知,DFAA和DCAA均有明显的季节变化趋势。DCAA在3月浓度最低,之后到6月有所升高,7月份明显下降,随后至12月又明显升高。而DFAA的浓度则在6月达到最高值后开始降低,9月降到最低值,而12月又有所回升。3—6月,DFAA和DCAA的浓度均有所升高,这可能与浮游植物生物量的双峰分布有关。研究发现,渤海海域浮游植物生物量在上下半年均有一次高峰[22-23],上半年在春季,高峰之后,浮游植物死亡,藻细胞被分解,释放出较多的DFAA和DCAA,从而使海水中DFAA和DCAA的浓度升高,这就为抑食金球藻褐潮的暴发与持续提供了合适的营养物质条件。7月,DFAA和DCAA的浓度明显降低,此时,在该海域抑食金球藻为优势种,其优势度为0.82。研究发现,抑食金球藻对氨基酸的吸收速率要高于其它藻类,如微小原甲藻(Prorocentrumminimum)、血红哈卡藻(Akashiwosanguinea)[24]。因此,DFAA和DCAA浓度的降低可能与抑食金球藻的相对密度在此时达到最高峰有关,该藻利用环境中的溶解氨基酸满足细胞对氮的需求。同样在9月的浮游植物高峰,DCAA的浓度有所升高,与春季不同的是,DFAA的浓度却有所降低,这可能是海水中的DFAA更易于被抑食金球藻吸收利用的结果。9月之后,DFAA和DCAA的浓度又开始回升,这可能是因为此时抑食金球藻褐潮开始衰退,死亡的藻细胞经过微生物分解进入海洋,使海水中溶解氨基酸的含量增加。
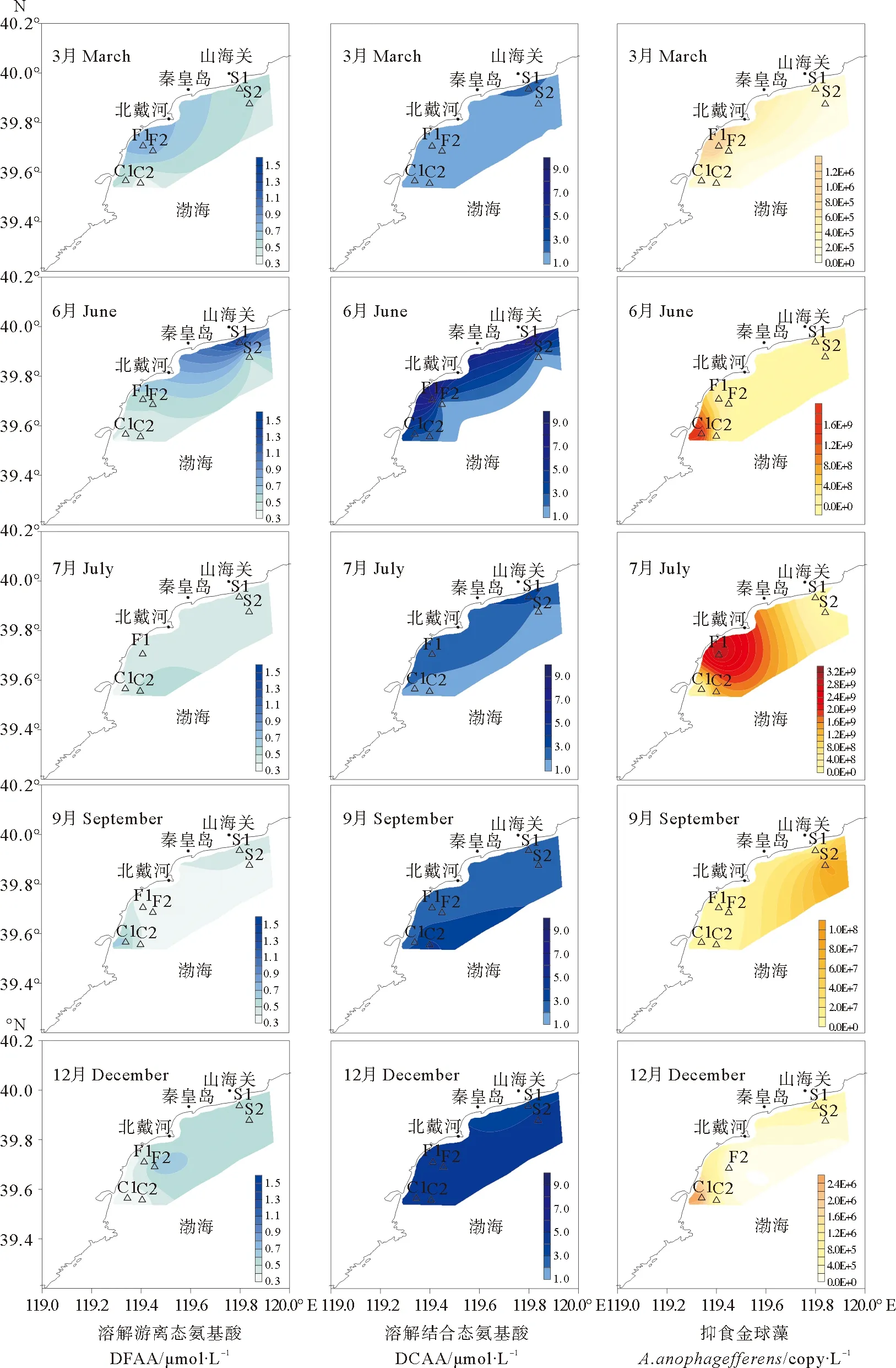
图3 不同季节表层海水中溶解游离态氨基酸、溶解结合态氨基酸浓度和抑食金球藻细胞密度的平面分布图
图3为秦皇岛海域褐潮暴发区不同季节DFAA、DCAA和抑食金球藻细胞密度的平面分布图。由图可知,3月,抑食金球藻细胞从调查海域的南部(F1和F2)开始增长,而此时该海域的DFAA浓度也相对较高,这样就为抑食金球藻的暴发提供了合适的营养物质条件。6月,抑食金球藻的细胞密度大幅度升高,且在调查海域南部明显高于北部,此时,DFAA的浓度则北高南低,而DCAA的浓度南北部并没有很大差异,这是因为抑食金球藻在生长代谢过程中可以利用环境中的溶解氨基酸来满足细胞对氮的需求,且与DCAA相比,DFAA可直接被抑食金球藻优先吸收利用;7月,抑食金球藻细胞密度达到最高峰,且褐潮开始向北部扩展,此时整个调查海域中DFAA的浓度均较低,而DCAA浓度则是北高南低,这可能是因为抑食金球藻褐潮在南部持续时间较长,DCAA也被该藻吸收利用;9月,抑食金球藻褐潮中心继续向北迁移,且细胞密度逐渐降低,而此时DFAA和DCAA的浓度均开始上升,且南高北低,这可能是因为死亡藻细胞的分解产物进入海水,增加了海洋中的溶解氨基酸含量;12月,抑食金球藻褐潮衰退,DFAA和DCAA的浓度均进一步升高,此时,抑食金球藻的细胞密度南高北低,而DFAA的浓度则北部明显高于南部,DCAA的浓度在调查海域均较高。整个过程呈现出抑食金球藻褐潮由南向北迁移,同时DFAA先随之降低,DCAA再随之降低。
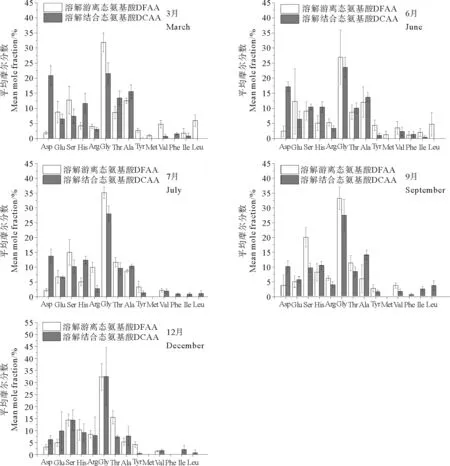
(Asp-天冬氨酸;Glu-谷氨酸;Ser-丝氨酸;His-组氨酸;Arg-精氨酸;Gly-甘氨酸;Thr-苏氨酸;Ala-丙氨酸;Tyr-酪氨酸;Met-蛋氨酸;Val-缬氨酸;Phe-苯丙氨酸;Ile-异亮甘酸;Leu-亮氨酸。Asp-aspartic acid; Glu-glutamic acid; Ser-serine; His-histidine; Arg-arginine; Gly-glycine; Thr-threonine; Ala-alanine; Tyr-tyrosine; Met-methionine; Val-valine; Phe-phenylalanine; Ile-isoleucine; Leu-leucine.)
图4不同季节溶解游离态氨基酸和溶解结合态氨基酸中个体氨基酸的平均摩尔百分比
Fig.4Mean mole fraction of individual amino acids of DFAA and DCAA in different seasons
2.2 不同季节溶解氨基酸的组成
2.2.1 不同季节溶解氨基酸的组成分析不同氨基酸在环境中的可利用性不同,通过研究不同季节秦皇岛海域褐潮暴发区表层海水中溶解氨基酸的组成变化,分析抑食金球藻褐潮对个体氨基酸含量及组成的影响。DFAA中共测定出14种个体氨基酸,分别为天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、组氨酸(His)、精氨酸(Arg)、甘氨酸(Gly)、苏氨酸(Thr)、丙氨酸(Ala)、酪氨酸(Tyr)、蛋氨酸(Met)、缬氨酸(Val)、苯丙氨酸(Phe)、异亮甘酸(Ile)和亮氨酸(Leu),由于消解过程中Met与盐酸反应,所以DCAA中只测定出除Met外的13种氨基酸。由图4可知,不同季节DFAA中的优势氨基酸的组成略有不同。3和6月,Gly、Ser、Ala、Glu、Thr为含量较高的氨基酸,分别占DFAA总浓度的74.33%与69.65%;7月,占比例较大的个体氨基酸则为Gly、Ser、Thr、Arg、Ala,占DFAA总浓度的80.55%;9和12月,优势氨基酸为Gly、Ser、Thr、His、Arg,分别占DFAA总浓度的78.92%与81.05%。其中Gly的平均摩尔分数百分比最高,平均约为31.85%,且其浓度随季节变化并不明显(见图5),而Glu仅在抑食金球藻细胞密度达到峰值之前即3和6月为优势氨基酸。由图5可知,与Gly不同,Glu的浓度有明显的季节变化趋势,3月开始升高,6月达到峰值,7月明显降低,这可能是因为抑食金球藻对这两种氨基酸的吸收利用情况不同。通过现场培养实验发现,向海水中添加Gly,抑食金球藻的增长速率并没有显著升高[25],而添加Glu,该藻的增长速度和相对丰度都有一定程度的增加[6]。不同季节DCAA的优势氨基酸基本相同,均为Gly、Ala、Ser、His、Asp、Thr,共占DCAA总浓度的83.68%。
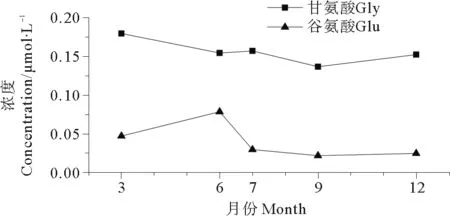
图5 2013年表层海水中甘氨酸和谷氨酸浓度的季节变化
无论是DFAA还是DCAA,占比例较大的个体氨基酸均包括Gly、Ser和Thr。浮游植物中蛋白质和氨基酸组成的研究表明Gly、Ser和Thr是构成藻类蛋白质的主要氨基酸[26-27],且其性质比较稳定,不易被微生物降解或是被浮游动物吞噬[28],因而Gly、Ser和Thr是海水中DFAA和DCAA的优势氨基酸。
根据氨基酸分子中所含氨基和羧基数目的不同,可以将溶解氨基酸分为酸性氨基酸(Asp、Glu)、碱性氨基酸(His、Arg)和中性氨基酸(Gly、Ala、Val、Leu、Ile、Ser、Thr、Met、Tyr、Phe)。如图6所示,DFAA和DCAA中均以中性氨基酸含量最高,且其在DFAA中所占比例高于DCAA,这与南黄海和胶州湾的调查结果相一致[29]。
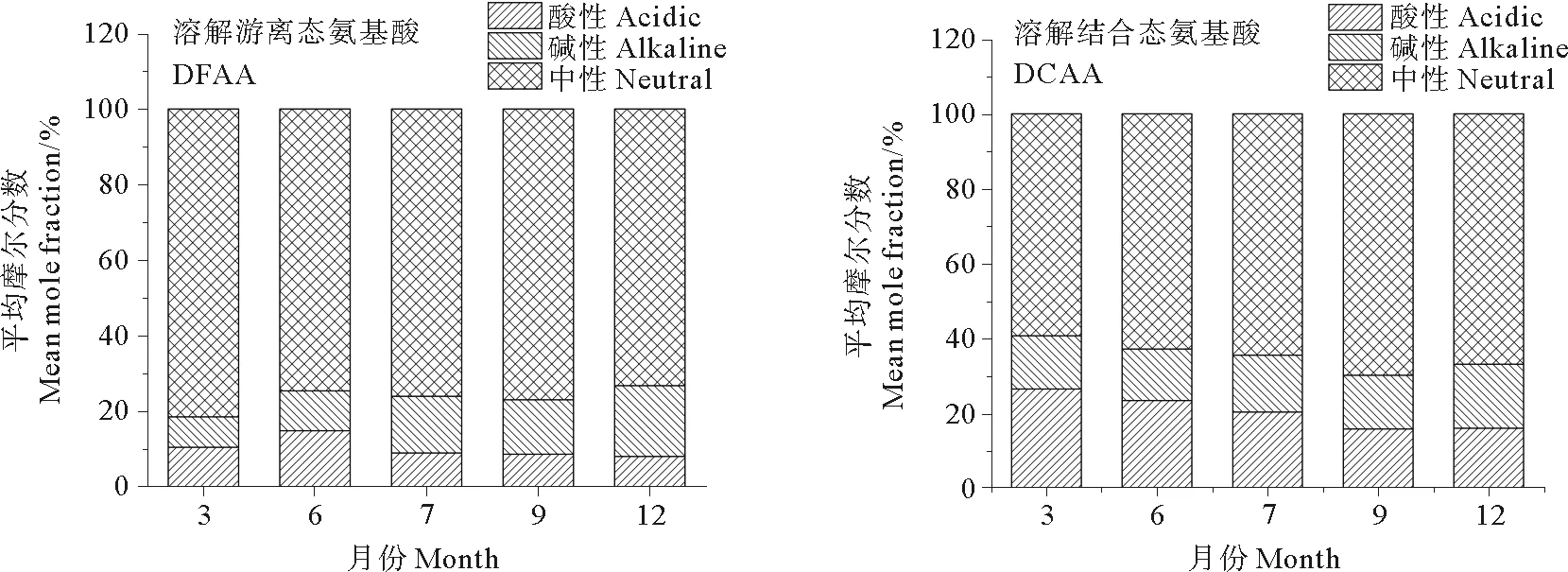
图6 溶解游离态氨基酸和溶解结合态氨基酸中不同类型氨基酸的的平均摩尔百分比
不同季节DFAA和DCAA中,酸性氨基酸和碱性氨基酸含量的相对大小随季节变化而略有不同。DCAA在3、6、7和9月均是酸性氨基酸多于碱性氨基酸,仅在12月是碱性氨基酸多于酸性氨基酸;而DFAA在3和6月是酸性氨基酸多于碱性氨基酸,在7、9和12月则是碱性氨基酸多于酸性氨基酸。海洋微藻对海洋中不同种类的氨基酸的吸收利用情况存在明显的差异[30],研究发现,抑食金球藻对酸性氨基酸Glu的最大吸收速率高于碱性氨基酸赖氨酸(Lys)[31],因此抑食金球藻对酸性氨基酸的利用能力可能高于碱性氨基酸,具体情况还需有待进一步分析。
2.2.2 个体氨基酸的聚类分析为了研究个体氨基酸之间的相关关系及其变化趋势,分别对DFAA和DCAA中的个体氨基酸进行聚类分析(见图7)。

(Asp-天冬氨酸;Glu-谷氨酸;Ser-丝氨酸;His-组氨酸;Arg-精氨酸;Gly-甘氨酸;Thr-苏氨酸;Ala-丙氨酸;Tyr-酪氨酸;Met-蛋氨酸;Val-缬氨酸;Phe-苯丙氨酸;Ile-异亮甘酸;Leu-亮氨酸。Asp-aspartic acid; Glu-glutamic acid; Ser-serine; His-histidine; Arg-arginine; Gly-glycine; Thr-threonine; Ala-alanine; Tyr-tyrosine; Met-methionine; Val-valine; Phe-phenylalanine; Ile-isoleucine; Leu-leucine.)
图7溶解游离态氨基酸和溶解结合态氨基酸中个体氨基酸组成的聚类分析
Fig.7Cluster plot showing the similarity in the composition of individual amino acids of DFAA and DCAA
由图7可知,DFAA中个体氨基酸可以分为两类:第一类包括Ala、Val、Tyr、Phe、Glu、Met、Ile、Leu,其中Ala、Val、Phe、Met、Ile、Leu均为非极性氨基酸,仅Tyr和Glu为极性氨基酸;第二类包括Ser、Gly、His、Thr、Asp、Arg,均为极性氨基酸,这就说明DFAA中个体氨基酸的生物地球化学行为可能与该氨基酸的极性有关。DCAA则可分为四类:第一类为Ser和Gly,这两种氨基酸均为极性中性氨基酸,且富含这两种氨基酸的蛋白质-硅复合物很容易在硅藻细胞壁上形成[27]。陆田生等[3]在实验室培养条件下研究了一种硅藻——小角刺藻(Chaetocerosminutissimus)生长过程中水体中溶解游离氨基酸含量的变化状况,结果发现,在该藻生长过程中,海水中Ser和Gly的含量逐渐增加,且成为水体中含量最高的氨基酸,所以Ser和Gly具有相似的环境分布特征和季节变化趋势很可能与硅藻的生长有关;第二类为Asp、Thr、Ala、Val、Tyr、Phe;第三类为Glu、Arg、His;其中Glu为极性酸性氨基酸,Arg和His为极性碱性氨基酸;第四类为Ile和Leu,且两种氨基酸都属于支链氨基酸,由此可见,DCAA中化学性质相近的个体氨基酸存在较为相似的生物地球化学行为。孙岩等[13]利用DTAA中个体氨基酸摩尔百分含量对秋季南黄海表层海水中15种氨基酸进行聚类分析,以80%相似度可以将DTAA中的个体氨基酸分为2类。第一类有Ser、Gly、Ala、Asp和Glu;其他的10种可以归为第二类氨基酸。南黄海表层海水中溶解氨基酸聚类分析的结果与秦皇岛海域存在一些差异,这可能是由区域和季节差异引起的。通过对秦皇岛海域褐潮暴发区表层海水中个体氨基酸进行聚类分析,有利于进一步认识该海域中溶解氨基酸在水环境中的变化规律。
2.3 溶解氨基酸与理化因子的相关性分析
溶解氨基酸是海水中溶解有机物的重要组成部分,其产生、分布和消耗都与理化因子有着密切的关系,表1为2013年秦皇岛海域褐潮暴发区溶解氨基酸与理化因子的相关性分析,结果显示,DFAA、DCAA与温度(T)、盐度(S)、溶解氧(DO)、溶解无机氮(DIN)、抑食金球藻细胞密度均没有显著相关性。但这并不能说明DIN和抑食金球藻对海水中溶解氨基酸的含量及组成没有影响,研究发现,海洋中的细菌可以通过影响N形态间的转化对溶解氨基酸的组成和分布发挥作用[13],而抑食金球藻可以直接利用溶解氨基酸而改变其含量及组成[32-33]。由表1可知,DFAA和DCAA都与尿素呈显著正相关(p<0.01),这是因为溶解氨基酸和尿素可能具有类似的迁移转化机制,使其均有较高的生物可利用性,作为海水中溶解有机氮的重要组成成分,两者均可以被微生物分解代谢或被抑食金球藻直接吸收利用[32-34]。
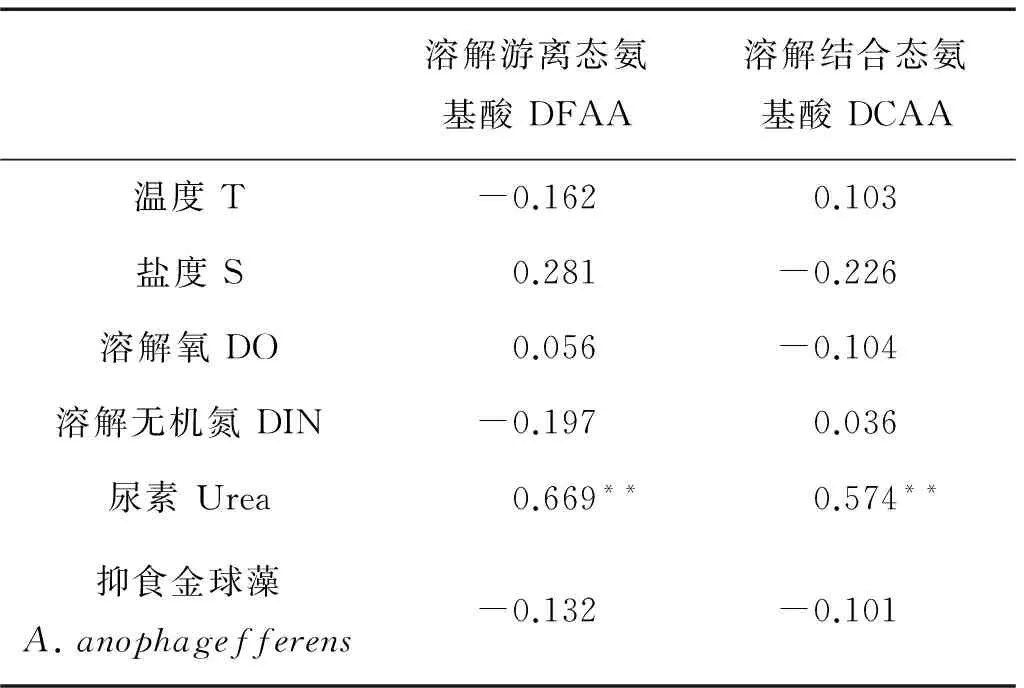
表1 溶解游离态氨基酸、溶解结合态
注:**: 表示在0.01水平上显著相关。 **: Significant values reported as:p<0.01.
3结论
(1)2013年秦皇岛海域褐潮暴发区表层海水中DFAA和DCAA的浓度范围分别为0.32~1.43和1.10~8.26μmol/L,平均浓度分别为0.52、3.02μmol/L,DCAA是DTAA的主要组成部分,约占DTAA含量的85%;研究发现,海水中DFAA和DCAA的浓度都与尿素浓度呈显著正相关(p<0.01)。
(2)该海域中DFAA和DCAA的浓度均有明显的季节变化趋势:3—6月,DFAA和DCAA的浓度因浮游植物死亡分解而有所增加,为抑食金球藻褐潮的暴发与持续提供了合适的营养物质条件,7月DFAA和DCAA的浓度明显下降,12月又有所回升,这与抑食金球藻对海水中溶解氨基酸的利用情况有关;抑食金球藻褐潮暴发过程中,呈现出褐潮中心由南向北迁移的现象,在褐潮暴发区,DFAA先降低,随后DCAA再降低。
(3)DFAA和DCAA中个体氨基酸的组成以及丰度受抑食金球藻褐潮的影响并存在季节差异;DFAA中个体氨基酸的生物地球化学行为与该氨基酸的极性有关,而DCAA中个体氨基酸的生物地球化学行为受生物作用影响较大。
参考文献:
[1]Kong F Z, Yu R C, Zhang Q C, et al. Pigment characterization for the 2011 bloom in Qinhuangdao implicated “brown tide” events in China[J]. Chinese Journal of Oceanology and Limnology, 2012, 30(3): 361-370.
[2]Zhang Q C, Qiu L M, Yu R C, et al. Emergence of brown tides caused byAureococcusanophagefferensHargraves et Sieburth in China[J]. Harmful Algae, 2012, 19: 117-124.
[3]陆田生, 纪明侯. 小角刺生长过程中溶解游离氨基酸含量在海水中的变化[J]. 海洋与湖沼, 1997, 28(3): 256-261.
Lu Tiansheng, Ji Minghou. The change of contents of dissolved free amino acids in seawater during the growth ofChaetocerosminutissimus[J]. Oceanologia Et Limnologia Sinica, 1997, 28(3): 256-261.
[4]Poulet S A, Martin-Jézéquel v. Relationships between dissolved free amino acids, chemical composition and growth of the marine diatomChaetocerosdebile[J]. Marine Biology, 1983, 77(1): 93-100.
[5]Mulholland M R, Gobler C J, Lee C. Peptide hydrolysis, amino acid oxidation, and nitrogen uptake in communities seasonally dominated byAureococcusanophagefferens[J]. Limnology and Oceanography, 2002, 47(4): 1094-1108.
[6]Gobler C J, Boneillo G E, Debenham C J, et al. Nutrient limitation, organic matter cycling, and plankton dynamics during anAureococcusanophagefferensbloom[J]. Aquatic Microbial Ecology, 2004, 35(1): 31-43.
[7]Taylor G T, Gobler C J, Sanudo-Wilhelmy S A. Speciation and concentrations of dissolved nitrogen as determinants of brown tide Aureococcus anophagefferens bloom initiation[J]. Marine Ecology Progress Series, 2006, 312: 67-83.
[8]夏清艳. 中国近海海水中溶解氨基酸的分布与组成研究[D]. 青岛: 中国海洋大学, 2011.
Xia Qingyan. Distribution and composition of dissolved amino acids in the coastal waters of China[D]. Qingdao: Ocean University of China, 2011.
[9]陆田生, 纪明侯. 胶州湾海水中溶解氨基酸的研究[J]. 海洋与湖沼, 1996, 27(2): 117-124.
Lu Tiansheng, Ji Minghou. Studies on dissolved amino acids in seawater of Jiaozhou Bay[J]. Oceanologia Et Limnologia Sinica, 1996, 27(2): 117-124.
[10]陈岩. 北黄海和胶州湾海水中溶解游离氨基酸的分布与组成研究[D]. 青岛: 中国海洋大学, 2009.
Chen Yan. Study on the distribution and composition of dissolved free amino acids in the North Yellow Sea and Jiaozhou Bay[D]. Qingdao: Ocean University of China, 2009.
[11]陈岩, 杨桂朋. 春季北黄海表层海水中溶解游离氨基酸的分布与组成研究[J]. 中国海洋大学学报(自然科学版), 2010, 40(7): 93-97.
Chen Yan, Yang Guipeng. Study on dissolved free amino acid (DFAA) in the surface water of the North Yellow Sea[J]. Periodical of Ocean University of China, 2010, 40(7): 93-97.
[12]Yang G P, Chen Y, Gao X C. Distribution of dissolved free amino acids, dissolved inorganic nitrogen and chlorophyll a in the surface microlayer and subsurface water of the Yellow Sea, China[J]. Continental Shelf Research, 2009, 29(14): 1737-1747.
[13]孙岩, 杨桂朋, 陈岩, 等. 秋季南黄海表层海水中溶解氨基酸的分布与组成研究[J]. 中国海洋大学学报(自然科学版), 2012, 42(10): 81-87.
Sun Yan, Yang Guipeng, Chen Yan, et al. Distribution and composition of dissolved amino acids in the surface water of the South Yellow Sea during autumn[J]. Periodical of Ocean University of China, 2012, 42(10): 81-87.
[14]侯继灵. 不同氮源和铁对浮游植物生长影响的围隔实验研究[D]. 青岛: 中国海洋大学, 2006.
Hou Jiling. Influence of nitrogen nutrients and iron to the growth of phytoplankton in mesocosm experiments[D]. Qingdao: Ocean University of China, 2006.
[15]中华人民共和国国家标准. 海洋监测规范, 第4部分: 海水分析[S]. 北京: 中国标准出版社, 2007.
GB17378. 4-2007. The specification for marine monitoring, part 4: Seawater analysis[S]. Beijing: Standards Press of China, 2007.
[16]古彬, 甄毓, 米铁柱. 秦皇岛扇贝养殖区褐潮暴发期浮游微藻群落结构特点研究[J]. 中国海洋大学学报(自然科学版), 2015, 45(7): 64-72.
Gu Bin, Zhen Yu, Mi Tiezhu. Characterization of phytoplankton community in the coastal waters of Qinhuangdao during brown tide[J]. Periodical of Ocean University of China, 2015, 45(7): 64-72.
[17]Zhang G, Liang S, Shi X, et al. Dissolved organic nitrogen bioavailability indicated by amino acids during a diatom to dinoflagellate bloom succession in the Changjiang River estuary and its adjacent shelf[J]. Marine Chemistry, 2015, 176: 83-95.
[18]Preston T, Bury S, McMeekin B, et al. Isotope Dilution Analysis of Combined Nitrogen in Natural Waters: II. Amino Acids[J]. Rapid Communications in Mass Spectrometry, 1996, 10: 965-968.
[19]Romera-Castillo C, Sarmento H, álvarez-Salgado X A, et al. Net production and consumption of fluorescent colored dissolved organic matter by natural bacterial assemblages growing on marine phytoplankton exudates[J]. Applied and Environmental Microbiology, 2011, 77(21): 7490-7498.
[20]Middelboe M, Borch N H, Kirchman D L. Bacterial utilization of dissolved free amino acids, dissolved combined amino acids and ammonium in the Delaware Bay estuary: effects of carbon and nitrogen limitation[J]. Marine Ecology Progress Series, 1995, 128: 109-120.
[21]Keil R G, Kirchman D L. Utilization of dissolved protein and amino acids in the northern Sargasso Sea[J]. Aquatic Microbial Ecology, 1999, 18: 293-300.
[22]王俊, 康元德. 渤海浮游植物种群动态的研究[J]. 海洋水产研究, 1998, 19(1): 43-52.
Wang Jun, Kang Yuande. Study on population dynamics of phytoplankton in the Bohai Sea[J]. Marine Fisheries Research, 1998, 19(1): 43-52.
[23]王俊. 渤海近岸浮游植物种类组成及其数量变动的研究[J]. 海洋水产研究, 2003, 24(4): 44-50.
Wang Jun. Species composition and quantity variation of phytoplankton in inshore waters of the Bohai Sea[J]. Marine Fisheries Research, 2003, 24(4): 44-50.
[24]Capone D G,Bronk D A,Mulholland M R,et a1.Nitrogen in the Marine Environment[M].US:Academic Press, 2008: 303-384.
[25]Gobler C J, Renaghan M J, Buck N J. Impacts of nutrients and grazing mortality on the abundance ofAureococcusanophagefferensduring a New York brown tide bloom[J]. Limnology and Oceanography, 2002, 47(1): 129-141.
[26]Hayashi T, Suitani Y, Murakami M, et al. Chemistry and utilization of plankton. VII. Protein and amino acid compositions of five species of marine phytoplankton[J]. Nippon Suisan Gakkaishi, 1986, 52(2): 337-343.
[27]Marsot P, Cembella A D, Colombo J C. Intracellular and extracellular amino acid pools of the marine diatom Phaeodactylum tricornutum (Bacillariophyceae) grown on unenriched seawater in high-cell-density dialysis culture[J]. Journal of Phycology, 1991, 27: 478-491.
[28]Cowie G L, Hedges J I. Hedges Digestion and alteration of the biochemical constituents of a diatom (Thalassiosira weissflogii) ingested by a herbivorous zooplankton (Calanus pacificus) [J]. Limnology and Oceanography, 1996, 41(4): 581-594.
[29]孙岩. 南黄海和胶州湾海水中溶解氨基酸的分布与组成研究[D]. 青岛: 中国海洋大学, 2012.
Sun Yan. Distribution and composition of dissolved amino acids in the South Yellow Sea and Jiaozhou Bay[D]. Qingdao: Ocean University of China, 2012.
[30]徐宁, 刘静雅, 赖海燕, 等. 海洋微藻对游离氨基酸的利用特性研究[J]. 环境科学学报, 2013, 33(4): 1058-1065.
Xu Ning, Liu Jingya, Lai Haiyan, et al. Uptake and utilization characteristics ofProrocentrumdonghaiense,Phaeoecystisglobosa,KareniamikimotoiandSkeletonemacostatumfor dissolved free amino acids[J]. Acta Scientiae Circumstantiae, 2013, 33(4): 1058-1065.
[31]Berg G M, Glibert P M, Lomas M W, et al. Organic nitrogen uptake and growth by the chrysophyte Aureococcus anophagefferens during a brown tide event[J]. Marine Biology, 1997, 129(2): 377-387.
[32]Mulholland M R, Boneillo G, Minor E C. A comparison of N and C uptake during brown tide (Aureococcusanophagefferens) blooms from two coastal bays on the east coast of the USA[J]. Harmful Algae, 2004, 3(4): 361-376.
[33]Lomas M W, Kana T M, MacIntyre H L, et al. Interannual variability ofAureococcusanophagefferensin Quantuck Bay, Long Island: natural test of the DON hypothesis[J]. Harmful Algae, 2004, 3(4): 389-402.
[34]Gobler C J, Sunda W G. Ecosystem disruptive algal blooms of the brown tide species,AureococcusanophagefferensandAureoumbralagunensis[J]. Harmful Algae, 2012, 14: 36-45.
责任编辑庞旻
Spatial Distributions and Seasonal Variations of Dissolved Amino Acids in the Coastal Waters of Qinhuangdao During Brown Tide
QIAO Ling1, 2, 3, MI Tie-Zhu1, 2, 3, ZHEN Yu1, 2, 3, GU Bin4, WANG Guo-Shan3, 5, YU Zhi-Gang3, 5
(1.The Key Laboratory of Marine Environment and Ecology, Ministry of Education, Qingdao 266100, China; 2.College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China; 3.Laboratory for Marine Ecology and Environmental Science,Qingdao National Laboratory for Marine Science and Technology,Qingdao 266071,China; 4.Yellow Sea Fisheries Research Institute, Academy of Fishery Sciences, Qingdao 266071, China; 5.The Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Qingdao 266100, China)
Abstract:Based on field investigations, the concentrations, horizontal distribution, seasonal variations, composition of dissolved amino acids in the coastal waters of Qinhuangdao during brown tide caused by Aureococcus anophagefferens were analyzed. The correlation between the dissolved amino acids and physical-chemical factors was also studied. The results showed that the average concentrations of dissolved free amino acids (DFAA) and dissolved combined amino acids (DCAA) were 0.52 μmol/L and 3.02 μmol/L, respectively. DCAA was a main component of total dissolved amino acids (DTAA), accounting for 85% approximately. The concentrations of DCAA and DFAA showed a significant seasonal difference in the study area, increasing from March to June, decreasing obviously in July, rising again in December. The area with high cell density of Aureococcus anophagefferens were in the south waters of Qinhuangdao and migrated from south to north during the whole process of brown tide. The concentrations of DFAA decreased firstly, and then DCAA concentrations also decreased in the area concentrated Aureococcus anophagefferens. Significant positive correlation was found between dissolved amino acids and urea (p<0.01). Major constituents of DFAA and specific values of acidic amino acids and basic amino acids had obvious seasonal difference. The reason may be the different source and preservation of dissolved amino acids, as well as their utilization by Aureococcus anophagefferens.
Key words:Qinhuangdao; brown tide; Aureococcus anophagefferens; dissolved amino acids
基金项目:❋ 海洋公益性行业科研专项(201205031);国家自然科学基金项目(61271406)资助
收稿日期:2015-07-14;
修订日期:2015-10-22
作者简介:乔玲(1991-),女,博士生,主要研究方向为褐潮成因、监测手段与控制研究。E-mail:qiaoling1990123@126.com ❋❋通讯作者:E-mail:mitiezhu@ouc.edu.cn
中图法分类号:X172
文献标志码:A
文章编号:1672-5174(2016)05-095-09
DOI:10.16441/j.cnki.hdxb.20150259
Supported by National Marine Public Welfare Research Project(201205031); National Natural Science Foundation of China(61271406)
