不同浓度的普伐他汀对小鼠巨噬细胞极性的影响研究
2016-06-15谷祥任
谷祥任,张 雁
(湖南省张家界市人民医院心血管内科 427000)
不同浓度的普伐他汀对小鼠巨噬细胞极性的影响研究
谷祥任,张雁△
(湖南省张家界市人民医院心血管内科427000)
[摘要]目的探讨不同浓度的普伐他汀对小鼠巨噬细胞极性的影响。方法对小鼠骨髓来源的巨噬细胞进行体外培养,以0 μmol/L普伐他汀钠组作为对照组,分别给予10、25、50 μmol/L的普伐他汀钠进行药物干预24 h,用酶联免疫吸附试验(ELISA)检测白细胞介素(IL)-10、IL-12的分泌,流式细胞仪检测细胞膜CD16/32、CD206的表达,荧光定量聚合酶链反应(PCR)检测Toll样受体4(TLR4)、髓样分化因子88(MyD88)、干扰素调控因子5(IRF5) mRNA的表达。结果普伐他汀钠干预后的巨噬细胞,随着普伐他汀钠的浓度升高,IL-12、CD16/32的表达下降,而IL-10、CD206的表达升高,并伴有TLR4、MyD88、IRF5 mRNA的表达下调,且呈剂量依赖性。结论普伐他汀钠促进巨噬细胞向抗炎性M2型极化,该效应可能与普伐他汀钠的抗炎作用有关。
[关键词]普伐他汀;炎症;巨噬细胞极性;动脉粥样硬化
炎症与动脉粥样硬化(atherosclerosis,AS)密切相关。AS更被认为是一种慢性炎症性疾病[1]。巨噬细胞作为AS发生发展的关键细胞,其可见于AS的各个阶段。有研究发现,巨噬细胞是一种兼具促炎与抗炎作用于一体的异质性细胞,在不同的环境与条件下表现为不同的表型[2]:M1型(经典激活型)与M2型(替代激活型),前者表现为促炎性,能释放炎症介质,参与炎性反应,与人群中冠心病的患病率和病死率可能呈正相关;后者表现为抗炎性,分泌许多抗炎因子,如转化生长因子-β(TGF-β)、血管内皮生长因子(VEGF)参与组织修复,与动脉粥样硬化性心血管疾病的发病率可能呈负相关,有抗AS的作用。已有研究表明,二者能相互转化,可成为防治AS的新策略[3]。研究发现,作为心血管疾病的常用药物,他汀类除具有传统的降脂效应外,还具有抗炎的作用,具有逆转斑块的效应,但具体机制尚不清楚。本研究以不同浓度的水溶性最高的他汀类代表药普伐他汀钠作用于体外培养的巨噬细胞,观察他汀类药物浓度因素对巨噬细胞极性的影响,探讨其抗炎、抗AS的细胞和分子机制。
1材料与方法
1.1材料(1)实验动物:SPF级4~6周龄C57BL/6雌性小鼠,购自湖南斯莱克景达实验动物有限公司。(2)仪器与试剂:重组小鼠γ-干扰素(IFN-γ,Peprotech公司),普伐他汀钠原料药(浙江海正药业有限公司),脂多糖(LPS,Sigma公司),异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的大鼠抗小鼠F4/80抗体(Biolegend公司),FITC标记的大鼠抗小鼠CD16/32抗体(Biolegend公司),FITC标记的大鼠抗小鼠 CD206 抗体( AbD Serotec 公司)及对应的同型抗体,小鼠白细胞介素(IL)-10,IL-12酶联免疫吸附试验(ELISA)检测试剂盒(达科为生物技术有限公司),RNApure高纯总RNA快速提取试剂盒(艾德莱生物科技有限公司),M-MLV逆转录试剂盒(Invitrogen公司),荧光定量聚合酶链反应(PCR)试剂盒 Maxima SYBR Green qPCR Master Mix(Thermo Scientific公司)。FACSAria Ⅲ流式细胞仪(美国BD公司),多功能酶标仪(瑞士Tecan公司),7500 Fast实时荧光定量PCR仪(美国ABI公司)。
1.2方法
1.2.1M0型巨噬细胞模型的建立借鉴Pradel等[4]的方法,将C57BL/6小鼠颈椎脱臼处死,无菌分离出股骨和胫骨,截断骨骺端,用2.5 mL注射器吸取培养基(20%胎牛血清、100 μg/mL链霉素、100 U/mL青霉素的DMEM培养液)冲洗骨髓,收集冲洗物, 2 000 r/min离心10 min后弃上清液,加入含L929成纤维细胞上清液的培养基(20%胎牛血清、100 μg/mL链霉素、100 U/mL青霉素的DMEM培养液),培养7 d后弃去未贴壁细胞,再在不含L929成纤维细胞上清液的培养基中进行培养,1 d后获得的贴壁细胞即为骨髓来源的巨噬细胞(M0型巨噬细胞组)。
1.2.2M1型巨噬细胞模型的建立去除悬浮的细胞及旧的细胞培养液,重新换上不含L929成纤维细胞上清液的培养基与贴壁的细胞共培养,在Vats等[5]的方法基础上浓度减半(预实验显示减半后的浓度效果较佳,细胞无成片死亡或状态极差的情况),即脂多糖(LPS)2.5 ng/mL和IFN-γ 50 U/mL,对骨髓来源的M0型巨噬细胞进行12 h的刺激,使其形成M1型巨噬细胞。
1.2.3实验分组实验分为4组。对照组:即M1型巨噬细胞组(0 μmol/L普伐他汀钠组);用药组:分别给予10、25、50 μmol/L的普伐他汀钠对M1型巨噬细胞进行药物干预24 h。
1.2.4ELISA测定细胞因子分泌收集各组巨噬细胞培养上清液,按照试剂盒说明操作,检测IL-10、IL-12的分泌。加入配好的标准品,设置对照,在450 nm波长处检测吸光度(OD值)。
1.2.5流式细胞术检测细胞膜表面抗原表达0.25%胰蛋白酶消化贴壁细胞,PBS洗涤1次,离心,去除上清液后用100 μL PBS重悬细胞,再分别加入0.25 μg FITC标记的大鼠抗小鼠F4/80抗体、0.5 μg FITC标记的大鼠抗小鼠CD16/32抗体、0.5 μg FITC标记的大鼠抗小鼠CD206抗体及对应的同型抗体,4 ℃避光孵育30 min,2 000 r/min离心,PBS冲洗2次,300 μL PBS重悬后再用流式细胞仪进行检测。
1.2.6RNA提取及荧光定量PCR检测收集各组细胞,提取细胞总RNA,操作严格按照说明书进行。逆转录生成cDNA,然后-20 ℃保存。采用美国ABI 7500 Fast实时荧光定量PCR仪进行检测。引物由Invitrogen公司设计合成,TLR4 上游:5′-AGA CCT CAG CTT CAA TGG TG-3′;下游:5′-GAG ACT GGT CAA GCC AAG AA-3′。MyD88上游:5′-TCC GGC AAC TAG AAC AGA CAG ACT-3′;下游:5′-GCG GCG ACA CCT TTT CTC AAT-3′。IRF5上游:5′-AAT ACC CCA CCA CCT TTT GA-3′;下游:5′-TTG AGA TCC GGG TTT GAG AT-3′。为保证各cDNA样本量的均一性,采用β-actin作为内参。β-actin上游:5′-TCC GTA AAG ACC TCT ATG CC-3′,下游:5′-TAC TCC TGC TTG CTG ATC C-3′。采用两步法扩增目的DNA片段,每个样本设置3个复孔,反复检测3次,采用2-△△Ct法分析基因表达。定量PCR反应体系配置见表1。

表1 定量PCR反应体系的配置
1.3统计学处理采用SPSS19.0软件对数据进行统计分析;多组间均数差异比较先采用方差分析,再用S-N-K检验进行两均数间的两两比较;以P<0.05为差异有统计学意义。
2结果
2.1M0型巨噬细胞模型的鉴定M0型巨噬细胞的鉴定主要有表型(F4/80)、形态及吞噬功能测定(如吞噬墨汁、鸡红细胞、中性红细胞等)3种鉴定方法,其中,表型鉴定是最具可靠性的鉴定手段。本实验采集的骨髓细胞,经L929成纤维细胞分泌的巨噬细胞集落刺激因子(macrophage-colony stimulating factor,M-CSF)的作用,在含L929成纤维细胞上清液的培养基中培养7 d后,流式细胞术检测小鼠巨噬细胞特异性标记F4/80示巨噬细胞的纯度高达96%(图1),可用于后续试验。

图1 M0型巨噬细胞F4/80的表达(96%)
2.2M1型巨噬细胞模型的鉴定将IFN-γ(50 U/mL)和LPS(2.5 ng/mL)联合刺激M0型巨噬细胞后,通过检测发现,CD16/32阳性表达率为(78.15± 2.02)%,CD206阳性表达率为(6.74± 3.08)%(表2)。IL-12的分泌较高,IL-10的分泌较低(图2)。与M1型巨噬细胞的表型特点相符。

M0:M0型巨噬细胞组;M1:M1型巨噬细胞组;10P:10 μmol/L普伐他汀钠组;25P:25 μmol/L普伐他汀钠组;50P:50 μmol/L普伐他汀钠组。
图2各组巨噬细胞IL-10、IL-12的分泌水平
2.3各组形成的巨噬细胞表型指标检测巨噬细胞分泌的IL-12、IL-10及膜表面抗原蛋白分子CD16/32、CD206是鉴定巨噬细胞表型的主要指标。通过检测发现,普伐他汀钠组炎症因子IL-12的分泌和CD16/32的阳性表达率均低于M1型巨噬细胞组,差异有统计学意义(P<0.05),而抗炎因子IL-10的分泌和CD206的阳性表达率较M1型巨噬细胞组升高明显,差异有统计学意义(P<0.05),见表2。
2.4荧光定量PCR检测各组TLR4、MyD88、IRF5 mRNA的基因表达M1型巨噬细胞组TLR4、MyD88、IRF5 mRNA的表达最高,而经不同浓度的普伐他汀钠干预后,其TLR4、MyD88、IRF5 mRNA的表达下降明显,呈剂量依赖性,与M1型巨噬细胞组比较,差异有统计学意义(P<0.05),见表3。
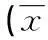
表2 各组巨噬细胞表型指标检测±s,n=4)
a:P<0.05,与M1型巨噬细胞组比较;b:P<0.05,与10 μmol/L普伐他汀钠组比较;c:P<0.05,与25 μmol/L普伐他汀钠组比较。
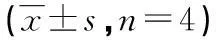
表3 各组TLR4、MyD88、IRF5 DNA的相对拷贝数检测
a:P<0.05,与M1型巨噬细胞组比较;b:P<0.05,与10 μmol/L普伐他汀钠组比较;c:P<0.05,与25 μmol/L普伐他汀钠组比较。
3讨论
炎症是驱动AS及其相关疾病发生发展的主要原因[6]。目前,对炎症与AS的研究涉及多个方面,在细胞层面主要有T淋巴细胞、内皮细胞、血管平滑肌细胞以及巨噬细胞等。研究表明,巨噬细胞在AS过程中发挥核心作用,因为它是脂类代谢和炎症免疫反应的调节剂[7]。巨噬细胞是一种具有双向调节作用的免疫细胞,具有促炎与抗炎两种作用,而巨噬细胞极性就是这两种极端性质。M1型巨噬细胞分泌炎性因子IL-12,高表达膜抗原CD16/32,与炎性损伤有关;而M2型巨噬细胞分泌抗炎因子IL-10,高表达膜抗原CD206,有抑制炎症的作用。研究发现,在特定条件下,AS斑块中的M1与M2型巨噬细胞可相互转化,根据数量优劣表现为促炎或抗炎的作用[8]。
作为调脂的常规用药,他汀类药物还具有其他的多效性作用,如稳定粥样斑块,改善血管内皮功能,保护神经,抗凝防血栓和抗炎等作用,尤其需要特别关注的是抗炎作用。研究显示其与斑块的稳定、血管壁的内皮功能亦密切相关,在急性冠脉综合征(ACS)早期患者中使用能够抑制血管内皮的炎性反应,稳定粥样斑块,改善血管内皮功能[9-10]。
人类和小鼠AS病变显示出增强的 TLR4 表达。观察发现,经oxLDL刺激后,在AS区域TLR4 表达增加[11]。除了TLR3外,MyD88能传递所有TLR受体的信号,是一种非常关键的衔接蛋白。Bjorkbacka等[12]研究显示MyD88 的缺失及灭活,能导致巨噬细胞招募到动脉壁的减少,并引起AS的减少,与趋化因子相关联。新的研究表明,IRF5可作为控件操纵巨噬细胞抗炎或促炎的特性[13]。Weiss等[14]为了弄清IRF5的表达在巨噬细胞中的作用是否与炎症性巨噬细胞存在相关联,采用活体小鼠实验性诱导成关节炎的做法来检测IRF5的表达,发现关节腔中的巨噬细胞IRF5的表达升高,其他相关检测符合M1型巨噬细胞或炎症性巨噬细胞的特征,提示IRF5与炎症相关,其表达升高可作为炎症性巨噬细胞或M1型巨噬细胞的一个标志。
现有的研究资料显示,炎性反应与巨噬细胞上TLR4及其中下游的MyD88、IRF5传导通路密切相关[15]。本实验从TLR4-MyD88-IRF5分子信号通路出发,用他汀类代表药普伐他汀钠,以10、25、50 μmol/L的浓度进行药物干预发现,与M1型巨噬细胞组比较,不同浓度的普伐他汀钠干预组炎症标志物IL-12、CD16/32的表达均下降,而抗炎标志物IL-10、CD206的表达均升高,并伴有TLR4、MyD88、IRF5 mRNA的表达下调,且呈剂量依赖性,推测他汀类药物可能通过抑制TLR4-MyD88-IRF5分子信号通路来调控巨噬细胞的极性,使M1型巨噬细胞极化为M2型巨噬细胞,进而发挥抗炎效应,其具体机制尚需更进一步研究。
综上所述,在AS的发生发展过程中,机体始终存在着巨噬细胞促炎与抗炎的极性转换,而他汀类代表药普伐他汀钠具有促进M1型向M2型转换而发挥抗炎的作用,这为他汀类药物对AS的防治提供了理论支持。
参考文献
[1]Tuttolomondo A,Di Raimondo D,Pecoraro R,et al.Atherosclerosis as an inflammatory disease[J].Curr Pharm Des,2012,18(28):4266-4288.
[2]Sica A,Mantovani A.Macrophage plasticity and polarization:in vivo veritas[J].J Clin Invest,2012,122(3):787-795.
[3]Khallou-Laschet J,Varthaman A,Fornasa G,et al.Macrophage plasticity in experimental atherosclerosis[J].PLoS One,2010,5(1):e8852.
[4]Pradel LC,Mitchell AJ,Zarubica A,et al.ATP-binding cassette transporter hallmarks tissue macrophages and modulatescytokine-triggered polarization programs[J].Eur J Immunol,2009,39(8):2270-2280.
[5]Vats D,Mukundan L,Odegaard JI,et al.Oxidative metabolism and PGC -1beta attenuate macrophage-mediated inflammation[J].Cell Metab,2006,4(1):13-24.
[6]Johan F.Immunity,atherosclerosis and cardiovascular disease[J].BMC Med,2013,11:117.
[7]Glass CK,Witztum JL.Atherosclerosis:the road ahead[J].Cell,2001,104(4):503-516.
[8]Wilson HM.Macrophages heterogeneity in atherosclerosis implications for therapy[J].J Cell Mol Med,2010,14(8):2055-2065.
[9]Gelosa P,Cimino M,Pignieri A,et al.The role of HMG-CoA reductase inhibition in endothelial dysfunction and inflammation[J].Vasc Health Risk Manag,2007,3(5):567-577.
[10]Sposito AR,Aguiar Filho GB,Aarao AR,et al.Statins in acute coronary syndromes[J].Arq Bras Cardiol,2011,97(4):350-356.
[11]Xu XH,Shah PK,Faure E,et al.Toll-like receptor-4 is expressed by mac-rophages in murine and human lipid-rich atherosclerotic plaques and upregulated by oxidized LDL[J].Circulation,2001,104(25):3103-3108.
[12]Bjorkbacka H,Kunjathoor VV,Moore KJ,et al.Reduced atherosclerosis in MyD88-null mice links elevated serum cholesterol levels to activation of innate immunity signaling pathways[J].Nat Med,2004,10(4):416-421.
[13]Krausgruber T,Blazek K,Smallie T,et al.IRF5 promotes inflammatory macrophage polarization and T(H)1-T(H)17 responses[J].Nat Immunol,2011,12(3):231-238.
[14]Weiss M,Blazek K,Byrne AJ,et al.IRF5 is a specific marker of inflammatory macrophages in vivo[J].Med Inflam,2013,2013:245804.
[15]Paun A,Reinert JT,Jiang Z,et al.Functional characterization of murine interferon regulatory factor 5 (IRF-5) and its role in the innate antiviral response[J].J Biol Chem,2008,283(21):14295-14308.
Effect of different concentrations of pravastatin treatment on macrophage polarity in micer
Gu Xiangren,Zhang Yan△
(Department of Cardiology,Zhangjiajie Municipal People′s Hospital,Zhangjiajie,Hunan 427000,China)
[Abstract]ObjectiveTo study the effect of different concentrations of pravastatin treatment on macrophage polarity in mice.MethodsThe mice bone marrow sources of macrophages were cultured in vitro,with the 0 μmol/L sodium pravastatin group as control,by giving 10,25,50 μmol/L sodium pravastatin to conduct the drug intervention for 24 h.The enzyme linked immunosorbent assay (ELISA) was used to detect the secretion of interleukin 10 (IL-10) and IL-12;the flow cytometry instrument was used to detect cell membrane CD16/32,CD206 expression;real time quantitative polymerase chain reaction (RT-qPCR) was adopted to detect toll-like receptor 4 (TLR4),myeloid differentiation factor 88 (MyD88),interferon regulatory factor 5 (IRF5) mRNA expression.ResultsAfter the intervention of pravastatin sodium on macrophages,as the pravastatin sodium concentration increase,the expression of IL-12 and CD16/32 was decline,while the expression of IL-10 and CD206 was risen,which was accompanied by TLR4,MyD88,IRF5 mRNA expression down regulatyion,and a dose dependent manner.ConclusionSodium pravastatin promote the polarization of macrophages toward an anti-inflammatory macrophage phenotype (M2),this effect may be related with the anti-inflammatory effect of sodium pravastatin.
[Key words]pravastatin;inflammation;macrophage polarity;atherosclerosis
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.09.007
作者简介:谷祥任(1975-),硕士,副主任医师,主要从事心血管疾病的研究及临床、介入工作。△通讯作者,E-mail:yz0369@163.com。
[中图分类号]R363
[文献标识码]A
[文章编号]1671-8348(2016)09-1173-03
(收稿日期:2015-09-18修回日期:2015-12-10)
